Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 51 nº 5 - Set. / Out. of 2018
Vol. 51 nº 5 - Set. / Out. of 2018
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Pedro Paulo Teixeira e Silva Torres1; Marcelo Fouad Rabahi2; Maria Auxiliadora Carmo Moreira2; Pablo Rydz Pinheiro Santana3; Antônio Carlos Portugal Gomes4; Edson Marchiori5 |
|
|
Descritores: Infecções fúngicas invasivas; Tomografia computadorizada; Diagnóstico por imagem. |
|
|
Resumo: INTRODUÇÃO
Pneumopatias fúngicas proporcionam considerável morbidade e mortalidade, podendo ser oportunistas ou endêmicas. Nas últimas décadas houve importante aumento na incidência das infecções fúngicas, em decorrência de aspectos relacionados a tratamentos médicos (drogas imunossupressoras, transplantes, uso e abuso de antibióticos), incidência de leucemias, linfomas e síndrome da imunodeficiência adquirida e maior acurácia nas técnicas diagnósticas(1). Em geral, histoplasmose, coccidioidomicose e paracoccidioidomicose comprometem indivíduos imunocompetentes, e aspergilose, candidíase, criptococose e pneumocistose comprometem indivíduos imunodeprimidos. As manifestações clínicas são múltiplas, com padrões de imagem variáveis e superponíveis. É essencial ao médico assistente o conhecimento da realidade epidemiológica dos fungos em sua região, do estado imunológico do paciente e familiaridade com os padrões de imagem próprios de cada entidade(2-4). Neste trabalho serão abordados os principais padrões tomográficos observados no compartimento pulmonar e mediastinal relacionados às doenças fúngicas pulmonares mais frequentes em nosso meio. DISTRIBUIÇÃO GEOGRÁFICA NACIONAL DAS DOENÇAS PULMONARES FÚNGICAS ENDÊMICAS São escassos os dados a respeito da distribuição das doenças fúngicas no Brasil, e o conhecimento de áreas endêmicas, dados de prevalência, incidência e morbidade disponíveis em algumas condições baseiam-se em relatos de casos clínicos e inquéritos intradérmicos(5). As doenças fúngicas endêmicas com comprometimento pulmonar não configuram na lista de agravos de notificação compulsória nacional(6). Admite-se que a epidemiologia dessas infecções possa estar mudando, parcialmente decorrente de mudanças globais no clima, novas práticas de agricultura com mecanização intensa e uso de fungicidas, além de migração humana, turismo de aventura e outros motivos(7). A paracoccidioidomicose é considerada doença endêmica, com cerca de 80% dos casos concentrados no Brasil, especialmente nos estados de São Paulo, Paraná, Rio Grande do Sul, Goiás, Rio de Janeiro e Rondônia(8,9). Tem sido relatada ocorrência de casos em áreas de colonização mais recentes submetidas a desmatamento, como em partes da Amazônia, Maranhão, Tocantins, Pará, Mato Grosso, Rondônia, Acre e Amazonas(5,10). Os estados do nordeste brasileiro reportaram a maior quantidade de casos de coccidioidomicose, e a última área endêmica definida para esta micose no continente americano compreende, especialmente, os estados do Piauí, Ceará, Maranhão e Bahia(9,11,12). Vinte e seis microepidemias de histoplasmose já foram relatadas em oito estados brasileiros (Rio de Janeiro, Rio Grande do Sul, São Paulo, Distrito Federal, Minas Gerais, Paraíba, Amazonas e Bahia), com isolamento do fungo no solo em cinco deles (Rio de Janeiro, Rio Grande do Sul, São Paulo, Distrito Federal e Paraíba)(13). DOENÇA PULMONAR FÚNGICA NO INDIVÍDUO IMUNOCOMPROMETIDO Doenças fúngicas estão entre as infecções mais graves nos indivíduos imunodeprimidos, nos quais o acometimento pulmonar se mantém como a forma documentada mais comum de infecção invasiva tecidual(14). De maneira geral, algumas delas têm predileção pelo indivíduo imunocomprometido, incluindo a pneumocistose, a criptococose e a aspergilose(3,4,15). Outros agentes implicados são os fungos dos gêneros Mucor, Fusarium, Rhizopus, Petriellidium, Cryptococcus, Histoplasma, Coccidioides e Candida. As infecções por Aspergillus ainda são as mais comuns entre indivíduos imunocomprometidos nos Estados Unidos e na Europa, embora em outros locais do mundo infecções por Cryptococcus e Pneumocystis têm maior significância devido a associação com o vírus da imunodeficiência humana (HIV)(16). As populações em risco incluem indivíduos portadores de neoplasias sólidas e hematológicas, submetidos a transplantes de órgãos ou de medula óssea e portadores do HIV, além de outros com risco considerado intermediário, como pacientes em uso de corticoidoterapia crônica ou imunossupressores, insuficiência renal crônica, doença pulmonar obstrutiva crônica (DPOC) e cirrose hepática(14,16). Nesse subgrupo de indivíduos, é necessário um protocolo agressivo de investigação etiológica, visto que o atraso na investigação aumenta a mortalidade, sendo recomendado o uso precoce da tomografia computadorizada nos protocolos de diagnóstico(14). PADRÕES DE ACOMETIMENTO TOMOGRÁFICO NO TÓRAX Opacidades em vidro fosco Opacidades em vidro fosco são o achado mais característico na tomografia computadorizada de alta resolução dos pacientes com pneumonia por Pneumocystis jirovecii ou pneumocistose, refletindo acúmulo intra-alveolar de fibrina, débris e micro-organismos. Na tomografia computadorizada de alta resolução, o aspecto é de pneumopatia difusa, com opacidades em vidro fosco que tendem a predominar nos lobos superiores e poupar a periferia pulmonar(17). Superpostas às opacidades em vidro fosco podem ser observadas opacidades reticulares, caracterizando o padrão de pavimentação em mosaico (Figura 1). Algumas vezes pode ser difícil a percepção de vidro fosco discreto, bilateral e uniforme, podendo ser útil a utilização da acentuação da discrepância entre a atenuação do parênquima pulmonar e o conteúdo aéreo brônquico, descrito como sinal do “brônquio negro”(18). Como achado acessório descreve-se, ainda, a possibilidade de associação do vidro fosco a consolidações - mais frequente em indivíduos sem infecção pelo HIV - e cistos(17). 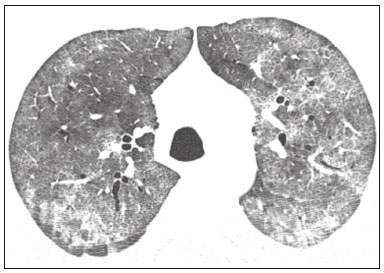 Figura 1. HIV-positivo e pneumocistose. Tomografia de alta resolução do tórax na área dos lobos superiores mostrando opacidades em vidro fosco difusas no parênquima pulmonar e pequenos focos de consolidação esparsos. Opacidades em vidro fosco são o achado mais frequente nos pacientes com paracoccidioidomicose sem tratamento, comumente de distribuição esparsa(19). Refletem espessamento intersticial intralobular por inflamação, com ou sem preenchimento do espaço aéreo, ou podem resultar, ainda, de fibrose intralobular(20). Na manifestação crônica da doença ou após o tratamento, as alterações evoluem para fibrose, com surgimento de opacidades reticulares caracterizadas por espessamento do feixe peribroncovascular, enfisema paracicatricial, bronquiectasias de tração, bandas parenquimatosas e distorção arquitetural(20,21). Nódulos Nódulos são achados frequentes nas micoses pulmonares, incluindo a criptococose, a paracoccidioidomicose, a coccidioidomicose e os fungos com manifestação angioinvasiva (Aspergillus sp., mucormicose, candidíase)(4,20,22,23). Nódulos múltiplos de predomínio periférico, especialmente se associados a halo em vidro fosco, são típicos da manifestação angioinvasiva da aspergilose nos pacientes neutropênicos febris(23). Aspecto semelhante pode ser observado em outros fungos com manifestação angioinvasiva (ordem Mucorales e Candida sp.)(23). Na evolução da doença, os nódulos progridem para necrose central e escavação, com surgimento de conteúdo aéreo no interior das lesões, descrito como sinal do “crescente aéreo”, características morfológicas tipicamente observadas duas a três semanas após início do tratamento, coincidindo com a resolução da neutropenia(23-25) (Figura 2). Nódulos móveis no interior de escavação pulmonar também são característicos na apresentação saprofítica da aspergilose(23). Nódulos e nódulos escavados, bem como opacidades nodulares centrolobulares, são padrões frequentes na paracoccidioidomicose sem tratamento, achados que mais frequentemente predominam nos campos pulmonares periféricos, posteriores e com pequeno predomínio nos campos pulmonares médios (Figura 3) (19). 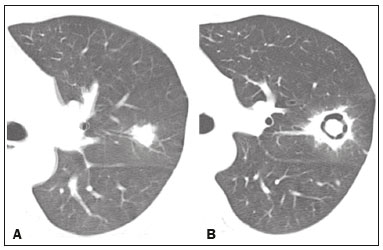 Figura 2. Leucemia linfoide aguda, neutropenia febril, doença fúngica angioinvasiva. A: Imagem axial de tomografia do tórax mostrando nódulo irregular com discreto halo em vidro fosco (sinal do halo). B: Evolutivamente, após instituída terapêutica antifúngica, houve escavação do nódulo, com presença de nódulo intracavitário (sinal do crescente aéreo). 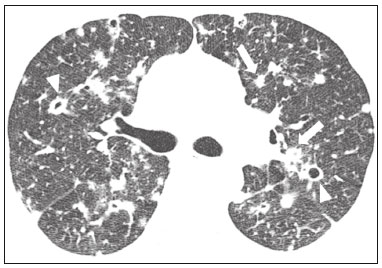 Figura 3. Paracoccidioidomicose sem tratamento. Imagem axial de tomografia de alta resolução do tórax demonstrando múltiplos nódulos irregulares esparsos (setas), alguns escavados (cabeças de seta). Nódulos pulmonares e massas predominam na criptococose, geralmente com distribuição periférica (Figura 4). Embora escavação dos nódulos possa ser observada tanto em imunocompetentes quanto em imunocomprometidos, é descrita como mais frequente no último grupo(3,22). 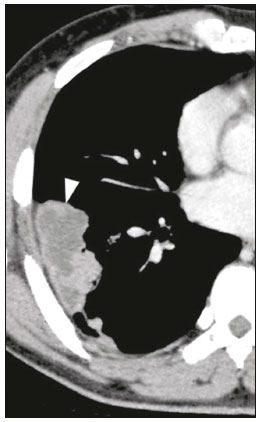 Figura 4. Criptococose. Imagem axial de tomografia do tórax em janela de mediastino após administração do meio de contraste mostrando consolidação periférica lobulada com componente de necrose central (cabeça de seta). A forma aguda da coccidioidomicose tem como apresentação tomográfica típica a de nódulos irregulares de dimensões variáveis com tendência a confluência e escavação, sendo de particular importância a observação deste aspecto em indivíduos provenientes de regiões semiáridas no nordeste do Brasil(26). Há associação da doença com o hábito de caça de tatus, e o aspecto imaginológico disseminado possivelmente decorre da aspiração maciça de fungos oriundos do solo contaminado durante o processo de retirada do animal dos buracos(26). Merece nota o fato de que a apresentação nodular de doenças fúngicas pode ser confundida com doenças neoplásicas, especialmente quando há nódulos irregulares(27). Sinal do halo e halo invertido O sinal do halo refere-se à presença de atenuação em vidro fosco envolvendo um nódulo, sendo primeiramente descrito na manifestação angioinvasiva da aspergilose em indivíduos imunodeprimidos, e nesses casos representa, histopatologicamente, área de infarto envolvida por hemorragia alveolar(24,28). Entretanto, o sinal, isoladamente, é inespecífico, podendo ser observado em uma variedade de doenças infecciosas (fúngicas, bacterianas, virais e parasitárias), inflamatórias e neoplásicas(28). Considerando as doenças fúngicas, sua apresentação é descrita, além da aspergilose, na mucormicose, candidíase, coccidioidomicose e criptococose(28). O sinal do halo tem particular importância em indivíduos imunossuprimidos, nos quais a especificidade é maior para manifestação angioinvasiva de alguns fungos, especialmente a aspergilose. Sua ocorrência é usualmente transitória, mais frequente nos estágios iniciais da doença(29). Para fins de diagnóstico diferencial, merece nota o fato de que maior espessura do halo em vidro fosco mais frequentemente relaciona-se a condições infecciosas(30). Em contraponto, o sinal do halo invertido refere-se a opacidade focal em vidro fosco circundada por anel de consolidação, completo ou parcial(24). Pode ser observado em uma variedade de doenças infecciosas e não infecciosas, e dentre as doenças fúngicas merecem atenção, por maior frequência, sua ocorrência na paracoccidioidomicose e nas doenças fúngicas angioinvasivas (aspergilose, zigomicoses e fusariose)(31,32). Na tentativa de estreitar o diagnóstico diferencial de doenças com apresentação de halo invertido, a presença de reticulação interna, espessura do halo periférico > 1,0 cm e a presença de derrame pleural favorecem o diagnóstico de doença fúngica angioinvasiva em favor de pneumonia em organização, dentro do contexto clínico adequado de imunossupressão(33,34). Na paracoccidioidomicose, bem como em outras doenças granulomatosas como a tuberculose, pode ser observada uma variação do halo invertido, com presença de margens nodulares (Figura 5)(31,33,35). 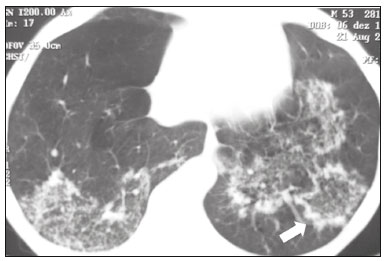 Figura 5. Paracoccidioidomicose. Imagem axial de tomografia do tórax em janela de pulmão mostrando inúmeros micronódulos agrupados esparsos e lesão com morfologia de halo invertido no lobo inferior esquerdo (seta). Consolidações Consolidações do espaço aéreo podem fazer parte da apresentação de múltiplos agentes fúngicos(2-4,20,22,23). Seguindo a apresentação nodular, é o segundo achado mais frequente na criptococose, com distribuição predominantemente periférica(22). Pode, ainda, estar presente na apresentação de outros fungos endêmicos, como na paracoccidioidomicose (descrita como forma pneumônica), histoplasmose e coccidioidomicose aguda(4,26). Considerando indivíduos imunodeprimidos, a doença fúngica angioinvasiva (aspergilose, mucormicose, candidíase) pode levar a consolidações, usualmente de distribuição periférica, e também pode apresentar halo em vidro fosco relacionado a hemorragia alveolar(4,23). São descritas consolidações fazendo parte das manifestações semi-invasiva, invasiva das vias aéreas e broncopulmonar alérgica da aspergilose(23). Apresentações avançadas da pneumocistose também podem cursar com consolidação, e sua ocorrência é mais frequente em pacientes não HIV, tendendo a ter desenvolvimento mais rápido, refletindo dano pulmonar pela resposta imune do hospedeiro(17). Padrão miliar Micronódulos de disseminação randômica (miliar) é apresentação comum a múltiplas micoses pulmonares, sendo descritos mais frequentemente na histoplasmose (Figura 6), paracoccidioidomicose, coccidioidomicose e candidíase, esta última mais observada nos pacientes imunodeprimidos(4,20). Diagnósticos diferenciais deste padrão incluem a disseminação hematogênica da tuberculose e metástases miliares. 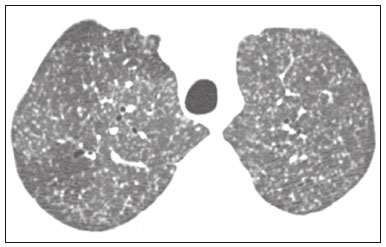 Figura 6. Histoplasmose miliar. Imagem axial de tomografia do tórax em janela de pulmão demonstrando micronódulos de distribuição aleatória. Escavações Lesões escavadas podem ser observadas em múltiplas doenças fúngicas, como as doenças angioinvasivas (aspergilose, mucormicose, candidíase), as manifestações semi- invasiva (necrosante crônica) e saprofítica da aspergilose, a histoplasmose, a paracoccidioidomicose, a criptococose e a coccidioidomicose(36). A aspergilose semi-invasiva ou necrosante crônica é a manifestação granulomatosa crônica da aspergilose, apresentando-se, clinicamente, por tosse produtiva, febre e hemoptise com duração de alguns meses(4). Compromete indivíduos com imunocomprometimento leve, como portadores de DPOC, alcoolistas, diabéticos e portadores de doenças do tecido conjuntivo(4,23,36). Nos estudos tomográficos observam-se sinais de broncopneumonia e consolidações de predomínio nos lobos superiores, que evoluem para lesões escavadas de paredes espessas, inclusive com aspergilomas (Figura 7)(4,23). 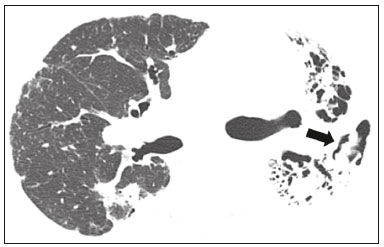 Figura 7. Antecedente de leucemia linfoide aguda, aspergilose necrosante crônica. Imagem axial de tomografia de alta resolução do tórax identificando consolidações de evolução crônica nos lobos do pulmão esquerdo, com bronquiectasias associadas, destacando-se lesão escavada com conteúdo em seu interior no lobo inferior esquerdo (seta). Lesões escavadas podem estar presentes na histoplasmose, tanto na forma aguda quanto na crônica, tendendo a ser mais frequentes em pacientes com doenças pulmonares crônicas, como DPOC, e indivíduos com imunossupressão (Figura 8)(36). Na forma escavada crônica, os sintomas são semelhantes aos da tuberculose pós-primária, com febre baixa, tosse, hemoptise e perda ponderal. Nos métodos de imagem são observadas opacidades reticulares associadas a lesões escavadas, com predomínio nos campos pulmonares superiores(2). Na forma saprofítica da aspergilose, o fungo desenvolve-se no interior de lesões escavadas, especialmente relacionadas a tuberculose, sarcoidose e outras. A presença de nódulo ou massa móvel no interior de escavação é a manifestação típica da aspergilose saprofítica (Figura 9)(23). 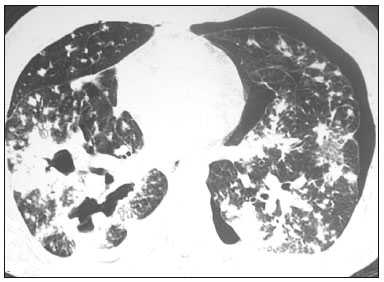 Figura 9. Doença fúngica saprofítica. Imagem axial de tomografia em janela de pulmão demonstrando lesão escavada no lobo médio, com nódulo móvel em seu interior (sinal do crescente aéreo), aspecto característico da aspergilose saprofítica (seta cheia). Como achado adicional, bronquiectasias no mesmo lobo (seta vazada). 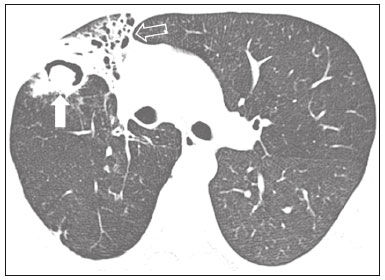 Figura 8. Histoplasmose. Imagem axial de tomografia de alta resolução do tórax mostrando opacidades centrolobulares e focos de consolidação esparsos bilaterais, além de lesão escavada no lobo inferior direito. Pequeno pneumotórax à esquerda. Doença das vias aéreas A aspergilose broncopulmonar alérgica é uma manifestação clínica incomum de doença das vias aéreas e decorre de uma reação de hipersensibilidade complexa ao Aspergillus. Compromete especialmente indivíduos asmáticos de longa data, mas também portadores de fibrose cística, síndrome de Kartagener e pacientes com transplante pulmonar(4,23). O acometimento leva a aumento na produção de muco e prejuízo no clearance ciliar, resultando em dano à parede brônquica, impacção mucoide e bronquiectasias(23). Os achados tomográficos que merecem atenção são as bronquiectasias centrais (segmentares e subsegmentares), especialmente nos campos pulmonares superiores, associadas a impacção mucoide (Figura 10). Destaca-se que em cerca de 30% dos pacientes a impacção mucoide será hiperdensa ou com calcificações(23). 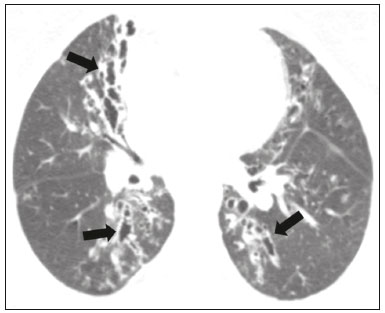 Figura 10. Mulher asmática, aspergilose broncopulmonar alérgica. Imagem axial de tomografia do tórax em janela de pulmão mostrando bronquiectasias varicosas de predomínio central, com espessamento parietal brônquico associado (setas). Especialmente nos indivíduos neutropênicos imunodeprimidos e naqueles com síndrome da imunodeficiência adquirida, pode sobrevir a manifestação invasiva das vias aéreas da aspergilose. O espectro da doença se estende desde comprometimento de grandes vias aéreas (traqueia) até das pequenas vias aéreas. O comprometimento das pequenas vias aéreas pode ocorrer na forma de bronquiolite, com nódulos centrolobulares, “árvore em brotamento” e consolidações peribroncovasculares, ou broncopneumonia, com padrão semelhante ao das broncopneumonias em geral (Figura 11)(23). Embora raro, em indivíduos gravemente imunossuprimidos pode ocorrer envolvimento da traqueia e brônquios pela aspergilose (aspergilose traqueobrônquica invasiva), podendo determinar úlceras ou necrose extensa/pseudomembranas na superfície mucosa(37). 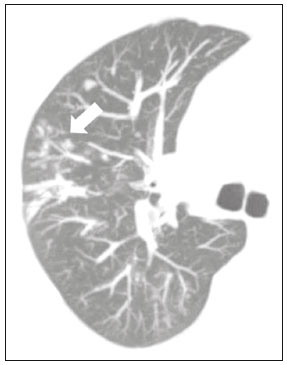 Figura 11. Leucemia mieloide aguda, aspergilose invasiva das vias aéreas. Imagem axial de tomografia do tórax em reformatação de projeção de intensidade máxima exibindo opacidades centrolobulares agrupadas com arranjo de árvore em brotamento (seta). Acometimento mediastinal A mediastinite fibrosante resulta de resposta imune do hospedeiro determinando proliferação de tecido denso fibroso no mediastino(35), cuja causa permanece indefinida em vários casos. Pode ser idiopática, secundária a doenças neoplásicas infiltrativas ou causas infecciosas, entre elas tuberculose, aspergilose, mucormicose, criptococose e, especialmente, histoplasmose, esta última sendo causa importante particularmente em locais endêmicos(38). Afeta especialmente indivíduos jovens, com manifestações clínicas variáveis e usualmente relacionadas a compressão de estruturas mediastinais vitais. Ao estudo tomográfico caracteriza-se lesão sólida infiltrativa com densidade de partes moles e realce variável (Figura 12), que compromete especialmente o mediastino médio, podendo apresentar calcificações. 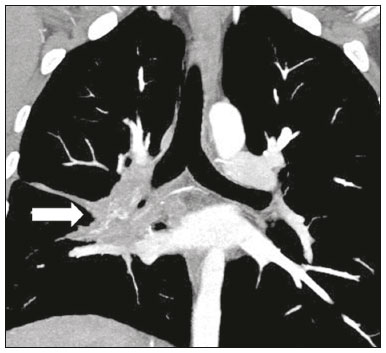 Figura 12. Mediastinite fibrosante. Imagem coronal de tomografia em janela de mediastino após administração do meio de contraste, em reformatação de projeção de intensidade máxima, mostrando lesão infiltrativa subcarinal e hilar à direita (seta), obliterando a artéria pulmonar deste lado, com extensa rede de colaterais. Os métodos de imagem têm importância na caracterização do envolvimento de estruturas vitais, cardiovasculares ou vias aéreas, quantificando o comprometimento. Podem ser observadas, ainda, repercussões secundárias no compartimento pulmonar, como infartos ou espessamento de septos interlobulares, decorrentes de obliteração de ramos arteriais ou venosos, respectivamente(38). Comprometimento de linfonodos mediastinais é descrito em algumas micoses, particularmente na histoplasmose, criptococose, coccidioidomicose e, de modo menos frequente, na paracoccidioidomicose(2-4,20,39). Linfonodomegalias disseminadas são descritas na criptococose e histoplasmose, especialmente quando relacionadas a imunossupressão. Eventualmente, podem ser observados linfonodos com centro necrótico(4,33). Derrame pleural De maneira geral, a presença de derrame pleural é possível, porém incomum(4,40). Entre as infecções, associa-se com frequência pouco maior na mucormicose(4). Acometimento da parede torácica Envolvimento da parede torácica pode ser observado como extensão do acometimento pulmonar na aspergilose, determinando lesões líticas em arcos costais e vértebras, sendo mais bem caracterizado nos estudos de tomografia e ressonância magnética(41). O envolvimento da parede torácica na forma de costocondrite tem sido reportado em usuários de drogas intravenosas(42). CONCLUSÃO São observados múltiplos achados de imagem nas pneumopatias fúngicas, frequentemente inespecíficos e superponíveis entre os agentes, com inúmeros diagnósticos diferenciais que incluem causas infecciosas e não infecciosas. Visando sistematizar a abordagem dessas doenças, foram revisados alguns aspectos que incluem padrões básicos no parênquima pulmonar e acometimento extrapulmonar. Ante a multiplicidade de apresentações dessas doenças, é necessário familiaridade com as manifestações por parte do médico assistente, bem como estreita correlação no ambiente multidisciplinar, para correto manejo e diagnóstico dessas doenças. REFERÊNCIAS 1. Xavier MO, Oliveira FM, Severo LC. Capítulo 1 - Diagnóstico laboratorial das micoses pulmonares. J Bras Pneumol. 2009;35:907-19. 2. McAdams HP, Rosado-de-Christenson ML, Lesar M, et al. Thoracic mycoses from endemic fungi: radiologic-pathologic correlation. Radiographics. 1995;15:255-70. 3. McAdams HP, Rosado-de-Christenson ML, Templeton PA, et al. Thoracic mycoses from opportunistic fungi: radiologic-pathologic correlation. Radiographics. 1995;15:271-86. 4. Chong S, Lee KS, Yi CA, et al. Pulmonary fungal infection: imaging findings in immunocompetent and immunocompromised patients. Eur J Radiol. 2006;59:371-83. 5. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Proposta de vigilância epidemiológica da paracoccidioidomicose. Cited 2017 Aug 18. Available from: http://www.sgc.goias.gov.br/upload/arquivos/2012-05/proposta_ve-pbmicose.pdf. 6. Brasil. Ministério da Saúde. Portaria nº 204, de 17 de fevereiro de 2016. Define a Lista Nacional de Notificação Compulsória de doenças, agravos e eventos de saúde pública nos serviços de saúde públicos e privados em todo o território nacional, nos termos do anexo, e dá outras providências. Cited 2017 Aug 18. Available from: http://bvsms.saude.gov.br/bvs/saudelegis/gm/2016/prt0204_17_02_2016.html. 7. Queiroz-Telles F, Fahal AH, Falci DR, et al. Neglected endemic mycoses. Lancet Infect Dis. 2017;17:e367-e377. 8. Shikanai-Yasuda MA, Mendes RP, Colombo AL, et al. Brazilian guidelines for the clinical management of paracoccidioidomycosis. Rev Soc Bras Med Trop. 2017;50:715-40. 9. Colombo AL, Tobón A, Restrepo A, et al. Epidemiology of endemic systemic fungal infections in Latin America. Med Mycol. 2011;49: 785-98. 10. Wanke B, Aidê MA. Capítulo 6 - Paracoccidioidomicose. J Bras Pneumol. 2009;35:1245-9. 11. Deus Filho A. Capítulo 2 - Coccidioidomicose. J Bras Pneumol. 2009;35:920-30. 12. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Doenças infecciosas e parasitárias - guia de bolso. 8ª ed. Brasília, DF: Ministério da Saúde; 2010. 13. Oliveira FM, Unis G, Severo LC. Microepidemia de histoplasmose em Blumenau, Santa Catarina. J Bras Pneumol. 2006;32:375-8. 14. Silva RF. Capítulo 8 - Infecções fúngicas em imunocomprometidos. J Bras Pneumol. 2010;36:142-7. 15. Roden AC, Schuetz AN. Histopathology of fungal diseases of the lung. Semin Diagn Pathol. 2017;34:530-49. 16. Batzlaff CM, Limper AH. When to consider the possibility of a fungal infection: an overview of clinical diagnosis and laboratory approaches. Clin Chest Med. 2017;38:385-91. 17. Kanne JP, Yandow DR, Meyer CA. Pneumocystis jiroveci pneumonia: high-resolution CT findings in patients with and without HIV infection. AJR Am J Roentgenol. 2012;198:W555-61. 18. Yadav P, Seith A, Sood R. The ''dark bronchus'' sign: HRCT diagnosis of Pneumocystis carinii pneumonia. Ann Thorac Med. 2007;2: 26-7. 19. Souza AS Jr, Gasparetto EL, Davaus T, et al. High-resolution CT findings of 77 patients with untreated pulmonary paracoccidioidomycosis. AJR Am J Roentgenol. 2006;187:1248-52. 20. Barreto MM, Marchiori E, Amorim VB, et al. Thoracic paracoccidioidomycosis: radiographic and CT findings. Radiographics. 2012;32: 71-84. 21. Funari M, Kavakama J, Shikanai-Yasuda MA, et al. Chronic pulmonary paracoccidioidomycosis (South American blastomycosis): high-resolution CT findings in 41 patients. AJR Am J Roentgenol. 1999;173:59-64. 22. Chang WC, Tzao C, Hsu HH, et al. Pulmonary cryptococcosis: comparison of clinical and radiographic characteristics in immunocompetent and immunocompromised patients. Chest. 2006;129:333-40. 23. Franquet T, Müller NL, Giménez A, et al. Spectrum of pulmonary aspergillosis: histologic, clinical, and radiologic findings. Radiographics. 2001;21:825-37. 24. Silva CIS, Marchiori E, Souza Jr AS, et al. Consenso brasileiro ilustrado sobre a terminologia dos descritores e padrões fundamentais da TC de tórax. J Bras Pneumol. 2010;36:99-123. 25. Walker CM, Abbott GF, Greene RE, et al. Imaging pulmonary infection: classic signs and patterns. AJR Am J Roentgenol. 2014;202: 479-92. 26. Capone D, Marchiori E, Wanke E, et al. Acute pulmonary coccidioidomycosis: CT findings from 15 patients. Br J Radiol. 2008; 81:721-4. 27. Guimaraes MD, Marchiori E, Godoy MCB. Fungal infection mimicking lung cancer: a potential cause of misdiagnosis. AJR Am J Roentgenol. 2013;201:W364. 28. Lee YR, Choi YW, Lee KJ, et al. CT halo sign: the spectrum of pulmonary diseases. Br J Radiol. 2005;78:862-5. 29. Georgiadou SP, Sipsas NV, Marom EM, et al. The diagnostic value of halo and reversed halo signs for invasive mold infections in compromised hosts. Clin Infect Dis. 2011;52:1144-55. 30. Alves GRT, Marchiori E, Irion K, et al. Sinal do halo: achados de TCAR em 85 pacientes. J Bras Pneumol. 2016;42:435-9. 31. Marchiori E, Zanetti G, Escuissato DL, et al. Reversed halo sign: high-resolution CT scan findings in 79 patients. Chest. 2012;141: 1260-6. 32. Marchiori E, Zanetti G, Hochhegger B, et al. Reversed halo sign on computed tomography: state-of-the-art review. Lung. 2012;190: 389-94. 33. Marchiori E, Marom EM, Zanetti G, et al. Reversed halo sign in invasive fungal infections: criteria for differentiation from organizing pneumonia. Chest. 2012;142:1469-73. 34. Marchiori E, Zanetti G, Hochhegger B. Sinal do halo invertido. J Bras Pneumol. 2015;41:564. 35. Marchiori E, Zanetti G, Irion KL, et al. Reversed halo sign in active pulmonary tuberculosis: criteria for differentiation from cryptogenic organizing pneumonia. AJR Am J Roentgenol. 2011;197:1324-7. 36. Gadkowski LB, Stout JE. Cavitary pulmonary disease. Clin Microbiol Rev. 2008;21:305-33. 37. Krenke R, Grabczak EM. Tracheobronchial manifestations of Aspergillus infections. ScientificWorldJournal. 2011;11:2310-29. 38. Rossi SE, McAdams HP, Rosado-de-Christenson ML, et al. Fibrosing mediastinitis. Radiographics. 2001;21:737-57. 39. Suwatanapongched T, Gierada DS. CT of thoracic lymph nodes. Part II: disease and pitfalls. Br J Radiol. 2006;79:999-1000. 40. Limper AH. The changing spectrum of fungal infections in pulmonary and critical care practice: clinical approach to diagnosis. Proc Am Thorac Soc. 2010;7:163-8. 41. Jeung MY, Gangi A, Gasser B, et al. Imaging of chest wall disorders. Radiographics. 1999;19:617-37. 42. Crawford SJ, Swan CD, Boutlis CS, et al. Candida costochondritis associated with recent intravenous drug use. IDCases. 2016;4:59-61. 1. Multimagem Diagnósticos, Goiânia, GO, Brasil 2. Departamento de Clínica Médica, Faculdade de Medicina da Universidade Federal de Goiás (UFG), Goiânia, GO, Brasil 3. Med Imagem/Hospital Beneficência Portuguesa e Grupo Fleury, São Paulo, SP, Brasil 4. Med Imagem/Hospital Beneficência Portuguesa, São Paulo, SP, Brasil 5. Departamento de Radiologia, Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil Correspondência: Dr. Pedro Paulo Teixeira e Silva Torres Avenida Doutor Ismerino Soares de Carvalho, 775, Setor Aeroporto Goiânia, GO, Brasil, 74075-040 E-mail: pedroptstorres@gmail.com Received November 25, 2017 Accepted after revision February 14, 2018 Trabalho realizado no Departamento de Radiologia da Faculdade de Medicina da Universidade Federal de Goiás (UFG), Goiânia, GO, Brasil |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554