Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 51 nº 4 - Jul. / Ago. of 2018
Vol. 51 nº 4 - Jul. / Ago. of 2018
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Aline Falqueto1; Gustavo Lemos Pelandré2; Mariânges Zadrozny Gouvêa da Costa3; Marcelo Souto Nacif4; Edson Marchiori5 |
|
|
Descritores: Pâncreas; Cisto pancreático; Neoplasias pancreáticas. |
|
|
Resumo: INTRODUÇÃO
As lesões císticas do pâncreas compreendem amplo espectro de doenças com características clínicas e prognósticos variados. Quando decorrentes de síndromes congênitas ou injúrias pancreáticas (inflamação ou trauma), podem ter origem não neoplásica, destacando-se os pseudocistos, frequentemente associados a pancreatite(1–3). As neoplasias císticas pancreáticas podem surgir do epitélio ductal (neoplasia cística serosa, neoplasia cística mucinosa, neoplasia mucinosa papilar intraductal e adenocarcinoma ductal), de células endócrinas, de células acinares (cistoadenoma acinar e cistoadenocarcinoma acinar) ou, ainda, de elementos mesenquimais(2,4). O adenocarcinoma ductal representa, aproximadamente, 90% das neoplasias malignas e consiste, na maioria dos casos, em carcinomas mucinosos moderadamente diferenciados originados no epitélio cuboide dos ductos pancreáticos. Estima-se incidência anual mundial de mais de 367.000 casos, sendo mais de 10.000 no Brasil, com taxa de mortalidade global de 98%(5). Com a evolução tecnológica dos exames de imagem e sua maior disponibilização nas últimas décadas, as lesões císticas do pâncreas incidentais têm sido cada vez mais diagnosticadas em estudos radiológicos do abdome, especialmente nas modalidades de tomografia computadorizada (TC) e ressonância magnética (RM). Embora a prevalência exata de lesões císticas do pâncreas detectadas incidentalmente em exames de imagem não seja conhecida, sua identificação não deve ser ignorada, já que parte dessas lesões sofrerá degeneração maligna, especialmente em pacientes idosos, sintomáticos ou com pancreatite concomitante(1,3,6,7). As características radiológicas isoladas nem sempre permitem distinguir com segurança as lesões benignas e malignas(3,8–10). Segundo a diretriz da Associação Americana de Gastroenterologia, as lesões císticas com dimensões superiores a 30 mm, presença de dilatação do ducto pancreático principal ou componente sólido estão associadas a maior risco de malignização e devem ser submetidas a investigação anatomopatológica(11). O presente estudo tem como objetivo identificar a prevalência de lesões císticas do pâncreas em exames de TC e RM, bem como sua associação com fatores de risco para malignidade. MATERIAIS E MÉTODOS Foi realizado estudo observacional, com delineamento transversal, de pacientes oriundos de um serviço de imagem privado colaborador desse estudo, com atendimento predominantemente ambulatorial. O estudo foi aprovado pelo Comitê de Ética em Pesquisa da Universidade do Sul de Santa Catarina, protocolo nº 1.122.097/2015. Foi realizado cálculo amostral de 1000 laudos médicos de pacientes adultos submetidos a exames de TC e RM, no período de janeiro a maio de 2015. A amostra foi calculada pela fórmula de cálculo de estudo de prevalência, utilizando software OpenEpi versão 3.01, com os seguintes parâmetros: poder estatístico de 80% e nível de confiança de 95%. Foram incluídos no estudo, sequencialmente, pacientes que realizaram TC ou RM abdominais a partir de 1º de janeiro de 2015, até que fossem obtidos 500 exames de RM e 500 de TC. Foram excluídos pacientes menores de 18 anos e com manipulação cirúrgica pancreática prévia. Os pacientes que realizaram mais de um exame no período tiveram somente o exame mais recente utilizado. Foram revisados os dados demográficos disponíveis nos prontuários e as imagens de todos os pacientes incluídos no estudo. As variáveis analisadas foram: sexo, idade, sintomas, indicação clínica e plano de assistência de saúde. As imagens de TC e RM foram revisadas por médico radiologista com seis anos de experiência em radiologia abdominal. Os casos de discordância em relação ao laudo inicial foram resolvidos por consenso entre os autores. As variáveis analisadas foram: número de lesões císticas, localização, dimensões, presença de componente sólido, dilatação ductal, calcificações, septações, atrofia do parênquima, alterações inflamatórias peripancreáticas e impressão diagnóstica do médico radiologista. Com base na morfologia das lesões, aspectos radiológicos e impressão do médico radiologista, as lesões císticas do pâncreas foram divididas em dois grupos: cistos neoplásicos e cistos não neoplásicos. A análise estatística foi realizada com os softwares Excel e Statistical Package for the Social Sciences versão 18 (SPSS Inc.; Chicago, EUA). Foi utilizando o teste de quiquadrado de Pearson para a associação de variáveis qualitativas. O nível de significância estabelecido foi p < 0,05. RESULTADOS Dos 1000 pacientes incluídos no estudo, foram excluídos 33 pacientes menores de 18 anos, 17 com ressecções pancreáticas e 26 por duplicidade de exames. A população estudada foi 924 pacientes, com média de idade de 55,2 anos, sendo 558 (60,4%) do sexo feminino e 366 (39,6%) do sexo masculino. Em relação ao tipo de exame, 481 (52,1%) pacientes realizaram TC, com utilização de contraste intravenoso em 91% deles. Dos 443 (47,9%) pacientes que realizaram RM, em 92,1% foi utilizado contraste intravenoso. A grande maioria dos pacientes (88,2%) era proveniente de convênios de saúde suplementar. Foram identificadas lesões císticas do pâncreas em 42 (4,5%) pacientes, com prevalência semelhante entre homens e mulheres (Tabela 1) e média de idade de 67,9 anos. A prevalência aumentou progressivamente com a idade (Figura 1). Foi identificada maior prevalência nos pacientes com queixa pancreática (42,9%). A detecção de lesão cística do pâncreas foi 6,1% na RM e 3,1% na TC (p < 0,05). 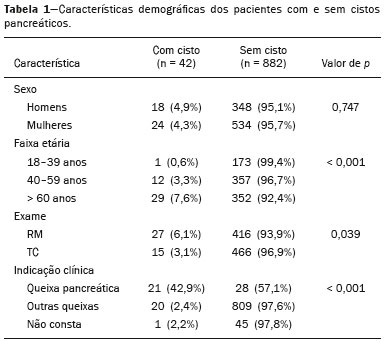 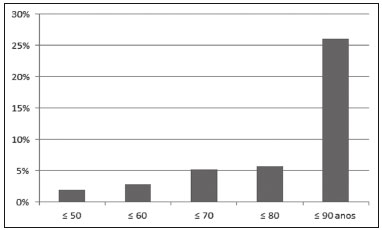 Figura 1. Prevalência de lesões císticas pancreáticas, de acordo com a faixa etária. Entre as lesões císticas encontradas, 4 (9,5%) foram classificadas como cistos não neoplásicos (pseudocistos) e 38 (90,5%) como cistos neoplásicos, com base nos achados morfológicos de TC e RM e nas informações clínicas. Entre as lesões císticas com impressão diagnóstica de cistos neoplásicos, 31 (81,6%) foram classificadas como tumores intraductais produtores de mucina (Figura 2), 2 (5,3%) como cistos epiteliais simples, 2 (5,3%) como cistoadenocarcinomas (Figura 3), 2 (5,3%) como cistoadenomas mucinosos e 1 (2,6%) como cistoadenoma seroso (Figura 4). 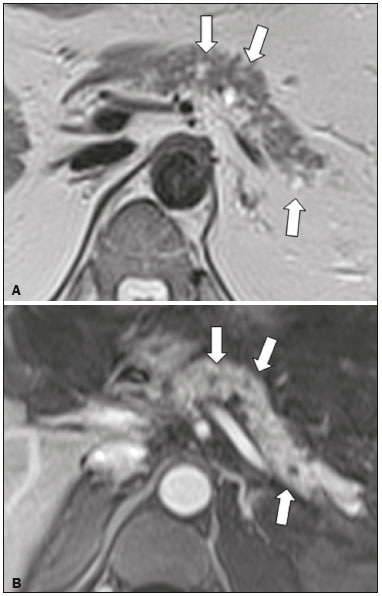 Figura 2. RM ponderada em T2 (A) e T1 com contraste (B) mostrando pequenas lesões císticas em contato com o ducto pancreático (setas), com aspecto de neoplasias intraductais produtoras de mucina. 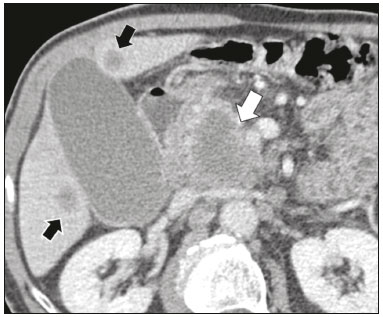 Figura 3. TC com contraste venoso mostrando volumosa lesão sólido-cística na cabeça do pâncreas, medindo 40 mm (seta branca), e lesões hepáticas com aspecto de implantes secundários (setas pretas). Aspecto de adenocarcinoma pancreático. 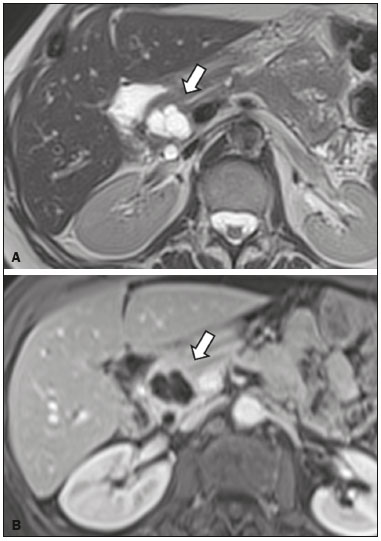 Figura 4. RM ponderada em T2 (A) e T1 com contraste (B) mostrando lesão cística multiloculada na cabeça do pâncreas, com finas septações e aspecto de neoplasia cística serosa (setas). Cistos neoplásicos foram mais prevalentes em pacientes do sexo feminino (60,5%), e os cistos não neoplásicos, no sexo masculino (75%), como mostra a Tabela 2. Entre os pacientes com cistos neoplásicos, 73,7% encontravam-se na faixa etária acima de 60 anos, e entre os pacientes com pseudocistos, 75% encontravam-se na faixa etária entre 40 e 59 anos. Metade dos pacientes tinha cisto único e 39,5% possuíam três ou mais cistos. A maioria dos cistos media entre 10 e 30 mm, localizava-se na cabeça pancreática e não apresentava calcificações, atrofia do parênquima, dilatação ductal ou componentes sólidos. 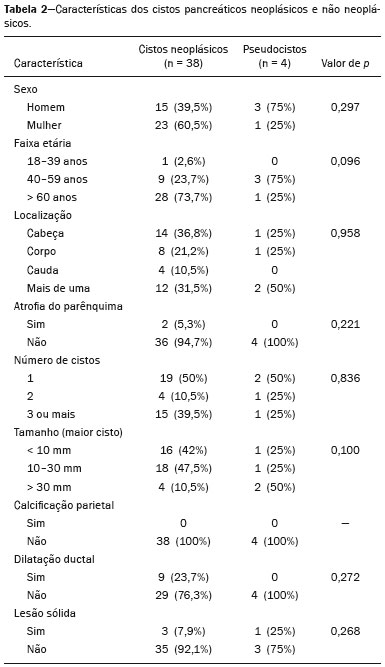 Entre os 38 pacientes diagnosticados com cistos neoplásicos, 10 (26,3%) apresentaram sinais radiológicos de risco para malignização (Tabela 3), sendo 9 (23,7%) com dilatação ductal (Figura 5), 3 (7,9%) com componente sólido (Figura 3) e 3 (7,9%) com dimensão superior a 30 mm (Figura 3). Houve maior predomínio dos fatores de risco entre os pacientes do sexo masculino (40%), maiores de 60 anos (32,1%) e com mais de três lesões císticas (40%). 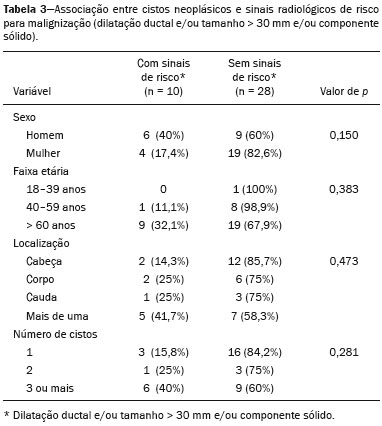 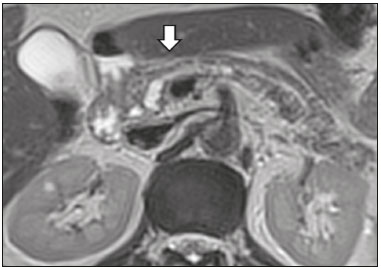 Figura 5. RM ponderada em T2 mostrando dilatação cística do ducto pancreático (setas). DISCUSSÃO As lesões císticas do pâncreas têm sido cada vez mais identificadas em exames de imagem, principalmente a partir da disseminação dos métodos seccionais. Nos EUA, estima-se que a incidência de lesões císticas do pâncreas na população se situa entre 3% e 15%, com aumento da prevalência com a idade(11). No presente estudo foi avaliada a prevalência de lesões císticas do pâncreas em população adulta submetida a exames de TC e RM, bem como sua associação com fatores de risco para malignidade. Foram identificadas lesões císticas do pâncreas em 4,5% dos pacientes, destacando-se maior detecção pela RM (6,1%), quando comparada com a TC (3,1%). Outros autores confirmam essa tendência, como Zhang et al., que observaram prevalência de 19,6% na RM, enquanto Laffan et al. encontraram prevalência de 2,6% na TC(12,13). Tal discrepância pode estar relacionada a diferenças entre a acurácia dos métodos diagnósticos empregados ou a diferenças populacionais, já que outros estudos identificaram sensibilidade levemente superior da RM em relação à TC no diagnóstico de lesões císticas do pâncreas(10,14,15). A TC e a RM são exames que apresentam características específicas na avaliação por imagem do abdome. A TC tem aplicação difusa na avaliação de queixas abdominais e atualmente funciona como exame de triagem para várias doenças, com papel de destaque na avaliação de quadros de emergências ou dores abdominais inespecíficas. Já a RM fornece informações adicionais com associação de imagens anatômicas e funcionais dentro de protocolos específicos de estudo para diversas indicações clínicas. Representa uma modalidade de imagem mais seletiva, com tempo de aquisição prolongado, habitualmente solicitada em caráter ambulatorial por especialistas em doenças abdominais. Essas características podem influenciar o perfil epidemiológico dos pacientes submetidos a esses exames, o que pode ter contribuído para a maior detecção de lesões císticas do pâncreas diagnosticadas por RM. Além disso, a RM apresenta melhor caracterização tecidual e identificação de pequenos componentes císticos. A prevalência da lesão cística do pâncreas em pacientes com queixas pancreáticas foi 42,9%, cerca de 17 vezes maior do que em pacientes com outras queixas. Tais resultados podem estar relacionados ao fato de que alguns pacientes já possuíam diagnóstico prévio de lesões císticas e estavam em acompanhamento dessas lesões ou já possuíam alguma suspeita de doença pancreática. Foram identificados cistos neoplásicos com prevalências semelhantes entre os gêneros. Em relação aos pseudocistos, a ocorrência foi três vezes maior no sexo masculino, o que poderia ser explicado pela maior prevalência de alcoolismo entre os homens, representando a principal causa de pancreatite crônica em nosso meio(16). A média de idade dos pacientes com cistos foi 67,9 anos e a presença de cistos aumentou linearmente com a idade, com 7,6% de prevalência de lesão cística do pâncreas em pacientes com idade acima de 60 anos (p < 0,01). Tais achados são semelhantes aos descritos por outros autores(10,13,17). As lesões císticas do pâncreas possuem amplo espectro de doenças que podem ser categorizadas em dois grupos: cistos não neoplásicos (traumáticos, inflamatórios, congênitos) e cistos neoplásicos, que incluem cistoadenoma seroso, cistoadenoma mucinoso, neoplasia mucinosa papilar intraductal, neoplasia pseudopapilar sólido-cística, tumores neuroendócrinos císticos e cistoadenocarcinoma, entre outros(11,18). A caracterização por imagem pode auxiliar na definição etiológica e no planejamento terapêutico, já que essas lesões apresentam espectro clínico e prognóstico muito variados(19). No presente estudo, os cistos foram classificados como neoplásicos ou não de acordo com suas características morfológicas na TC e RM e nas informações clínicas. Entre as lesões císticas encontradas, 4 (9,5%) foram classificadas como cistos não neoplásicos (pseudocistos) e 38 (90,5%) como cistos neoplásicos. Os pseudocistos foram caracterizados como lesões císticas pancreáticas sem componentes sólidos, associadas a alterações inflamatórias peripancreáticas em pacientes com história prévia de pancreatite(11). A maioria das lesões císticas neoplásicas foi caracterizada como neoplasia mucinosa papilar intraductal (81,6%), com poucos casos de cisto epitelial simples (5,3%), cistoadenocarcinomas (5,3%), cistoadenomas mucinosos (5,3%) e cistoadenomas serosos (2,6%). Esses achados representam apenas a impressão radiológica e não apresentam confirmação histopatológica. No entanto, refletem o amplo predomínio de lesões císticas benignas incidentais. Gardner et al., em estudo transversal de base populacional realizado nos EUA entre 2005 e 2009, detectaram prevalência de cistos pancreáticos em 2,5% na população adulta, com frequência de 0,03% de adenocarcinomas provenientes de pacientes com cistos pancreáticos(6). Outros estudos mostraram que o aumento na identificação de neoplasia mucinosa papilar intraductal em exames de imagem não apresentou aumento na mortalidade relacionada a essa neoplasia ou na mortalidade global relacionada ao câncer pancreático, de modo que esses números provavelmente resultam em aumento no controle diagnóstico e não de pacientes com doença clinicamente relevante(20). A neoplasia mucinosa papilar intraductal geralmente se apresenta como lesão cística em contato com o ducto pancreático principal ou ductos secundários. Pode apresentar aspecto multiloculado, componente sólido, dilatação ductal e atrofia do parênquima(19,21) . Os cistoadenomas mucinosos se apresentam como lesões císticas uniloculares, com paredes bem diferenciadas do restante do parênquima pancreático, podendo ser divididos em múltiplos compartimentos por finos septos, com ou sem conteúdo espesso (mucina). Tais lesões têm aspecto radiológico semelhante aos pseudocistos pancreáticos e a história clínica tem papel fundamental na sua diferenciação. Os cistoadenomas serosos se apresentam como lesões bem delimitadas por cápsula fibrosa, contendo numerosos microcistos de conteúdo fluido, em aspecto de “favos de mel”, podendo também ser macrocísticos e uniloculares(11,19). O cistoadenocarcinoma geralmente se apresenta como massa infiltrativa e hipovascular, com obstrução do ducto pancreático e invasão de estruturas vasculares adjacentes. O componente cístico raramente pode ser identificado por exames de imagem e está relacionado a necrose ou retenção de secreção pancreática por obstrução ductal(21). Embora pouco frequente, tem taxa de mortalidade excepcionalmente elevada, tornando-o uma das causas mais comuns de mortalidade por câncer em países desenvolvidos. Chernyak et al. identificaram aumento no risco de desenvolver adenocarcinoma em pacientes com lesão cística do pâncreas(22). Segundo diretriz da Associação Americana de Gastroenterologia, os achados de imagem com predição de risco para malignidade em lesão cística do pâncreas são tamanho do cisto, dilatação ductal e presença de componente sólido(11). Diversos estudos analisaram cistos pancreáticos após a ressecção cirúrgica e identificaram que lesões maiores que 30 mm apresentavam duas vezes mais malignização do que lesões menores que 30 mm, com taxas de sensibilidade variando entre 68–80% e especificidade variando entre 44–54%. As lesões císticas com componente sólido apresentavam três vezes mais malignização do que as lesões sem componente sólido, com taxas de sensibilidade variando entre 42–54% e especificidade variando entre 88–93%. Da mesma forma, as lesões císticas com dilatação ductal apresentam incidência de malignização cerca de 50% superior às lesões sem dilatação ductal, com taxas de sensibilidade variando entre 25–38% e especificidade variando entre 75–84%(11). No presente estudo, dos 38 pacientes diagnosticados com cistos neoplásicos, 10 (26,3%) apresentaram fatores de risco de malignização (tamanho superior a 30 mm, presença de componente sólido ou dilatação ductal), sendo 9 com dilatação ductal (23,7%), 3 com componente sólido (7,9%) e 3 com tamanho superior a 30 mm (7,9%). A maioria dos casos com fatores de risco foi observada em pacientes acima de 60 anos (32,1%), em indivíduos do sexo masculino (40%) e com mais de uma lesão cística (60%). A associação entre características clínicas e outros aspectos morfológicos com os cistos neoplásicos ou sinais de alerta para malignidade não apresentou significância estatística, possivelmente pelo montante final de lesões císticas do pâncreas ter sido relativamente pequeno para permitir conclusões definitivas. Este trabalho incluiu uma grande população submetida a exames de imagem, em que a detecção de lesões císticas do pâncreas foi semelhante aos padrões descritos na literatura. No entanto, este estudo apresenta algumas limitações. Os pacientes são oriundos de um único centro de imagem, em que o regime de trabalho ambulatorial sem vinculação hospitalar pode ter refletido nas características epidemiológicas da população. O predomínio de pacientes oriundos de convênios privados de saúde pode também ter refletido no nível socioeconômico da amostra. Em alguns casos havia poucas informações clínicas, limitando o raciocínio diagnóstico radiológico. A revisão dos casos por um único radiologista garante critérios homogêneos para classificação das lesões císticas do pâncreas identificadas neste trabalho, no entanto, não permite análise de variações entre observadores com diferentes níveis de experiência. O seguimento de longo prazo dos pacientes submetidos aos exames de imagem poderia auxiliar na elucidação diagnóstica das lesões císticas encontradas. Como conclusão, no presente estudo, a prevalência de lesões císticas do pâncreas visualizadas em TC e RM foi 4,5%, sendo mais frequente em pacientes acima de 60 anos ou com alguma queixa pancreática. A RM apresentou maior taxa de identificação de lesões císticas. A maioria das lesões apresentou características de neoplasia mucinosa papilar intraductal. Foram observados sinais de risco para malignidade em 26,3% dos cistos neoplásicos identificados. REFERÊNCIAS 1. Duell EJ, Lucenteforte E, Olson SH, et al. Pancreatitis and pancreatic cancer risk: a pooled analysis in the International Pancreatic Cancer Case-Control Consortium (PanC4). Ann Oncol. 2012;23:2964–70. 2. Roggin KK, Chennat J, Oto A, et al. Pancreatic cystic neoplasm. Curr Probl Surg. 2010;47:459–510. 3. Spinelli KS, Fromwiller TE, Daniel RA, et al. Cystic pancreatic neoplasms: observe or operate. Ann Surg. 2004;239:651–9. 4. Costa-Neto GD, Amico EC, Costa GID, et al. Solid-pseudopapillary tumor of the pancreas: report of four cases. Arq Gastroenterol. 2004;41:259–62. 5. Ferlay J, Steliarova-Foucher E, Lortet-Tieulent J, et al. Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012. Eur J Cancer. 2013;49:1374–403. 6. Gardner TB, Glass LM, Smith KD, et al. Pancreatic cyst prevalence and the risk of mucin-producing adenocarcinoma in US adults. Am J Gastroenterol. 2013;108:1546–50. 7. Stapley S, Peters TJ, Neal RD, et al. The risk of pancreatic cancer in symptomatic patients in primary care: a large case-control study using electronic records. Br J Cancer. 2012;106:1940–4. 8. Fernández-del Castillo C, Targarona J, Thayer SP, et al. Incidental pancreatic cysts: clinicopathologic characteristics and comparison with symptomatic patients. Arch Surg. 2003;138:427–34. 9. Lahat G, Ben Haim M, Nachmany I, et al. Pancreatic incidentalomas: high rate of potentially malignant tumors. J Am Coll Surg. 2009;209:313–9. 10. Lee KS, Sekhar A, Rofsky NM, et al. Prevalence of incidental pancreatic cysts in the adult population on MR imaging. Am J Gastroenterol. 2010;105:2079–84. 11. Scheiman JM, Hwang JH, Moayyedi P. American gastroenterological association technical review on the diagnosis and management of asymptomatic neoplastic pancreatic cysts. Gastroenterology. 2015;148:824–48.e22. 12. Laffan TA, Horton KM, Klein AP, et al. Prevalence of unsuspected pancreatic cysts on MDCT. AJR Am J Roentgenol. 2008;191:802– 7. 13. Zhang XM, Mitchell DG, Dohke M, et al. Pancreatic cysts: depiction on single-shot fast spin-echo MR images. Radiology. 2002; 223:547–53. 14. Minami M, Itai Y, Ohtomo K, et al. Cystic neoplasms of the pancreas: comparison of MR imaging with CT. Radiology. 1989;171:53–6. 15. Vege SS, Ziring B, Jain R, et al. American gastroenterological association institute guideline on the diagnosis and management of asymptomatic neoplastic pancreatic cysts. Gastroenterology. 2015; 148:819–22. 16. Bang UC, Benfield T, Hyldstrup L, et al. Mortality, cancer, and comorbidities associated with chronic pancreatitis: a Danish nationwide matched-cohort study. Gastroenterology. 2014;146:989–94. 17. Matsubara S, Tada M, Akahane M, et al. Incidental pancreatic cysts found by magnetic resonance imaging and their relationship with pancreatic cancer. Pancreas. 2012;41:1241–6. 18. Nougaret S, Mannelli L, Pierredon MA, et al. Cystic pancreatic lesions: from increased diagnosis rate to new dilemmas. Diagn Interv Imaging. 2016;97:1275–85. 19. Ardengh JC, Goldman SM, Lima-Filho ER. Current role of imaging methods in the diagnosis of cystic solid pancreas neoplasms: part II. Rev Col Bras Cir. 2011;38:192–7. 20. Klibansky DA, Reid-Lombardo KM, Gordon SR, et al. The clinical relevance of the increasing incidence of intraductal papillary mucinous neoplasm. Clin Gastroenterol Hepatol. 2012;10:555–8. 21. Kucera JN, Kucera S, Perrin SD, et al. Cystic lesions of the pancreas: radiologic-endosonographic correlation. Radiographics. 2012;32: E283–301. 22. Chernyak V, Flusberg M, Haramati LB, et al. Incidental pancreatic cystic lesions: is there a relationship with the development of pancreatic adenocarcinoma and all-cause mortality? Radiology. 2015;274:161–9. 1. Médica Residente em Radiologia e Diagnóstico por Imagem do Hospital Universitário da Universidade Federal de Santa Catarina (UFSC), Florianópolis, SC, Brasil 2. Professor Assistente de Radiologia da Universidade Federal de Santa Catarina (UFSC), Florianópolis, SC, Brasil 3. Professora de Gastroenterologia da Universidade do Sul de Santa Catarina (Unisul), Palhoça, SC, Brasil 4. Professor Adjunto do Departamento de Radiologia da Universidade Federal Fluminense (UFF), Niterói, RJ, Brasil 5. Professor Titular de Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil Endereço para correspondência: Dr. Gustavo Lemos Pelandré Rua Esteves Júnior, 428, ap. 702, Centro Florianópolis, SC, Brasil, 88015-130 E-mail: gustavo.pelandre@ufsc.br Recebido para publicação em 19/6/2017 Aceito, após revisão, em 11/8/2017 Trabalho realizado na Universidade do Sul de Santa Catarina (Unisul), Palhoça, SC, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554