Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 51 nº 4 - Jul. / Ago. of 2018
Vol. 51 nº 4 - Jul. / Ago. of 2018
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Maria Fernanda Arruda Almeida1; Leonardo Verza2; Almir Galvão Vieira Bitencourt1; Camila Silva Boaventura3; Paula Nicole Vieira Pinto Barbosa4; Rubens Chojniak5 |
|
|
Descritores: Neoplasias gástricas; Tomografia computadorizada de multidetectores; Estadiamento de neoplasias. |
|
|
Resumo: INTRODUÇÃO
O câncer gástrico é um dos mais prevalentes cânceres no mundo e uma das mais frequentes causas de morte relacionada a câncer(1,2). Embora a mortalidade venha diminuindo, é um tumor agressivo, usualmente detectado em fases avançadas e com sobrevida média em cinco anos menor que 20%(1,3,4). Entretanto, se diagnosticado precocemente, o tratamento tem potencial curativo, com sobrevida média em cinco anos superior a 90%(1,3). Os principais fatores relacionados ao prognóstico e planejamento terapêutico são profundidade do tumor, acometimento linfonodal e metástase a distância(5,6). No Brasil, utiliza-se para o estadiamento oncológico o sistema tumor-linfonodo-metástase (TNM), mantido colaborativamente entre a International Union for Cancer Control e o American Joint Committee on Cancer(7,8), atualmente na oitava edição, mantendo a classificação apresentada na sétima edição, a seguir caracterizado: • T1 – Tumor invade a lâmina própria ou muscular da mucosa ou submucosa: T1a: tumor invade a lâmina própria ou muscular da mucosa; T1b: tumor invade a submucosa. • T2 – Tumor invade a muscular própria. • T3 – Tumor penetra a subserosa, mas sem invadir o peritônio visceral. • T4a – Tumor invade a serosa (peritônio visceral). • T4b – Tumor invade estruturas adjacentes. O ultrassom endoscópico vem sendo utilizado desde 1980 como método padrão ouro para avaliar a profundidade de acometimento da parede gástrica e a extensão local dos tumores gástricos (estádio T)(3,4,9). Entretanto, apresenta desvantagens: é um método invasivo, operador dependente, requer sedação e é limitado para lesões estenóticas(7,9). A despeito do detalhamento da lesão, não é adequado para avaliar metástases a distância, acometimento linfonodal e disseminação peritonial(10,11). Além disso, a disponibilidade é limitada no Brasil, inclusive em grandes centros, sendo também de alto custo. A tomografia computadorizada (TC) é rotineiramente utilizada para o estadiamento oncológico. Especificamente para o câncer gástrico, cumpria o papel de avaliar a presença de metástases a distância e invasão direta da lesão para órgãos adjacentes(1,12). Fruto do grande avanço tecnológico nas últimas décadas, a TC com multidetectores (TCMD) permite a realização de exames com cortes mais finos e mais rápidos, o que melhorou significativamente a resolução da imagem e o uso das técnicas de reformatação multiplanar e reconstrução tridimensional. O uso dessas diferentes técnicas de reconstrução aumentou a precisão diagnóstica para a detecção de lesões mucosas sutis que não são detectadas em imagens bidimensionais, oferecendo uma visão global do estômago com a localização exata do tumor e o estadiamento preciso, contribuindo para o planejamento eficaz do tratamento(13,14). Atualmente, com estudos de boa qualidade com TCMD, é possível avaliar a extensão da lesão para o tecido adiposo perigástrico, bem como detectar linfonodopatia regional e sinais de carcinomatose peritonial limitada(6,10,12,15,16). Estudos demonstraram que com adequada distensão gástrica, a TCMD é capaz de detectar pequenas lesões, bem como avaliar a profundidade de acometimento neoplásico das camadas da parede gástrica, diferenciando os estádios T1-T2, T3 e T4(9,10,15,16). A TCMD com protocolo gástrico ainda permite a realização de gastroscopia virtual (GV), técnica de reconstrução tridimensional com navegação endoluminal por meio de software específico, que possibilita a detecção de alterações na mucosa e submucosa da parede gástrica(1,9,10,17). MATERIAIS E MÉTODOS Estudo retrospectivo, de corte transversal, unicêntrico, realizado mediante revisão de imagens de TC com protocolo gástrico e GV realizadas no estadiamento do câncer gástrico, comparando com o resultado anatomopatológico. O estudo foi aprovado pelo comitê de ética da instituição, antes do início da coleta dos dados. Foram incluídos 16 pacientes, no período de setembro de 2015 a dezembro de 2016, que realizaram TCMD com protocolo gástrico, num centro oncológico de referência. Desses pacientes, dois foram excluídos do estudo – um por perda de seguimento e outro por não ter realizado cirurgia. Todos os pacientes incluídos no estudo foram submetidos a gastrectomia total ou parcial associada a linfadenectomia. Em todos os casos, a peça cirúrgica foi submetida a estudo histopatológico padronizado, com avaliação da profundidade da lesão nas camadas da parede gástrica, da presença de extensão tumoral para peritônio perigástrico e de acometimento linfonodal, sendo utilizada a classificação TNM. O estadiamento T e N pela TCMD com protocolo gástrico foi comparado com o estadiamento patológico final, para análise de sensibilidade, especificidade e acurácia da técnica. Protocolo de TC Os exames tomográficos foram realizados em tomógrafo multidetectores com 16 canais (Brilliance Big Bore; Philips Healthcare, Cleveland, OH, EUA), em aquisição volumétrica no plano axial com colimação de 1,25 mm. Para melhor avaliação da parede gástrica, foi realizado protocolo gástrico com as seguintes especificações: jejum de 8 horas; uso de medicação antiespasmódica por via intravenosa 10 minutos antes do exame; ingestão de dois envelopes de sal efervescente diluídos em 10 mL de água, imediatamente antes da aquisição das imagens. Após a obtenção de imagens do abdome superior na fase pré-contraste, foi realizado o estudo dinâmico com os seguintes parâmetros: injeção intravenosa de contraste iodado não iônico (Optiray; Mallinckrodt Inc., Raleigh, NC, EUA), com volume de 85–100 mL conforme peso do paciente, com velocidade de fluxo de 2,5–3,0 mL/s; imagens do abdome superior na fase arterial; imagens do abdome superior e pelve na fase portal; imagens do abdome superior e pelve na fase de equilíbrio venoso. A fase de equilíbrio deve ser realizada em decúbito que garanta a melhor distensão da porção do estômago onde está localizada a lesão (dorsal, oblíquo direito ou oblíquo esquerdo). Estadiamento T e análise das imagens Os exames foram analisados por um mesmo radiologista com experiência em imagem oncológica abdominal. O radiologista tinha conhecimento de que as imagens correspondiam a exames de pacientes com diagnóstico de câncer gástrico, além de ter a informação de tamanho e localização da lesão na endoscopia. Contudo, não havia informação sobre os achados patológicos. O estadiamento T foi realizado pela análise das imagens no plano axial e nas reformatações nos planos coronal e sagital, seguida da realização de navegação endoluminal mediante reconstrução tridimensional utilizando software específico do programa Aquarius iNtuition (TeraRecon, Inc., Foster City, CA, EUA) ou da Vitrea Workstation (Canon Medical Systems do Brasil, Campinas, SP, Brasil). Os critérios de imagem utilizados para avaliação da extensão da lesão na parede gástrica foram os mesmos utilizados em estudos anteriores para TCMD(1,5,6,9,17), compatíveis com a classificação TNM(7,8) e a seguir caracterizados: • T1 – Alterações não evidentes na parede gástrica. Espessamento focal da parede com ou sem realce da camada interna e uma faixa de baixa densidade na base da lesão correspondendo à camada submucosa preservada. Apenas realce focal, sem espessamento da parede. • T2 – Espessamento completo da parede gástrica acompanhado de desaparecimento ou interrupção da faixa de baixa densidade, mantendo contorno externo nítido e liso. Não há abaulamento do contorno externo gástrico pelo tumor. Plano adiposo perigástrico preservado. • T3 – Espessamento completo da parede gástrica acompanhado de desaparecimento ou interrupção da faixa de baixa densidade, mantendo contorno externo nítido, mas com leve abaulamento da camada externa pelo tumor. Plano adiposo perigástrico preservado. • T4 – Espessamento nodular ou irregular da camada externa da parede gástrica circundando o tumor. Densificação dos planos adiposos perigástricos ou invasão de estruturas/órgãos adjacentes. RESULTADOS Dezenove pacientes realizaram TCMD com protocolo gástrico. Desses, três pacientes não tiveram diagnóstico histológico de adenocarcinoma (dois com tumor estromal gastrintestinal e um com leiomioma) e foram excluídos da análise. Dos 16 pacientes com confirmação histológica de adenocarcinoma pela biópsia endoscópica, perdeu-se o seguimento de um, que foi excluído da análise. Outro paciente foi excluído devido ao estadiamento clínico M1 pelo achado de carcinomatose peritonial na tomografia, sendo realizado apenas tratamento sistêmico com quimioterapia. Foram incluídos 14 pacientes na análise, com idade média de 61,5 anos (31–89 anos), sendo 53,8% do sexo masculino. Todos os pacientes tinham confirmação histológica de adenocarcinoma, e a maioria correspondia a adenocarcinoma pouco ou moderadamente diferenciado (55,2%). Em todos os casos, as imagens de TCMD com protocolo gástrico e GV possibilitaram a identificação do tumor gástrico e foram consideradas adequadas para o estadiamento. Em 35,7% dos casos, as lesões gástricas foram classificadas como T1/T2, em 28,5% como T3 e em 35,7% como T4. Quanto ao estadiamento linfonodal, 11 pacientes exibiam linfonodos suspeitos (N positivo), representando 68,7%. Em 75% dos casos, a TC de abdome não demonstrou metástases a distância (M0). Treze pacientes foram submetidos a ressecção cirúrgica; desses, oito foram submetidos a quimioterapia neoadjuvante (61,5%). Com relação ao estadiamento patológico, cinco pacientes (35,7%) apresentaram sinais de invasão da submucosa ou lâmina própria (T1), dois (14,2%), sinais de invasão da camada muscular (T2), três (21,4%) tinham invasão da serosa (T3) e três (21,4%) apresentaram sinais de invasão do peritônio ou de estruturas vizinhas (T4). Um paciente com estadiamento T4N+ pela TC teve a proposta de ressecção cirúrgica cancelada após achado de lesão T4 (por infiltração do peritônio perigástrico) associada a carcinomatose peritonial na videolaparoscopia estadiadora, confirmada com biópsia. Esse paciente foi, então, classificado como cT4yN3pM1. Os valores de sensibilidade e especificidade do estadiamento foram calculados separadamente, em três grupos, sendo T1/T2, T3 e T4 (Tabela 1), baseados na concordância entre o estadiamento por TC e o anatomopatológico (Tabela 2). 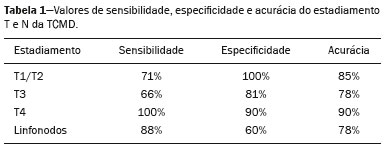 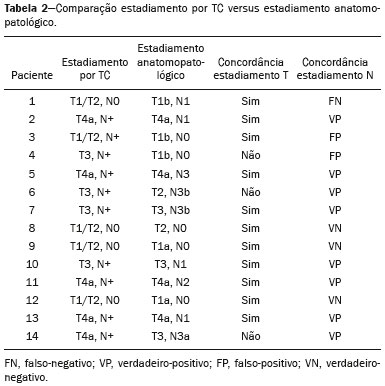 DISCUSSÃO Atualmente, com o avanço nas modalidades terapêuticas e maior evidência do benefício da quimioterapia neoadjuvante para os estádios clínicos T3 e T4 e/ou N+ do câncer gástrico, as técnicas de imagem contribuem de modo marcante na decisão terapêutica dos pacientes(18). A técnica padrão ouro para o estadiamento local do câncer gástrico é o ultrassom endoscópico. Em metanálise sistemática, Kwee et al. demonstraram taxas variáveis de acurácia no diagnóstico do estadiamento T (65–92%), além de sensibilidade de 70,8% e especificidade de 84,6% na detecção de acometimento linfonodal perigástrico(19). Estudos iniciais comparando o estadiamento local por ultrassom endoscópico e a TC apresentaram resultados decepcionantes(20). Entretanto, nos últimos anos, deu-se grande avanço tecnológico com a TCMD, permitindo aquisição de imagens com cortes finos e alta resolução, reformatações multiplanares e reconstrução tridimensional. Todas essas melhorias, aliadas ao desenvolvimento de novos protocolos, contribuíram para aumento da sensibilidade e da acurácia da TC no estadiamento local do câncer gástrico(9). Além disso, softwares para navegação endoluminal têm auxiliado na detecção de lesões precoces de mucosa e submucosa (T1/T2) (Figura 1), por proporcionar avaliação da superfície interna do órgão. As imagens virtuais geralmente superam os limites temporais da gastroscopia ótica na avaliação de lesões da pequena curvatura e do bulbo duodenal, além de possibilitar a navegação retrospectiva para avaliar possíveis pontos-cegos(21). Ainda, exibe as vantagens de ser método não invasivo, amplamente disponível e de menor custo. 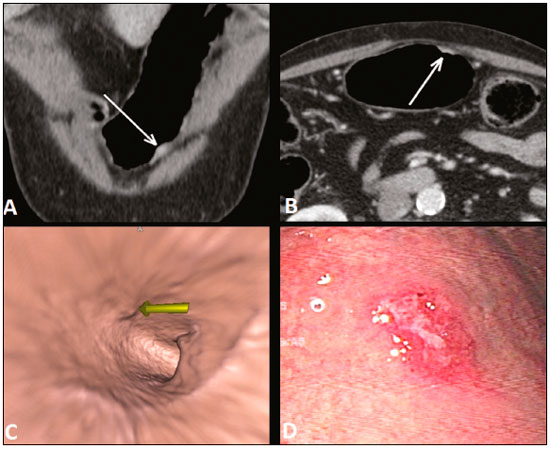 Figura 1. A,B: Cortes coronal e axial de TC demonstrando espessamento parietal focal (setas) na parede anterior da grande curvatura do corpo gástrico, com realce pós-contraste poupando a serosa. C: Reconstrução tridimensional com estudo de GV mostrando lesão irregular na superfície interna do estômago, podendo corresponder a ulceração. D: Endoscopia digestiva demonstrando lesão de aspecto infiltrativo hiperemiada no corpo distal da grande curvatura. Estadiamento por TC: T1/T2N0. Anatomopatológico: T1N0. A aplicação do protocolo gástrico garante distensão gástrica ótima, sendo fundamental para a adequada avaliação de espessamentos focais da parede gástrica e visualização da superfície interna do estômago por meio da GV. Um estômago colapsado pode obscurecer uma lesão ou simular uma doença. Estudos recentes demonstraram valores de acurácia semelhantes da TCMD com protocolo gástrico em relação ao ultrassom endoscópico(9,22). Kim et al.(12) relataram valores de sensibilidade de 62–93% e especificidade de 90–97%. Outro estudo comparou a acurácia da TCMD no estadiamento T do câncer gástrico, utilizando a análise no plano axial (modo bidimensional isolado) ou associando a análise multiplanar e reconstrução tridimensional, com melhora significativa da performance diagnóstica (73% versus 89%)(13), reafirmando a importância da associação dessas técnicas na avaliação das imagens. Nosso trabalho não focou em diferenciar lesões T1 e T2, apesar de estudos recentes terem defendido que a TCMD com protocolo gástrico pode alcançar a resolução de imagem necessária para tal distinção. Do ponto de vista clínico, a diferenciação entre lesões T1 e T2 não é fundamental, uma vez que em ambos os estádios não há recomendação para terapia neoadjuvante. Classificamos os grupos em T1/T2, T3 e T4, utilizando os novos critérios de padrões de acometimento da parede gástrica. Os valores de sensibilidade, especificidade e acurácia foram semelhantes aos de outros estudos. Três pacientes não apresentaram concordância entre o estadiamento por TCMD e o patológico. Dois deles foram classificados em estádio T3 pela TCMD e no estadiamento patológico final foram classificados em T1b e T2. Outro paciente, classificado como T4 pela TCMD, teve estadiamento patológico T3. Ressaltamos que os três casos foram submetidos a quimioterapia neoadjuvante após o exame tomográfico de estadiamento, podendo tal discordância corresponder a um downstage por resposta terapêutica. Não houve casos de lesões com estadiamento patológico superior ao da imagem. Os demais pacientes apresentaram concordância entre os achados de imagem e doença. Algumas lesões limítrofes T2/T3 podem ser difíceis de serem definidas na TCMD. Alguns fatores podem dificultar na diferenciação, como a variação da quantidade de tecido adiposo de paciente para paciente e a distensão exagerada da câmara gástrica, reduzindo a área de realce(23). Para lesões limítrofes, pode ainda haver dificuldade em quantificar o borramento do plano perigástrico. Algumas lesões T2 podem causar discreto borramento da gordura perigástrica por reação desmoplásica. Habermann et al.(22) utilizaram o mesmo critério do ultrassom endoscópico para diferenciar reação desmoplásica e infiltração tumoral, ou seja, quando o borramento ocupa menos de um terço do limite tumoral, a lesão é classificada em T2, e quando vai além disso, é classificada em T3. De acordo com esse estudo, não houve overstaging de tumores T2 quando aplicado tal critério. A diferenciação entre lesões T3 (Figura 2) e T4 (Figuras 3 e 4) é muito importante, tendo em vista a dificuldade operatória das lesões profundas ou que se estendam para estruturas vizinhas, além de contribuir para a indicação de terapias associadas, como quimioterapia intraperitonial hipertérmica. Tumores T4a geralmente apresentam borramento mais evidente da gordura perigástrica do que os tumores T3, com estriação densa ou até mesmo aspecto nodular(5,12). Para lesões T4b, observa-se invasão direta de estruturas ou órgãos adjacentes. A reconstrução tridimensional é útil e deve ser utilizada na diferenciação entre essas formas de acometimento. 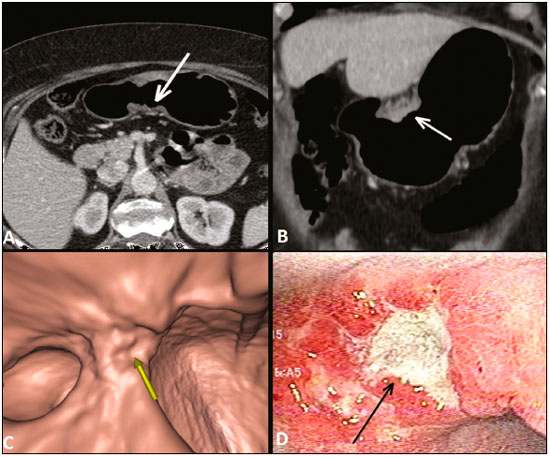 Figura 2. A,B,C: Cortes axial e coronal de TC associados a estudo por GV (seta amarela) mostrando lesão ulcerada na incisura angular (setas). D: Imagem de estudo endoscópico identificando lesão ulcerada, friável, no mesmo local citado no estudo de TC (seta). Estadiamento por TC: T3. Anatomopatológico: T3. 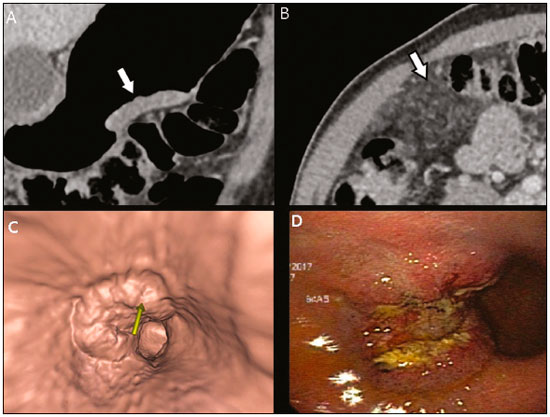 Figura 3. A,B: Cortes coronal e axial de TC demonstrando espessamento parietal irregular com realce pós-contraste acometendo a grande curvatura gástrica (seta), associado a borramento da gordura omental no hipocôndrio direito (seta), sugestivo de carcinomatose peritonial. C,D: GV e endoscopia revelando lesão ulcerada e elevada. Estadiamento por TC: T4a. Anatomopatológico: T4a. 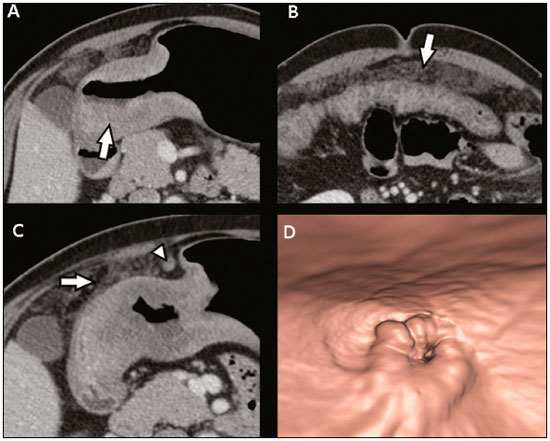 Figura 4. A,B: Corte axial de TCmostrando espessamento e realce de toda a parede gástrica antropilórica (seta), associado a densificação de aspecto nodular no peritônio, sugestivo de carcinomatose peritonial (seta). C: Obliteração dos planos adiposos perigástricos (seta) e linfonodomegalia adjacente (cabeça de seta). D: Estudo com GV demonstrando lesão estenosante da região antropilórica. Estadiamento por TC: T4N+. Anatomopatológico: T4bN2. Um dos fatores que influenciam diretamente no prognóstico do paciente é o acometimento linfonodal. Em uma metanálise, Kwee et al.(11) encontraram valores de sensibilidade variando entre 62,5–93,0% e especificidade variando entre 90,5–97,9% no estadiamento linfonodal pela TCMD. Um dos motivos da oscilação entre os diversos estudos é a variedade de critérios utilizados para classificar um linfonodo como comprometido, sendo o parâmetro dimensional o mais utilizado, com limite de corte variando de 5 a 10 mm no menor diâmetro(23). Nós definimos comprometimento linfonodal perigástrico quando o menor diâmetro é maior que 6 mm ou quando o maior diâmetro é igual ou superior a 8 mm. Outro critério valorizado é a presença de necrose(14). Em nosso estudo, os valores de sensibilidade e especificidade foram 60% e 80%, respectivamente. Importante ressaltar que na GV é impossível avaliar envolvimento tumoral perigástrico, presença de linfonodopatias regionais e metástases a distância, portanto, a interpretação deve sempre associar a análise das imagens do plano axial e reformatação multiplanar com os achados da GV(13). Outras limitações da GV estão relacionadas ao protocolo de exame específico, que requer preparo do paciente com jejum prolongado (oito horas), uso de medicações adicionais e médico radiologista acompanhando a realização do exame. Além disso, demanda tempo adicional do radiologista para realização da reconstrução tridimensional e navegação endoluminal, somando em média 20 a 30 minutos por paciente. Nosso estudo apresenta limitações, como o pequeno número de pacientes, alguns submetidos a quimioterapia neoadjuvante, aumentando a probabilidade de discordância entre os achados. Apesar de representar nossa experiência inicial, acreditamos que a TCMD com protocolo gástrico traz benefícios no estadiamento clínico do câncer gástrico, como demonstrado por várias publicações internacionais. Estudos adicionais, com amostra maior de pacientes, podem ajudar a confirmar os resultados que vêm sendo apresentados nos últimos anos e também avaliar o impacto da TC no manejo desses pacientes. Em conclusão, a TCMD vem se consolidando como método acessível e não invasivo para avaliação da extensão local e do acometimento linfonodal no estadiamento do câncer gástrico. Quando realizada com protocolo gástrico, fornece informações adicionais para melhor decisão terapêutica, apresentando boa acurácia ao diferenciar as lesões T1/T2, T3 ou T4, podendo ser considerada método alternativo ao ultrassom endoscópico. REFERÊNCIAS 1. Kumano S, Murakami T, Kim T, et al. T staging of gastric cancer: role of multi-detector row CT. Radiology. 2005;237:961–6. 2. Brasil. Ministério da Saúde. Instituto Nacional de Câncer José Alencar Gomes da Silva. Estimativa/2016: incidência de câncer no Brasil. Rio de Janeiro, RJ: INCA; 2016. 3. Hallissey MT, Allum WH, Jewkes AJ, et al. Early detection of gastric cancer. BMJ. 1990;301:513–5. 4. Hohenberger P, Gretschel S. Gastric cancer. Lancet. 2003;362:305– 15. 5. Adachi Y, Shiraishi N, Suematsu T, et al. Most important lymph node information in gastric cancer: multivariate prognostic study. Ann Surg Oncol. 2000;7:503–7. 6. Kim AY, Kim HJ, Ha HK. Gastric cancer by multidetector row CT: preoperative staging. Abdom Imaging. 2005;30:465–72. 7. Edge SB, Byrd DR, Compton CC, et al. AJCC cancer staging manual. 7th ed. New York, NY: Springer; 2010. 8. Amin MB, Edge S, Green F, et al. AJCC cancer staging manual. 8th ed. New York, NY: Springer; 2017. 9. Furukawa K, Miyahara R, Itoh A, et al. Diagnosis of the invasion depth of gastric cancer using MDCT with virtual gastroscopy: comparison with staging with endoscopic ultrasound. AJR Am J Roentgenol. 2011;197:867–75. 10. Chen CY, Wu DC, Kuo YT, et al. MDCT for differentiation of category T1 and T2 malignant lesions from benign gastric ulcers. AJR Am J Roentgenol. 2008;190:1505–11. 11. Kwee RM, Kwee TC. Imaging in local staging of gastric cancer: a systematic review. J Clin Oncol. 2007;25:2107–16. 12. Kim JH, Eun HW, Chi JH, et al. Diagnostic performance of virtual gastroscopy using MDCT in early gastric cancer compared with 2D axial CT: focusing on interobserver variation. AJR Am J Roentgenol. 2007;189:299–305. 13. Kim JH, Eun HW, Hong SS, et al. Gastric cancer detection using MDCT compared with 2D axial CT: diagnostic accuracy of three different reconstruction techniques. Abdom Imaging. 2012;37:541–8. 14. Kim JW, Shin SS, Heo SH, et al. The role of three-dimensional multidetector CT gastrography in the preoperative imaging of stomach cancer: emphasis on detection and localization of the tumor. Korean J Radiol. 2015;16:80–9. 15. Shen Y, Kang HK, Jeong YY, et al. Evaluation of early gastric cancer at multidetector CT with multiplanar reformation and virtual endoscopy. Radiographics. 2011;31:189–99. 16. Barros RHO, Penachim TJ, Martins DL, et al. Multidetector computed tomography in the preoperative staging of gastric adenocarcinoma. Radiol Bras. 2015;48:74–80. 17. Moschetta M, Scardapane A, Telegrafo M, et al. Differential diagnosis between benign and malignant ulcers: 320-row CT virtual gastroscopy. Abdom Imaging. 2012;37:1066–73. 18. Schuhmacher C, Gretschel S, Lordick F, et al. Neoadjuvant chemotherapy compared with surgery alone for locally advanced cancer of the stomach and cardia: European Organisation for Research and Treatment of Cancer randomized trial 40954. J Clin Oncol. 2010;28:5210–8. 19. Kwee RM, Kwee TC. Imaging in assessing lymph node status in gastric cancer. Gastric Cancer. 2009;12:6–22. 20. Botet JF, Lightdale CJ, Zauber AG, et al. Preoperative staging of gastric cancer: comparison of endoscopic US and dynamic CT. Radiology. 1991;181:426–32. 21. Inamoto K, Kouzai K, Ueeda T, et al. CT virtual endoscopy of the stomach: comparison study with gastric fiberscopy. Abdom Imaging. 2005;30:473–9. 22. Habermann CR, Weiss F, Riecken R, et al. Preoperative staging of gastric adenocarcinoma: comparison of helical CT and endoscopic US. Radiology. 2004;230:465–71. 23. Chi JI, Joo I, Lee JM. State-of-the-art preoperative staging of gastric cancer by MDCT and magnetic resonance imaging. World J Gastroenterol. 2014;20:4546–57. 1. Doutores, Médicos Radiologistas do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 2. Médico Residente do Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 3. Médica Radiologista do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 4. Doutora, Coordenadora do Setor de Tomografia Computadorizada do A.C. Camargo Cancer Center, São Paulo, SP, Brasil 5. Doutor, Diretor do Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil Endereço para correspondência: Dra. Maria Fernanda Arruda Almeida A.C. Camargo Cancer Center – Departamento de Imagem Rua Professor Antônio Prudente, 211, Liberdade São Paulo, SP, Brasil, 01509-010 E-mail: maria.almeida@ accamargo.org.br Recebido para publicação em 9/6/2017 Aceito, após revisão, em 11/8/2017 Trabalho realizado no Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554