Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 51 nº 1 - Jan. / Fev. of 2018
Vol. 51 nº 1 - Jan. / Fev. of 2018
|
ENSAIO ICONOGRÁFICO
|
|
|
|
|
Autho(rs): Denislene da Silva Eduardo1; Suyane Benevides Franco2; José Daniel Vieira de Castro3 |
|
|
Descritores: Sela turca; Ressonância magnética; Hipófise. |
|
|
Resumo: INTRODUÇÃO
A região selar, apesar de pequena, abrange uma série de estruturas importantes que incluem o componente ósseo da sela turca, a glândula hipofisária, o seio cavernoso e a cisterna suprasselar. As alterações dessa região podem se manifestar por consequência de hipoprodução ou hiperprodução hormonal ou por sinais e sintomas neurológicos decorrentes da compressão de estruturas adjacentes. Praticamente, qualquer um destes componentes pode originar doenças que variam de inócuas a graves. (1,2) A ressonância magnética (RM) é, atualmente, o método de avaliação por imagem de eleição, tendo suplantado a tomografia computadorizada (TC) na avaliação da região selar/justasselar(3). Os adenomas hipofisários são as lesões mais frequentes nessa região, porém, várias outras lesões com origem em outras estruturas podem acometer essa mesma localização, às vezes gerando dificuldades diagnósticas. Avaliamos, retrospectivamente, 70 casos de anormalidades selares/justasselares comprovados histopatologicamente ou clinicolaboratorialmente, com o objetivo de demonstrar aspectos comuns e incomuns dessas alterações que auxiliem no diagnóstico diferencial. ADENOMA Adenomas pituitários representam as lesões intrasselares mais comuns. Classificam-se, quanto à dimensão, em macroadenomas (≥ 10 mm) e microadenomas (< 10 mm), e quanto à produção hormonal, em secretores e não secretores(4–6). Tipicamente, os adenomas são hipointensos nas sequências ponderadas em T1 e têm sinal variável em T2. Um aspecto importante é que a maioria, por serem hipointensos em T1, pode ser detectada nesta sequência, o que a torna a mais importante do protocolo de avaliação por RM dessa alteração, pois permite o diagnóstico mesmo sem realização de contraste. Outro aspecto importante é que a maioria deles apresenta realce pós-contraste mais lento que o parênquima normal, tornando importante a realização de sequências com injeção dinâmica do meio de contraste para detecção de microadenomas (Figura 1)(7–9). 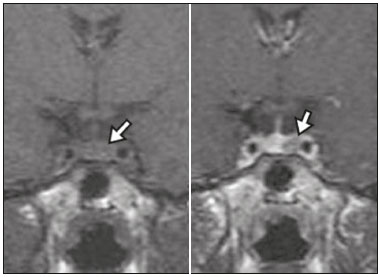 Figura 1. Sequências pós-contraste dinâmicas coronais ponderadas em T1 mostrando realce mais lento que o parênquima hipofisário de microadenoma na asa esquerda da adeno-hipófise (setas). Dentre os adenomas secretores, os mais comuns são os produtores de prolactina (prolactinomas). Esses podem ser, na maioria das vezes, tratados exclusivamente farmacologicamente com agonistas dopaminérgicos, os quais podem provocar alterações na imagem que devem ser reconhecidas pelo radiologista (Figura 2)(6). 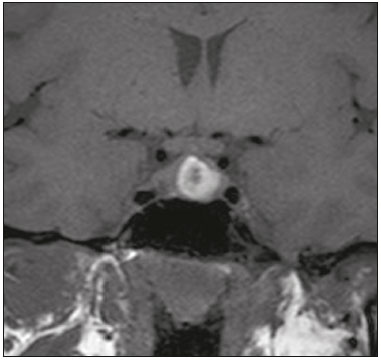 Figura 2. Sequência coronal ponderada em T1, sem contraste paramagnético. Prolactinoma com sinal heterogêneo predominantemente hiperintenso após manejo terapêutico, devido à presença de hemorragia intralesional. Macroadenomas, às vezes, estendem-se além dos limites da sela, podendo invadir o seio cavernoso, o seio esfenoidal ou o clivo, bem como comprimir o quiasma óptico e envolver a artéria carótida interna (Figura 3). Na RM considera-se invasão do seio cavernoso quando pelo menos dois terços da circunferência do segmento cavernoso da artéria carótida interna são englobados pela lesão. Assim, eventualmente, seu diagnóstico diferencial com outras lesões dessa região, como meningiomas e até aneurismas, é necessário(4,5). 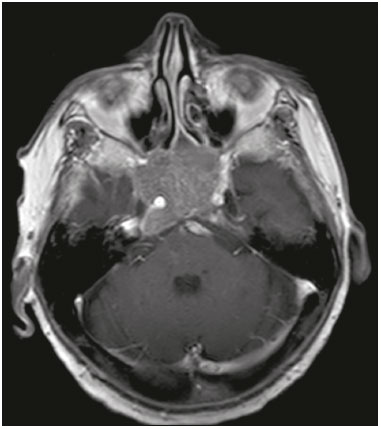 Figura 3. Sequência T1 pós-contraste axial. Macroadenoma com invasão do seio cavernoso, observando-se preservação do calibre da artéria carótida esquerda. Grandes lesões costumam ser heterogêneas, com áreas císticas em permeio decorrentes de degeneração cística e/ou necrose e, eventualmente, podem desenvolver infarto ou hemorragia, por deficiente suprimento vascular(3,8). CRANIOFARINGIOMA Craniofaringiomas são neoplasias epiteliais originadas do remanescente do ducto faríngeo que crescem lentamente e responsáveis por 3% a 5% das neoplasias intracranianas. Há dois picos de incidência, o primeiro ocorrendo entre 10 e 14 anos de idade e o segundo entre a quarta e sexta década da vida. A despeito de a origem ser suprasselar, cerca de 50% estendem-se para a sela turca. A aparência típica consiste em componentes sólido-císticos e calcificações(3,5,9). O tipo clássico, adamantimatoso, geralmente consiste em aspecto cístico e nódulos heterogêneos. O menos comum, o tipo escamoso-papilar, apresenta componente sólido predominante. Nas imagens em T2, o componente cístico apresenta hipersinal, enquanto os componentes sólidos têm sinal heterogêneo. Após a administração de contraste, as porções sólidas apresentam intenso realce heterogêneo, além de realce das paredes císticas (Figura 4)(3,8). 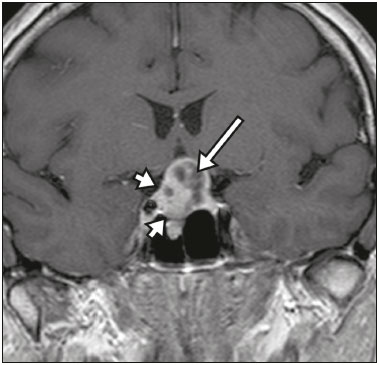 Figura 4. Craniofaringioma adamantimatoso. RM demonstrando componente cístico (seta longa) e componente sólido (setas curtas), o qual exibe realce pelo meio de contraste. Macroadenomas com apoplexia (Figura 5) e bolsas de Rathke podem ter aspectos muito parecidos aos craniofaringiomas, porém, um aspecto importante dos craniofaringiomas é a presença de calcificações. Assim, quando não for possível a confirmação de calcificações na RM, recomenda-se a realização de TC sem contraste para se certificar de sua presença, o que praticamente corrobora o diagnóstico (Figura 6). 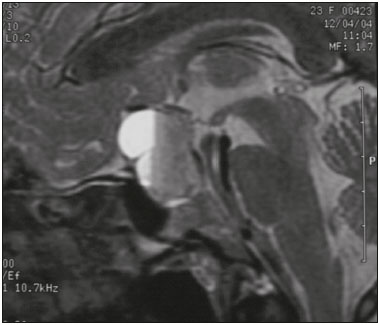 Figura 5. Macroadenoma com apoplexia. RM em corte sagital ponderado em T2 demonstrando lesão expansiva selar com extensão suprasselar, tendo nível líquido-líquido no interior e sinais de hemorragia intralesional. 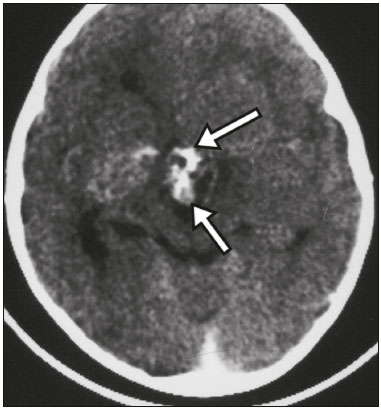 Figura 6. Craniofaringioma. TC sem contraste demonstrando calcificações (setas) no interior da lesão, o que é um importante achado para diagnóstico por imagem. CISTO DA BOLSA DE RATHKE Os cistos da bolsa de Rathke são lesões selares benignas frequentemente assintomáticas, sendo na maior parte das vezes intrasselares. Geralmente são hiperintensas nas sequências ponderadas em T2, e em T1 podem ser hiperintensas ou hipointensas a depender da quantidade de proteína contida no cisto (Figura 7). O diagnóstico diferencial que se impõe com essas lesões é sempre o craniofaringioma. A ausência de calcificações reforça a possibilidade diagnóstica de cisto da bolsa de Rathke(6). 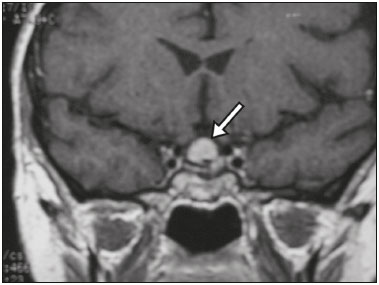 Figura 7. Cisto da bolsa de Rathke. RM em sequência ponderada em T1 no plano coronal demonstrando lesão expansiva cística selar com extensão suprasselar, de contornos regulares e paredes finas (seta). MENINGIOMA Meningiomas da região selar representam 20% a 30% dos meningiomas intracranianos. Na RM apresentam sinal isointenso em T1 e isointenso/hiperintenso em T2, além de realce precoce, geralmente se associando cauda dural (Figura 8). Quando invadem o seio cavernoso, tendem a causar constrição da artéria carótida, o que usualmente não ocorre com adenomas (Figura 9). Podem também apresentar calcificações e ocasionar hiperostose(5–8). 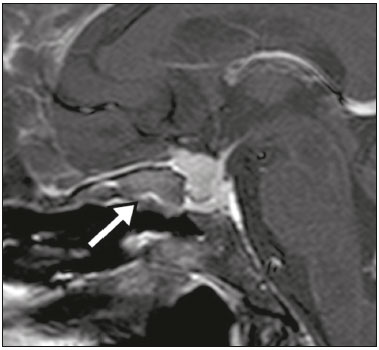 Figura 8. Meningioma suprasselar em imagem de RM em sequência ponderada em T1, plano sagital. Observar a hiperostose do osso esfenoidal (seta) e a nítida separação com a sela pelo diafragma selar, achados que reforçam a hipótese de meningioma. 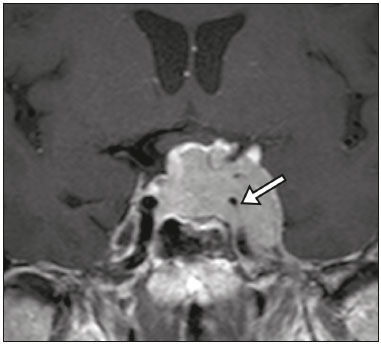 Figura 9. Grande meningioma com invasão do seio cavernoso esquerdo. Sequência T1 pós-gadolínio coronal demonstrando realce homogêneo e envolvimento circunferencial do seio cavernoso esquerdo. Notar a redução do calibre da luz do segmento cavernoso da artéria carótida interna esquerda (seta), achado que é muito sugestivo de meningioma. ANEURISMA Aneurismas da região selar geralmente se originam das porções cavernosas ou supraclinóideas da artéria carótida interna, sendo responsáveis por até 10% de todos os aneurismas cerebrais. A RM faz esse diagnóstico mais facilmente que a TC, pois demonstra ausência de sinal por fluxo (flow void), determinada pelo rápido fluxo no lúmen e sinal heterogêneo nas áreas com fluxo lento e turbulento (Figura 10). Eventualmente, aneurismas trombosados podem causar dificuldades diagnósticas (Figura 11)(3,5). 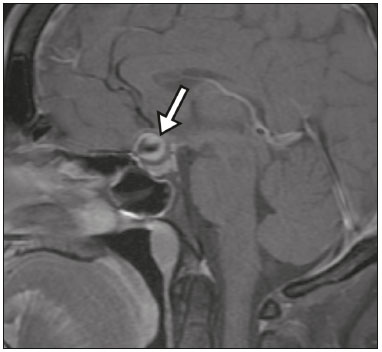 Figura 10. Aneurisma intrasselar identificado pela ausência de sinal (flow void) indicada por seta, devido à alta velocidade de fluxo na sequência pesada em T1. 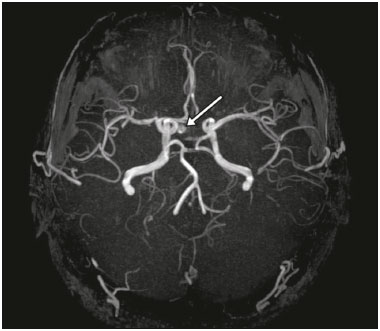 Figura 11. Aneurisma (seta) do segmento cavernoso da artéria carótida interna direita protruindo para o interior da sela turca. A presença de trombose parcial gerou confusão diagnóstica com adenoma com hemorragia, porém, a angio-RM foi capaz de fazer o diagnóstico. HAMARTOMA HIPOTALÂMICO Hamartomas hipotalâmicos consistem em focos de tecido neuronal (substância cinzenta) ectópicos localizados mais frequentemente no túber cinéreo e corpos mamilares. Caracteristicamente, apresentam-se como uma expansão do túber cinéreo, com isossinal à substância cinzenta em T1 e iso/hipersinal em T2, sem realce pelo meio de contraste ou calcificação (Figura 12). Podem ser parahipotalâmicos ou intra-hipotalâmicos (Figura 13), estes últimos mais associados clinicamente a epilepsia com crises do tipo gelásticas e os demais mais associados a puberdade precoce. A estabilidade da lesão ao longo do tempo auxilia no diagnóstico diferencial com outras lesões dessa região, como os gliomas(3,5,6,9). 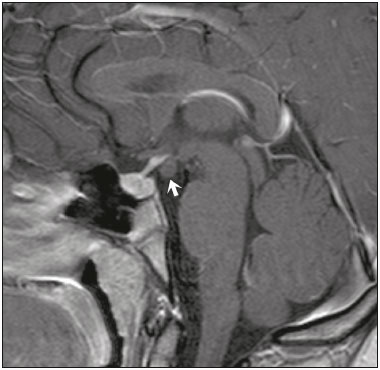 Figura 12. RM em sequência ponderada em T1 pós-contraste no plano sagital mostrando hamartoma para-hipotalâmico em criança com puberdade precoce, entre a haste infundibular e os corpos mamilares (seta). 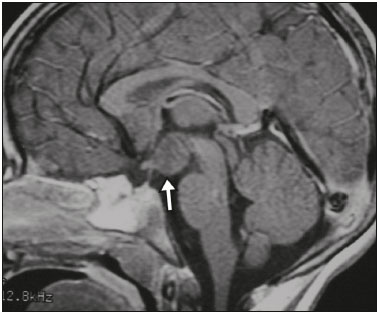 Figura 13. Imagem ponderada em T1 no plano sagital demonstrando hamartoma intra-hipotalâmico (seta) em criança com convulsões tipo gelásticas. HEMANGIOMA Hemangiomas são malformações vasculares encontradas em diversos órgãos, incluindo o sistema nervoso central. Quando extracerebrais, podem se originar do seio cavernoso ou de tecidos vizinhos. Assim como no fígado, apresentam-se na RM como massas bem definidas de baixo a isossinal em T1 e marcado hipersinal em T2 (Figura 14), tendo realce pós-contraste periférico inicialmente, com progressão centrípeta, tornando-se homogêneos tardiamente. A realização da injeção dinâmica (Figura 15) é imprescindível para a caracterização da lesão(10). 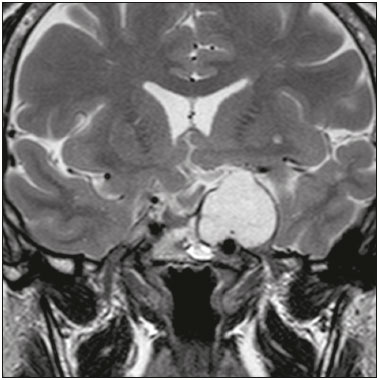 Figura 14. Hemangioma. Ponderação em T2 no plano coronal mostrando lesão parasselar esquerda homogeneamente e fortemente hiperintensa. 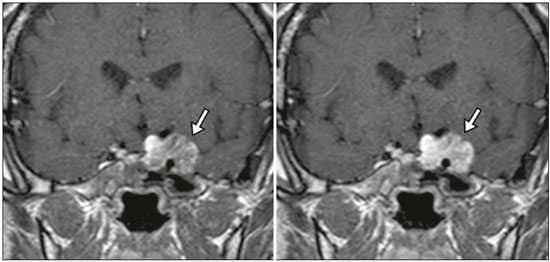 Figura 15. Hemangioma. Ponderações em T1 em planos coronais, dinâmicas após o uso do contraste, mostrando realce inicial predominantemente periférico, com subsequente preenchimento centrípeto. HIPOFISITE Inflamação da glândula hipofisária compreende um grupo complexo de doenças, havendo duas formas histológicas principais: linfocítica (mais comum, autoimune) e não linfocítica (secundária a infecção, sarcoidose ou histiocitose de células de Langerhans). Como a diferenciação radiológica entre ambas é praticamente impossível, a história clínica tem grande valor no diagnóstico diferencial. A RM mostra espessamento da haste hipofisária em combinação com realce intenso pelo contraste (Figura 16)(1,5,11,12). 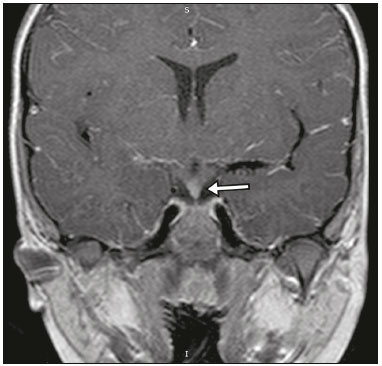 Figura 16. Ponderação em T1 sem contraste no plano coronal, em paciente com histiocitose de células de Langerhans, demonstrando espessamento da haste e realce (seta). NEURO-HIPÓFISE ECTÓPICA A neuro-hipófise normal situa-se no interior da sela turca em situação posterior à adeno-hipófise. É composta de prolongamento de neurônios hipotalâmicos diferenciados para armazenar os hormônios ocitocina e antidiurético. Pode-se encontrá-la em localização ectópica em três situações: por compressão da haste hipofisária por lesão expansiva (Figura 17), por trauma, lesando a haste hipofisária, ou congênita (Figura 18). Esta última situação está relacionada a déficit idiopático de hormônio de crescimento(11,13,14). 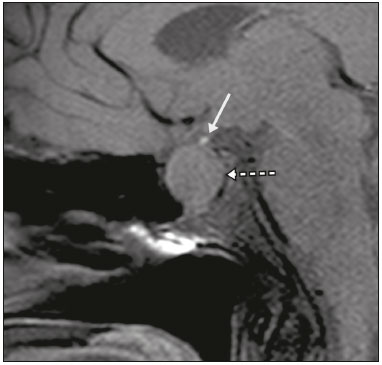 Figura 17. Ponderação em T1 com saturação de gordura em plano sagital mostrando neuro-hipófise ectópica (seta contínua), secundariamente à presença de macroadenoma (seta tracejada). 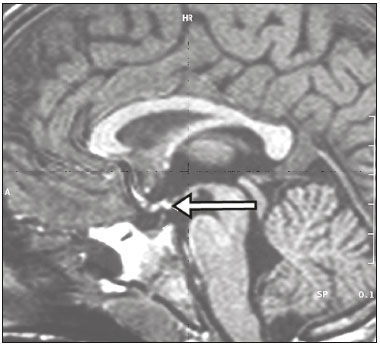 Figura 18. Ponderação em T1 no plano sagital identificando neuro-hipófise ectópica (seta) em paciente com déficit idiopático de hormônio de crescimento. CONCLUSÃO A grande quantidade de lesões que podem acometer a região selar e parasselar impõe ao radiologista, além do conhecimento da anatomia e do conteúdo dessa região, a familiarização com os diversos aspectos possíveis dessas alterações, levando, na maioria das vezes, a um diagnóstico etiológico preciso. REFERÊNCIAS 1. Osborn AG. Neoplasias selares e lesões semelhantes a tumores. In: Osborn AG, editor. Encéfalo de Osborn: imagem, patologia e anatomia. 1ª ed. Porto Alegre, RS: Artmed; 2014. p. 687–732. 2. García-Garrigós E, Arenas-Jiménez JJ, Monjas-Cánovas I, et al. Transsphenoidal approach in endoscopic endonasal surgery for skull base lesions: what radiologists and surgeons need to know. Radiographics. 2015;35:1170–85. 3. Johnsen DE, Woodruff WW, Allen IS, et al. MR imaging of the sellar and juxtasellar regions. Radiographics. 1991;11:727–58. 4. Pierallini A, Caramia F, Falcone C, et al. Pituitary macroadenomas: preoperative evaluation of consistency with diffusion-weighted MR imaging—initial experience. Radiology. 2006;239:223–31. 5. Doerfler A, Richter G. Lesions within and around the pituitary: much more than adenomas. Clin Neuroradiol. 2008;18:5–18. 6. Rodrigues JA. Avaliação radiológica da hipófise e hipotálamo. In: Rodrigues JA, editor. Neuroendocrinologia básica e aplicada. 1ª ed. Rio de Janeiro, RJ: Guanabara Koogan; 2005. p. 495–514. 7. Ginat DT, Meyers SP. Intracranial lesions with high signal intensity on T1-weighted MR images: differential diagnosis. Radiographics. 2012;32:499–516. 8. Bladowska J, Sasiadek M. Diagnostic imaging of the pituitary and parasellar region. In: Rahimi-Movaghar V, editor. Pituitary adenomas. Rijeka, Croatia: InTech Europe; 2012. p. 13–32. 9. Saleem SN, Said AH, Lee DH. Lesions of the hypothalamus: MR imaging diagnostic features. Radiographics. 2007;27:1087–108. 10. Salanitri GC, Stuckey SL, Murphy M. Extracerebral cavernous hemangioma of the cavernous sinus: diagnosis with MR imaging and labeled red cell blood pool scintigraphy. AJNR Am J Neuroradiol. 2004;25:280–4. 11. Bonneville F, Cattin F, Marsot-Dupuch K, et al. T1 signal hyper intensity in the sellar region: spectrum of findings. Radiographics. 2006;26:93–113. 12. Zaveri J, La Q, Yarmish G, et al. More than just Langerhans cell histiocytosis: a radiologic review of histiocytic disorders. Radiographics. 2014;34:2008–24. 13. van der Linden ASA, van Es HW. Case 112: Pituitary stalk transection syndrome with ectopic posterior pituitary gland. Radiology. 2007;243:594–7. 14. Wang CY, Chung HW, Cho NY, et al. Idiopathic growth hormone deficiency in the morphologically normal pituitary gland is associated with perfusion delay. Radiology. 2011;258:213–21. 1. Médica Radiologista da São Carlos Imagem, Fortaleza, CE, Brasil 2. Médica Residente de Radiologia e Diagnóstico por Imagem, Universidade Federal do Ceará (UFC), Fortaleza, CE, Brasil 3. Doutor, Médico Neurorradiologista, Professor Associado de Radiologia do Departamento de Medicina Clínica da Faculdade de Medicina da Universidade Federal do Ceará (UFC), Fortaleza, CE, Brasil Endereço para correspondência: Dra. Denislene da Silva Eduardo Avenida Beira Mar, 3960, ap. 1508, Mucuripe Fortaleza, CE, Brasil, 60165-121 E-mail: denislene.se@gmail.com Trabalho realizado no Hospital Universitário Walter Cantídio da Universidade Federal do Ceará (UFC), Fortaleza, CE, Brasil. Recebido para publicação em 29/2/2016. Aceito, após revisão, em 24/7/2016. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554