Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 50 nº 5 - Set. / Out. of 2017
Vol. 50 nº 5 - Set. / Out. of 2017
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Camila Souza Guatelli1; Almir Galvão Vieira Bitencourt2; Cynthia Aparecida Bueno de Toledo Osório3; Luciana Graziano1; Alessandra Araújo de Castro4; Juliana Alves de Souza5; Elvira Ferreira Marques6; Rubens Chojniak7 |
|
|
Descritores: Neoplasias da mama; Mamografia; Ultrassonografia mamária; Ressonância magnética. |
|
|
Resumo: INTRODUÇÃO
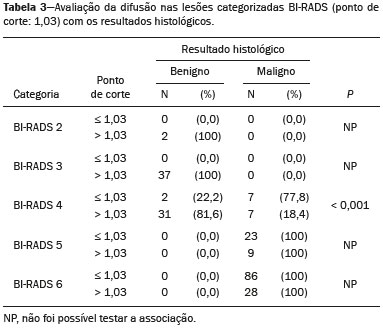
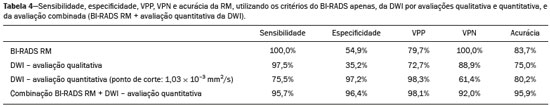
A ressonância magnética (RM), por fornecer avaliação da vascularização do parênquima mamário, tem maior sensibilidade na detecção do câncer de mama em relação a mamografia e ultrassonografia, tornando-a impactante no rastreamento de pacientes de alto risco e com mamas densas(1). A RM apresenta maior acurácia na delimitação da extensão da doença e na detecção de lesões adicionais na mama contralateral durante o estadiamento, contribuindo para o melhor planejamento cirúrgico e terapêutico(2-4). Novas técnicas de RM têm sido desenvolvidas com o objetivo de acrescentar informações funcionais à análise morfológica e cinética e, com isso, melhorar a especificidade do método. Dentre estas técnicas, a que atualmente vem sendo mais estudada é a sequência em difusão (DWI – diffusion-weighted imaging)(5). A DWI é uma sequência obtida pela RM utilizando gradientes que são sensíveis ao movimento das moléculas da água(6). Dessa forma, a DWI demonstra a diferença de movimentação das moléculas de água nos tecidos. A alta proliferação celular nos tumores malignos causa aumento da densidade celular, criando mais barreiras para a difusão das moléculas de água (restrição) e resultando em imagens de hipossinal na DWI. Ao contrário, nos tumores benignos, a densidade celular é menor e o espaço extracelular é maior, promovendo menor restrição à difusão das moléculas de água. A imagem obtida do mapa do coeficiente de difusão aparente (ADC – apparent diffusion coefficient) pode ser analisada de forma qualitativa e quantitativa. Em função destas características, a DWI parece ser uma ferramenta útil para diferenciação entre lesões benignas e malignas, aumentando a especificidade da RM, podendo contribuir para o planejamento e acompanhamento terapêutico, e também na avaliação da resposta à quimioterapia neoadjuvante(7-10). O objetivo deste trabalho foi avaliar o papel da DWI na avaliação de lesões mamárias suspeitas na RM, correlacionando seus achados com os resultados histológicos e imuno-histoquímicos. MATERIAIS E MÉTODOS Foi realizado estudo retrospectivo, descritivo, baseado na análise de prontuários médicos e coleta de dados de um grupo de pacientes que realizaram RM com DWI, no período de agosto de 2010 a dezembro de 2013, em um centro de referência oncológico. O estudo foi aprovado pelo Comitê de Ética em Pesquisa da instituição. Foram selecionados na amostra 238 pacientes que realizaram exames de RM com DWI, com lesões identificadas na RM, e que foram posteriormente submetidos a biópsia percutânea ou cirúrgica. Desses 238 pacientes, foram excluídos 23 que tiveram a avaliação da DWI na RM prejudicada por artefatos de movimentação ou outros motivos técnicos, restando 215 pacientes no estudo com 252 lesões. O exame da RM foi realizado em aparelho de 1,5 T (Signa HDxt; GE Healthcare, Waukesha, WI, EUA) utilizando bobina dedicada a mama. A DWI foi realizada antes da fase dinâmica pós-contraste empregando a técnica ASSET echo-planar imaging no plano axial (TR/TE, 4000/94; matriz, 192 × 192; signal average, 3; espessura de corte, 3 mm; distance factor, 20%). A sensibilização dos gradientes de difusão foi aplicada em duas direções ortogonais com dois valores b: 0 e 750 s/mm2. As imagens da RM das mamas foram revisadas por um radiologista com experiência em imagem da mama, numa estação de trabalho dedicada (Advantage Workstation 4; GE Healthcare). As lesões foram avaliadas e classificadas com base nos critérios do Breast Imaging Reporting and Data System (BI-RADS®) 5a edição para RM, definindo-se os aspectos morfológicos quanto ao tipo de realce (nodular ou não nodular), sua distribuição, forma e contornos, e posteriormente avaliação dinâmica relacionada ao padrão de captação pelo meio de contraste intravenoso. A DWI foi pós-processada com software comercial (Functool 7.4.01d; GE Healthcare), sendo realizadas avaliações qualitativa e quantitativa por meio do cálculo do ADC. Para avaliação qualitativa foi utilizado mapa ADC em escala de cinza, no qual as lesões com sinal alto na DWI que apresentaram queda do sinal no mapa ADC foram classificadas como restrição presente. Para análise quantitativa, foi calculado o valor médio do ADC, selecionando a região de interesse (ROI – region of interest) no interior da lesão, evitando áreas necróticas ou císticas. Os valores do ADC foram calculados segundo a fórmula: 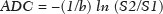 onde: S2 e S1 são as intensidades de sinal dos valores b de 0 e 750, respectivamente(5). Vinte lesões não foram incluídas na análise quantitativa pois não foi possível calcular o valor do ADC devido a limitações do resgate das imagens para a estação de trabalho, sendo obtida apenas a avaliação qualitativa da difusão nesses casos. A coleta dos dados histológicos foi realizada mediante análise da peça cirúrgica, quando disponível, ou do material de biópsia percutânea. Os tipos histológicos foram relatados de acordo com a classificação de tumores da Organização Mundial da Saúde(11) e o grau histológico final de Nottingham, de acordo com a modificação de Elston e Ellis(12) do sistema de graduação Scarff-Bloom- Richardson. Para análise estatística, a normalidade das variáveis foi testada pelo teste de Shapiro-Wilk e as associações foram testadas pelo teste qui-quadrado de Pearson ou o teste exato de Fisher, quando necessário. As variáveis contínuas foram avaliadas por meio do teste t-Student não pareado, da análise de variância e dos testes não paramétricos de Mann-Whitney e Kruskal-Wallis, todas com nível de significância de 5%, sendo, portanto, os resultados considerados estatisticamente significantes os com valor de p inferior a 0,05. Para avaliação da validade diagnóstica da DWI, o resultado histológico foi considerado como padrão ouro. A curva receiver operating characteristic (ROC) foi utilizada para determinar pontos de cortes que melhor classificassem as lesões como suspeitas de malignidade pelo valor do ADC. O modelo de regressão logística analisou a presença ou não de malignidade do tumor em função do acréscimo da DWI como fator preditivo, empregando as variáveis ADC e restrição à difusão. As informações coletadas formaram um banco de dados desenvolvido no programa Excel® para Windows e a análise estatística foi realizada pelos softwares Stata 11 SE (StataCorp LLC, College Station, TX, EUA), SPSS 16.0 (SPSS Inc., Chicago, IL, EUA) e MedCalc 15.6.1 (MedCalc Software, Ostend, Bélgica). RESULTADOS Dos 215 pacientes incluídos no estudo, apenas um era do sexo masculino, e a média de idade foi 49 anos (desvio-padrão de 12 anos), variando de 23 a 88 anos. A maioria dos pacientes avaliados apresentava idade igual ou superior a 40 anos (75,8%), 61 (28,4%) apresentavam histórico familiar positivo para câncer de mama e 19 (8,8%) apresentavam histórico pessoal prévio de câncer de mama. Foram identificadas 252 lesões nos 215 pacientes incluídos, com tamanho médio de 27 mm (desvio-padrão de 22 mm), variando de 4 a 117 mm. Destas lesões, 210 (83,3%) apresentaram realce tipo nodular, 40 (15,8%) apresentaram realce não nodular e 2 (0,8%) não apresentaram realce. Em 106 lesões (42,1%) foram realizadas apenas biópsias percutâneas, em 71 lesões (28,2%) foram realizadas apenas biópsias cirúrgicas e em 75 lesões (29,8%) foram realizadas ambas as biópsias. O resultado das biópsias indicou 91 (36,1%) lesões benignas e 161 (63,9%) lesões malignas. O grupo de lesões benignas incluiu fibroadenomas (n = 34), papilomas (n = 12), fibrose estromal (n = 11), alterações fibrocísticas (n = 8), dentre outros, sendo apenas uma lesão diagnosticada como lesão benigna com atipia (hiperplasia lobular atípica). Dentre os achados histológicos malignos, 11 foram carcinomas ductais in situ (CDIS) e 150 foram carcinomas invasivos, entre os quais 121 foram carcinomas invasivos tipo não especial (NST – no special type). A Tabela 1 mostra a relação das categorias BI-RADS e dos aspectos morfológicos e dinâmicos da RM com os resultados histológicos. Todas as pacientes com BI-RADS 2 e 3 tiveram seus resultados histológicos benignos. No grupo das pacientes com BI-RADS 4, 74,5% dos resultados foram benignos. Na categoria de BI-RADS 5, dentre as 30 lesões assim categorizadas, apenas uma foi benigna, com resultado histológico de lesão esclerosante complexa. Deste modo, encontramos na avaliação pela RM: 100% de sensibilidade, 54,9% de especificidade, 79,7% de valor preditivo positivo (VPP), 100% valor preditivo negativo (VPN) e 83,7% de acurácia. 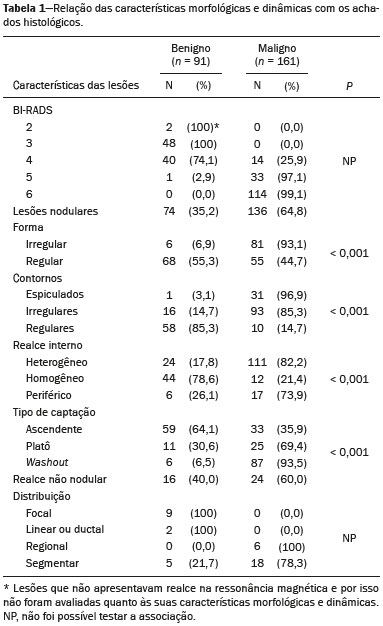 A análise da DWI demonstrou restrição em 216 lesões (85,7%) na análise qualitativa. Na análise quantitativa, o valor do ADC calculado variou de 0,38 × 10–3 mm2/s a 2,69 × 10–3 mm2/s, com média de 1,13 × 10–3 mm2/s e desvio-padrão de 0,38 × 10–3 mm2/s. As Figuras 1 e 2 ilustram exemplos de lesões avaliadas. 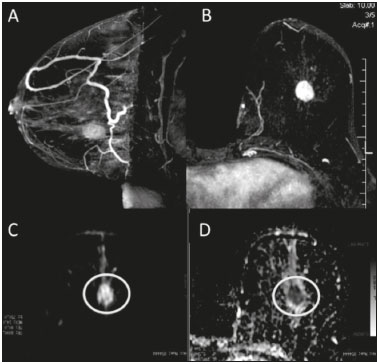 Figura 1. Mulher de 64 anos com nódulo na mama esquerda. Reconstruções MIP da sequência com subtração pós-contraste, nos eixos sagital (A) e axial (B), demonstrando nódulo circunscrito, com realce heterogêneo, que apresenta alto sinal na sequência DWI (C) e baixo sinal no mapa de ADC (D), com valor de ADC de 0,74 × 10–3 mm2/s. O resultado histológico foi compatível com carcinoma invasivo sem tipo especial. 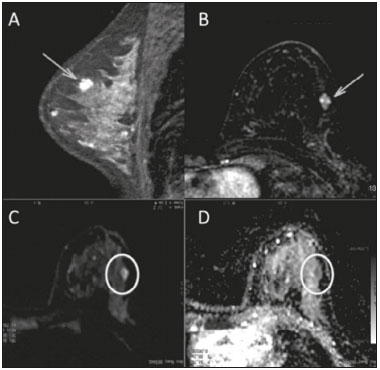 Figura 2. Mulher de 35 anos com carcinoma invasivo na mama direita, que apresentou nódulo na mama esquerda na RM. Imagens da sequência T1 pós-contraste no eixo sagital (A) e subtração no eixo axial (B) mostrando nódulo circunscrito, com realce heterogêneo, que apresenta alto sinal na sequência DWI (C) e baixo sinal no mapa de ADC (D), com valor de ADC de 1,32 × 10–3 mm2/s. O resultado histológico foi compatível com fibroadenoma. A relação da análise qualitativa da DWI e os resultados histológicos demonstrou que a maioria dos pacientes que apresentaram restrição à difusão teve resultado maligno (72,7%), com significância estatística (p < 0,001). Deste modo, a análise qualitativa apresentou 97,5% de sensibilidade, 35,2% de especificidade, 72,7% de VPP, 88,9% de VPN e 75,0% de acurácia. A análise quantitativa da difusão foi obtida pelo cálculo do valor do ADC de cada lesão e posteriormente comparada com os resultados histológicos. A média obtida do valor do ADC nas lesões benignas (1,50 ± 0,35 × 10–3 mm2/s) foi superior à média das lesões malignas (0,97 ± 0,27 × 10–3 mm2/s), com significância estatística (p < 0,001). Os resultados histológicos foram ainda consolidados em três grupos: carcinomas invasivos (n = 149; ADC médio: 0,95 ×10–3 mm2/s); lesões precursoras (n = 12; ADC médio: 1,24 × 10–3 mm2/s), que incluíram 11 lesões com diagnóstico histológico de CDIS e 1 lesão com diagnóstico histológico de hiperplasia lobular atípica; e lesões benignas (n = 71; ADC médio: 1,49 × 10–3 mm2/s). Houve diferença estatisticamente significante entre as médias encontradas (p < 0,001). Dentro dos carcinomas invasivos, não houve associação entre a média do ADC e achados histológicos e imuno- histoquímicos relacionados à agressividade do tumor (Tabela 2). Também não houve diferença significativa no valor do ADC médio entre os CDISs avaliados, de acordo com o grau nuclear. 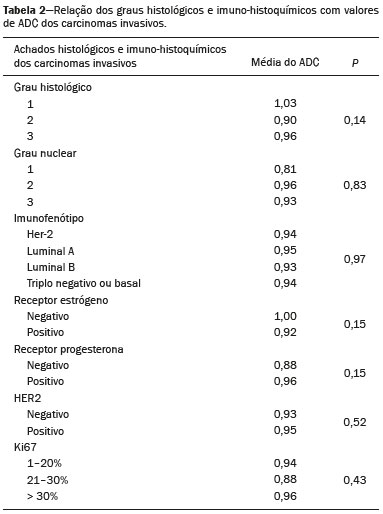 A análise da curva ROC (Figura 3) mostrou área sob a curva ROC de 0,901 (erro-padrão: 0,0199; intervalo de confiança 95%: 0,855–0,936; p < 0,0001). O ponto de corte com maior sensibilidade e especificidade definido pela curva ROC foi 1,03 × 10–3 mm2/s. Considerando este ponto de corte para o valor de ADC, observou-se número maior de lesões malignas nos casos em que o ADC era igual ou menor que o ponto de corte (n = 116; 98,3%), enquanto nos pacientes com ADC maior que o ponto de corte observou-se número maior de resultados benignos (n = 70; 61,4%), com significância estatística (p < 0,001). 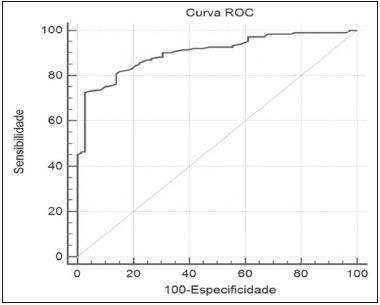 Figura 3. Curva ROC para avaliação da acurácia diagnóstica do valor de ADC no diagnóstico das lesões mamárias. Tivemos duas lesões com valores de ADC suspeitos para malignidade, porém, com resultado histológico benigno (resultados falso-positivos), ambos com diagnóstico de fibrose estromal sem atipia. Além disso, 44 lesões apresentaram valores de ADC acima do ponto de corte, porém, com resultado histológico maligno (resultados falso-negativos). Destes, os diagnósticos foram: 20 pacientes com NST (45,5%), 9 CDISs (20,5%), 6 carcinomas lobulares invasivos (13,6%), 1 linfonodo intramamário com carcinoma (2,3%), 1 carcinoma mucinoso invasivo (2,3%), 1 carcinoma lobular pleomórfico (2,3%), 1 carcinoma tubular invasivo focal (2,3%), 1 carcinoma papilífero invasivo (2,3%), 1 carcinoma misto ductal e lobular (2,3%) e 2 carcinomas metaplásicos (4,5%). Ao analisarmos as características histológicas e imuno-histoquímicas dos carcinomas invasivos falso-negativos, observamos que a maioria apresentou grau histológico 2 ou 3 (91,2%), nuclear 3 (69,0%) e o perfil imunofenótipo mais frequente foi luminal B (51,5%). A Tabela 3 correlaciona os achados da classificação BI-RADS, baseada na avaliação dos critérios morfológicos e dinâmicos, com os valores de ADC obtidos na DWI, utilizando o ponto de corte de 1,03. A Tabela 4 apresenta a sensibilidade, a especificidade, o VPP, o VPN e a acurácia da RM e da DWI isoladamente, assim como da combinação destes parâmetros. Para a combinação dos achados da RM com a DWI, considerou-se a DWI apenas para analisar a categoria BI-RADS 4, da seguinte forma: • BI-RADS 2 ou 3, independente da DWI = provavelmente benigno. • BI-RADS 4, com DWI provavelmente benigna = provavelmente benigno. • BI-RADS 4, com DWI suspeita de malignidade = suspeito de malignidade. • BI-RADS 5 ou 6, independente da DWI = suspeito de malignidade. Com a combinação da DWI com a RM, a acurácia dos testes chegou a 95,9%, com sensibilidade de 95,7% e especificidade de 96,4%. DISCUSSÃO A capacidade da DWI da RM de caracterizar a mobilidade das moléculas de água possibilita fazer a avaliação indireta da microestrutura do tecido graduando sua celularidade. Com base neste princípio, o que se espera é que o uso desta sequência possa aumentar a especificidade do método e, em consequência, diminuir a quantidade de procedimentos invasivos desnecessários relacionados à elevada sensibilidade da sequência pós-contraste(13). Esta sequência já está presente no protocolo da maioria dos aparelhos de RM, de maneira que não implica custos adicionais e apresenta tempo médio de aquisição inferior a 5 minutos. No presente estudo, a avaliação qualitativa na DWI isolada demonstrou elevada sensibilidade (97,5%), mas baixa especificidade (35,2%), não sendo suficiente para diferenciar maligno e benigno na maioria das lesões. Na análise quantitativa, as lesões malignas apresentaram valores do ADC significativamente menores que as lesões benignas. Desta forma, o uso da DWI na avaliação das lesões mamárias do nosso estudo por meio da análise quantitativa (medições do ADC) apresentou uma maior contribuição para a diferenciação entre lesões benignas e malignas. Chen et al. realizaram uma metanálise para avaliar o desempenho da análise quantitativa na DWI. Foram avaliadas 964 lesões, sendo 615 malignas e 349 benignas, nas quais os valores médios de corte do ADC para diferenciação variaram de 0,9 × 10–3 mm2/s a 1,76 × 10–3 mm2/s, enquanto a sensibilidade e a especificidade variaram, respectivamente, de 63% a 100% e 46% a 97%. Os valores médios do ADC encontrados nas lesões benignas variaram de 1,0 × 10–3 mm2/s a 1,82 × 10–3 mm2/s e nas malignas variaram de 0,87 × 10–3 mm2/s a 1,36 × 10–3 mm2/s(9). Esta grande variação se justifica pelos diferentes protocolos utilizados nos estudos. Os valores do ADC de corte obtidos na diferenciação entre benigno e maligno são dependentes dos respectivos valores b escolhidos, e por isso o valor de corte obtido com valor b de 1000 s/mm2 não pode ser utilizado para as lesões avaliadas com o valor b de 500 s/mm2. Nossos resultados de valores do ADC, valor de corte, sensibilidade e especificidade, com valor b de 750 s/mm2, apresentaram concordância com os valores encontrados na literatura. Apesar desta diferença promissora entre lesões benignas e malignas com uso do ADC, existe sobreposição dos valores do ADC de lesões malignas e benignas que nos leva a resultados falso-positivos e falso-negativos. Parsian et al. estudaram as lesões benignas e encontraram que os tipos falso-positivos mais comuns foram as lesões de alto risco, e entre estas a hiperplasia ductal atípica foi o subtipo mais frequente(14). Outros estudos encontraram, com frequência, os papilomas intraductais entre os falso-positivos(15-17). No nosso estudo encontramos apenas 2 casos falso-positivos e ambos resultaram em fibrose estromal sem atipia (valores do ADC de 0,89 × 10–3 mm2/s e 0,90 × 10–3 mm2/s). Sabe-se que valores altos de ADC estão frequentemente associados a alterações ou tumores benignos, porém, alguns NSTs expressam valores de ADC mais elevados que o ponto de corte estabelecido para a malignidade, resultando em falso-negativo(15,17). O subtipo histológico maligno que apresenta valores de ADC mais elevados e, por isso, frequentemente se comporta como falso-negativo na DWI, é o carcinoma mucinoso, que se caracteriza por baixa celularidade e pelo predomínio de mucina, expressando valores altos de ADC na DWI(18,19). No presente estudo, entre os 161 casos malignos, 44 apresentaram resultados falso-negativos utilizando o ponto de corte estabelecido para o ADC, e os achados histológicos neste grupo foram, em ordem decrescente de frequência: NST (45,5%), CDIS (20,5%) e carcinoma lobular invasivo (13,6%). Entre os NSTs falso-negativos na DWI, a maioria eram tumores de grandes dimensões, com índices elevados de grau histológico e nuclear, assim como valores altos de Ki67, o que pode estar associado à presença de necrose e edema, fatores relacionados a aumento dos valores de ADC. Por outro lado, as características morfológicas e dinâmicas da RM, nestes casos, possuem alta sensibilidade e especificidade, e por isso na avaliação conjunta esses tumores seriam diagnosticados independente de qualquer outra sequência adicional. Na nossa população houve um maior percentual de resultados falso-negativos nas lesões com realce tipo não nodular (56,0%), quando comparadas às lesões nodulares (22,2%). Os realces não nodulares geralmente abrangem CDISs, doença fibrocística e carcinomas lobulares e podem conter áreas de tecido fibroglandular e adiposo normais de permeio, ou seja, livres de hiperproliferação celular, que podem afetar os valores de ADC obtidos, elevando-os, e com isso podem resultar em falso-negativos(20-22). Além disso, os valores de ADC elevados relacionados aos realces não nodulares explicam também o predomínio de falso-negativos entre os casos de CDIS da nossa casuística. Apesar da pequena amostra de CDIS (11 casos), estes tumores apresentaram média dos valores de ADC superior à dos carcinomas invasivos. A seleção de um valor limite do ADC para diferenciação das lesões mamárias benignas e malignas deve ser determinada de acordo com o propósito do exame. Se o objetivo é o rastreamento com a DWI, o uso de valores limites mais elevados é recomendado para reduzir falso-negativos, e quando a DWI é utilizada em conjunto com a RM, o uso de um valor limite mais baixo é recomendado, com o intuito de reduzir resultados falso-positivos(9). Alguns estudos compararam a graduação histológica e os marcadores biológicos tumorais (expressão de receptores hormonais de estrogênio e progesterona; receptor de fator de crescimento epidermal humano 2 – HER2; índice de proliferação celular – Ki67) com os valores de ADC, buscando alguma associação, porém os resultados ainda não são consistentes e às vezes são contraditórios(23). Belli et al. estudaram 289 pacientes com carcinoma maligno, e comparando os valores de ADC com os subtipos histológicos e com sua graduação encontraram diferenças significativas nos valores de ADC, tanto entre carcinomas grau 1 e carcinomas grau 2 e 3 quanto entre carcinomas invasivos e CDIS(24). Jeh et al. estudaram 107 casos de NST, e na correlação com fatores prognósticos tumorais encontraram valores de ADC significativamente menores em tumores HER2 negativos quando comparados com os tumores HER2 positivos(25). Mori et al. estudaram 86 casos de NST e demonstraram diferença significativa nos valores de ADC entre os tumores com índices elevado e baixo de Ki67(26). Kim et al. estudaram 67 mulheres com carcinoma invasivo e não encontraram diferença significativa entre os valores de ADC com os fatores prognósticos tumorais, incluindo grau tumoral e expressão de marcadores biológicos(27). No presente estudo não encontramos associação estatisticamente significante entre os valores de ADC e achados histológicos e imuno-histoquímicos relacionados à agressividade nos tumores malignos. Entretanto, as lesões malignas invasivas de nossa casuística apresentaram características similares quanto ao grau histológico e perfil imuno-histoquímico: 91,9% das lesões apresentaram grau histológico 2 ou 3, 74,1% apresentaram grau nuclear 3 e 84,5% corresponderam a lesões luminais A ou B. Esta relativa homogeneidade do grau histológico e do perfil imuno-histoquímico entre as lesão malignas invasivas de nossa amostragem pode ter limitado associações com a DWI. Ao avaliarmos o uso combinado da RM com a DWI em comparação com a RM sem DWI, constatamos um aumento significativo da especificidade (96,4%), sem redução significativa da sensibilidade (95,7%), além de importante acréscimo da acurácia (95,9%), confirmando nossas expectativas e os resultados da literatura(28). A DWI foi particularmente útil nos casos classificados na categoria BI-RADS 4, responsável pela queda da especificidade da RM. Durante análise dos valores de ADC do grupo BI-RADS 4 combinada com a RM, conseguimos propor uma subdivisão da categoria BI-RADS 4 em dois grupos: um provável benigno, representado por lesões com valores de ADC acima do ponto de corte, e outro suspeito de malignidade, representado por lesões com valores de ADC abaixo do ponto de corte, com taxas elevadas de sensibilidade (95,7%), especificidade (96,4%) e acurácia (95,9%). O uso da DWI trouxe maior impacto na avaliação das lesões da categoria BI-RADS 4, possibilitando uma avaliação melhor e mais completa dessas lesões e levando a condutas individualizadas. Estes achados estão de acordo com os resultados de Almeida et al., que demonstraram que a DWI pode melhorar o desempenho diagnóstico da RM e auxiliar na divisão das lesões classificadas como BI-RADS 4 nas subcategorias 4A, 4B e 4C(29). Além disso, a DWI pode corroborar com mais confiabilidade as lesões BI-RADS 4 com resultado benigno, assim como as lesões com resultado histológico discordante na biópsia por fragmento, direcionando para avaliação cirúrgica com maior acurácia. Os resultados do presente estudo devem ser considerados no contexto de algumas limitações. Por se tratar de um estudo retrospectivo, muitos casos foram perdidos em razão da impossibilidade da recuperação das imagens da RM em nosso arquivo digital. Também foram excluídos exames com dificuldades técnicas na aquisição das imagens decorrentes de artefatos de suscetibilidade, promovendo distorção da imagem e prejudicando a caracterização da lesão. Sabe-se que a DWI é muito sensível a tais artefatos e espera-se que as inovações técnicas em andamento possam trazer melhorias na resolução da DWI na mama(20). Além disso, é importante ressaltar que nossa população, por ser proveniente de um centro oncológico, apresenta predomínio de achados patológicos malignos sobre os benignos, o que pode influenciar alguns resultados. Em conclusão, os achados do presente estudo demonstraram que o uso da DWI pode auxiliar na caracterização das lesões mamárias na RM, principalmente daquelas classificadas como BI-RADS 4, aumentando a especificidade e a acurácia diagnóstica da RM. Este método fornece maior confiança no manejo dessas pacientes e, no futuro, com estudos mais amplos, pode inclusive ser utilizado para reduzir o número de biópsias desnecessárias. REFERÊNCIAS 1. Mainiero MB, Lourenco A, Mahoney MC, et al. ACR appropriateness criteria breast cancer screening. J Am Coll Radiol. 2013; 10:11-4. 2. Marques EF, Medeiros MLL, Souza JA, et al. Indications for breast magnetic resonance imaging in an oncology reference center. Radiol Bras. 2011;44:363-6. 3. American College of Radiology. ACR practice guideline for the performance of magnetic resonance imaging (MRI) of the breast. Reston, VA: American College of Radiology; 2014. 4. Mann RM, Kuhl CK, Kinkel K, et al. Breast MRI: guidelines from the European Society of Breast Imaging. Eur Radiol. 2008;18:1307-18. 5. Kul S, Cansu A, Alhan E, et al. Contribution of diffusion-weighted imaging to dynamic contrast-enhanced MRI in the characterization of breast tumors. AJR Am J Roentgenol. 2011;196:210-7. 6. Woodhams R, Ramadan S, Stanwell P, et al. Diffusion-weighted imaging of the breast: principles and clinical applications. Radiographics. 2011;31:1059-84. 7. Partridge SC, DeMartini WB, Kurland BF, et al. Quantitative diffusion-weighted imaging as an adjunct to conventional breast MRI for improved positive predictive value. AJR Am J Roentgenol. 2009;193:1716-22. 8. Arantes Pereira FP, Martins G, Figueiredo E, et al. The use of diffusion-weighted magnetic resonance imaging in the differentiation between benign and malignant breast lesions. Radiol Bras. 2009;42:283-8. 9. Chen X, Li WL, Zhang YL, et al. Meta-analysis of quantitative diffusion-weighted MR imaging in the differential diagnosis of breast lesions. BMC Cancer. 2010;10:693. 10. Yabuuchi H, Matsuo Y, Sunami S, et al. Detection of non-palpable breast cancer in asymptomatic women by using unenhanced diffusion-weighted and T2-weighted MR imaging: comparison with mammography and dynamic contrast-enhanced MR imaging. Eur Radiol. 2011;21:11-7. 11. Tavassoli FA, Devilee P. World Health Organization Classification of Tumours. Pathology and genetics of tumours of the breast and female genital organs. 5th ed. Lyon, France: IARC Press; 2003. 12. Elston CW, Ellis IO. Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up. Histopathology. 1991;19:403-10. 13. Partridge SC, Rahbar H, Murthy R, et al. Improved diagnostic accuracy of breast MRI through combined apparent diffusion coefficients and dynamic contrast-enhanced kinetics. Magn Reson Med. 2011;65:1759-67. 14. Parsian S, Rahbar H, Allison KH, et al. Nonmalignant breast lesions: ADCs of benign and high-risk subtypes assessed as false-positive at dynamic enhanced MR imaging. Radiology. 2012;265:696-706. 15. Woodhams R, Matsunaga K, Kan S, et al. ADC mapping of benign and malignant breast tumors. Magn Reson Med Sci. 2005;4:35-42. 16. Tozaki M, Fukuma E. 1H MR spectroscopy and diffusion-weighted imaging of the breast: are they useful tools for characterizing breast lesions before biopsy? AJR Am J Roentgenol. 2009;193:840-9. 17. Jin G, An N, Jacobs MA, et al. The role of parallel diffusion-weighted imaging and apparent diffusion coefficient (ADC) map values for evaluating breast lesions: preliminary results. Acad Radiol. 2010; 17:456-63. 18. Woodhams R, Kakita S, Hata H, et al. Diffusion-weighted imaging of mucinous carcinoma of the breast: evaluation of apparent diffusion coefficient and signal intensity in correlation with histologic findings. AJR Am J Roentgenol. 2009;193:260-6. 19. Bitencourt AGV, Graziano L, Osório CABT, et al. MRI features of mucinous cancer of the breast: correlation with pathologic findings and other imaging methods. AJR Am J Roentgenol. 2016;206:238-46. 20. Brandão AC, Lehman CD, Partridge SC. Breast magnetic resonance imaging: diffusion-weighted imaging. Magn Reson Imaging Clin N Am. 2013;21:321-36. 21. Partridge SC, Mullins CD, Kurland BF, et al. Apparent diffusion coefficient values for discriminating benign and malignant breast MRI lesions: effects of lesion type and size. AJR Am J Roentgenol. 2010;194:1664-73. 22. Sahin C, Aribal E. The role of apparent diffusion coefficient values in the differential diagnosis of breast lesions in diffusion-weighted MRI. Diagn Interv Radiol. 2013;19:457-62. 23. Costantini M, Belli P, Rinaldi P, et al. Diffusion-weighted imaging in breast cancer: relationship between apparent diffusion coefficient and tumour aggressiveness. Clin Radiol. 2010;65:1005-12. 24. Belli P, Costantini M, Bufi E, et al. Diffusion magnetic resonance imaging in breast cancer characterisation: correlations between the apparent diffusion coefficient and major prognostic factors. Radiol Med. 2015;120:268-76. 25. Jeh SK, Kim SH, Kim HS, et al. Correlation of the apparent diffusion coefficient value and dynamic magnetic resonance imaging findings with prognostic factors in invasive ductal carcinoma. J Magn Reson Imaging. 2011;33:102-9. 26. Mori N, Ota H, Mugikura S, et al. Luminal-type breast cancer: correlation of apparent diffusion coefficients with the Ki-67 labeling index. Radiology. 2015;274:66-73. 27. Kim SH, Cha ES, Kim HS, et al. Diffusion-weighted imaging of breast cancer: correlation of the apparent diffusion coefficient value with prognostic factors. J Magn Reson Imaging. 2009;30:615-20. 28. Yabuuchi H, Matsuo Y, Okafuji T, et al. Enhanced mass on contrast-enhanced breast MR imaging: lesion characterization using combination of dynamic contrast-enhanced and diffusion-weighted MR images. J Magn Reson Imaging. 2008;28:1157-65. 29. Almeida JRM, Gomes AB, Barros TP, et al. Simple magnetic resonance imaging criteria can differentiate ductal carcinomas in situ from invasive carcinomas. Rev Bras Mastologia. 2015;25:84-9. 1. Mestres, Médicas Radiologistas do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 2. Doutor, Médico Radiologista do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 3. Doutora, Médica Patologista do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 4. Médica Residente do Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 5. Médica Radiologista do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 6. Médica Radiologista, Responsável pelo Serviço de Imagem da Mama do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 7. Doutor, Médico Radiologista, Diretor do Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil Endereço para correspondência: Dr. Almir Galvão Vieira Bitencourt A.C.Camargo Cancer Center – Departamento de Imagem Rua Professor Antônio Prudente, 211, Liberdade São Paulo, SP, Brasil, 01509-010 E-mail: almirgvb@yahoo.com.br Recebido para publicação em 22/5/2016. Aceito, após revisão, em 1/11/2016. Trabalho realizado no Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554