Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 50 nº 4 - Jul. / Ago. of 2017
Vol. 50 nº 4 - Jul. / Ago. of 2017
|
CARTAS AO EDITOR
|
|
|
|
|
Autho(rs): Pedro Paulo Teixeira e Silva Torres1; Matheus Rabahi2; Sebastião Alves Pinto3; Karla Cristina de Morais Arantes Curado4; Marcelo Fouad Rabahi3 |
|
|
Sr. Editor,
Paciente do sexo masculino, 58 anos, queixando-se de dispneia aos esforços e tosse, eventualmente com secreção mucoide. Referiu tratamento para asma há 14 anos, uso de broncodilatadores e corticosteroides inalatórios, e negou sintomas de asma na infância. Foram realizadas tomografia computadorizada (TC) (Figuras 1A, 1B e 1C) e, posteriormente, broncoscopia (Figura 1D) com biópsia. A TC mostrou espessamento parietal concêntrico regular da traqueia, brônquios principais, lobares, segmentares e subsegmentares, com discretas calcificações. A broncoscopia identificou infiltrado difuso e concêntrico da mucosa, com aspecto amarelo-acinzentado. O estudo histopatológico demonstrou deposição de material amorfo, cujas características eram compatíveis com depósito amiloide. 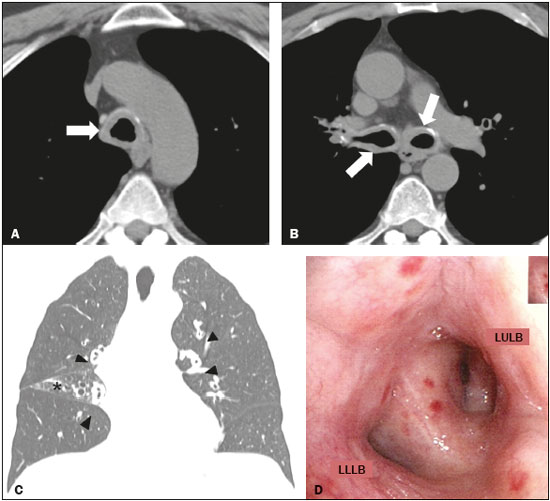 Figura 1. A,B: Imagens axiais de tomografia do tórax em janela de mediastino, sem administração do meio de contraste, ao nível da traqueia proximal (A) e abaixo da carina (B) mostram importante espessamento parietal concêntrico regular e com discretas calcificações comprometendo a traqueia e brônquios principais (setas). C: Imagem coronal de tomografia do tórax em janela de pulmão mostra espessamento parietal regular comprometendo brônquios segmentares e subsegmentares (cabeças de setas). Sinais de perda volumétrica do lobo médio (asterisco) por redução luminal do respectivo brônquio lobar (não demonstrada na imagem). D: Imagem de broncoscopia demonstra redução na luz brônquica por infiltração na mucosa, concêntrica e difusa, com coloração amarelo-acinzentada, determinando alargamento da carina secundária. BLSE, brônquio do lobo superior esquerdo; BLIE, brônquio do lobo inferior esquerdo. Amiloidose compreende um conjunto de doenças caracterizadas por depósito e acúmulo anormal de material proteico em órgãos e tecidos(1). Considerando a distribuição anatômica, a amiloidose pode ser sistêmica (envolvimento de múltiplos órgãos) ou localizada (envolvimento de órgão único). Na classificação bioquímica, segundo o tipo de componente fibrilar nos depósitos amiloides, são considerados inúmeros subtipos. Na grande maioria dos casos estão presentes o amiloide fibrilar de cadeia leve e o amiloide sérico A(1). No compartimento torácico, a doença compromete mais frequentemente o coração, podendo envolver parênquima pulmonar, pleura, cadeias linfonodais, árvore traqueobrônquica, entre outros(1,2). O acometimento pulmonar é raro, descrito nas manifestações traqueobrônquica, difusa/alveolar-septal e nodular, sendo a primeira a mais comum(2–4). A manifestação traqueobrônquica caracteriza-se pela deposição de material amiloide na traqueia e brônquios principais, determinando espessamento parietal, estreitamento luminal e consequente obstrução de vias aéreas, além de consolidações, atelectasias, hiperinsuflação pulmonar e bronquiectasias(3). Clinicamente, o comprometimento traqueobrônquico pode ser assintomático ou provocar manifestações de dispneia, sibilância, hemoptise, tosse e pneumonias de repetição(4,5). Os sintomas podem ser semelhantes a doenças brônquicas de maior frequência, incluindo asma brônquica(5). A TC de tórax tem se mostrado o exame de imagem de escolha não só para avaliação das doenças torácicas(6–9), como também da árvore traqueobrônquica(10–12). A TC demonstra espessamento parietal liso ou irregular/nodular da parede traqueal e brônquios, podendo haver calcificações nodulares submucosas associadas(4). Diagnósticos diferenciais de doenças traqueobrônquicas difusas incluem vasculites (granulomatose de Wegener), papilomatose traqueobrônquica, comprometimento infeccioso (Klebsiella rhinoscleromatis – rinoscleroma), traqueo-broncopatia osteocondroplástica e policondrite recidivante(13). Ao contrário do comprometimento traqueal na traqueobroncopatia osteocondroplástica ou policondrite recidivante, a amiloidose traqueobrônquica determina comprometimento da parede membranosa posterior traqueal(4,13). A broncoscopia usualmente mostra espessamento parietal com placas planas multifocais amarelo-acinzentadas na traqueia e brônquios. Não comumente pode-se observar massa pseudotumoral (pseudotumor amiloide)(5,13). Os achados histopatológicos da doença demonstram espessamento da submucosa por material amiloide em massas nodulares ou lâminas, com birrefringência “verde maçã” na coloração vermelho Congo(14). Há ainda redução numérica das glândulas submucosas, calcificações e focos de metaplasia óssea nas vias aéreas maiores(14). Diagnósticos diferenciais devem ser considerados em pacientes com sintomas de asma brônquica que apresentem sintomas atípicos e resposta insuficiente ao tratamento clínico(15). O paciente em questão apresentou diagnóstico inicial de asma, sem resposta terapêutica, cujo diagnóstico definitivo de amiloidose traqueobrônquica primária foi realizado após seguimento propedêutico direcionado. Conclui-se que, embora rara, a amiloidose traqueobrônquica deve ser considerada neste subgrupo de pacientes. REFERÊNCIAS 1. Czeyda-Pommersheim F, Hwang M, Chen SS, et al. Amyloidosis: modern cross-sectional imaging. Radiographics. 2015;35:1381–92. 2. Marchiori E, Souza Jr AS, Ferreira A, et al. Amiloidose pulmonar: aspectos na tomografia computadorizada. Radiol Bras. 2003;36:89–94. 3. Lee AY, Godwin JD, Pipavath SN. Case 182: pulmonary amyloidosis. Radiology. 2012;263:929–32. 4. Ngo AV, Walker CM, Chung JH, et al. Tumors and tumorlike conditions of the large airways. AJR Am J Roentgenol. 2013;201:301–13. 5. Serraj M, Kamaoui I, Znati K, et al. Pseudotumoral tracheobronchial amyloidosis mimicking asthma: a case report. J Med Case Rep. 2012;6:40. 6. Francisco FAF, Rodrigues RS, Barreto MM, et al. Can chest high-resolution computed tomography findings diagnose pulmonary alveolar microlithiasis? Radiol Bras. 2015;48:205–10. 7. Batista MN, Barreto MM, Cavaguti RF, et al. Pulmonary artery sarcoma mimicking chronic pulmonary thromboembolism. Radiol Bras. 2015;48:333–4. 8. Torres PPTS, Moreira MAR, Silva DGST, et al. High-resolution computed tomography and histopathological findings in hypersensitivity pneumonitis: a pictorial essay. Radiol Bras. 2016;49:112–6. 9. Mogami R, Goldenberg T, Marca PGC, et al. Pulmonary infection caused by Mycobacterium kansasii: findings on computed tomography of the chest. Radiol Bras. 2016;49:209–13. 10. Ribeiro GMR, Natal MRC, Silva EF, et al. Tracheobronchopathia osteochondroplastica: computed tomography, bronchoscopy and histopathological findings. Radiol Bras. 2016;49:56–7. 11. Barbosa BC, Amorim VB, Ribeiro LFM, et al. Tuberculosis: tracheal involvement. Radiol Bras. 2016;49:410–1. 12. Barbosa AGJ, Penha D, Zanetti G, et al. Foreign body in the bronchus of a child: the importance of making the correct diagnosis. Radiol Bras. 2016;49:340–2. 13. Prince JS, Duhamel DR, Levin DL, et al. Nonneoplastic lesions of the tracheobronchial wall: radiologic findings with bronchoscopic correlation. Radiographics. 2002;22 Spec No:S215–30. 14. Kurtz KA, Kirby PA. Pathologic quiz case: a 49-year-old man with chronic cough and a left lung hilar mass. Tracheobronchial amyloidosis. Arch Pathol Lab Med. 2003;127:e420–2. 15. Tilles SA. Differential diagnosis of adult asthma. Med Clin North Am. 2006;90:61–76. 1. Multimagem Diagnósticos, Goiânia, GO, Brasil 2. Pontifícia Universidade Católica de Goiás (PUC Goiás), Goiânia, GO, Brasil 3. Universidade Federal de Goiás (UFG), Goiânia, GO, Brasil 4. Hospital e Maternidade Jardim América, Goiânia, GO, Brasil Endereço para correspondência: Dr. Pedro Paulo Teixeira e Silva Torres Rua 9, nº 326, Residencial Amaury Menezes, ap. 1502, Setor Oeste Goiânia, GO, Brasil, 74110-100 E-mail: pedroptstorres@yahoo.com.br |
|
GN1© Copyright 2024 - All rights reserved to Colégio Brasileiro de Radiologia e Diagnóstico por Imagem
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554