Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 50 nº 2 - Mar. / Abr. of 2017
Vol. 50 nº 2 - Mar. / Abr. of 2017
|
ARTIGOS ORIGINAIS
|
|
|
|
|
Autho(rs): Thiago de Oliveira Ferrão1; Paulo Ricardo Martins-Filho2; Cleverton Aragão3; Marlyson Santana3; Allan Nascimento3; Thayane Cardoso3; Rosana Cipolotti4 |
|
|
Descritores: Anemia falciforme; Ultrassonografia Doppler; Órbita/irrigação sanguínea; Hemólise; Biomarcadores. |
|
|
Resumo: INTRODUÇÃO
Anemia falciforme (AF), forma homozigótica da doença falciforme, é uma das hemoglobinopatias hereditárias mais comuns(1,2). Estimativas mostram que 250.000 crianças nascem anualmente com AF no mundo. Originária da África e trazida para a América pelo tráfico de escravos, é mais frequente onde a proporção de afrodescendentes é maior. Estima-se que aproximadamente 2.500 crianças nasçam por ano com AF no Brasil, onde a população não branca foi estimada em 50,74% pelo Censo 2010, e desta população não branca, cerca de 1% a 6% como portadores de AF(3). A doença falciforme é caracterizada pela produção de hemoglobina anormal, conhecida como hemoglobina S. Eritrócitos "em foice" são formados durante a polimerização e precipitação intracelular de hemoglobina S no estado desoxigenado, resultando em rigidez celular que provoca diminuição do fluxo sanguíneo microvascular, com subsequente isquemia tecidual e infarto(4,5). É reconhecido que a hemólise também exerce papel significativo na patogênese da doença, possivelmente ao provocar redução da biodisponibilidade do óxido nítrico produzido pelas células endoteliais vasculares(6). As manifestações clínicas dessa doença multissistêmica resultam da anemia hemolítica crônica e das consequências vaso-oclusivas das hemácias em foice, afetando quase todos os tecidos no corpo, incluindo os olhos. As afecções oculares mais significativas ocorrem no fundo do olho, mais frequentes em portadores de hemoglobinopatia SC que nos portadores de AF(7), e podem ser agrupadas em alterações retinianas proliferativas e não proliferativas. Na retina, diversos processos patológicos (hipóxia, isquemia, neovascularização e fibrovascularização) podem resultar de oclusão microvascular secundária à AF. A formação de novos vasos é o fator precursor mais importante de complicações potencialmente amauróticas, precedendo o desenvolvimento de hemorragia vítrea ou descolamento de retina. As manifestações oculares podem ser assintomáticas, a despeito da progressão da doença, e podem ter consequências devastadoras(8). A ultrassonografia com Doppler das órbitas permite a avaliação não invasiva da resistência vascular arterial pela medida dos índices de resistência (IR) e de pulsatilidade (IP), principalmente no estudo do fluxo sanguíneo em doenças oculares(9). Estudos prévios descreveram os achados dopplervelocimétricos em artérias intracranianas, pulmonares, renais e periféricas em portadores de AF(4,10–14). Entretanto, pelo que sabemos, pouco é conhecido sobre alterações vasculares orbitárias em portadores de AF, bem como suas relações com biomarcadores de hemólise. O objetivo deste estudo foi investigar o estado de resistência vascular arterial orbitária por meio de dopplervelocimetria em pacientes portadores de AF, e sua relação com biomarcadores de hemólise. MATERIAIS E MÉTODOS Este é um estudo transversal analítico conduzido de setembro de 2012 a outubro de 2013 na Unidade de Diagnóstico por Imagem e no Ambulatório de Onco-Hematologia Pediátrica do Hospital Universitário da Universidade Federal de Sergipe. Tamanho amostral A fórmula n = (Zα/2 *σ/E)2 foi adotada no cálculo do tamanho amostral (n), na qual Zα/2 representa o valor crítico Z para um intervalo de confiança de 95%; σ, o desvio-padrão na população; E, a margem de erro. Como o valor σ é desconhecido, foi substituído pelo desvio-padrão na amostra (s). Com base em estudo piloto prévio com 39 pacientes, os valores s = 13,05 e E = 3,0 foram calculados, e o valor Zα/2= 1,96 foi obtido a partir de tabela estatística, resultando numa amostra estimada de 73 pacientes. Dois grupos (total de 105 sujeitos) foram examinados. Um grupo formado por 73 pacientes com AF (padrão homozigoto SS confirmado por eletroforese de hemoglobina, 38 masculinos, faixa etária de 3 a 31 anos), acompanhados regularmente no ambulatório, compensados e sem história recente (por três meses) de crise dolorosa ou hemotransfusão. Definiu-se "compensado" como o paciente em estado basal sem dor aguda requerendo hospitalização. O outro grupo foi constituído por 32 controles aparentemente saudáveis, pareados por idade e gênero (16 masculinos, faixa etária de 3 a 27 anos) sem evidências na história clínica de alterações patológicas. Os controles foram recrutados por seleção aleatória de pacientes que se submeteram a exame ultrassonográfico de órgãos e sistemas não relacionados, atendidos rotineiramente na Unidade de Diagnóstico por Imagem. Nenhum dos grupos tinha sinais objetivos de envolvimento ocular. Do grupo de 73 portadores de AF, duas pacientes foram excluídas por falta de cooperação. Não houve perda de seguimento dos demais participantes. A amostra final consistiu de 71 pacientes e de 32 controles. Todos os pacientes e controles assinaram termo de consentimento livre e esclarecido antes da participação no estudo. Aprovação pelo Comitê de Ética da Instituição foi previamente obtida. Protocolo ultrassonográfico A avaliação ultrassonográfica foi realizada em equipamento Logiq P6 (GE Healthcare; Milwaukee, WI, EUA) com recursos de Doppler colorido e pulsado, com transdutor linear (11L) multifrequencial 3,4 a 10,8 MHz, de acordo com técnica já padronizada(15,16). Os pacientes foram examinados em posição supina, mantendo o olhar fixo em direção anterior, e com os olhos imóveis e fechados, o transdutor foi posicionado transversalmente na pálpebra superior, após a aplicação de uma gota de gel. O exame foi realizado sob condições confortáveis com técnica não compressiva, para evitar que a pressão do transdutor sobre a pálpebra interferisse nos resultados dopplervelocimétricos. As artérias oftálmica e central da retina foram identificadas com o auxílio do modo colorido, que facilitou o posicionamento do volume de amostra, ajustado entre 2 mm e 4 mm e no menor ângulo de insonação possível, para a medida das variáveis dopplervelocimétricas. Os parâmetros dopplervelocimétricos avaliados foram: velocidade de pico sistólico (VPS), velocidade diastólica final (VDF), velocidade média (VM), IR e IP. Cada parâmetro foi medido somente quando pelo menos três ondas consecutivas com aparência similar foram observadas no modo espectral. As medidas foram obtidas com os recursos disponíveis nos aplicativos do equipamento. IR e IP foram calculados de modo convencional com as fórmulas: IR = (VPS – VDF)/VPS, e IP = (VPS – VDF)/VM. A média de três leituras de cada parâmetro de cada artéria de ambas as órbitas foi obtida e registrada para cada participante. A duração média do exame ultrassonográfico foi 10 a 15 minutos por paciente, dependendo da cooperação dos sujeitos em não mover os olhos. Frequência cardíaca e pressão arterial foram aferidas antes do procedimento e todos os participantes estavam com frequência cardíaca normal e normotensos no momento do exame. Todos os exames foram realizados pelo mesmo radiologista (com sete anos de experiência), cego para a alocação dos sujeitos. Investigação laboratorial Amostras de sangue foram obtidas dos participantes do estudo para realização de hemograma por processo automatizado (Labmax; Labtest, Minas Gerais, Brasil), para contagem de hemácias, nível de hemoglobina, hematócrito, volume corpuscular médio, hemoglobina corpuscular média, concentração de hemoglobina corpuscular média e contagem de reticulócitos. A investigação bioquímica foi realizada por análise automatizada (Cell-Dyn; Abbott Laboratories, Abbott Park, IL, EUA), com a determinação dos níveis de bilirrubinas total e indireta e de desidrogenase lática. Como marcadores de hemólise intravascular crônica(5), foram considerados nível de hemoglobina, contagem de reticulócitos, desidrogenase lática e bilirrubinas total e indireta. Análise estatística A distribuição dos grupos de pacientes e controles foi testada para normalidade dos dados (teste de D'Agostino-Pearson). Média e desvio-padrão foram calculados para a idade e variáveis laboratoriais e dopplervelocimétricas (VPS, VDF, VM, IR, IP). Para comparação entre os grupos, os valores p foram calculados pelo teste t não pareado ou pelo teste de Mann-Whitney. Para determinar a relação entre os marcadores laboratoriais de hemólise e os índices vasculares IR e IP, foi utilizada regressão linear múltipla. Teste de Spearman foi aplicado após a análise de regressão para medir a força de correlação das variáveis com significância estatística, mediante o cálculo do coeficiente de correlação linear (r). A força de associação foi considerada, para valores absolutos de r, como segue: 0 ≤ r < 0,2, muito fraca; 0,2 ≤ r < 0,4, fraca; 0,4 ≤ r < 0,6, moderada; 0,6 ≤ r < 0,8, forte; 0,8 ≤ r < 1,0, muito forte. Todos os testes estatísticos foram bicaudais, com valor p < 0,05 considerado significante. A análise estatística foi conduzida com o auxílio do aplicativo BioStat versão 5.3 (AnalystSoft, Inc.; Alexandria, VA, EUA). RESULTADOS Os grupos não diferiram quanto a idade e frequência cardíaca (Tabela 1). Todos os marcadores laboratoriais foram anormais nos portadores de AF em comparação aos controles (p < 0,0001 para todas as comparações). 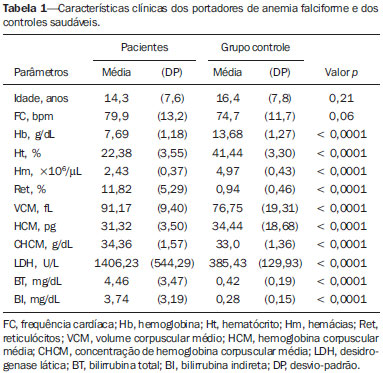 A avaliação dopplervelocimétrica revelou velocidades aumentadas na artéria oftálmica e reduzidas na artéria central da retina, e IR e IP elevados em ambas as artérias no grupo AF em relação ao grupo controle (p < 0,0001). A VPS da artéria central da retina, apesar de menor nos portadores de AF, não apresentou diferença estatisticamente significante entre os grupos (Tabela 2). Não houve diferenças dopplervelocimétricas entre os olhos de cada participante. 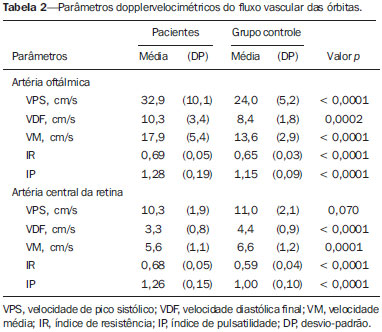 A análise por regressão linear múltipla da relação entre os marcadores de hemólise e os índices IR e IP mostrou associação significativa entre reticulócitos e IR e IP na artéria oftálmica, e entre nível de hemoglobina e IR e IP na artéria central da retina (Tabelas 3 e 4). Desidrogenase lática e bilirrubinas total e indireta não apresentaram associação significativa com os índices em nenhuma das artérias. 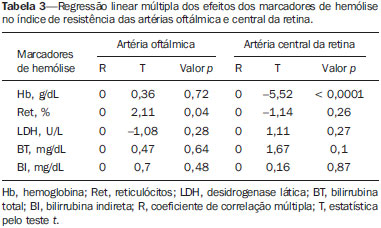 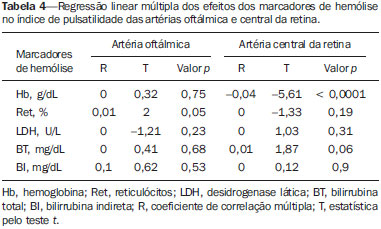 Em razão dos achados significativos relacionando contagem de reticulócitos e nível de hemoglobina a IR e IP, detectados por análise multivariada, o coeficiente de correlação linear de Spearman (r) foi calculado, e diagramas de dispersão com linha de ajuste para a análise bivariada foram gerados para ilustrar e quantificar essa relação em cada artéria. Moderada correlação direta (r = 0,41) foi observada entre contagem de reticulócitos e ambos os índices na artéria oftálmica (Figura 1). Forte correlação inversa foi observada entre nível de hemoglobina e IR (r = 0,62) e entre nível de hemoglobina e IP (r = 0,63) na artéria central da retina (Figura 2). 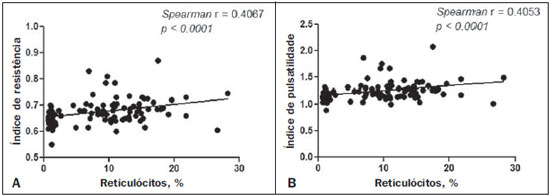 Figura 1. Análise de correlação entre reticulócitos e índices de resistência e pulsatilidade na artéria oftálmica. 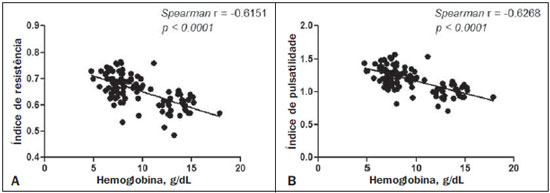 Figura 2. Análise de correlação entre hemoglobina e índices de resistência e pulsatilidade na artéria central da retina. DISCUSSÃO As complicações oftalmológicas da AF podem afetar a órbita, a conjuntiva, a câmara anterior e o segmento posterior. Na órbita, manifesta-se como síndrome de compressão orbital, causada por infarto do osso esfenoide, com formação de hematoma subperiosteal e resposta inflamatória. Na conjuntiva, segmentos vasculares sofrem dilatação sacular transitória, com aspecto em "salsicha" ou "vírgula", notadamente na porção bulbar inferior; o "sinal da vírgula" é mais comum na hemoglobinopatia SS que na forma SC. Proliferação endotelial, agregação de hemácias na porção distal dos capilares e dilatação e afilamento dos segmentos proximais dos vasos são os achados histopatológicos predominantes; baixos níveis de hemoglobina e hematócrito predispõem a alterações conjuntivais(17). Preenchida por humor aquoso, a câmara anterior é um ambiente com baixo pH e baixa concentração de oxigênio. Na vigência de hemorragia, eritrócitos e leucócitos consomem oxigênio e liberam gás carbônico e lactato, provocando acidose e falcização; as hemácias em foice obstruem a malha trabecular (responsável pela drenagem do humor aquoso), levando a um aumento da pressão intraocular – glaucoma agudo –, uma emergência oftalmológica. No segmento posterior, as manifestações incluem hemorragia e exsudato da retina, estrias angioides, infarto coriorretiniano, hemorragia vítrea, oclusão da artéria retiniana (central ou dos ramos) e retinopatia proliferativa. Oclusão arteriolar e perda da perfusão capilar na periferia da retina são as características mais marcantes da retinopatia falciforme, mais frequente na hemoglobinopatia SC que na forma SS, com predomínio na região superotemporal; as áreas isquêmicas liberam substâncias que estimulam a angiogênese; e o remodelamento vascular inicial na junção entre a periferia não perfundida e a região central perfundida promove a formação de anastomoses arteriovenosas(8,17). Nossos dados mostraram aumento das velocidades na artéria oftálmica e redução das velocidades na artéria central da retina, em concordância com Aikimbaev et al.(15). Observamos elevada resistividade ao fluxo em ambos os vasos, entretanto, Aikimbaev et al. detectaram aumento de IR e IP apenas na artéria central da retina, sem alterações significativas na artéria oftálmica. Tantawy et al.(8) observaram aumento das velocidades na artéria oftálmica em relação aos controles, mas sem significância estatística; esses autores utilizaram protocolo de Doppler transcraniano em suas mensurações, com transdutor padrão de 2,0 MHz, que apresenta menor resolução espacial em relação ao probe empregado em nosso trabalho (10,8 MHz). A maior resolução facilita o estudo de estruturas superficiais, com maiores nitidez e sensibilidade na avaliação dopplervelocimétrica; este fator pode ter contribuído para a detecção de significância estatística em nossa amostra. Polska et al.(18) afirmaram que o IR da artéria central da retina, medido por ultrassonografia Doppler, não corresponde à resistência vascular retiniana verdadeira, quando aferida por método bem mais complexo (dopplervelocimetria laser, medida do diâmetro dos vasos por analisador Zeiss com videocâmera e software específico, e medida da pressão de perfusão ocular por tonometria de Goldmann). Após uso de oxigênio a 100% como agente vasoconstritor retiniano, ambos – IR e resistência retiniana vascular verdadeira – demonstraram o aumento na resistência vascular, mas o efeito detectado pelo IR foi menor. Em nosso estudo utilizamos transdutores com frequência maior (10,8 MHz, contra 5,0 MHz de Polska et al.(18)) e equipamento com software mais avançado em relação ao que se dispunha há 13 anos, quando esses autores publicaram seus dados. O avanço tecnológico permitiu o aprimoramento das ferramentas de diagnóstico por imagem em todas as áreas, incluindo a ultrassonografia Doppler, com aumento na acurácia das aferições. As medidas do IR hoje permitem melhor estimativa da resistência vascular retiniana que na década passada; ademais, seu uso é mais prático, disponível e reprodutível que o método complexo proposto por Polska et al., a um custo muito menor e sem prejuízo da avaliação clínica do paciente. O diâmetro médio da artéria oftálmica é de 1430 ± 260 µm(19) e o da artéria central da retina é de 163 ± 17 µm(20), ou seja, o diâmetro da artéria central da retina é cerca de dez vezes menor que o diâmetro da artéria oftálmica. O efeito esperado da vasoconstrição na artéria oftálmica é de aumento da velocidade do fluxo, como ocorre em outras artérias na vigência de processo patológico que promova estreitamento luminal, a exemplo da estenose por placa ateromatosa nas artérias carótida interna, renal e femoral. Já o efeito da vasoconstrição numa artéria de diâmetro muito pequeno, como a artéria central da retina, seria possivelmente de promover redução da velocidade de fluxo, considerando a ação vasoconstritora num lúmen já anatomicamente estreito, o que seria comparável a um efeito suboclusivo. Conforme a Lei de Poiseuille, o volume de fluxo num vaso é diretamente proporcional à quarta potência do raio deste vaso. A artéria central da retina, que possui raio dez vezes menor que a artéria oftálmica, teria um volume de fluxo dez mil vezes menor, comparado a este vaso; qualquer evento vasoconstritor, por mínimo que seja, teria repercussão hemodinamicamente significante, o que justificaria o achado de redução das velocidades. Comportamento semelhante é observado nos diminutos vasos da conjuntiva bulbar, quando avaliados por microscopia intravital assistida por computador, método que estuda a microcirculação: na vigência de vasoconstrição, ocorre redução de velocidade de fluxo, em vez de aumento(21). Quanto aos biomarcadores de hemólise, nosso estudo revelou forte correlação inversa entre os níveis de hemoglobina e IR e IP na artéria central da retina, e moderada correlação direta entre os níveis de reticulócitos e IR e IP na artéria oftálmica. Aikimbaev et al.(15) demonstraram forte associação entre níveis reduzidos de hemoglobina e resistência vascular retiniana aumentada (risco relativo: 6,7; p < 0,009); contudo, não identificaram relação estatisticamente significante quanto aos níveis de reticulócitos. Ainda, Cheung et al.(21) não detectaram significância estatística na associação entre os níveis de hemoglobina e de reticulócitos com as velocidades de fluxo na artéria cerebral média, mensuradas por meio de Doppler transcraniano, nem com as velocidades na microcirculação da conjuntiva bulbar, avaliadas por microscopia intravital assistida por computador. Nenhum desses trabalhos avaliou os outros dois marcadores de hemólise (desidrogenase lática e bilirrubinas). Estudos recentes classificaram as complicações clínicas da AF em dois subfenótipos distintos: vasculopatia/disfunção endotelial/hemólise (que compreende hipertensão pulmonar, priapismo, úlcera de membro inferior e acidente vascular encefálico, mais frequente em pacientes que apresentam taxas de hemólise intravascular maiores), e viscosidade/vaso-oclusão (que abrange crise dolorosa vaso-oclusiva, síndrome torácica aguda e osteonecrose)(5,22,23). A taxa de hemólise intravascular crônica pode ser estimada por meio de marcadores laboratoriais, assim caracterizados: baixos níveis de hemoglobina, altos níveis de desidrogenase lática, altos níveis de bilirrubina e alta contagem de reticulócitos(1,5). A literatura não menciona qual o subfenótipo a que a retinopatia falciforme pertence. Alguns indícios apontam para o primeiro subfenótipo: fibroproliferação vascular, que ocorre tanto na retinopatia proliferativa quanto na hipertensão pulmonar (envolve depleção de óxido nítrico e desvio do metabolismo da síntese de arginina e óxido nítrico para síntese de prolina e colágeno)(8,17,22), e correlação com biomarcadores laboratoriais de hemólise (hemoglobina e reticulócitos), caracterizada em nosso estudo. As manifestações vaso-oclusivas na conjuntiva bulbar e retina, contudo, sugerem o segundo subfenótipo(17,21). Mais estudos são necessários para melhor entendimento, com a inclusão de dados de pesquisa molecular. Não encontramos na literatura, até o momento, trabalhos que expliquem por que o IR e o IP se correlacionam apenas com alguns biomarcadores de hemólise, e não com todos. Este é um ponto de partida interessante para investigações adicionais. Foram limitações de nosso trabalho: não dispusemos de outro radiologista como observador, para análise de concordância e determinação do índice kappa; faltou avaliação oftalmológica para correlações com mais dados clínicos; a microcirculação retiniana não foi estudada, pela indisponibilidade de ferramenta diagnóstica para tal. CONCLUSÃO O estudo demonstrou que a resistência vascular arterial das órbitas, aferida por meio de dopplervelocimetria, é elevada em portadores de AF, com moderada a forte correlação com alguns biomarcadores de hemólise. REFERÊNCIAS 1. Wood KC, Hsu LL, Gladwin MT. Sickle cell disease vasculopathy: a state of nitric oxide resistance. Free Radic Biol Med. 2008;44: 1506–28. 2. Tharaux PL. Endothelin in renal injury due to sickle cell disease. Contrib Nephrol. 2011;172:185–99. 3. Lervolino LG, Baldin PEA, Picado SM, et al. Prevalence of sickle cell disease and sickle cell trait in national neonatal screening studies. Rev Bras Hematol Hemoter. 2011;33:49–54. 4. Guvenc B, Aikimbaev K, Unsal C, et al. Renal vascular resistance in sickle cell painful crisis. Int J Hematol. 2005;82:127–31. 5. Kato GJ, Hebbel RP, Steinberg MH, et al. Vasculopathy in sickle cell disease: biology, pathophysiology, genetics, translational medicine, and new research directions. Am J Hematol. 2009;84:618–25. 6. Akinsheye I, Klings ES. Sickle cell anemia and vascular dysfunction: the nitric oxide connection. J Cell Physiol. 2010;224:620–5. 7. Clarke WN, Vomiero G, Leonard BC. Bilateral simultaneous retinal arteriolar obstruction in a child with hemoglobin SS sickle cell disease. J AAPOS. 2001;5:126–8. 8. Tantawy AAG, Andrawes NG, Adly AAM, et al. Retinal changes in children and adolescents with sickle cell disease attending a paediatric hospital in Cairo, Egypt: risk factors and relation to ophthalmic and cerebral blood flow. Trans R Soc Trop Med Hyg. 2013;107: 205–11. 9. Kuzmic AC, Brkljacic B, Ivankovic D, et al. Doppler sonographic renal resistance index in healthy children. Eur Radiol. 2000;10: 1644–8. 10. Taori KB, Chaudhary RS, Attarde V, et al. Renal Doppler indices in sickle cell disease: early radiologic predictors of renovascular changes. AJR Am J Roentgenol. 2008;191:239–42. 11. Adams RJ. TCD in sickle cell disease: an important and useful test. Pediatr Radiol. 2005;35:229–34. 12. Bernaudin F, Verlhac S, Coïc L, et al. Long-term follow-up of pediatric sickle cell disease patients with abnormal high velocities on transcranial Doppler. Pediatr Radiol. 2005;35:242–8. 13. Gladwin MT, Sachdev V, Jison ML, et al. Pulmonary hypertension as a risk factor for death in patients with sickle cell disease. N Engl J Med. 2005;350:886–95. 14. Zawar SD, Vyawahare MA, Nerkar M, et al. Non-invasive detection of endothelial dysfunction in sickle cell disease by Doppler ultrasonography. J Assoc Physicians India. 2005;53:677–80. 15. Aikimbaev K, Guvenc B, Canataroglu A, et al. Value of duplex and color doppler ultrasonography in the evaluation of orbital vascular flow and resistance in sickle cell disease. Am J Hematol. 2001;67: 163–7. 16. Diniz ALD, Moron AF, Santos MC, et al. Dopplervelocimetria colorida dos vasos orbitais: técnica de exame e anatomia vascular normal. Radiol Bras. 2004;37:287–90. 17. Ballas SK, Kesen MR, Goldberg MF, et al. Beyond the definitions of the phenotypic complications of sickle cell disease: an update on management. ScientificWorldJournal. 2012;2012:949535. 18. Polska E, Kircher K, Ehrlich P, et al. RI in central retinal artery as assessed by CDI does not correspond to retinal vascular resistance. Am J Physiol Heart Circ Physiol. 2001;280:H1442–7. 19. Kocabiyki N, Yazar F, Ozan H. The intraorbital course of ophthalmic artery and its relationship with the optic nerve. Neuroanatomy. 2009;8:36–8. 20. Dorner GT, Polska E, Garhöfer G, et al. Calculation of the diameter of the central retinal artery from noninvasive measurements in humans. Curr Eye Res. 2002;25:341–5. 21. Cheung AT, Harmatz P, Wun T, et al. Correlation of abnormal intracranial vessel velocity, measured by transcranial Doppler ultrasonography, with abnormal conjunctival vessel velocity, measured by computer-assisted intravital microscopy, in sickle cell disease. Blood. 2001;97:3401–4. 22. Morris CR. Mechanisms of vasculopathy in sickle cell disease and thalassemia. Hematology Am Soc Hematol Educ Program. 2008; 177–85. 23. Zorca S, Freeman L, Hildesheim M, et al. Lipid levels in sickle-cell disease associated with haemolytic severity, vascular dysfunction and pulmonary hypertension. Br J Haematol. 2010;149:436–45. 1. Doutor, Radiologista, Professor Assistente do Departamento de Medicina da Universidade Federal de Sergipe (UFS), Aracaju, SE, Brasil 2. Doutor, Professor Adjunto e Chefe do Laboratório de Patologia Investigativa do Programa de Pós-Graduação em Ciências da Saúde da Universidade Federal de Sergipe (UFS), Aracaju, SE, Brasil 3. Graduando do Curso de Medicina da Universidade Federal de Sergipe (UFS), Aracaju, SE, Brasil 4. Doutora, Onco-Hematologista Pediátrica do Hospital Universitário, Professora Associada do Departamento de Medicina da Universidade Federal de Sergipe (UFS), Aracaju, SE, Brasil Endereço para correspondência: Dr. Thiago de Oliveira Ferrão Rua Anita Garibaldi, 550, ap. 501, Centro Caçador, SC, Brasil, 89500-000 E-mail: ferroferrao@gmail.com Recebido para publicação em 24/9/2015. Aceito, após revisão, em 8/3/2016. Trabalho realizado no Hospital Universitário da Universidade Federal de Sergipe (UFS), Aracaju, SE, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554