Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 50 nº 2 - Mar. / Abr. of 2017
Vol. 50 nº 2 - Mar. / Abr. of 2017
|
ARTIGOS ORIGINAIS
|
|
|
|
|
Autho(rs): Luciana Karla Lira França1; Almir Galvão Vieira Bitencourt2; Hugo Lamartine Souza Paiva1; Caroline Baptista Silva1; Nara Pacheco Pereira1; Jociana Paludo1; Luciana Graziano3; Camila Souza Guatelli3; Juliana Alves de Souza3; Elvira Ferreira Marques4 |
|
|
Descritores: Câncer de mama; Estadiamento de neoplasias; Ressonância magnética. |
|
|
Resumo: INTRODUÇÃO
A ressonância magnética (RM) tem sido cada vez mais utilizada no manejo de pacientes com câncer de mama. Uma das principais indicações da RM das mamas é para estadiamento locorregional pré-operatório, uma vez que este exame tem alta sensibilidade na avaliação da extensão tumoral e na detecção de tumores multifocais e multicêntricos(1). Estudos demonstram que a incidência de câncer sincrônico na mama ipsilateral pode chegar a 27% e, na mama contralateral, em torno de 1–10% nas mulheres diagnosticadas com câncer de mama, e tal achado é associado com pior prognóstico(2–7). O uso da RM das mamas como estadiamento pré-operatório da mama contralateral nas pacientes com câncer de mama comprovado é recomendado tanto pelo Colégio Americano de Radiologia quanto pela Sociedade Europeia de Imagem da Mama(8,9). Existe controvérsia sobre o papel da RM das mamas em pacientes com câncer de mama conhecido e elegíveis para terapia conservadora. Estudos têm demonstrado que a RM das mamas é mais acurada na avaliação da extensão tumoral e na detecção de tumores multifocais e multicêntricos, em comparação com os exames convencionais – mamografia (MMG), ultrassonografia (US) e exame clínico(10–16). Como resultado desta maior acurácia, espera-se que a RM das mamas aumente os índices de ressecção completa, reduza o número de reoperações e melhore o prognóstico destas pacientes, mas tais efeitos ainda não foram demonstrados consistentemente(17–20). O objetivo deste artigo é avaliar o papel da RM das mamas para estadiamento pré-operatório em pacientes com câncer de mama, na avaliação das dimensões do tumor principal e pesquisa de lesões adicionais, bem como sua influência no planejamento terapêutico. MATERIAIS E MÉTODOS Foram avaliadas, retrospectivamente, todas as pacientes com diagnóstico de câncer de mama submetidas a RM, na instituição, para estadiamento e planejamento terapêutico, no período de agosto de 2012 a agosto de 2014. Os critérios de inclusão foram terem diagnóstico histológico de câncer de mama e terem realizado RM das mamas antes de qualquer tratamento clínico ou cirúrgico. Os critérios de exclusão foram pacientes que realizaram RM em outra instituição ou que não realizaram acompanhamento posterior no serviço. Desta forma, foram incluídas 160 mulheres, com idade média de 52,2 ± 11,5 anos (variação: 30 a 81 anos). Destas, 146 possuíam MMG e 145 possuíam US descrita. O tamanho do tumor principal avaliado pela RM e pelos exames convencionais (MMG e US) foi comparado com o exame anatomopatológico (padrão ouro). Foi avaliada, ainda, a presença de lesões adicionais não identificadas nos exames convencionais e sua influência no planejamento terapêutico. Após revisão do prontuário eletrônico dessas pacientes, uma ficha de dados padrão foi preenchida, incluindo dados da RM, MMG e US, além do resultado histológico da biópsia percutânea e/ou cirurgia. Para as pacientes incluídas no estudo, foi feita revisão das imagens da RM de mamas por radiologista com experiência em imagem da mama, a fim de caracterizar adequadamente as lesões descritas. Para análise da MMG e US, foram considerados os laudos disponíveis dos exames prévios no prontuário. Dados histológicos foram obtidos a partir dos relatórios do departamento de anatomia patológica da instituição. As pacientes que, após a realização da RM de mamas, foram direcionadas para quimioterapia neoadjuvante não foram excluídas, uma vez que o estudo se propõe a avaliar a influência da RM na indicação terapêutica e a opção pela quimioterapia neoadjuvante pode ser influenciada pela realização deste exame. Nesses casos, não foi possível realizar correlação das medidas das lesões nos exames de imagem com a peça cirúrgica. As imagens de RM foram obtidas com as pacientes em decúbito ventral, em aparelho de 1,5 T Signa HDxt (General Electric; Milwaukee, WI, EUA), usando bobina dedicada à mama. Cada exame consiste de imagens realizadas antes e após injeção de 20 mL de contraste paramagnético gadopentato dimeglumine, com velocidade de 3 mL/s. Antes do contraste, são realizadas uma sequência pré-contraste gradienteeco em T1, tridimensional (3D), no plano axial, com cortes de 2,5 mm de espessura, e uma sequência T2/STIR, pré-contraste, no plano sagital, de ambas as mamas, com cortes de 4 mm de espessura. Para o exame dinâmico, são realizadas cinco sequências gradiente-eco em T1, 3D, no plano axial, com supressão de gordura. A primeira é obtida antes da injeção do contraste, a segunda, após 20 segundos da injeção do contraste, e as demais, sequencialmente, nos minutos seguintes. Destas imagens dinâmicas são obtidas imagens pósprocessamento, subtraindo-se a imagem pré-contraste das imagens pós-contraste para melhorar a visualização das áreas de realce. A última sequência são imagens gradiente-eco em T1, pós-contraste, 3D, no plano sagital, de ambas as mamas, com cortes de 1 mm de espessura e saturação de gordura. Os dados obtidos foram armazenados em um banco de dados para análise estatística pelo programa SPSS versão 20.0 (IBM Corporation; Armonk, NY, EUA). A análise descritiva das variáveis categóricas consistiu no cálculo das frequências simples e relativas. As variáveis numéricas foram descritas como média, desvio-padrão, mínimo e máximo. Para avaliação do tamanho do tumor principal, foi considerada a medida do maior eixo avaliado pela RM e pelos exames de imagem convencionais, quando disponíveis. O coeficiente de correlação de Pearson (r) foi calculado para cada método de imagem, utilizando a avaliação anatomopatológica como padrão ouro. Para esta análise, foram consideradas apenas as pacientes que tinham as dimensões do tumor principal descritas no laudo anatomopatológico, excluindo as pacientes submetidas a quimioterapia neoadjuvante. Para adequada comparação entre os métodos de imagem (RM versus MMG e RM versus US), foram considerados apenas os casos em que a medida do tumor foi fornecida no relatório dos exames prévios de MMG e US. Foram considerados estatisticamente significantes os resultados com probabilidade de erro tipo I menor ou igual a 5% (p ≤ 0,05). RESULTADOS O tumor principal se apresentou na RM como nódulo em 121 casos (75,6%) e como realce não massa em 39 casos (24,4%). Os tipos histológicos mais comuns foram carcinoma ductal invasivo (60,6%), carcinoma lobular invasivo (13,8%) e carcinoma ductal in situ (7,5%). O tamanho médio do maior eixo do tumor principal foi 38,1 mm na RM, 26,3 mm na MMG, 23,6 mm na US e 26,8 mm no exame anatomopatológico. Das 146 pacientes que apresentavam MMG prévia, os achados mais comuns do tumor principal foram nódulo em 73 (50,0%), microcalcificações em 31 (21,2%), distorção em 18 (12,3%), assimetria focal em 13 (8,9%) e ausência de lesões em 11 (7,5%). Das 145 pacientes que possuíam US prévia, os achados mais comuns foram nódulo em 111 (76,6%), área de distorção em 19 (13,1%) e ausência de lesões em 15 (10,3%). As medidas do maior eixo do tumor principal, na MMG, US, RM e exame anatomopatológico, estão citadas na Tabela 1. A correlação entre o tamanho do maior eixo do tumor principal avaliado pelo exame anatomopatológico e pelos métodos de imagem está descrita na Tabela 2. A medida do tumor na RM teve melhor correlação com o tamanho no exame anatomopatológico, quando comparado com a MMG (r = 0,872 × 0,710) e com a US (r = 0,836 × 0,704). A Figura 1 ilustra caso em que a RM colaborou para melhor caracterização da extensão do tumor primário.   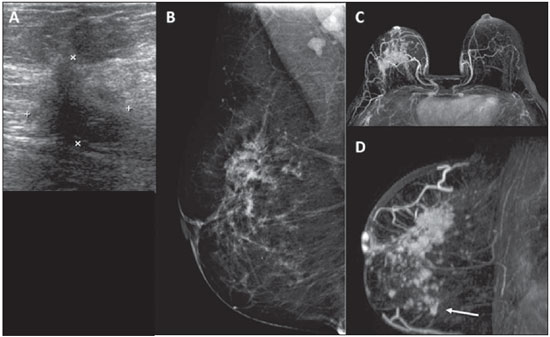 Figura 1. Ultrassonografia (A) demonstra nódulo hipoecogênico irregular no quadrante superolateral da mama direita, que corresponde a assimetria focal na mamografia (B). Ressonância magnética mostra uma área de realce maior (C,D), com extensão para os quadrantes inferiores (seta). A RM identificou lesões adicionais em 53 pacientes (33,1%), sendo 34 na mesma mama e 19 na mama oposta. Dessas lesões, 42 eram nódulos (79,2%) e 11 eram realces não massa (20,8%). A média do maior eixo da lesão adicional foi 12,6 ± 13,7 mm (variação: 4 mm a 94 mm). A Figura 2 ilustra caso de lesão adicional identificada na RM. 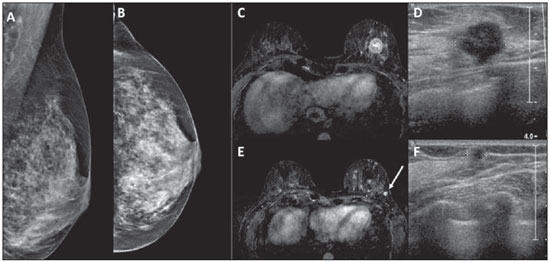 Figura 2. Paciente com mamas densas na mamografia (A,B). Ressonância magnética e ultrassonografia (C,D) mostram o tumor principal na mama esquerda como nódulo irregular. A ressonância magnética também mostra pequeno nódulo na mesma mama (seta em E), que foi encontrado na ultrassonografia second-look (F). A biópsia confirmou carcinoma ductal invasivo em ambas as lesões. Das lesões adicionais identificadas na RM, 33 foram submetidas a estudo histológico, sendo 13 benignas e 20 malignas (12,5% do total). O material para estudo histológico foi obtido por biópsia percutânea guiada por US second-look (n = 16) ou MMG (n = 1), ou biópsia cirúrgica após localização pré-operatória guiada por US (n = 10) ou RM (n = 5). Das lesões malignas, os tipos histológicos mais comuns foram carcinoma ductal invasivo em 9 (45,0%), carcinoma lobular invasivo em 2 (10,0%) e carcinoma ductal in situ em 2 (10,0%). As lesões adicionais com baixa suspeita de malignidade que não foram submetidas a estudo histológico, por decisão do médico assistente em conjunto com a paciente, demonstraram estabilidade ou regrediram nos exames de acompanhamento, que foram seguidas por um período de 12–24 meses, sendo consideradas provavelmente benignas até o encerramento da coleta dos dados. A Tabela 3 descreve o número de lesões adicionais malignas e benignas de acordo com a localização e tipo de lesão. 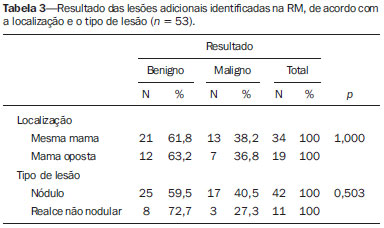 A RM modificou o planejamento terapêutico em 23 dessas pacientes (14,4% do total): em 12 casos foi realizada ressecção segmentar adicional, em 10 casos foi realizada mastectomia e em 1 caso a paciente foi encaminhada para quimioterapia neoadjuvante. Das 12 pacientes em que foi realizada ressecção adicional, em 6 (50%) a lesão adicional ressecada era benigna. Nos demais casos em que foi realizada ressecção segmentar adicional, assim como nos casos em que a paciente foi submetida a mastectomia, as lesões foram confirmadas como malignas (10,6% do total). DISCUSSÃO Os resultados deste estudo demonstraram que RM das mamas possui melhor correlação com o tamanho do tumor encontrado na avaliação da peça cirúrgica, quando comparada com MMG e US. Além disso, a RM das mamas identificou lesões adicionais em número significativo de pacientes (33,1%), sendo cerca de um terço destas malignas, e modificou o planejamento terapêutico em 14,4% dos casos. Vários autores já descreveram a importância da RM das mamas no estadiamento pré-operatório, uma vez que é exame mais sensível que os estudos de imagem convencionais na avaliação da extensão do tumor, mesmo para o carcinoma ductal in situ e o carcinoma lobular invasivo(10,12,14,15,21–23). Além disso, a RM tem alta sensibilidade na detecção de tumores multifocais, multicêntricos e contralaterais. A RM pode identificar tumores adicionais em 15–27% das pacientes na mesma mama e em 1–10% na mama contralateral. Avaliação pré-operatória por RM modifica o tratamento em até um terço das pacientes com câncer de mama(7,24). Os focos de câncer de mama identificados na RM são clinicamente significativos na maioria dos casos(25). A US second-look, direcionada para avaliação dessas lesões adicionais identificadas na RM, tem papel fundamental em nosso meio, pois permite a identificação da maioria das lesões suspeitas, possibilita melhor avaliação do grau de suspeição delas e realização de biópsia percutânea ou localização pré-operatória. Não há consenso, na literatura, sobre o benefício para a paciente proporcionado pela realização da RM pré-operatória. Alguns trabalhos mostram que a RM reduz a taxa de ressecções com margens positivas, e outros demonstram que, apesar de haver um aumento no número de mastectomias, justificado pelo maior número de lesões malignas adicionais confirmadas por biópsia, não há redução nas taxas de reoperação(25–31). Ainda não existem trabalhos prospectivos controlados que tenham demonstrado redução das recidivas ou aumento da sobrevida em pacientes com câncer de mama que foram submetidas a RM para estadiamento e planejamento terapêutico. Além disso, questiona-se o número de cirurgias adicionais realizadas com base nos resultados da RM e qual seu impacto em termos de morbidade e mortalidade a médio e longo prazo. Porém, é preciso destacar a dificuldade em demonstrar que um método diagnóstico como a RM possa alterar desfechos clínicos ou cirúrgicos, como taxas de reoperação e mortalidade, pela presença de diversos fatores confundidores relacionados ao próprio tratamento, inclusive pelos diferentes estilos individuais aplicados às técnicas cirúrgicas, podendo acarretar uma variabilidade de resultados. Deste modo, sabemos apenas que a RM pode fornecer informações adicionais relacionadas à extensão da doença que terão influência no planejamento terapêutico final. Trabalhos têm demonstrado que a RM pré-operatória das mamas pode ser superior em subgrupos específicos. Pacientes jovens, com mamas densas e com diagnóstico de carcinoma lobular invasivo estão entre os subgrupos que apresentam maior benefício com a RM para planejamento terapêutico(32). Além disso, diferentes subtipos moleculares também podem influenciar na avaliação pré-operatória pela RM. Nos últimos anos, a quimioterapia neoadjuvante tem sido cada vez mais utilizada para pacientes com câncer de mama, a fim de realizar mais cirurgias conservadoras, alcançando um melhor resultado estético, e melhorar o prognóstico, atingindo resposta patológica completa. A RM das mamas tem sido ainda mais utilizada neste contexto, para adequada avaliação da resposta terapêutica. Além disso, vários parâmetros da RM antes do início do tratamento têm sido utilizados para predizer a resposta terapêutica e até sobrevida nesses pacientes. Os resultados deste trabalho devem ser considerados no contexto de suas limitações. Por ser um trabalho retrospectivo, não foi possível avaliar o tamanho do tumor em todos os exames de imagem convencionais avaliados (MMG e US). Como em muitos casos os exames de MMG e US foram realizados em outros serviços, a padronização dos aparelhos utilizados não foi possível, assim como a revisão das imagens, sendo consideradas apenas as informações presentes no relatório de cada exame. Em razão do número crescente de pacientes sendo submetidas a quimioterapia neoadjuvante no nosso meio, também não foi possível avaliar o tamanho do tumor na peça cirúrgica nesses casos. Além disso, nem todas as lesões adicionais identificadas na RM foram submetidas a estudo histológico, sendo considerado o acompanhamento clinicorradiológico para definição de benignidade nesses casos. Em conclusão, a RM das mamas demonstrou ser mais acurada que os exames convencionais na avaliação das dimensões do tumor principal e foi capaz de identificar lesões adicionais não identificadas pelos outros métodos, que alteraram o planejamento terapêutico em um percentual importante dos casos. Futuros estudos prospectivos devem ser realizados para avaliar o impacto dessas alterações na morbimortalidade a médio e longo prazo e definir o real benefício da RM para planejamento terapêutico nas pacientes com câncer de mama. REFERÊNCIAS 1. Marques EF, Medeiros MLL, Souza JA, et al. Indications for breast magnetic resonance imaging in an oncology reference center. Radiol Bras. 2011;44:363–6. 2. Viehweg P, Rotter K, Laniado M, et al. MR imaging of the contralateral breast in patients after breast-conserving therapy. Eur Radiol. 2004;14:402–8. 3. Liberman L, Morris EA, Dershaw DD, et al. MR imaging of the ipsilateral breast in women with percutaneously proven breast cancer. AJR Am J Roentgenol. 2003;180:901–10. 4. Hungness ES, Safa M, Shaughnessy EA, et al. Bilateral synchronous breast cancer: mode of detection and comparison of histologic features between the 2 breasts. Surgery. 2000;128:702–7. 5. Heron DE, Komarnicky LT, Hyslop T, et al. Bilateral breast carcinoma: risk factors and outcomes for patients with synchronous and metachronous disease. Cancer. 2000;88:2739–50. 6. Takahashi H, Watanabe K, Takahashi M, et al. The impact of bilateral breast cancer on the prognosis of breast cancer: a comparative study with unilateral breast cancer. Breast Cancer. 2005;12:196–202. 7. Berg WA, Gutierrez L, NessAiver MS, et al. Diagnostic accuracy of mammography, clinical examination, US, and MR imaging in preoperative assessment of breast cancer. Radiology. 2004;233:830–49. 8. American College of Radiology. ACR practice guideline for the performance of magnetic resonance imaging (MRI) of the breast. Reston, VA: American College of Radiology; 2004. 9. Mann RM, Kuhl CK, Kinkel K, et al. Breast MRI: guidelines from the European Society of Breast Imaging. Eur Radiol. 2008;18: 1307–18. 10. Boetes C, Mus RD, Holland R, et al. Breast tumors: comparative accuracy of MR imaging relative to mammography and US for demonstrating extent. Radiology. 1995;197:743–7. 11. Esserman L, Hylton N, Yassa L, et al. Utility of magnetic resonance imaging in the management of breast cancer: evidence for improved preoperative staging. J Clin Oncol. 1999;17:110–9. 12. Amano G, Ohuchi N, Ishibashi T, et al. Correlation of three-dimensional magnetic resonance imaging with precise histopathological map concerning carcinoma extension in the breast. Breast Cancer Res Treat. 2000;60:43–55. 13. Houssami N, Ciatto S, Macaskill P, et al. Accuracy and surgical impact of magnetic resonance imaging in breast cancer staging: systematic review and meta-analysis in detection of multifocal and multicentric cancer. J Clin Oncol. 2008;26:3248–58. 14. Bleicher RJ, Morrow M. MRI and breast cancer: role in detection, diagnosis, and staging. Oncology (Williston Park). 2007;21:1521–8. 15. Sardanelli F, Giuseppetti GM, Panizza P, et al. Sensitivity of MRI versus mammography for detecting foci of multifocal, multicentric breast cancer in fatty and dense breasts using the whole-breast pathologic examination as a gold standard. AJR Am J Roentgenol. 2004; 183:1149–57. 16. Deurloo EE, Klein Zeggelink WFA, Teertstra HJ, et al. Contrastenhanced MRI in breast cancer patients eligible for breast-conserving therapy: complementary value for subgroups of patients. Eur Radiol. 2006;16:692–701. 17. Turnbull L, Brown S, Harvey I, et al. Comparative effectiveness of MRI in breast cancer (COMICE) trial: a randomised controlled trial. Lancet. 2010;375:563–71. 18. Brennan ME, Houssami N, Lord S, et al. Magnetic resonance imaging screening of the contralateral breast in women with newly diagnosed breast cancer: systematic review and meta-analysis of incremental cancer detection and impact on surgical management. J Clin Oncol. 2009;27:5640–9. 19. Sardanelli F. Overview of the role of pre-operative breast MRI in the absence of evidence on patient outcomes. Breast. 2010;19:3–6. 20. Kuhl C, Kuhn W, Braun M, et al. Pre-operative staging of breast cancer with breast MRI: one step forward, two steps back? Breast. 2007;16 Suppl 2:S34–44. 21. Almeida JRM, Gomes AB, Barros TP, et al. Predictive performance of BI-RADS magnetic resonance imaging descriptors in the context of suspicious (category 4) findings. Radiol Bras. 2016;49:137–43. 22. Bitencourt AGV. Subdividing BI-RADS category 4 breast lesions observed on magnetic resonance imaging: Is it feasible? Radiol Bras. 2016;49(3):v. 23. DeMartini W, Lehman C. A review of current evidence-based clinical applications for breast magnetic resonance imaging. Top Magn Reson Imaging. 2008;19:143–50. 24. Tsina G, Simon P. Breast magnetic resonance imaging and its impact on the surgical treatment of breast cancer. Obstet Gynecol Int. 2014;2014:632074. 25. Iacconi C, Galman L, Zheng J, et al. Multicentric cancer detected at breast MR imaging and not at mammography: important or not? Radiology. 2016;279:378–84. 26. Mann RM, Loo CE, Wobbes T, et al. The impact of preoperative breast MRI on the reexcision rate in invasive lobular carcinoma of the breast. Breast Cancer Res Treat. 2010;119:415–22. 27. Davis KL, Barth RJ, Gui J, et al. Use of MRI in preoperative planning for women with newly diagnosed DCIS: risk or benefit? Ann Surg Oncol. 2012;19:3270–4. 28. Miller BT, Abbott AM, Tuttle TM. The influence of preoperative MRI on breast cancer treatment. Ann Surg Oncol. 2012;19:536–40. 29. Obdeijn IM, Tilanus-Linthorst MMA, Spronk S, et al. Preoperative breast MRI can reduce the rate of tumor-positive resection margins and reoperations in patients undergoing breast-conserving surgery. AJR Am J Roentgenol. 2013;200:304–10. 30. Fancellu A, Soro D, Castiglia P, et al. Usefulness of magnetic resonance in patients with invasive cancer eligible for breast conservation: a comparative study. Clin Breast Cancer. 2014;14:114–21. 31. Gonzalez V, Sandelin K, Karlsson A, et al. Preoperative MRI of the breast (POMB) influences primary treatment in breast cancer: a prospective, randomized, multicenter study. World J Surg. 2014;38: 1685–93. 32. Debald M, Abramian A, Nemes L, et al. Who may benefit from preoperative breast MRI? A single-center analysis of 1102 consecutive patients with primary breast cancer. Breast Cancer Res Treat. 2015;153:531–7. 1. Médicos Residentes em Radiologia e Diagnóstico por Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 2. Doutor, Médico Titular do Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 3. Médicas Titulares do Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 4. Médica Responsável pelo Serviço de Imagem da Mama do A.C.Camargo Cancer Center, São Paulo, SP, Brasil Endereço para correspondência: Dr. Almir Galvão Vieira Bitencourt A.C.Camargo Cancer Center – Departamento de Imagem Rua Professor Antônio Prudente, 211, Liberdade São Paulo, SP, Brasil, 01509-010 E-mail: almirgvb@yahoo.com.br Recebido para publicação em 22/6/2015. Aceito, após revisão, em 13/2/2016. Trabalho realizado no A.C.Camargo Cancer Center, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554