Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 49 nº 6 - Nov. / Dez. of 2016
Vol. 49 nº 6 - Nov. / Dez. of 2016
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Antônio Arildo Reginaldo de Holanda1; Ana Katherine da Silveira Gonçalves2; Robinson Dias de Medeiros3; António Manuel Gouveia de Oliveira4; Técia Maria de Oliveira Maranhão5 |
|
|
Descritores: Gestação; Lactação; Mama; Ultrassonografia. |
|
|
Resumo: INTRODUÇÃO
A avaliação ultrassonográfica das mamas durante a gravidez e lactação representa um grande desafio para o médico, sobretudo pelas várias mudanças fisiológicas que tornam o exame mais difícil, impedindo ou dificultando, frequentemente, uma interpretação adequada dos achados(1–3). As alterações da imagem ultrassonográfica mamária nestes períodos podem simular a presença de algumas doenças, bem como tornar confusa a avaliação de outras pré-existentes(4). Alguns processos benignos como trauma e inflamação, que podem ser confundidos com doenças malignas, dificultam ainda mais o diagnóstico, se concomitantes com a gravidez ou lactação(5). A maioria das lesões mamárias diagnosticadas durante a gravidez e lactação é benigna, sendo mesmo algumas específicas, como adenoma da lactação e galactocele(3). O diagnóstico do câncer de mama, por sua vez, é de difícil elucidação e menos frequente nestes períodos, quando comparado com mulheres não grávidas na mesma faixa etária, sendo ainda um desafio para o médico(1). Além disso, a compreensão dos vários problemas mamários e das características das imagens correspondentes é fundamental para estabelecer uma abordagem adequada das pacientes(2). As alterações fisiológicas próprias da gravidez e lactação aumentam a densidade mamária(2,4,6), particularmente em mulheres jovens(4), e dificultam tecnicamente a avaliação mamária nos exames de imagem(4,6). Na mamografia, o aumento da densidade mamária limita o seu uso(4), não obstante haja discordância de que a avaliação da imagem seja tão comprometida na gravidez e lactação a ponto de não poder ser recomendado o seu emprego quando houver indicação clínica(7). Todavia, devido ao risco da radiação ionizante para o feto, no primeiro trimestre da gravidez, durante a organogênese, a mamografia deve ser evitada, embora só tenha sido encontrada associação com malformações quando a irradiação é cerca de dois milhões de vezes mais elevada que o padrão(4). A ressonância magnética também não é normalmente empregada em pacientes grávidas ou lactantes, uma vez que as alterações fisiológicas normais podem obscurecer o diagnóstico de doenças mamárias, sendo a ultrassonografia e a mamografia mais apropriadas(4). A ressonância magnética pode, entretanto, ser indicada em algumas situações, como no câncer associado à gravidez, para avaliar a sua extensão e definir se é multifocal(4). Atualmente, considera-se que este método possa ser indicado apenas em determinadas situações, levando sempre em conta o risco-benefício, evitando-se contrastes à base de gadolínio, ainda que não haja provas conclusivas de que o seu uso, assim como também os campos eletromagnéticos da ressonância, tenham efeitos nocivos sobre o feto(4). A ultrassonografia é considerada o método de eleição na gravidez e lactação(2,6), com sensibilidade de 86,7% a 100%(2,4), superior à da mamografia(2,4,6), que é referida como sendo de 30%(8). A ultrassonografia tem ainda o benefício de não expor o concepto à radiação(2), de ter alta resolução, permitindo uma avaliação mais eficaz das estruturas mamárias, sendo excelente para o diagnóstico e diferenciação entre lesões benignas e malignas(1). Entretanto, sempre que uma imagem for considerada suspeita, a mamografia(4) e/ou a biópsia(9) são indispensáveis. O uso da ultrassonografia requer, porém, um sólido conhecimento, tanto da anatomia como de doenças mamárias, especialmente durante a lactação(10). Apesar disso, poucos estudos investigando a anatomia mamária têm sido conduzidos, desde que Cooper estudou as mamas de lactantes mediante dissecções, há mais de 160 anos(10,11), mesmo que inconsistências na anatomia das mamas no ciclo grávidopuerperal tenham sido observadas(11). O presente artigo teve como objetivo fazer uma revisão das alterações fisiológicas que ocorrem nas mamas durante a gravidez e lactação, bem como relatar as principais características ultrassonográficas das doenças mamárias mais frequentes nestes períodos. ALTERAÇÕES FISIOLÓGICAS MAMÁRIAS DA GRAVIDEZ E LACTAÇÃO As alterações nos níveis séricos de estrogênio, progesterona e prolactina são as responsáveis pelas mudanças fisiológicas na arquitetura das mamas(1,4,12), que se mostram evidentes no exame histológico(4). Sob a influência do estrogênio, iniciam-se no primeiro trimestre da gestação o crescimento e a proliferação ductal, e em menor grau, o crescimento alvéolo-lobular(1,4,12). A expansão do tecido glandular se processa com invasão do tecido adiposo, que involui gradativamente(1,4,12), ocorrendo concomitantemente um aumento da vascularização e do fluxo sanguíneo(1,4). Durante o segundo e terceiro trimestres, a progesterona induz a hiperplasia lobular, assim como a contínua involução do estroma fibrogorduroso(1,4). Apesar de o maior crescimento das mamas ocorrer até 22 semanas de gravidez, um crescimento considerável no último trimestre e no pós-parto pode ocorrer em algumas mulheres(4). No final da gravidez, os níveis elevados de estrogênio e progesterona se contrapõem à prolactina, inibindo a produção láctea plena(1,4,13,14), ocorrendo, todavia, produção de colostro nas células alveolares(1,13,14). Após o parto, com a diminuição do estrogênio e da progesterona, ocorre liberação constante de prolactina, por estímulo do fator liberador de prolactina no hipotálamo, ao mesmo tempo em que a estimulação física do mamilo pelo recém-nascido determina a liberação de ocitocina pela hipófise anterior, mantendo a lactação(1,13,14). Esta conversão do tecido mamário, de um estado proliferativo durante a gravidez para um estado secretor durante a lactação, denomina-se lactogênese(4). Como resultado de tais mudanças, a imagem típica mamária na gestação é difusamente hipoecoica, devido ao aumento do tecido fibroglandular, tornando-se difusamente hiperecogênica durante a lactação, em função do aumento da vascularização(1,4) e proeminência dos ductos(4) (Figuras 1 e 2). 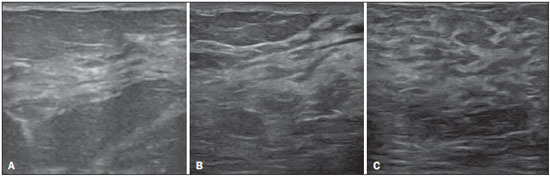 Figura 1. A: Mama no primeiro trimestre da gravidez: parênquima mamário predominantemente hipoecoico, observando-se dilatação ductal. B: Mama no segundo trimestre da gravidez: parênquima mamário com aumento da ecogenicidade, observando-se dilatação ductal mais pronunciada em comparação com o primeiro trimestre. C: Mama no terceiro trimestre da gravidez: parênquima mamário com considerável aumento da ecogenicidade, difusamente, e exuberante dilatação ductal quando comparado com o segundo trimestre. 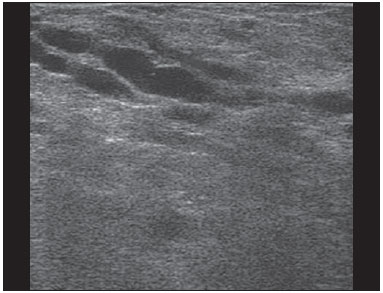 Figura 2. Mama durante a lactação. Parênquima mamário difusamente hiperecoico, com dilatação dos ductos decorrente do acúmulo de leite. Tais mudanças fisiológicas se manifestam, clinicamente, por aumento progressivo do volume, da firmeza e das nodularidades das mamas, o que torna o exame clínico mais difícil(11). Estas alterações foram avaliadas em um estudo com lactantes, que mostrou ser variável a distribuição de tecido adiposo e fibroglandular quando comparadas as várias mulheres, mas não entre as mamas de uma mesma mulher. O número médio de ductos principais observado foi 9,6 ± 2,9 para a mama esquerda e para a mama direita. O diâmetro médio dos ductos principais situados na base do mamilo foi 1,9 ± 0,6 mm para a mama esquerda e 2,1 ± 0,7 mm para a mama direita. A proporção de tecido fibroglandular e adiposo foi 63 ± 9% e 37 ± 9% para a mama esquerda e 65 ± 11% e 35 ± 12% para a mama direita. Não foi encontrada correlação entre a produção láctea e a quantidade de tecido fibroglandular, o número de ductos ou o diâmetro médio dos ductos, nem houve correlação entre a quantidade de tecido fibroglandular e a capacidade de armazenamento da mama(11). O estudo do fluxo sanguíneo mamário pelo Doppler pulsátil vem sendo bem aplicado em animais; todavia, em mulheres, os dados são ainda escassos, admitindo-se que ele aumente, principalmente, pelos ramos da artéria torácica interna e ramos da artéria torácica lateral, as quais fornecem 60–70% e 30% desse fluxo, respectivamente(13,14). Durante a gravidez, acredita-se que o fluxo sanguíneo dobre de volume(8,15–17), concomitantemente com o aumento da atividade metabólica e temperatura da mama, e persista durante a lactação, parecendo declinar até aos níveis pré-gestacionais duas semanas após o desmame(11). Estudos em animais documentam uma relação entre a produção láctea e o fluxo sanguíneo, alguns positivamente(17,18) e outros sem relação(15,19); já em mulheres(15,18), não há informações seguras que relacionem o aumento do fluxo sanguíneo mamário durante a gestação com a produção de leite(20). Um estudo com lactantes, utilizando Doppler colorido, mostrou que o fluxo sanguíneo varia muito entre as mulheres, mas não quando comparadas as mamas de uma mesma mulher. Apesar de não ter sido encontrada relação entre o fluxo sanguíneo mamário e a produção láctea, a redução substancial do fluxo sanguíneo em mulheres lactantes com baixa produção sugere um limiar abaixo do qual a produção de leite fica comprometida(15). ALTERAÇÕES INFLAMATÓRIAS/INFECCIOSAS Mastite puerperal Segundo a Organização Mundial da Saúde, mastite é definida como uma condição inflamatória da mama, a qual pode ou não ser acompanhada de infecção(2). As infecções, que raramente ocorrem na gestação, tornam-se frequentes durante a amamentação(1,2,4,12), com uma incidência de 6,6% a 31%(2,21), e apresentam maior incidência durante as seis semanas imediatamente após o parto(12). A causa permanece obscura(3), mas prováveis fatores etiopatogênicos considerados são a estase de leite, a obstrução de ductos, o ingurgitamento e, particularmente, a lesão da mama(2), que possibilita a entrada de micro-organismos oriundos do nariz e da boca do recém-nascido(1,4) no tecido mamário, pelas fissuras do epitélio do mamilo(1,2,12). O esvaziamento incompleto das mamas durante a amamentação predispõe à mastite(11), visto que o leite é um excelente meio de cultura, sobretudo quando estagnado(1), sendo o Staphylococcus aureus e o Streptococcus os agentes mais frequentes(1,4,12). A infecção por S. aureus, que é superficial, apresenta invasão focal desde o início do processo, enquanto a causada por Streptococcus é difusa e provoca abscesso apenas nas fases mais avançadas(1). Clinicamente, as pacientes apresentam mamas eritematosas e edemaciadas, sendo aventada a suspeita clínica de abscesso associado quando há área de flutuação(12). O diagnóstico da mastite puerperal não complicada normalmente é consolidado sem dificuldades com base na clínica(3,12), não havendo, em geral, a necessidade de se realizar ultrassonografia ou outros métodos de imagem, os quais podem ser indicados quando o tratamento clínico não é eficaz, visando descobrir abscessos(4,12,20,22). A ultrassonografia pode, no entanto, revelar espessamento da pele, áreas de diminuição da ecogenicidade do parênquima, aumento de vascularização no Doppler colorido, assim como linfoadenomegalia axilar(2) (Figura 3). 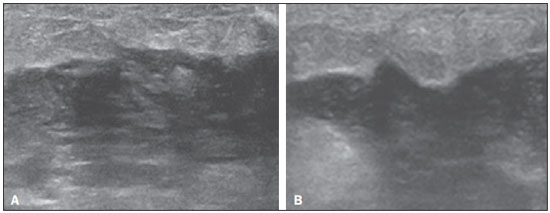 Figura 3. Mastite puerperal. Áreas amorfas de ecogenicidade variável, predominantemente hipoecoicas e heterogêneas, difusamente distribuídas no parênquima mamário, com limites mal definidos. Abscesso A formação de abscesso é normalmente uma complicação da mastite puerperal(2,4), principalmente se o tratamento tiver sido retardado ou inadequado(2). Aproximadamente 5% a 11% das mastites puerperais evoluem para abscessos(2,23), sendo o S. aureus e o Streptococcus os agentes patogênicos mais comuns. No exame clínico, a paciente apresenta febre, calafrios e eritema, além dos sinais observados na mastite, acrescidos de flutuação(12). A ultrassonografia é o método de eleição para o diagnóstico, bem como para guiar a drenagem da coleção, sendo útil também para acompanhar a evolução do processo durante o tratamento(1,2). O diagnóstico pode ser mais difícil na fase pré-supurativa e ser confundido com uma lesão maligna na fase supurativa(3). A imagem normalmente revela uma formação hipoecoica, complexa, de forma variada, geralmente multilocular, com margens não circunscritas, com vascularização periférica e reforço acústico posterior, podendo apresentar pontilhado ecogênico central, que corresponde a tecidos degenerados ou mortos(2,4). Porém, não há nenhuma vascularização dentro da coleção(2,24) (Figura 4). 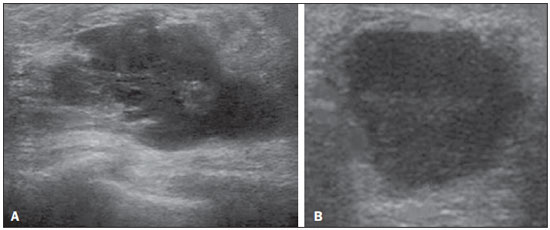 Figura 4. Abscesso. A: Lesão amorfa, unilocular, complexa, com margens não circunscritas, orientação paralela à pele, heterogênea, com ecogenicidade variável, predominantemente hipoecoica e discreto reforço acústico posterior, correspondendo a abscesso com área de flutuação. B: Lesão ovoide, com margens circunscritas, orientação paralela à pele, hipoecoica, homogênea, apresentando discreto reforço acústico posterior, correspondendo a abscesso em formação. Às vezes, o aspecto ultrassonográfico do abscesso pode sugerir outras doenças, como galactocele, que tem aspecto muito variável e pode apresentar infecção secundária, mostrando-se, frequentemente, como uma lesão heterogênea, com nível líquido-gordura(4), que deve requerer punção aspirativa guiada por ultrassonografia para o diagnóstico diferencial com o abscesso(4). A mamografia pode ser indicada se não há um diagnóstico prévio de certeza pela ultrassonografia, podendo mostrar sinais como massa, distorção, densidade assimétrica e espessamento da pele, os quais não são específicos de câncer e são indicativos de drenagem percutânea(2). Linfonodos intramamários e/ou axilares aumentados Os linfonodos benignos são comumente bilaterais, múltiplos, e surgem como resposta a processos inflamatórios, doenças infecciosas, neoplasias e artrite reumatoide. As causas malignas incluem metástase de câncer de mama e linfoma. Durante a lactação podem surgir linfonodos aumentados, sendo relacionados à propagação bacteriana a partir do mamilo durante a amamentação, e vistos normalmente no quadrante superior externo da mama e na axila(2). Na ultrassonografia, os linfonodos benignos apresentam bordas hipoecoicas e halo hiperecogênico. Quando hiperplásicos, normalmente demonstram espessamento cortical concêntrico(2) (Figura 5). 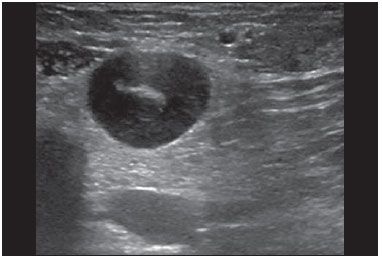 Figura 5. Linfonodo reacional benigno. Nódulo ovoide, com orientação paralela à pele, com margens circunscritas, bordas hipoecoicas e halo hiperecogênico, correspondendo a linfonodo benigno. Mastite granulomatosa Mastite granulomatosa é uma doença crônica, benigna, sem causa conhecida(25), rara, associada com a gravidez e a lactação, que afeta geralmente mulheres jovens, podendo mesmo surgir meses ou anos após o ciclo grávido-puerperal. A origem é provavelmente idiopática, embora a hipótese de ser causada por Corynebacterium seja aventada(1,4). Considera-se também que uma reação autoimune à secreção ductal possa estar relacionada, em que o parto, a lactação e o uso de anticoncepcionais orais apresentam papel relevante no desenvolvimento da doença(26). Comumente, manifestam-se alterações clínicas e radiológicas sugestivas de carcinoma inflamatório e abscesso mamários(1,25,27). Por este motivo e também pela tendência à recorrência e à resolução lenta(20), por existir linfoadenomegalia em 15% dos casos(1,12,27), o diagnóstico histopatológico é indispensável e o seguimento prolongado é necessário(25). O diagnóstico baseia-se na exclusão. O exame histopatológico revela, geralmente, reação inflamatória granulomatosa, indicando que precisam ser excluídas outras doenças como tuberculose, infecções fúngicas, sarcoidose, granulomatose de Wegener, além de reações granulomatosas encontradas em carcinomas. A aparência da imagem pode ser variável e às vezes ser sugestiva de malignidade. Na mamografia, pode não ser detectada nenhuma anormalidade ou serem vistas imagens não específicas, tais como massa única ou múltipla, área de distorção arquitetural, assimetria focal, calcificações ou espessamento da pele. A correlação da imagem com o exame histopatológico é fundamental, tendo em vista a possibilidade de associação com carcinoma, sobretudo quando não há resposta à corticoterapia(2). Os achados dos exames físico e ultrassonográfico são inespecíficos(20), habitualmente apresentando-se, na ultrassonografia, como nódulo ou massa hipoecoica(1,4), solitária ou múltipla, heterogênea, com margens circunscritas, com aspecto tubular. Abscesso difuso e formação de fístulas também podem ser vistos(2) (Figura 6). 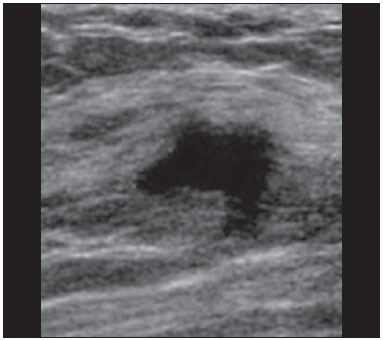 Figura 6. Mastite granulomatosa. Formação amorfa, com orientação não paralela à pele, margens não circunscritas, hipoecoica e de limites mal definidos. LESÕES BENIGNAS COMUNS Galactocele Geralmente ocorre como resultado de um ducto distal obstruído, o qual provoca distensão dos segmentos proximais lobulares, e apresenta-se clinicamente como uma massa amolecida à palpação(2,4), indolor, a qual contém proteína, gordura, lactose e frequentemente pode apresentar complicações como infecção e necrose(1,12). É a lesão mais comum durante a lactação(2,4,11), podendo ser diagnosticada semanas ou meses após a interrupção da amamentação, e também já no terceiro trimestre da gestação(1,12). Frequentemente é unilocular ou bilocular na região central ou multilocular na periferia(1). O aspecto da imagem na ultrassonografia é variável, dependendo da quantidade de gordura, proteína e água. O aspecto clássico é o de uma lesão cística, com sombra acústica posterior, com pontilhado fino ou grosseiro, correspondendo a partículas de gordura em suspensão(2,20) (Figura 7). 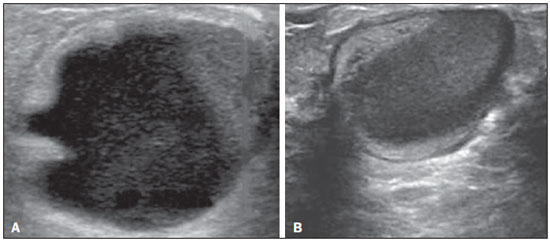 Figura 7. Galactocele. A: Lesão com orientação paralela à pele, com margens circunscritas, apresentando componente anecoico (cístico) e componente ecogênico (sólido), com discreto reforço acústico posterior e limites bem definidos. B: Lesão com orientação paralela à pele, margens circunscritas, predominantemente hipoecoica, com áreas periféricas de hiperecogenicidade e reforço acústico posterior. Pode se apresentar como lesão única ou múltipla(2,4), unilateral ou bilateral(4), e como lesão cística, com margens circunscritas, compatível com um processo benigno(2,4). Pode, também, apresentar características de lesão maligna, incluindo forma irregular e margens não circunscritas(4). O interior da lesão varia de homogêneo a heterogêneo, pela presença de ecos, a depender do conteúdo(2). A mamografia e a ressonância magnética podem ser necessárias quando houver suspeita de outras doenças como abscesso e câncer, pois a demonstração de gordura ou de nível líquido-gordura nestes métodos pode confirmar o diagnóstico. Se persistir a dúvida, a aspiração diagnóstica e terapêutica pode ser recomendada(4). Adenoma da lactação O adenoma da lactação é um tumor benigno, causado pelas alterações fisiológicas, sobretudo durante a lactação e no terceiro trimestre da gravidez(1,4,12), podendo ocasionalmente surgir também no primeiro e segundo trimestres(11). É interpretado, às vezes, como uma variante do fibroadenoma, adenoma tubular, hiperplasia lobular, que também são causados por alterações fisiológicas(1,28,29). Durante a gravidez é o tumor mais frequente(2) e evolui com redução de volume, podendo desaparecer espontaneamente no terceiro trimestre(2,4) ou na lactação(1,2,4,12), e algumas vezes também em decorrência de necrose(1,30). Clinicamente apresenta-se como massa palpável(1,2,12), indolor, macia, móvel(12), que pode, ocasionalmente, apresentar recorrência em gestações subsequentes(1,2), mas normalmente não recidiva após ressecção cirúrgica completa(1). Quando ocorre infarto, pode se tornar clinicamente atípico, apresentando-se como uma massa firme(12). É difícil a distinção, na ultrassonografia, entre um adenoma da lactação e um fibroadenoma(1,4,12). Os achados ultrassonográficos são normalmente compatíveis com um processo benigno, mas são inespecíficos(7), incluindo a baixa ecogenicidade(4). Mais frequentemente aparece como uma massa oval, com o maior eixo paralelo à pele, apresentando margens circunscritas, textura homogênea e sombra acústica posterior. Pode ainda ter discretas lobulações, as quais apresentam limites com o tecido circundante não muito definidos(1), mostrando também discreto fluxo no Doppler(2). Tal como o fibroadenoma, o adenoma da lactação pode ser múltiplo e bilateral(12). O diagnóstico diferencial com lesões malignas pode ser difícil quando ocorre infarto(4,28,30,31) e necrose(1), por apresentarem margens pouco claras(1,12), microlobulação periférica(1), heterogeneidade estrutural e sombra acústica posterior(1,4,13) (Figura 8). 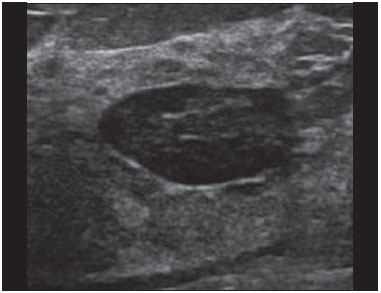 Figura 8. Adenoma da lactação. Nódulo ovoide, com orientação paralela à pele, margens circunscritas, padrão hipoecoico, heterogêneo, limites bem definidos. Fibroadenoma O fibroadenoma é comum em pacientes jovens não grávidas, aumentando de volume, frequentemente, durante a gravidez e lactação(1,2), em resposta ao aumento dos níveis estrogênicos(1,4). Assim como acontece com os adenomas da lactação, geralmente regride após a interrupção da amamentação(4). A lesão é normalmente indistinguível do adenoma da lactação na ultrassonografia(1,4), sendo predominantemente hipoecoica(2,4), com forma redonda ou oval, textura homogênea, margens circunscritas, pseudocápsula, ausência de sombra acústica posterior e tecido adjacente normal(2). Entretanto, durante a gravidez, pode apresentar-se atípico, com aspecto cístico, aumento da vascularização e ductos proeminentes(2). Tal como no adenoma da lactação, pode apresentar também infarto, em razão da relativa diminuição do suprimento vascular, aparecendo mais heterogêneo na ultrassonografia(4,18,28,30). A presença de características atípicas, tais como microlobulações, margens não circunscritas, ecotextura heterogênea, sombra acústica posterior e hipoecogenicidade exacerbada, pode indicar a realização de biópsia percutânea para confirmar o diagnóstico(2) (Figura 9). 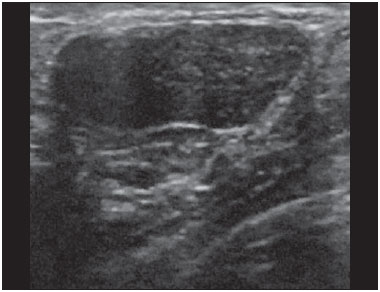 Figura 9. Fibroadenoma. Nódulo ovoide, com orientação paralela à pele, margens circunscritas, padrão hipoecoico, homogêneo, com discreto reforço acústico posterior. CÂNCER DE MAMA ASSOCIADO À GRAVIDEZ O câncer de mama associado à gravidez é definido como sendo o que ocorre concomitantemente com a gravidez ou até um ano após o parto. Representa 3% de todos os cânceres da mama, com incidência de um caso para cada 3.000 a 10.000 gestações(1,2), tendendo a aumentar atualmente, em razão do maior número de mulheres que engravidam tardiamente(4). Em geral, é biologicamente agressivo, receptornegativo para estrogênio e progesterona e positivo para receptores tipo 2 do fator de crescimento epidérmico humano (Her2-neu)(2). A ultrassonografia é o método ideal para detectar uma imagem latente na gravidez, tendo em vista a sua alta sensibilidade, a possibilidade de avaliar os linfonodos axilares e monitorar a resposta à quimioterapia. No entanto, se uma lesão suspeita é observada na ultrassonografia, recomenda-se que a mamografia, por ser considerada um método seguro, deva ser realizada(4,20,31–33), assim como a biópsia guiada por ultrassonografia(34). Nestes dois exames, a imagem encontrada normalmente não difere muito da do câncer em não grávidas(2,4). Se a lesão é considerada altamente suspeita ou se o resultado da biópsia é positivo, a avaliação da axila ipsilateral também deve ser feita(34). Este tumor tende a ser maior, é diagnosticado mais tardiamente e apresenta pior prognóstico do que o câncer em não grávidas da mesma idade(4,34). As pacientes geralmente apresentam massa palpável e indolor(4), fixa aos planos profundos(5), com edema e eritema difusos nas fases adiantadas da doença(4). Na ultrassonografia, aparece como massa heterogênea, hipoecoica ou complexa, cujo diâmetro transverso é igual ou menor que o diâmetro vertical (orientação não paralela à pele), com forma irregular, margens não circunscritas, halo ecogênico variável e sombreamento acústico posterior(2,5). O carcinoma ductal in situ, que está associado com microcalcificações, é facilmente detectado na mamografia e muitas vezes não é observado na ultrassonografia(5). Outros achados associados incluem espessamento dos ligamentos suspensores da mama, edema cutâneo e linfadenopatia axilar(2) (Figura 10). 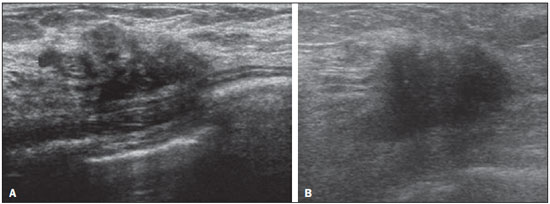 Figura 10. Câncer de mama associado à gravidez. A: Formação amorfa, com orientação paralela à pele, margens não circunscritas, com ecogenicidade variável, predominantemente hipoecoica, com textura heterogênea, discreto reforço acústico posterior e limites mal definidos. B: Nódulo irregular, com orientação paralela à pele, margens não circunscritas, hipoecoica, heterogênea, apresentando discreto sombreamento acústico posterior e limites mal definidos. No Doppler, apresenta fluxo, com padrão vascular caótico. Alguns carcinomas são muito sutis, com ecogenicidade semelhante à dos tecidos circundantes(5). CONCLUSÃO O diagnóstico ultrassonográfico de doenças mamárias durante a gravidez e lactação é desafiador por causa das alterações hormonais características desses períodos, que podem modificar o aspecto da imagem. Dependendo da natureza da suspeita diagnóstica, outros métodos de imagem e/ou biópsia podem ser necessários para a elucidação diagnóstica. Para tanto, é necessária uma compreensão adequada das alterações fisiológicas e das lesões mamárias benignas comuns nesses períodos, para as diferenciar do câncer da mama associado à gravidez. Com isso, a demora no diagnóstico é evitada, possibilitando uma abordagem satisfatória e um tratamento mais eficaz. REFERÊNCIAS 1. Yu JH, Kim MJ, Cho H, et al. Breast diseases during pregnancy and lactation. Obstet Gynecol Sci. 2013;56:143–59. 2. Joshi S, Dialani V, Marotti J, et al. Breast disease in the pregnant and lactating patient: radiological-pathological correlation. Insights Imaging. 2013;4:527–38. 3. Boisserie-Lacroix M, Dos Santos E, Belléannée G, et al. La femme enceinte: difficultés diagnostiques. Imagerie de la Femme. 2004;14: 145–52. 4. Canoy JM, Mitchell GS, Unold D, et al. A radiologic review of common breast disorders in pregnancy and the perinatal period. Semin Ultrasound CT MR. 2012;33:78–85. 5. Svensson WE. A review of the current status of breast ultrasound. Eur J Ultrasound. 1997;6:77–101. 6. Bock K, Hadji P, Ramaswamy A, et al. Rationale for a diagnostic chain in gestational breast tumor diagnosis. Arch Gynecol Obstet. 2006;273:337–45. 7. Swinford AE, Adler DD, Garver KA. Mammographic appearance of the breasts during pregnancy and lactation: false assumptions. Acad Radiol. 1998;5:467–72. 8. Lee SS, Hartman HJ, Kuzmiak CM, et al. Management of breast symptoms in the pregnant and lactating patient. Curr Obstet Gynecol Rep. 2013;2:53–8. 9. Sumkin JH, Perrone AM, Harris KM, et al. Lactating adenoma: US features and literature review. Radiology. 1998;206:271–4. 10. Geddes DT. Inside the lactating breast: the latest anatomy research. J Midwifery Womens Health. 2007;52:556–63. 11. Ramsay DT, Kent JC, Hartmann RA, et al. Anatomy of the lactating human breast redefined with ultrasound imaging. J Anat. 2005; 206:525–34. 12. Vashi R, Hooley R, Butler R, et al. Breast imaging of the pregnant and lactating patient: physiologic changes and common benign entities. AJR Am J Roentgenol. 2013;200;329–36. 13. Rosen PP. Anatomic and physiologic morphology. In: Rosen PP, editor. Rosen's breast pathology. 2nd ed. Philadelphia, PA: Lippicott-Raven; 2001. p 1–21. 14. Neville MC. Anatomy and physiology of lactation. Pediatr Clin North Am. 2001;48:13–34. 15. Gedds DT, Aljazaf KM, Kent JC, et al. Blood flow characteristics of the human lactating breast. J Hum Lact. 2012;28:145–52. 16. Vorherr H. The breast: morphology, physiology and lactation. London, UK: Academic Press; 1974. 17. Thoresen M, Wesche J. Doppler measurements of changes in human mammary and uterine blood flow during pregnancy and lactation. Acta Obstet Gynecol Scand. 1988;67:741–5. 18. Stelwagen K, Davis SR, Farr VC, et al. Mammary epithelial cell tight junction integrity and mammary blood flow during an extended milking interval in goats. J Dairy Sci. 1994;77:426–32. 19. Lacasse P, Prosser CG. Mammary blood flow does not limit milk yield in lactating goats. J Dairy Sci. 2003;86:2094–7. 20. Sebate JM, Clotet M, Torrubia S, et al. Radiologic evaluation of breast disorders related to pregnancy and lactation. Radiographics. 2007;27 Suppl 1:S101–24. 21. Kvist LJ, Larsson BW, Hall-Lord ML, et al. The role of bacteria in lactational mastitis and some considerations of the use of antibiotic treatment. Int Breastfeed J. 2008;3:6. 22. Marchant DJ. Inflammation of the breast. Obstet Gynecol Clin North Am. 2002;29:89–102. 23. Ulitzsch D, Nyman MK, Carlson RA. Breast abscess in lactating women: US-guided treatment. Radiology. 2004;232:904–9. 24. Karstrup S, Solvig J, Nolsoe CP, et al. Acute puerperal breast abscesses: US-guided drainage. Radiology. 1993;188:807–9. 25. Goulart APS, Silva RS, Volbrecht B, et al. Mastite granulomatosa lobular idiopática: relato de caso. Rev Bras Mastologia. 2011;21:46–9. 26. Hur SM, Cho DH, Lee SK, et al. Experience of treatment of patients with granulomatous lobular mastitis. J Korean Surg Soc. 2013;85:1–6. 27. Han BK, Choe YH, Park JM, et al. Granulomatous mastitis: mammographic and sonographic appearances. AJR Am J Roentgenol. 1999;35:941–5. 28. Baker TP, Lenert JT, Parker J, et al. Lactating adenoma: a diagnosis of exclusion. Breast J. 2001;7:354–7. 29. Saglam A, Can B. Coexistence of lactating adenoma and invasive ductal adenocarcinoma of the breast in a pregnant woman. J Clin Pathol. 2005;58:87–9. 30. Behrndt VS, Barbakoff D, Askin FB, et al. Infarcted lactating adenoma presenting as a rapidly enlarging breast mass. AJR Am J Roentgenol. 1999;173:933–5. 31. Son EJ, Oh KK, Kim EK. Pregnancy-associated breast disease: radiologic features and diagnostic dilemmas. Yonsei Med J. 2006;47: 34–42. 32. Hogge JP, De Paredes ES, Magnant CM, et al. Imaging and management of breast masses during pregnancy and lactation. Breast J. 1999;5:272–83. 33. Taylor D, Lazberger J, Ives A, et al. Reducing delay in the diagnosis of pregnancy-associated breast cancer: how imaging can help us. J Med Imaging Radiat Oncol. 2011;55:33–42. 34. Vashi R, Hooley R, Butler R, et al. Breast imaging of the pregnant and lactating patient: imaging modalities and pregnancy-associated breast cancer. AJR Am J Roentgenol. 2013;200:321–8. 1. Mestre, Doutorando do Programa de Pós-Graduação em Ciências da Saúde da Universidade Federal do Rio Grande do Norte (UFRN), Médico da Maternidade Escola Januário Cicco, Natal, RN, Brasil 2. Doutora, Professora Associada do Departamento de Tocoginecologia da Universidade Federal do Rio Grande do Norte (UFRN), Natal, RN, Brasil 3. Doutor, Professor Adjunto do Departamento de Tocoginecologia da Universidade Federal do Rio Grande do Norte (UFRN), Médico da Maternidade Escola Januário Cicco, Natal, RN, Brasil 4. Doutor, Professor Visitante da Universidade Federal do Rio Grande do Norte (UFRN), Natal, RN, Brasil 5. Doutora, Professora Titular do Departamento de Tocoginecologia da Universidade Federal do Rio Grande do Norte (UFRN), Natal, RN, Brasil Endereço para correspondência: Dr. Antônio Arildo Reginaldo de Holanda Rua Joaquim Câmara, 226, ap. 201, Tirol Natal, RN, Brasil, 59015-270 E-mail: arildoholanda@ufrnet.br Recebido para publicação em 30/4/2015. Aceito, após revisão, em 16/2/2016. Trabalho realizado no Departamento de Tocoginecologia da Universidade Federal do Rio Grande do Norte (UFRN), Natal, RN, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554