Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 49 nº 5 - Set. / Out. of 2016
Vol. 49 nº 5 - Set. / Out. of 2016
|
ARTIGOS ORIGINAIS
|
|
|
|
|
Autho(rs): Luiz de Abreu Junior1; Cristina Hiromi Kuniyoshi2; Angela Borri Wolosker1; Maria Lúcia Borri1; Augusto Antunes3; Vanessa Kiyomi Arashiro Ota4; Daniela Uchida2 |
|
|
Descritores: Compressão vascular; Ressonância magnética; Zumbido; Hipoacusia; Tontura. |
|
|
Resumo: INTRODUÇÃO
Dentre os sintomas otológicos comuns, podemos encontrar o zumbido (a percepção de sons na ausência de estímulos externos), a hipoacusia (ou deficiência auditiva) e a tontura. A prevalência estimada desses três sintomas na população brasileira é de aproximadamente 22% para zumbido(1), 9% para hipoacusia(2) e 42% para tontura(3), aumentando de acordo com a idade. Embora existam diversas doenças associadas aos sintomas otológicos, nem sempre a causa é identificada. Em alguns casos, acredita-se que uma alça vascular da artéria cerebelar anteroinferior (ACAI), insinuando-se ao interior do conduto auditivo interno, seja a etiologia. O termo síndrome de compressão vascular foi inserido pela primeira vez na literatura em 1936 por McKenzie(4,5) e popularizado por Jannetta em 1975(6), ao se referir a um grupo de doenças causadas pelo contato direto entre um vaso sanguíneo e um nervo craniano. O protótipo dessa alteração, o espasmo hemifacial, foi descrito pela primeira vez em 1875, quando se identificou um aneurisma de artéria vertebral comprimindo o nervo facial de um paciente(7). Dessa forma, esse conceito foi ampliado para tentar explicar doenças relacionadas a vários nervos cranianos. Jannetta et al., por exemplo, sugeriram que alças arteriais redundantes poderiam interferir com o nervo vestibulococlear (VIII par craniano), resultando em sintomas otológicos(8). Embora existam inúmeros artigos publicados versando sobre essa condição, a existência das síndromes de compressão vascular continua a ser questionada. O objetivo do presente estudo foi avaliar e analisar, por meio da ressonância magnética (RM), a presença de alça vascular e sua associação com o quadro otológico. MATERIAIS E MÉTODOS Selecionamos 33 adultos com queixas otológicas (zumbido, hipoacusia ou tontura) que realizaram RM em nosso serviço, entre junho e novembro de 2013. Estes pacientes responderam um questionário e assinaram termo de consentimento livre e esclarecido. A população foi composta de 21 mulheres (63,6%) e 12 homens (36,4%), com idades entre 21 e 83 anos (média de 51,1 ± 17,3 anos). Avaliamos o trajeto da ACAI em relação ao conduto auditivo interno por meio de uma sequência ponderada em T2, com técnica DRIVE 3D, que permite elevado contraste entre o líquor no espaço subaracnóideo e os nervos cranianos. Os exames foram realizados em equipamentos Gyroscan-NT e Intera (Philips; Best, Holanda), com campos magnéticos de 1,0 T e 1,5 T, respectivamente. Os tipos de alças vasculares foram determinados segundo a classificação de Chavda(8), por três radiologistas com experiência superior a cinco anos e que não tinham conhecimento do lado do sintoma otológico do paciente. A classificação de Chavda define as alças vasculares da ACAI da seguinte maneira(8): tipo I – quando se identifica uma alça vascular da ACAI margeando o conduto auditivo interno (poro acústico interno); tipo II – quando a alça se insinua para o interior do conduto auditivo interno, mas não se estende além de 50% do comprimento do canal; tipo III – quando a alça se estende por mais que 50% do comprimento do canal. Utilizamos o teste de qui-quadrado para avaliar a associação entre alça vascular com zumbido, hipoacusia e vertigem, sendo o índice de significância adotado de 0,05. O teste de kappa foi utilizado para verificar a concordância entre os examinadores quanto ao tipo de alça vascular identificado. RESULTADOS As frequências dos sintomas otológicos (zumbido, hipoacusia e tontura) estão descritas na Tabela 1. Catorze (42,4%) pacientes queixavam-se de zumbido (em qualquer das orelhas), 14 (42,4%) referiam perda auditiva e 25 (75,8%) queixavam-se de tontura. 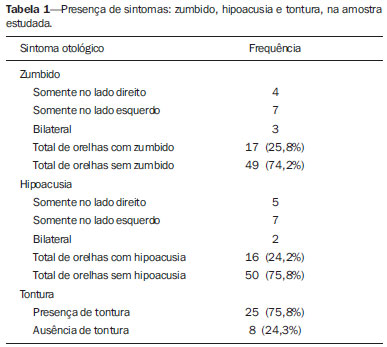 Para a classificação de Chavda, primeiramente calculamos a concordância entre os examinadores, e os valores de kappa encontram-se descritos na Tabela 2. 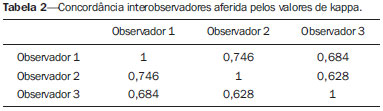 Exemplos dos exames com alças vasculares encontrados em nosso estudo, segundo a classificação de Chavda, são mostrados nas Figuras 1, 2 e 3. 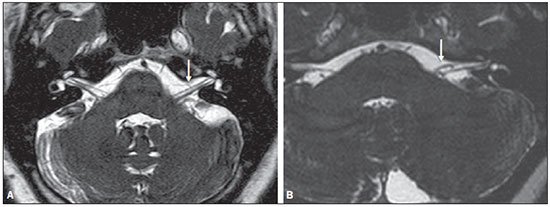 Figura 1. Alças de ACAI tipo I de Chavda. Notar que o vaso projeta-se junto do poro acústico interno esquerdo, sem se estender ao seu interior (setas). 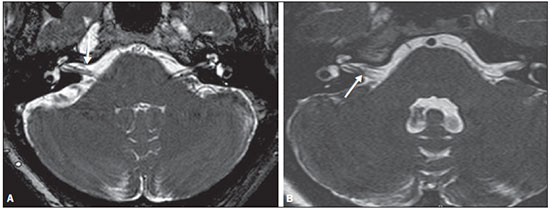 Figura 2. Exemplos de alças de ACAI tipo II de Chavda. A estrutura vascular estende-se ao interior do conduto auditivo interno, porém sem exceder 50% de seu comprimento total (setas). 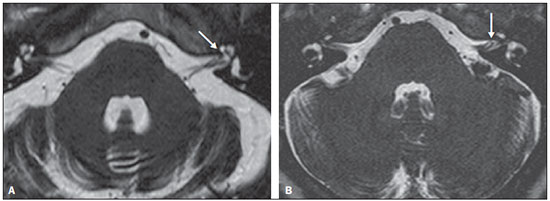 Figura 3. Exemplos de alças de ACAI do tipo III de Chavda. O vaso estende-se por mais de 50% do comprimento do conduto auditivo interno, atingindo sua porção fúndica (setas). Para a análise da concordância na classificação da alça vascular entre os examinadores, separamos pelo lado da orelha e consideramos as classificações de Chavda concordantes entre pelo menos dois avaliadores. Nesta análise, do total das 66 orelhas avaliadas, 2 foram excluídas por apresentarem diferentes classificações entre todos os três examinadores. Portanto, 64 medidas foram consideradas. Das 64 orelhas incluídas, 28 (43,75%) não apresentavam alça vascular, 31 (48,44%) apresentavam o tipo I de Chavda e 5 (7,81%), o tipo II. Realizamos o teste de qui-quadrado comparando a presença ou não de alça vascular e a classificação de Chavda com os seguintes sintomas: zumbido, perda auditiva e tontura. Os resultados estão descritos na Tabela 3. Como observado pelo valor de p, não encontramos associação entre os sintomas otoneurológicos e a presença ou o tipo de alça vascular.  Também avaliamos os grupos em presença (Chavda I ou II) ou ausência de alça vascular, entretanto, também não encontramos resultados estatisticamente significantes (zumbido: χ2 = 0,339, p = 0,561; perda auditiva: χ2 = 0,731, p = 0,393; tontura: χ2 = 0,451, p = 0,502). DISCUSSÃO Nossos resultados não indicaram associação entre os sintomas otológicos e a presença ou o tipo de alça vascular da ACAI. Isolamos os resultados de acordo com a orelha afetada e consideramos apenas a classificação de Chavda concordante entre pelo menos dois dos observadores. Esses achados corroboram a maior parte dos estudos presentes na literatura(5,9–11). Jannetta popularizou o conceito das síndromes de compressão vascular, ao relatar melhora da hiperatividade disfuncional do VIII par craniano após separá-lo de um vaso por microcirurgia, defendendo a teoria da alça arterial como fator etiológico da disfunção(6). A partir desse estudo, diversos outros investigadores tentaram estabelecer relação entre compressões vasculares e uma série de condições clínicas, como espasmo hemifacial e neuralgia do trigêmeo(4). Entretanto, ainda existe controvérsia no que se refere à fisiopatologia dessas condições, tendo sido sugerido que a compressão crônica possa ser responsável por desmielinização regional do nervo ou, ainda, que haja distúrbios na distribuição do fluxo sanguíneo, resultando em redução da perfusão vascular do nervo, determinando os quadros clínicos das síndromes de compressão vascular(12–15). Deve-se salientar que a possibilidade da investigação não invasiva da relação entre vasos e nervos intracranianos foi atingida pelo desenvolvimento de técnicas de RM bastante sensíveis. As sequências volumétricas com forte ponderação T2 (CISS, FIESTA, B-FFE) apresentam vantagens em relação aos exames angiográficos convencionais, uma vez que, além de se tratar de métodos não invasivos (sem uso de contraste algum), permitem avaliação tanto vascular quanto do nervo em questão, e da relação harmônica ou potencialmente patológica entre eles(16,17). Apesar de o conceito de compressão vascular ter sido amplamente aceito para o espasmo hemifacial e para a neuralgia do trigêmeo, a sua relação com sintomas otológicos como zumbido, hipoacusia e tontura ainda não está clara. Queixas otológicas são relativamente comuns em nosso cotidiano e não é incomum encontrarmos casos em que a causa não é identificada; para muitos desses casos, a compressão vascular tem sido considerada como fator etiológico(18). Makins et al. não relataram diferenças significativas com relação à presença de alças vasculares, entre orelhas com sinais e sintomas clínicos e orelhas sadias (assintomáticas), sugerindo que a presença de alça vascular na RM, per se, não é patológica, podendo ser encarada mais como um achado de exame(5). Semelhantemente, para Grocoske et al. a presença do conflito neurovascular do VIII par craniano nas imagens de RM não justificou, por si só, os sinais e sintomas otoneurológicos nos indivíduos avaliados(9). Nós também não encontramos associação entre a presença ou o tipo de alça vascular na RM e a clínica otoneurológica relatada. De acordo com estudos post mortem, as alças de ACAI são encontradas dentro do conduto auditivo interno em 12,3% dos ossos temporais humanos(11,19), embora isso possa ser diferente in vivo, uma vez que podem ocorrer alterações decorrentes do processo de fixação com o formaldeído(20). Assim, somente a presença de alças vasculares dentro do conduto auditivo interno pode não ser um indício de que haja compressão vascular do VIII par craniano. Há que se considerar que possa tratar-se apenas de uma variação anatômica. Neste sentido, observamos que a maior parte dos pacientes de nossa amostra (n = 36) apresentava, ao menos, alças do tipo I de Chavda. Gultekin et al. observaram, também, que 72% dos controles apresentavam alça vascular da ACAI no conduto auditivo interno (tipo I de Chavda)(10). Entretanto, os dados ainda são controversos e há estudos publicados que indicaram associação entre alças vasculares e sintomas otológicos(6,21–24). A discrepância de resultados pode ser explicada, ao menos parcialmente, por diferenças entre observadores, o que pode comprometer os resultados das estimativas e a aplicação dos diferentes tipos de classificação. Utilizamos, em nosso estudo, três observadores, e verificamos que eles apresentaram concordância na classificação das alças, que foi estimada de moderada a substancial pelo índice kappa. Parte das inconsistências pode ser explicada pela dificuldade na diferenciação entre os tipos consecutivos de alça vascular segundo a classificação de Chavda. Por conta disso, utilizamos, para nossas análises, apenas valores concordantes entre pelo menos dois observadores, reduzindo o risco de introdução de viés de observadores. Novos estudos serão úteis para demonstrar detalhes da relação entre a estrutura vascular e o complexo nervoso, eventualmente gerando novas classificações que permitam maior poder discriminatório entre casos realmente patológicos e os situados no limite da normalidade. Alguns achados, quando presentes, podem aumentar a probabilidade de o sintoma otoneurológico estar relacionado a compressão neurovascular, e entre eles devem ser lembrados: deslocamento do trajeto nervoso pela estrutura vascular, compressão vascular junto da emergência da raiz nervosa e cruzamento perpendicular entre o vaso e o nervo(25). CONCLUSÕES Os resultados mostraram independência entre os achados da RM e o quadro clínico, sugerindo que não existe relação direta e exclusiva entre o diagnóstico de alça vascular da ACAI identificado à RM e o quadro clínico otoneurológico correspondente. Portanto, à luz do conhecimento atual, acreditamos que o diagnóstico de síndrome de compressão vascular não deva ser baseado apenas nos achados do exame de imagem (RM em nosso caso), principalmente para que se evitem intervenções desnecessárias ou infrutíferas. REFERÊNCIAS 1. Oiticica J, Bittar RS. Tinnitus prevalence in the city of São Paulo. Braz J Otorhinolaryngol. 2015;81:167–76. 2. Bittar RSM, Oiticica J, Bottino MA, et al. Population epidemiological study on the prevalence of dizziness in the city of São Paulo. Braz J Otorhinolaryngol. 2013;79:688–98. 3. Cruz MS, Oliveira LR, Carandina L, et al. Prevalence of self-reported hearing loss and attributed causes: a population-based study. Cad Saúde Pública. 2009;25:1123–31. 4. Markowski J, Gierek T, Kluczewska E, et al. Assessment of vestibulocochlear organ function in patients meeting radiologic criteria of vascular compression syndrome of vestibulocochlear nerve—diagnosis of disabling positional vertigo. Med Sci Monit. 2011;17: CR169–73. 5. Makins AE, Nikolopoulos TP, Ludman C, et al. Is there a correlation between vascular loops and unilateral auditory symptoms? Laryngoscope. 1998;108(11 Pt 1):1739–42. 6. Jannetta PJ. Neurovascular cross-compression in patients with hyperactive dysfunction symptoms of the eighth cranial nerve. Surg Forum. 1975;26:467–9. 7. Shultze F. Linksseitieer fatialiskrampf in folge cines aneurysma der arterid verteralis sinistra. Virchows Arch. 1875;65:385–91. 8. Jannetta PJ, Mrller MB, Mrller AR. Disabling positional vertigo. N Engl J Med. 1984;310:1700–5. 9. Grocoske FLB, Mendes RCCG, Vosguerau R, et al. Achados otoneurológicos em pacientes com diagnóstico de alça vascular de VIII par craniano na ressonância magnética. Arq Int Otorrinolaringol. 2011;15:418–25. 10. Gultekin S, Celik H, Akpek S, et al. Vascular loops at the cerebellopontine angle: is there a correlation with tinnitus? AJNR Am J Neuroradiol. 2008;29:1746–9. 11. Sirikci A, Bayazit Y, Ozer E, et al. Magnetic resonance imaging based classification of anatomic relationship between the cochleovestibular nerve and anterior inferior cerebellar artery in patients with non-specific neuro-otologic symptoms. Surg Radiol Anat. 2005;27:531–5. 12. Girard N, Poncet M, Caces F, et al. Three-dimensional MRI of hemifacial spasm with surgical correlation. Neuroradiology. 1997;39:46–51. 13. McCabe BF, Gantz BJ. Vascular loop as a cause of incapacitating dizziness. Am J Otol. 1989;10:117–20. 14. Nielsen VK. Pathophysiology of hemifacial spasm: I. Ephaptic transmission and ectopic excitation. Neurology. 1984;34:418–26. 15. Applebaum EL, Valvasorri G. Internal auditory canal vascular loops: audiometric and vestibular system findings. Am J Otol. 1985; Suppl:110–3. 16. Yoshino N, Akimoto H, Yamada I, et al. Trigeminal neuralgia: evaluation of neuralgic manifestation and site of neurovascular compression with 3D CISS MR imaging and MR angiography. Radiology. 2003;228:539–45. 17. Satoh T, Onoda K, Date I. Fusion imaging oh three-dimensional MR cisternograms and angiograms for the assessment of microvascular decompression in patients with hemifacial spasms. J Neurosurg. 2007;106:82–9. 18. De Ridder D, Ryu H, Mrller AR, et al. Functional anatomy of the human cochlear nerve and its role in microvascular decompressions for tinnitus. Neurosurgery. 2004;54:381–8; discussion 88–90. 19. Reisser C, Schuknecht HF. The anterior inferior cerebellar artery in the internal auditory canal. Laryngoscope. 1991;101(7 Pt 1):761–6. 20. Fukuda H, Ishikawa M, Okumura R. Demonstration of neurovascular compression in trigeminal neuralgia and hemifacial spasm with magnetic resonance imaging: comparison with surgical findings in 60 consecutive cases. Surg Neurol. 2003;59:93–9; discussion 99–100. 21. Nowé V, De Ridder D, Van de Heyning PH, et al. Does the location of a vascular loop in the cerebellopontine angle explain pulsatile and non-pulsatile tinnitus? Eur Radiol. 2004;14:2282–9. 22. Ryu H, Yamamoto S, Sugiyama K, et al. Neurovascular compression syndrome of the eighth cranial nerve. What are the most reliable diagnostic signs? Acta Neurochir (Wien). 1998;140:1279–86. 23. Ryu H, Yamamoto S, Sugiyama K, et al. Neurovascular compression syndrome of the eighth cranial nerve. Can the site of compression explain the symptoms? Acta Neurochir (Wien). 1999;141:495–501. 24. De Ridder D, De Ridder L, Nowé V, et al. Pulsatile tinnitus and the intrameatal vascular loop: why do we not hear our carotids? Neurosurgery. 2005;57:1213–7. 25. Naraghi R, Tanrikulu L, Troescher-Weber R, et al. Classification of neurovascular compression in typical hemifacial spasm: threedimensional visualization of the facial and vestibulocochlear nerves. J Neurosurg. 2007;107:1154–63. 1. Doutores, Médicos Radiologistas do Grupo Fleury/Hospital São Luiz/Rede D’Or, São Paulo, SP, Brasil 2. Médicas Radiologistas do Grupo Fleury/Hospital São Luiz/Rede D’Or, São Paulo, SP, Brasil 3. Médico Radiologista da Axial Medicina Diagnóstica, Belo Horizonte, MG, Brasil 4. Biomédica, Pós-doutoranda do Departamento de Psiquiatria da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil Endereço para correspondência: Dr. Luiz de Abreu Junior Grupo Fleury Rua Doutor Alceu de Campos Rodrigues, 95, Vila Nova Conceição São Paulo, SP, Brasil, 04544-000 E-mail: abreu_jr@terra.com.br Recebido para publicação em 25/4/2015. Aceito, após revisão, em 2/9/2015. Trabalho realizado no Grupo Fleury/Hospital São Luiz/Rede D’Or, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554