Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 49 nº 5 - Set. / Out. of 2016
Vol. 49 nº 5 - Set. / Out. of 2016
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Andréa de Lima Bastos1; Ricardo de Amorim Corrêa2; Gilda Aparecida Ferreira3 |
|
|
Descritores: Esclerodermia; Esclerose sistêmica; Radiologia; Tomografia computadorizada; Doenças pulmonares. |
|
|
Resumo: INTRODUÇÃO
A esclerose sistêmica (ES) é uma doença autoimune do tecido conjuntivo, de causa desconhecida, caracterizada por alterações inflamatórias, fibróticas, vasculopatia obstrutiva de pequenos vasos e deposição de colágeno em vários órgãos, sobretudo nos pulmões(1,2). A doença é mais frequente em mulheres do que em homens, em média 3–8:1, com pico de incidência entre 45 e 64 anos(3,4). O comprometimento pulmonar tem destacada importância na evolução da doença, com incidência variando entre 70% e 90%, sendo este comprometimento, atualmente, o principal responsável pela morbidade e mortalidade desses doentes(4). No pulmão observa-se inflamação e fibrose intersticial com depósito excessivo de matriz extracelular e obliteração vascular podendo ocasionar, ainda, hipertensão pulmonar(5). As alterações anatômicas decorrentes têm expressões radiológicas variáveis, e a detecção precoce e interpretação apropriada constituem etapa crítica na tomada de decisão do momento adequado para se iniciar o tratamento. O curso clínico da doença pulmonar pode variar desde apresentações mais indolentes até apresentações de curso rapidamente progressivo, com rápido declínio da função respiratória. Em alguns casos, a fibrose pulmonar pode preceder por anos o aparecimento da doença sistêmica. Sintomas respiratórios, presentes em mais de 50% dos pacientes portadores de ES, não constituem indicadores seguros de comprometimento do parênquima pulmonar, pois podem decorrer também do comprometimento vascular pulmonar ou da debilidade muscular associados à doença(2,6). As alterações pulmonares decorrentes da ES podem ser demonstradas por meio de métodos de diagnóstico por imagem. Dentre estes métodos, destaca-se a tomografia computadorizada de alta resolução (TCAR) do tórax, que permite detalhamento anatômico do parênquima pulmonar com sensibilidade muito superior à radiografia, constituindo um importante auxiliar no diagnóstico e na avaliação da extensão da doença(7). O objetivo deste estudo foi realizar uma revisão da literatura sobre as principais alterações pulmonares decorrentes da ES e de suas manifestações radiológicas. MÉTODO A seleção de artigos, para este estudo, foi realizada utilizando mecanismos de busca em publicações de língua inglesa dos trabalhos realizados em humanos, aplicando-se as seguintes palavras-chaves em inglês, nas bases de dados Medline/PubMed, Lilacs e SciELO: esclerodermia, esclerose sistêmica, radiologia, tomografia computadorizada, doenças pulmonares. Considerando-se a abordagem pelos autores de estudos de alta resolução do tórax e, principalmente, as mudanças no consenso das doenças pulmonares intersticiais, foram selecionadas publicações entre os anos 2000 e 2015, e assim foram obtidos 21 artigos que incluíram informações descritivas relacionadas ao aspecto radiológico das alterações pulmonares secundárias à ES. Para identificar referências relevantes adicionais, a bibliografia das publicações selecionadas foi analisada manualmente. DISCUSSÃO Alterações intersticiais As formas de comprometimento pulmonar pela ES são variadas, sendo mais frequente a doença intersticial. Este comprometimento caracteriza-se pela distribuição pulmonar difusa e pode corresponder a variados subtipos histopatológicos. A TCAR desempenha papel importante na identificação topográfica das lesões, na avaliação de sua extensão e no acompanhamento da evolução do processo. Descrições iniciais das características patológicas provêm de estudos post mortem que sugeriam um padrão de fibrose com pouca reação inflamatória, mas atualmente a presença de inflamação e áreas de fibrose nas paredes alveolares tem sido debatida(8). A presença de fibrose foi observada em mais de 75% dos casos em estudo de necrópsia(9). A doença fibrosante é o componente histológico mais frequentemente observado, com evolução clínica variável. Pelo menos 50–77,5% dos casos de fibrose pulmonar na ES são decorrentes de pneumonia intersticial não específica, o que pode explicar seu melhor prognóstico em relação à fibrose pulmonar idiopática(10,11). A pneumonia intersticial não específica é uma forma específica de pneumonia intersticial idiopática, caracterizada por graus variados de inflamação e fibrose, desde formas com predomínio de processo inflamatório até as mais frequentes, em que se observa predomínio de fibrose, entretanto, sem apresentar focos de fibroblastos e faveolamento evidentes, como na pneumonia intersticial usual(8,12). As anormalidades encontradas na pneumonia intersticial não específica mais frequentemente observadas na TCAR são a presença de "vidro fosco", opacidades reticulares irregulares, bronquiectasias e bronquioloectasias de tração (Figura 1). Essas lesões, em geral, poupam as regiões subpleurais dos pulmões (Figura 2) e esta característica pode ser útil para diferenciá-la da pneumonia intersticial usual(12). 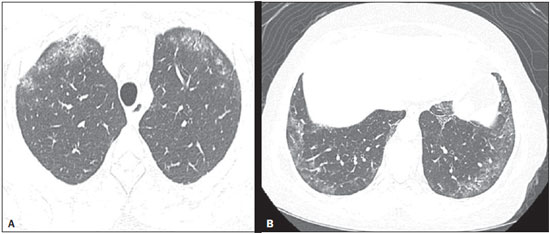 Figura 1. Mulher, 55 anos, portadora de ES há oito anos, sem sintomas respiratórios. Observam-se, nos lobos superiores (A) e segmentos basais dos lobos inferiores (B), áreas com atenuação em "vidro fosco" distribuídas nas regiões pulmonares corticais, bilateralmente. 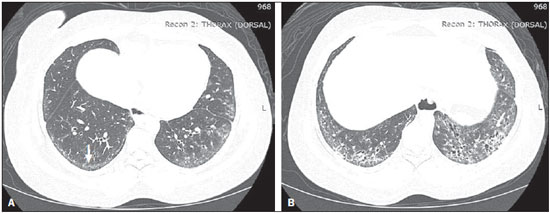 Figura 2. Mulher, 37 anos, portadora de ES há 10 anos, apresentando dispneia acentuada e dilatação esofágica. TCAR mostrando, em A, presença de "vidro fosco" poupando regiões subpleurais (seta), e em B, bronquiectasias de tração, espessamento de septos interlobulares e linhas subpleurais associadas ao "vidro fosco", de distribuição cortical. A pneumonia intersticial usual é uma apresentação menos frequente na ES. O padrão típico observado na TCAR caracteriza-se por alterações reticulares com predomínio basal, periférico e subpleural, com presença de faveolamento, bronquiectasias e bronquioloectasias de tração, distorção arquitetural e perda de volume da região comprometida(13). Este padrão apresenta pior prognóstico em relação à pneumonia intersticial não específica (Figura 3). 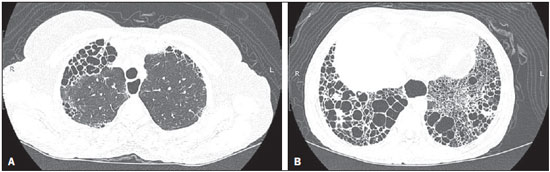 Figura 3. Mulher, 58 anos, portadora de ES há 26 anos, apresentando tosse, dispneia acentuada e broncoespasmo. TCAR mostrando dilatação esofágica importante e extenso faveolamento bilateral, predominante nos lobos inferiores (B) e destacados também nos lobos superiores (A), com padrão característico de pneumonia intersticial usual. Alterações alveolares Outras formas menos comuns de comprometimento pulmonar relatadas na ES são dano alveolar difuso, hemorragia pulmonar, pneumonia organizante, pneumonia aspirativa e pneumopatia associada às drogas utilizadas no tratamento(6). A pneumonia organizante foi relatada em poucos casos como manifestação associada à ES. Todavia, como o padrão ouro para o seu diagnóstico é a biópsia a céu aberto e essa é raramente realizada nestes pacientes, a sua real incidência não é conhecida. Taylor et al. relataram três casos de pneumonia organizante diagnosticada por biópsia a céu aberto em portadores de ES(14). A TCAR pode mostrar marcante consolidação bilateral do espaço aéreo subpleural (Figura 4) ou peribrônquica com característica migratória e algumas áreas de "vidro fosco". O sinal do halo invertido pode ser útil em sugerir o diagnóstico. Histologicamente, observa-se pneumonia organizante envolvendo alvéolos e ductos alveolares com ou sem pólipos bronquiolares intraluminais(12). Clinicamente, a doença se manifesta com tosse, febre e dispneia e, laboratorialmente, pelo predomínio de linfócitos no lavado broncoalveolar(12,14). De maneira semelhante, outros autores relataram essa apresentação(15–17). 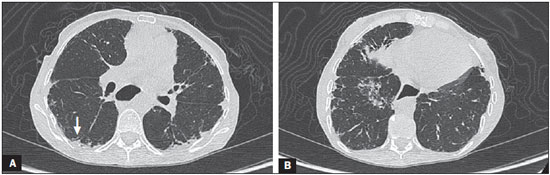 Figura 4. Mulher, 49 anos, com diagnóstico de ES há 10 anos, sem sintomas respiratórios. TCAR com janela de pulmão mostrando pequenas consolidações focais subpleurais com bronquiectasias de permeio (seta em A) nos terços médio (A) e inferior (B) dos segmentos pulmonares e dilatação importante do esôfago torácico. O padrão radiológico pulmonar é sugestivo de pneumonia organizante, ainda sem estudo histopatológico. No caso de apresentações clínicas e radiológicas atípicas, a realização de biópsia a céu aberto deve ser considerada, uma vez que a pneumonia organizante e as alveolites fibrosantes têm diferentes prognóstico e tratamento. Enquanto a pneumonia organizante responde aos corticosteroides, nas alveolites fibrosantes o uso de agentes imunossupressores é frequentemente necessário(14). A TCAR é o método de imagem de escolha na investigação da doença pulmonar intersticial na ES, em razão de demonstrar as alterações pulmonares em até 94% dos casos, que são vistas em apenas 25–53% dos casos com radiografia simples do tórax(18). A pneumonia aspirativa em portadores de ES ocorre em consequência do comprometimento esofágico secundário à doença. A doença esofagiana pode estar presente em 50–90% dos casos, levando a sintomas decorrentes da dismotilidade e refluxo(19). Na TCAR, o diâmetro coronal da luz do esôfago encontra-se aumentado nestes pacientes, variando entre 1,2 cm e 4,0 cm, em média, 2,3 cm(20). Alterações vasculares O envolvimento vascular pulmonar na ES pode provocar hipertensão arterial pulmonar, que decorre do aumento na resistência vascular pulmonar devido ao remodelamento e oclusão das arteríolas pulmonares. A hipertensão arterial pulmonar, definida por uma pressão arterial pulmonar média igual ou superior a 25 mmHg e pressão de oclusão da artéria pulmonar igual ou inferior a 15 mmHg, é uma causa importante de morbidade e mortalidade relacionadas à doença, com sobrevida média que varia de 1,5 a 3 anos após o diagnóstico (Figura 5)(21). 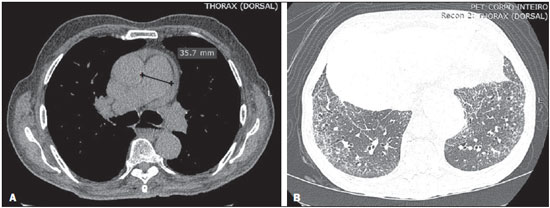 Figura 5. Homem, 81 anos, com diagnóstico de ES há 10 anos. Observa-se, na TCAR com janela de mediastino (A), aumento do calibre do tronco arterial pulmonar (35,7 mm) e dilatação esofágica com nível líquido no seu interior. Na janela de parênquima pulmonar notam-se áreas de atenuação em "vidro fosco" com espessamento de septos interlobulares e bronquiectasias de tração de permeio, predominantemente corticais, sugerindo pneumonia intersticial não específica. A hipertensão arterial pulmonar pode ocorrer isoladamente ou associada à doença pulmonar intersticial, o que piora o seu prognóstico. O diagnóstico baseado apenas em sintomas clínicos é limitado, pela presença de outras alterações pulmonares que podem se manifestar de maneira semelhante(2,22). Na TCAR, é frequente o achado de aumento do calibre do tronco arterial pulmonar (> 28,6 mm ± 2) e das artérias pulmonares principais, embora sua ausência não exclua o diagnóstico. O achado de derrame pericárdico, sobretudo no recesso anterior, com espessura superior a 10 mm, é indício de mau prognóstico e ainda é um forte preditor de hipertensão arterial pulmonar na ecocardiografia(23–26). Outra manifestação vascular pulmonar observada na ES é a doença pulmonar veno-oclusiva, que é caracterizada por proliferação intimal e fibrose de veias e vênulas intrapulmonares associadas a certo envolvimento arteriolar. O diagnóstico definitivo é obtido por biópsia e, alternativamente, pode ser sugerido pela clínica, em função do risco aumentado de complicações pós-operatórias(22). Estudos histológicos atuais têm mostrado maior envolvimento venoso na doença pulmonar da ES do que previamente descrito, o que explica, pelo menos em parte, a refratariedade desses doentes ao tratamento da hipertensão arterial pulmonar em relação àqueles que têm a forma idiopática(27). A TCAR, nestes casos, revela a presença de opacidades centrolobulares em "vidro fosco", espessamento septal e alargamento linfonodal(22). Outras alterações Algumas alterações observadas na tomografia de portadores de ES podem ser concomitantes aos achados da doença parenquimatosa e merecem destaque pela sua frequência ou gravidade. A linfonodomegalia é frequentemente observada em pacientes com ES, com uma prevalência variando entre 41% e 74%, e parece estar associada à presença de doença pulmonar intersticial crônica, secundária a uma resposta inflamatória a pneumonia aspirativa e refluxo ou a outras doenças concomitantes como linfoma e sarcoidose(24,28). Alguns estudos têm mostrado uma maior incidência de doenças neoplásicas, sobretudo pulmonares, associadas à ES. A incidência de neoplasias, de uma forma geral, em pacientes com ES pode chegar a 10,7%, e o risco de desenvolvimento de câncer de pulmão é até sete vezes maior em pacientes portadores de ES que têm o hábito de fumar(29). CONCLUSÃO As complicações pulmonares decorrentes da ES podem ter curso clínico bastante desfavorável e o principal dilema clínico refere-se a indicação de agentes imunossupressores e identificação do momento apropriado do seu início. Estes agentes têm papel importante no controle da evolução da fibrose, devendo-se considerar os potenciais efeitos adversos relacionados a esta medicação, sendo imprescindível o reconhecimento dos vários padrões radiológicos da doença pulmonar. As alterações mais frequentemente observadas na ES são decorrentes do comprometimento intersticial, mas manifestações relacionadas ao acometimento alveolar e vascular devem ser sempre lembradas diante de quadro clínico atípico e resposta inadequada ao tratamento instituído pela necessidade de abordagem terapêutica especifica imediata. Outras manifestações torácicas secundárias à ES são também observadas no estudo tomográfico do tórax, podendo estar associadas a doença pulmonar. Estas alterações tomográficas devem também ser reconhecidas e correlacionadas com os achados clínicos, para melhor orientar o manejo dos doentes. REFERÊNCIAS 1. Varga J. Systemic sclerosis: an update. Bull NYU Hosp Jt Dis. 2008;66:198–202. 2. Wells AU, Steen V, Valentini G. Pulmonary complications: one of the most challenging complications of systemic sclerosis. Rheumatology (Oxford). 2009;48 Suppl 3:iii40–4. 3. Chifflot H, Fautrel B, Sordet C, et al. Incidence and prevalence of systemic sclerosis: a systematic literature review. Semin Arthritis Rheum. 2008;37:223–35. 4. Gohari Moghadam K, Gharibdoost F, Parastandechehr G, et al. Assessments of pulmonary involvement in patients with systemic sclerosis. Arch Iran Med. 2011;14:22–6. 5. Kim EA, Lee KS, Johkoh T, et al. Interstitial lung diseases associated with collagen vascular diseases: radiologic and histopathologic findings. Radiographics. 2002;22 Spec No:S151–65. 6. Goh NS, du Bois RM. Interstitial disease in systemic sclerosis. In: Wells AU, Denton CP, editors. Handbook of systemic autoimmune diseases. 1st ed. Amsterdam, The Netherlands: Elsevier; 2004. p. 181–207. 7. Wells AU. High-resolution computed tomography and scleroderma lung disease. Rheumatology (Oxford). 2008;47 Suppl 5:v59–61. 8. King TE Jr. Nonspecific interstitial pneumonia and systemic sclerosis. Am J Respir Crit Care Med. 2002;165:1578–9. 9. D'Angelo WA, Fries JF, Masi AT, et al. Pathologic observations in systemic sclerosis (scleroderma): a study of fifty-eight autopsy cases and fifty-eight matched controls. Am J Med. 1969;46:428–40. 10. Fujita J, Yoshinouchi T, Ohtsuki Y, et al. Non-specific interstitial pneumonia as pulmonary involvement of systemic sclerosis. Ann Rheum Dis. 2001;60:281–3. 11. Bouros D, Wells AU, Nicholson AG, et al. Histopathologic subsets of fibrosing alveolitis in patients with systemic sclerosis and their relationship to outcome. Am J Respir Crit Care Med. 2002;165:1581–6. 12. Travis WD, Costabel U, Hansell DM, et al. An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med. 2013;188:733–48. 13. American Thoracic Society/European Respiratory. American Thoracic Society/European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias. This joint statement of the American Thoracic Society (ATS), and the European Respiratory Society (ERS) was adopted by the ATS board of directors, June 2001 and by the ERS Executive Committee, June 2001. Am J Respir Crit Care Med. 2002;165:277–304. 14. Taylor JG, Bolster MB. Bronchiolitis obliterans with organizing pneumonia associated with scleroderma and scleroderma spectrum diseases. J Clin Rheumatol. 2003;9:239–45. 15. Shimizu Y, Tsukagoshi H, Nemoto T, et al. Recurrent bronchiolitis obliterans organizing pneumonia in a patient with limited cutaneous systemic sclerosis. Rheumatol Int. 2002;22:216–8. 16. Bridges AJ, Hsu KC, Dias-Arias AA, et al. Bronchiolitis obliterans organizing pneumonia and scleroderma. J Rheumatol. 1992;19:1136–40. 17. Davison AG, Epstein O. Relapsing organising pneumonitis in a man with primary biliary cirrhosis, CREST syndrome, and chronic pancreatitis. Thorax. 1983;38:316–7. 18. Azevedo ABC, Guimarães SMM, Tavares Júnior WC, et al. Avaliação da tomografia de alta resolução versus radiografia de tórax na doença intersticial pulmonar na esclerose sistêmica. Radiol Bras. 2005;38:95–9. 19. Ebert EC. Esophageal disease in scleroderma. J Clin Gastroenterol. 2006;40:769–75. 20. Bhalla M, Silver RM, Shepard JA, et al. Chest CT in patients with scleroderma: prevalence of asymptomatic esophageal dilatation and mediastinal lymphadenopathy. AJR Am J Roentgenol. 1993;161:269–72. 21. Le Pavec J, Girgis RE, Lechtzin N, et al. Systemic sclerosis-related pulmonary hypertension associated with interstitial lung disease: impact of pulmonary arterial hypertension therapies. Arthritis Rheum. 2011;63:2456–64. 22. Hassoun PM. Lung involvement in systemic sclerosis. Presse Med. 2011;40:e25–e39. 23. Lynch DA. Lung disease related to collagen vascular disease. J Thorac Imaging. 2009;24:299–309. 24. Baque-Juston MC, Wells AU, Hansell DM. Pericardial thickening or effusion in patients with pulmonary artery hypertension: a CT study. AJR Am J Roentgenol. 1999;172:361–4. 25. Kuriyama K, Gamsu G, Stern RG, et al. CT-determined pulmonary artery diameters in predicting pulmonary hypertension. Invest Radiol. 1984;19:16–22. 26. Fischer A, Misumi S, Curran-Everett D, et al. Pericardial abnormalities predict the presence of echocardiographically defined pulmonary arterial hypertension in systemic sclerosis-related interstitial lung disease. Chest. 2007;131:988–92. 27. Dorfmüller P, Humbert M, Perros F, et al. Fibrous remodeling of the pulmonary venous system in pulmonary arterial hypertension associated with connective tissue diseases. Hum Pathol. 2007;38:893–902. 28. Wechsler RJ, Steiner RM, Spirn PW, et al. The relationship of thoracic lymphadenopathy to pulmonary interstitial disease in diffuse and limited systemic sclerosis: CT findings. AJR Am J Roentgenol. 1996;167:101–4. 29. Pontifex EK, Hill CL, Roberts-Thomson P. Risk factors for lung cancer in patients with scleroderma: a nested case-control study. Ann Rheum Dis. 2007;66:551–3. 1. Professora Adjunta do Departamento de Anatomia e Imagem da Faculdade de Medicina da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil 2. Professor Associado do Departamento de Clínica Médica da Faculdade de Medicina da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil 3. Professora Adjunta do Departamento do Aparelho Locomotor da Faculdade de Medicina da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil Endereço para correspondência: Dra. Andréa de Lima Bastos Avenida Professor Alfredo Balena, 190, 1º andar, sala 179, Centro Belo Horizonte, MG, Brasil, 30130-100 E-mail: andrealb@ufmg.br Recebido para publicação em 14/6/2015. Aceito, após revisão, em 4/11/2015. Trabalho realizado na Faculdade de Medicina da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554