Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 49 nº 3 - Maio / Jun. of 2016
Vol. 49 nº 3 - Maio / Jun. of 2016
|
ENSAIOS ICONOGRÁFICOS
|
|
|
|
|
Autho(rs): Carlos Fernando de Mello Júnior1; Severino Aires Araujo Neto2; Arlindo Monteiro de Carvalho Junior3; Rafael Batista Rebouças4; Gustavo Ramalho Pessoa Negromonte5; Carollyne Dantas de Oliveira5 |
|
|
Descritores: Variação anatômica; Artéria renal; Tomografia computadorizada com multidetectores. |
|
|
Resumo: INTRODUÇÃO
Variações nos padrões de irrigação e ramificação dos vasos abdominais são frequentes no leito vascular do sistema urogenital, e o conhecimento dessas variações é quase tão necessário quanto o conhecimento do padrão dito normal. Até a metade do século passado, a discussão sobre a anatomia vascular abdominal era tópico restrito ao domínio dos cirurgiões e anatomistas. Com o advento e o rápido desenvolvimento dos exames por imagem, os radiologistas passaram a ser parte indispensável no processo de diagnóstico e planejamento terapêutico de muitas condições vasculares(1). Compete ao radiologista o reconhecimento e a descrição nos seus relatórios dos padrões anatômicos da vascularização arterial e venosa, especialmente quando o exame em questão é realizado como parte do planejamento de cirurgias renais complexas. A angiografia digital continua sendo o padrão ouro com o qual são comparadas outras modalidades de exames para a análise da morfologia anatômica arterial dos rins(2,3). Porém, estudos de angiografia por tomografia computadorizada (angio-TC), além de apresentarem menores riscos, possuem acurácia comparável à angiografia digital, com a vantagem de não só avaliarem o lúmen dos vasos, mas também suas paredes e demais alterações viscerais, e por isso passaram a ser utilizados com maior frequência nos diversos cenários: transplantes renais, doença de Takayasu e estenose da junção ureteropélvica (JUP) por compressão da artéria polar inferior. Além disso, a angio-TC apresenta outras vantagens, como uma melhor avaliação do sistema coletor (hidronefrose) e dos rins (lesões tumorais, atrofias parenquimatosas, alterações congênitas - rim em ferradura, duplicação piélica)(4). O processamento e manipulação de imagens digitais em estações de diagnóstico dotadas de programas e monitores dedicados a este fim são parte indissociável do estudo por angio-TC. Neles são realizadas múltiplas reconstruções bidimensionais (2D) e tridimensionais (3D) a partir de dados brutos extraídos das imagens originais no plano axial. As técnicas de reconstrução multiplanar (MPR), projeção de intensidade máxima (MIP) e volume rendering (VRT) são amplamente aplicadas e merecem uma breve explanação. Por meio da MPR obtêm-se imagens seccionais 2D em todos os planos, axial, coronal e sagital , que podem ser perpendiculares ao plano axial, mas variações em planos oblíquos ou até mesmo curvos são especialmente úteis nos estudos de estruturas tortuosas como os vasos. A MIP é uma técnica que seleciona os voxels de maior densidade em um bloco contíguo (pacote ou slab) de imagens seccionais (axiais, coronais ou sagitais), somando-os e projetando-os em uma só visualização, geralmente 3D. Após a injeção intravenosa do contraste, quando a densidade luminal vascular aumenta significativamente, veias e artérias podem assim ser destacadas na MIP das demais estruturas intra-abdominais menos densas. O pacote com cortes consecutivos permite demonstrar de uma só vez longos segmentos vasculares tortuosos, que habitualmente entram e saem de um plano seccional convencional isolado. Esse efeito acaba por conferir à imagem MIP a sensação visual de tridimensionalidade. Uma limitação da técnica se deve justamente ao excesso de estruturas que vão se somando à imagem à medida que o pacote vai englobando mais cortes, confundindo visualmente o examinador. VRT é uma técnica que atribui valores de opacificação de 0% (transparência) a 100% (opaco) entre uma linha artificial de projeção de vários cortes em qualquer plano. Ao combinar estes valores a efeitos luminosos, a imagem 3D gerada em VRT reproduz a perspectiva de profundidade 3D de forma mais fidedigna do que na MIP(1). Assim, muito embora tanto a MIP quanto o VRT tenham resoluções e contraste muito semelhantes, alguns autores, como Urban et al.(5), conferem certa vantagem para o VRT, especialmente quando vasos tortuosos estão sendo examinados e é necessário saber quais se projetam mais próximos ou mais distantes do observador (mais superficiais ou mais profundos na região examinada, por exemplo). O presente texto consiste de um ensaio com imagens cujo objetivo é familiarizar o radiologista sobre as diversas variações encontradas do sistema vascular renal, enfatizando a prevalência, os termos mais adequados e as implicações clinicocirúrgicas envolvidas. Para isso, foram selecionados do arquivo de ensino dos autores casos de exames realizados em tomografia computadorizada com múltiplos detectores (TCMD) que ilustram os padrões anatômicos mais frequentes. Os exames foram realizados em aparelho Brilliance de 64 canais (Philips; Eindhoven, Holanda). Todos os pacientes eram adultos e realizaram o exame com o uso de contraste iodado intravenoso Ultravist® (Bayer Pharma AG; Leverkusen, Alemanha), na concentração de 769 mg/mL. A injeção foi feita por meio de bomba injetora Envision CT (Medrad; Indianola, PA, EUA), em fluxo de 5 mL/s, com dose aproximada de 1,5 mL/kg até um limite de até 150 mL. Apenas a fase pós-contraste arterial foi usada para os exemplos casos. Os cortes axiais foram realizados com 1 mm de espessura, pitch de 0,8, reconstrução com 2 mm de espessura e FOV padrão de 250 mm. Na fase arterial, a aquisição de imagens iniciou-se após 6 segundos de delay, após o limiar de 100 unidades Hounsfield ser alcançado na região de interesse dentro da aorta abdominal. Os parâmetros de aquisição utilizados para a fase arterial no protocolo de abdome foram semelhantes aos usados para os exames de angio-TC e apresentaram resolução espacial e temporal suficientes para caracterizar os vasos arteriais aqui estudados. As imagens foram processadas em uma estação de trabalho Philips Extended Brilliance dotada de programa viewer. Por fim, foram confeccionadas imagens nos planos axial, coronal e sagital, com as técnicas MPR (2D) e MIP e VRT (3D). ANATOMIA NORMAL DAS ARTÉRIAS RENAIS E SUAS VARIAÇÕES A vascularização do rim primitivo (pronefro, mesonefro e metanefro) tem origem em um grupo de artérias que partem da superfície lateral da aorta abdominal. Durante a migração superior do rim para a região lombar, diversos ramos arteriais involuem e uma artéria principal (ou hilar) irrigará o parênquima renal. Embora exista um processo de involução sequencial destas estruturas, as artérias mais caudais, localizadas entre o 10º segmento torácico e o 3º segmento lombar, podem persistir no rim já formado, dando origem a artérias polares inferiores e superiores(1,6). Segundo o padrão dito normal, os rins são supridos por uma única artéria renal principal, também chamada de hilar, com origem na aorta abdominal, ao nível de L1 e L2, que se divide próximo ao hilo em dois, três ou quatro ramos (Figura 1), para irrigarem as diversas regiões renais. Em geral, a artéria renal principal possui comprimento de 4 a 6 cm e diâmetro de 5 a 6 mm. Contudo, essa descrição clássica ocorre em menos de 25% dos casos(7). 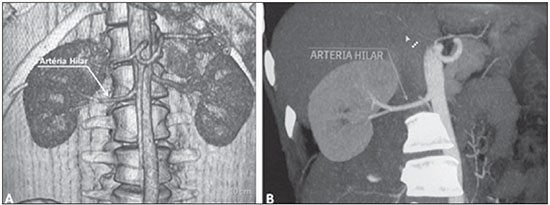 Figura 1. TCMD, reconstruções VRT em projeção frontal (A) e MIP de projeção coronal (B) demonstrando a artéria renal hilar direita (seta), que é um ramo da aorta que penetra o rim na região do hilo e somente no hilo ou seio renal oferta ramos terminais. Dada a diversidade no padrão de irrigação arterial renal, deve-se buscar a adoção de uma nomenclatura padronizada, evitando-se os termos dúbios e contemplando denominações que carreguem em si um sentido anatômico objetivo, autossuficiente na transmissão da ideia aproximada de sua morfologia. A uniformização destes termos entre profissionais de diversas especialidades e entre serviços é imprescindível para facilitar a comunicação, prevenir erros e possibilitar a aglutinação de dados estatísticos entre diferentes trabalhos. Os termos "extra", "aberrante" ou "supranumérico", descritos por alguns autores(8,9), devem ser evitados, uma vez que minimizam a importância desses vasos e não possuem significação morfológica objetiva(6,7). Embora haja diversidade e até discordâncias entre as diversas nomenclaturas propostas, a adotada por Sampaio et al.(6) é, na opinião dos autores, a que mais se aproxima dos preceitos acima colocados e, portanto, foi escolhida para classificar os achados expostos no presente trabalho. A seguir, os padrões arteriais dos rins (normal e variantes) serão relacionados e descritos, sendo referenciados, cada um, aos exemplos das figuras. Artéria hilar (Figura 1) - Ramo da aorta que penetra o rim na região do hilo e somente no hilo ou seio renal oferta ramos terminais. Palmieri et al. observaram prevalência deste padrão de 62,49% em rim direito e 72,5% em rim esquerdo da população estudada(7). Artéria extra-hilar superior (Figura 2) / inferior (Figura 3) - Ramo originado da artéria hilar, antes de ela adentrar no hilo e que penetra no parênquima renal fora do hilo (no polo superior ou inferior). Foi observada prevalência de artéria extra-hilar superior de 28,6% no rim direito e 11,6% no rim esquerdo e prevalência de artéria extra-hilar inferior de 0% no rim direito e 1,4% no rim esquerdo(7). 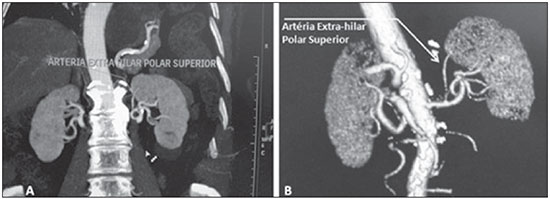 Figura 2. TCMD, reconstruções MIP de projeção coronal (A) e VRT em vista frontal (B). As setas apontam para a artéria extra-hilar polar superior esquerda, que sai da artéria hilar esquerda e se dirige para o polo superior esquerdo. 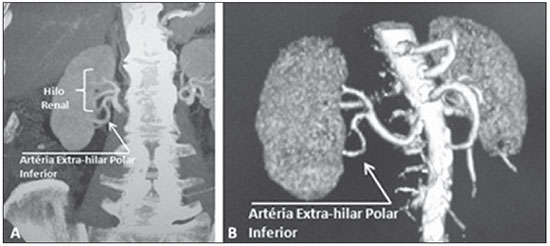 Figura 3. TCMD, reconstruções MIP de projeção coronal (A) e VRT em vista frontal (B). As setas apontam para a artéria extra-hilar polar inferior direita, que sai da artéria hilar direita e vai para o polo inferior direito. A chave mostra os limites do hilo renal. Artéria polar superior (Figura 4) - Ramo da aorta que penetra o rim pelo polo superior. Sua prevalência é de 7,14% no rim direito e 11,6% no rim esquerdo(7). 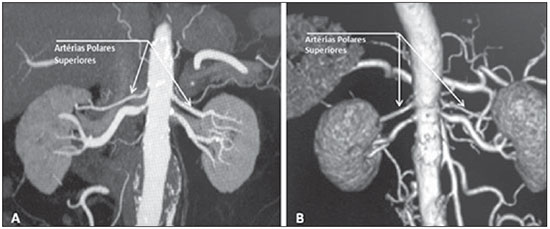 Figura 4. TCMD, reconstruções MIP de projeção coronal (A) e VRT em vista posterior (B). As setas apontam para a artéria renal polar superior direita e esquerda, ramo da aorta que vai para o polo superior renal direto e esquerdo, respectivamente. Artéria polar inferior - Ramo da aorta ou da artéria ilíaca comum que penetra o rim pelo polo inferior, com prevalência de 3,57% no rim direito e 2,9% no rim esquerdo(7). Bifurcação precoce (Figuras 5 e 6) - Artéria renal direita e/ou esquerda onde o tronco principal tem menos de 1 cm em comprimento antes de se ramificar. Este padrão foi encontrado em apenas 1 caso em 200 pedículos renais estudados(7). Quando houver duas ou mais artérias hilares, a de maior calibre será chamada de principal(6). 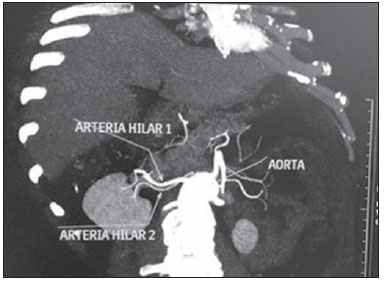 Figura 5. TCMD, reconstrução MIP coronal oblíqua. Visualiza-se a artéria hilar principal direita, nomeada de artéria hilar 1, e uma artéria hilar acessória direita, nomeada de artéria hilar 2. Neste caso, as duas artérias se originam na aorta. 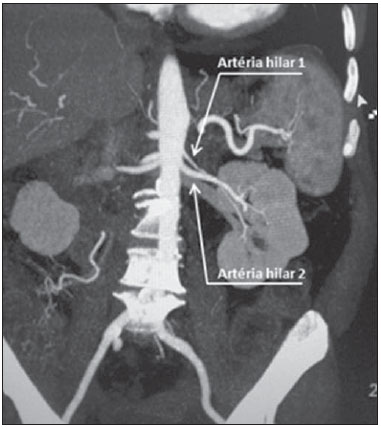 Figura 6. TCMD, reconstrução MIP de projeção coronal. Observa-se a artéria hilar principal esquerda (artéria hilar 2) entrando no hilo, e a artéria hilar acessória esquerda (artéria hilar 1) que a acompanha. Ambas originam-se da aorta. As prevalências citadas dos padrões morfológicos foram restritas ao trabalho de Palmieri et al.(7), por ser ele o que mais se uniformiza com a nomenclatura de Sampaio et al.(6). A falta de uniformidade de nomenclatura nos muitos outros trabalhos publicados sobre o tema dificulta e às vezes inviabiliza a unificação ou comparação de dados entre eles. IMPLICAÇÕES CLINICOCIRÚRGICAS DOS ACHADOS DE IMAGEM No planejamento de procedimentos cirúrgicos como nefrectomias parciais, pieloplastias por estenose da JUP, transplantes renais, os exames de imagem são indispensáveis(1,3,5) e as informações anatômicas por eles trazidos podem interferir no planejamento da técnica cirúrgica a ser aplicada. Estudos recentes demonstram que a nefrectomia parcial em tumores possui resultado oncológico equivalente à nefrectomia radical, com menor taxa de progressão para insuficiência renal crônica e eventos cardiovasculares(10-12). No planejamento de nefrectomias parciais, o prévio conhecimento da anatomia vascular é imprescindível. A redução da isquemia quente é um dos pontos técnicos para melhorar os resultados funcionais da nefrectomia parcial(13-16). A principal técnica envolvida é o clampeamento arterial seletivo, que melhora potencialmente a função renal no pós-operatório de curto prazo, quando comparado ao clampeamento da artéria principal(17). O surgimento de modelos de imagem 3D de alta definição da vascularização renal baseada em estudos de imagem permite uma melhor orientação para a realização precisa das técnicas de clampeamento arterial seletivo(17). Artérias renais polares ou extra-hilares estão associadas em 29% a 65% dos casos de estenose da JUP(18,19). O prévio conhecimento destes vasos pode mudar a abordagem cirúrgica, pois eles dificultam a realização de procedimentos endoscópicos e reduzem a taxa de sucesso do tratamento convencional(20-22). Portanto, a TCMD possui vantagens sobre outros métodos como ultrassonografia e urografia excretora na avaliação de estenose da JUP, particularmente na pesquisa de artérias renais polares. No transplante renal entre vivos, a existência de artéria renal única é favorável e propicia menores taxas de complicações. A presença de variações(6) aumenta a incidência de trombose vascular, o tempo de isquemia quente, a perda sanguínea, a dificuldade de se realizar anastomoses, e a possibilidade de ocorrerem fístulas urinárias e lesões ureterais(6,23). Por outro lado, a taxa de rejeição do enxerto no primeiro ano e a taxa de sobrevivência com o enxerto em cinco anos não parecem ser afetadas pela presença de variações anatômicas arteriais(23). Além de citar as variações numéricas e de bifurcação, é importante que o relatório do radiologista faça referência a outras duas informações: a) ao diâmetro ortogonal das artérias renais e suas variações (Figura 7), visto que em artérias com diâmetro menor que 3 mm a anastomose é difícil e há maiores riscos de trombose; b) ao comprimento da artéria de sua origem até sua primeira bifurcação (Figura 8), uma vez que cirurgiões recomendam que a artéria renal deva ter pelo menos 20 mm de comprimento para garantir boa anastomose(24). 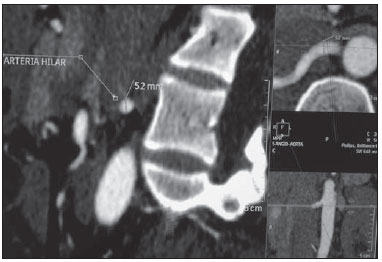 Figura 7. TCMD, reconstrução MPR no plano sagital oblíquo, para medida do calibre da artéria hilar direita. Na margem direita da figura, planos axial e coronal da mesma região, observa-se a orientação do corte, perpendicular ao trajeto do vaso. 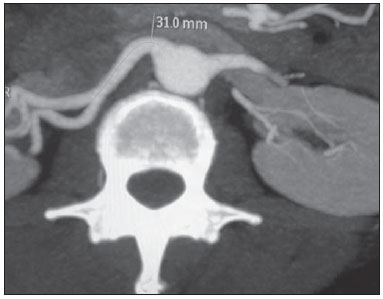 Figura 8. TCMD, reconstrução MIP de projeção axial, para medida do comprimento da artéria hilar direita de sua origem, na aorta, até sua primeira bifurcação. RECOMENDAÇÕES PRÁTICAS NA INTERPRETAÇÃO DA ANGIO-TC As imagens axiais ainda são a base para o diagnóstico. Porém, o auxílio das técnicas MPR, MIP e VRT traz informações adicionais importantes(3). Na angio-TC é recomendável que o examinador opere diretamente a estação de trabalho. Na prática, o uso dinâmico dos recursos de reconstrução confere mais segurança e agilidade na análise quando comparado ao uso isolado dos filmes. Na interpretação e elaboração do relatório do exame, é recomendável que o radiologista siga um roteiro mínimo. A detecção de calcificações arteriais pode ser feita já na fase pré-contraste. Na fase arterial deve-se acompanhar ambas as artérias renais, da emergência ao seio renal, verificando bifurcações precoces e ramos extra-hilares; as artérias polares são buscadas a seguir. Principalmente em caso de transplante renal, é importante mencionar o diâmetro ortogonal das artérias hilares e eventuais variações, e o comprimento das artérias de sua origem até a primeira bifurcação. CONCLUSÕES A vascularização renal arterial tem significativa prevalência de variações. O baixo risco e a excelente acurácia da TCMD na avaliação da anatomia arterial do rim(5) faz dela uma opção à angiografia digital em muitas situações. Tendo em vista a importância desta anatomia para o planejamento do tratamento de diversas condições urológicas clinicocirúrgicas, o médico radiologista deve estar capacitado a identificar e descrever os achados usando termos padronizados, atendendo às recomendações mais consensuais da literatura. REFERÊNCIAS 1. Pérez JA, Torres FG, Toribio AM, et al. Angio CT assessment of anatomical variants in renal vasculature: its importance in the living donor. Insights Imaging. 2013;4:199-211. 2. European Association of Urology. EAU guidelines. Edition presented at the 25th EAU Annual Congress, Barcelona; 2010. 3. American College of Radiology. ACR-SIR-SPR practice parameter for performance of arteriography. Res. 5 - 2012, Amended 2014 (Res. 39). 4. Türkvatan A, Ozdemir M, Cumhur T, et al. Multidetector CT angiography of renal vasculature: normal anatomy and variants. Eur Radiol. 2009;19:236-44. 5. Urban BA, Ratner LE, Fishman EK. Three-dimensional volume rendered CT angiography of the renal arteries and veins: normal anatomy, variants, and clinical applications. Radiographics. 2001;21:373-86. 6. Sampaio FJB, Passos MARF. Renal arteries: anatomic study for surgical and radiological practice. Surg Radiol Anat. 1992;14:113-7. 7. Palmieri BJ, Petroianu A, Silva LC, et al. Study of arterial pattern of 200 renal pedicle through angiotomography. Rev Col Bras Cir. 2011;38:116-21. 8. Chai JW, Lee W, Yin YH, et al. CT angiography for living kidney donors: accuracy, cause of misinterpretation and prevalence of variation. Korean J Radiol. 2008;9:333-9. 9. Guan WH, Han Y, Zhang X, et al. Multiple renal arteries with renal cell carcinoma: preoperative evaluation using computed tomography angiography prior to laparoscopic nephrectomy. J Int Med Res. 2013;41:1705-15. 10. Clark MA, Shikanov S, Raman JD, et al. Chronic kidney disease before and after partial nephrectomy. J Urol. 2011;185:43-8. 11. Sun M, Bianchi M, Hansen J, et al. Chronic kidney disease after nephrectomy in patients with small renal masses: a retrospective observational analysis. Eur Urol. 2012;62:696-703. 12. Huang WC, Elkin EB, Levey AS, et al. Partial nephrectomy versus radical nephrectomy in patients with small renal tumors - is there a difference in mortality and cardiovascular outcomes? J Urol. 2009;181:55-61. 13. Thompson RH, Lane BR, Lohse CM, et al. Renal function after partial nephrectomy: effect of warm ischemia relative to quantity and quality of preserved kidney. Urology. 2012;79:356-60. 14. Porpiglia F, Fiori C, Bertolo R, et al. Long-term functional evaluation of the treated kidney in a prospective series of patients who underwent laparoscopic partial nephrectomy for small renal tumors. Eur Urol. 2012;62:130-5. 15. Nguyen MM, Gill IS. Halving ischemia time during laparoscopic partial nephrectomy. J Urol. 2008;179:627-32. 16. Gill IS, Patil MB, Abreu AL, et al. Zero ischemia anatomical partial nephrectomy: a novel approach. J Urol. 2012;187:807-14. 17. Shao P, Qin C, Yin C, et al. Laparoscopic partial nephrectomy with segmental renal artery clamping: technique and clinical outcomes. Eur Urol. 2011;59:849-55. 18. Sampaio FJ, Favorito LA. Ureteropelvic junction stenosis: vascular anatomical background for endopyelotomy. J Urol. 1993;150:1787-91. 19. Rouvière O, Lyonnet D, Berger P, et al. Ureteropelvic junction obstruction: use of helical CT for preoperative assessment - comparison with intraarterial angiography. Radiology. 1999;213:668-73. 20. Faerber GJ, Richardson TD, Farah N, et al. Retrograde treatment of ureteropelvic junction obstruction using the ureteral cutting balloon catheter. J Urol. 1997;157:454-8. 21. Schwartz BF, Stoller ML. Complications of retrograde balloon cautery endopyelotomy. J Urol. 1999;162:1594-8. 22. Van Cangh PJ, Wilmart JF, Opsomer RJ, et al. Longterm results and late recurrence after endoureteropyelotomy: a critical analysis of prognostic factors. J Urol. 1994;151:934-7. 23. Kok NFM, Dols LFC, Hunink MGM, et al. Complex vascular anatomy in live kidney donation: imaging and consequences for clinical outcome. Transplantation. 2008;85:1760-5. 24. Santos Montón C, Manzano Rodriguez C, El Karzazi K, et al. CT imaging of presurgical evaluation of potential renal transplant donors: what do surgeons should know? Insights Imaging. 2014;5:S268. 1. Doutor, Professor Adjunto IV de Radiologia Médica da Universidade Federal da Paraíba (UFPB), João Pessoa, PB, Brasil 2. Doutor, Professor Adjunto II de Radiologia Médica da Universidade Federal da Paraíba (UFPB), João Pessoa, PB, Brasil 3. Doutor, Professor do Departamento de Cirurgia da Universidade Federal da Paraíba (UFPB), João Pessoa, PB, Brasil 4. Médico Urologista, Professor da Disciplina de Urologia da Faculdade de Ciências Médicas da Paraíba, João Pessoa, PB, Brasil 5. Graduandos em Medicina da Universidade Federal da Paraíba (UFPB), João Pessoa, PB, Brasil Endereço para correspondência: Dr. Severino Aires Araujo Neto Avenida Sapé, 1780, ap. 2201, Manaíra João Pessoa, PB, Brasil, 58038-382 E-mail: severinoaires @hotmail.com Recebido para publicação em 5/6/2014. Aceito, após revisão, em 12/5/2015. Trabalho realizado na Universidade Federal da Paraíba (UFPB), João Pessoa, PB, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554