Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 49 nº 1 - Jan. / Fev. of 2016
Vol. 49 nº 1 - Jan. / Fev. of 2016
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Marcos Pretto Mosmann1; Marcelle Alves Borba2; Francisco Pires Negromonte de Macedo2; Adriano de Araujo Lima Liguori2; Arthur Villarim Neto3; Kenio Costa de Lima4 |
|
|
Descritores: Nódulo pulmonar solitário; Tomografia por emissão de pósitrons; Tomografia computadorizada. |
|
|
Resumo: INTRODUÇÃO
O nódulo pulmonar solitário é uma opacidade radiológica única, esférica, bem circunscrita e que possui um diâmetro igual ou menor que 3 cm. Caracteriza-se por estar completamente cercada por parênquima pulmonar e não ter atelectasia, linfadenopatia, pneumonia ou derrame pleural associados(1). Subdividem-se, ainda, em lesões com dimensões abaixo de 8-10 mm (nódulos subcentimétricos), por apresentarem menor probabilidade de malignidade e possuírem recomendações de investigação diferentes em relação aos nódulos pulmonares solitários maiores(2). A definição clássica de nódulo pulmonar solitário indeterminado, lesão possivelmente maligna, refere-se a nódulos pulmonares que não preencham critérios radiológicos típicos de benignidade(3). O termo massa pulmonar é utilizado atualmente para lesões pulmonares com dimensões acima de 3 cm de diâmetro, cuja probabilidade de doença maligna eleva-se consideravelmente(2). PREVALÊNCIA E INCIDÊNCIA A maioria dos nódulos pulmonares solitários é detectada incidentalmente em radiografia e em tomografia computadorizada (TC) de tórax solicitadas para investigação de outras doenças. Aproximadamente 150.000 nódulos pulmonares solitários são detectados anualmente nos Estados Unidos(4). Estima-se uma elevada frequência de nódulos pulmonares solitários no Brasil, diante das elevadas taxas de incidência de câncer de pulmão, bem como de doenças infecciosas. Um estudo de base populacional realizado em 1959(5) demonstrou a presença de um nódulo pulmonar solitário para cada 500 radiografias de tórax realizadas (0,2%). O estudo Early Lung Cancer Action Project incluiu 1.000 voluntários de uma população norte-americana de alto risco para câncer de pulmão, que foram submetidos a radiografia e TC de tórax. Nódulos não calcificados foram detectados em 23% dos indivíduos pela TC de baixa dose. A radiografia de tórax mostrou resultados positivos em 7% dos casos, e cerca de metade destes correspondeu a achados falso-positivos. Doença maligna foi diagnosticada em 2,7% dos casos(6). A prevalência de câncer varia muito conforme a população ou subgrupo avaliados(7). Estudos utilizando tomografia por emissão de pósitrons (PET) com 18-fluordesoxiglicose (18F-FDG) registram prevalência de malignidade variando de 46% a 82%(7). Em estudos de rastreamento, a prevalência de malignidade é bem menor, de 2% a 13% dos nódulos(7). DIAGNÓSTICO DIFERENCIAL O primeiro passo na avaliação é determinar, de fato, se a anormalidade corresponde a um nódulo pulmonar solitário. Cerca de 20% dos "suspeitos nódulos" à radiografia de tórax podem, na verdade, estar associados a alterações que mimetizam um nódulo pulmonar solitário(4). Dentre as principais causas destacam-se: fraturas de costelas, lesões ósseas escleróticas, lesões de pele (hemangiomas, verrugas, lipomas, neurofibromas), eletrodos e mamilos(4). Existe uma série de entidades que se manifestam como um nódulo pulmonar solitário a radiografia e TC de tórax, tornando extensas as possibilidades no diagnóstico diferencial, incluindo, principalmente, lesões neoplásicas (benignas e malignas), inflamatórias (infecciosas e não infecciosas), vasculares e congênitas (Tabela 1)(4). 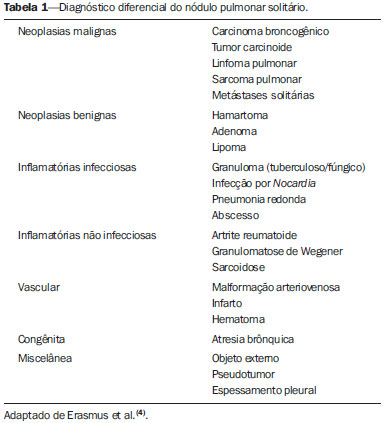 As principais causas de doenças malignas são adenocarcinomas (47%), carcinoma de células escamosas (22%), metástases solitárias (8%), carcinoma não pequenas células indiferenciado (7%), câncer pulmonar de pequenas células (4%) e adenocarcinoma in situ (anteriormente denominado de carcinoma bronquioloalveolar) (4%). Dentre as causas menos frequentes salientam-se os carcinomas de células grandes, tumores carcinoides, linfomas intrapulmonares, carcinoma adenoescamoso e teratomas malignos(7). As principais causas de doença benigna correspondem a granulomas residuais ou não específicos (25%), granulomas infecciosos (15%) e hamartomas (15%). Causas de nódulos benignos menos frequentes incluem inflamação, fibrose, abscessos pulmonares, pneumonia redonda, atelectasia, cistos broncogênicos, infartos pulmonares residuais, hemorragia focal, hemangioma e malformações arteriovenosas(7). Estes dados correspondem a estudos que avaliaram nódulos pulmonares solitários com 18F-FDG PET, a maioria deles realizada em população norte-americana(7). CARACTERÍSTICAS MORFOLÓGICAS A avaliação de características morfológicas específicas do nódulo pulmonar solitário em exames de imagem convencionais é fundamental para adequada investigação dos pacientes(8). Tamanho O tamanho do nódulo pulmonar solitário é um fator importante para auxiliar na diferenciação de processos benignos e malignos. Como regra geral, nódulos maiores apresentam maior probabilidade de câncer(8). Existe grande variabilidade da probabilidade de câncer de acordo com o tamanho do nódulo em diferentes populações estudadas. Aproximadamente 80% dos nódulos benignos possuem menos de 2 cm de diâmetro. Entretanto, 15% dos nódulos malignos têm menos de 1 cm e aproximadamente 42%, menos de 2 cm(4). Crescimento Um parâmetro fundamental, diante de um paciente com nódulo pulmonar solitário, é a determinação da velocidade de crescimento da lesão, que pode ser obtida comparando radiografia ou TC de tórax seriadas. O tempo que um nódulo duplica o seu volume corresponde a um aumento de 26% em seu diâmetro(3). Quando se observa duplicação do diâmetro do tamanho do nódulo, há um aumento de oito vezes em seu volume(9). O tempo de duplicação de nódulos malignos apresenta ampla variação, geralmente permanecendo entre 20 e 300 dias(7). Uma estabilidade em um período de dois anos confere um tempo de duplicação de, pelo menos, 730 dias, sugerindo fortemente um nódulo de origem benigna(3). Embora a estabilidade de dois anos ainda seja amplamente aceita, alguns autores questionam sua validade como fator preditivo(10), portanto, um seguimento mais prolongado pode ser considerado no subgrupo de pacientes que apresentam opacidades em vidro fosco na TC, uma vez que estas podem estar associadas a adenocarcinoma in situ (câncer bronquioloalveolar) de crescimento biológico lento(7). Há recomendação formal de obtenção de amostra histológica dos nódulos pulmonares solitários que apresentarem evidência de crescimento nos exames de imagem, exceto na presença de contraindicações(7). Margens As margens e contornos dos nódulos são classificados como lisos, lobulados ou irregulares (Figura 1). Existe forte associação entre esta variável e a probabilidade de câncer(4). 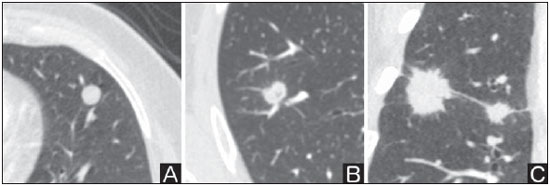 Figura 1. Margens. TC de tórax em janela pulmonar. A: Contornos regulares e margens lisas. B: Contornos lobulados. C: Contornos irregulares. Margem lisa não é indicativo de benignidade, pois até um terço das lesões malignas apresenta esta característica. Margem lobulada corresponde a um nódulo com diferentes taxas de crescimento e em cerca de 40% dos casos está associada a processo maligno. Margem irregular possui forte valor preditivo de malignidade, de aproximadamente 90%(8). Embora margens irregulares sugiram fortemente processo maligno, ocasionalmente podem ser decorrentes de outras alterações, como, por exemplo, doença granulomatosa, pneumonia organizante e fibrose maciça progressiva(8). Localização A localização do nódulo pulmonar solitário no parênquima pulmonar é bastante variável, uma vez que condições benignas e malignas podem se manifestar em qualquer dos lobos pulmonares(8). Alguns padrões podem ser observados no câncer de pulmão. Estudos demonstraram que cerca de 70% das neoplasias malignas do pulmão são localizadas nos lobos superiores e, também, principalmente no pulmão direito(11,12). Além disso, geralmente metade dos adenocarcinomas primários se manifesta como um nódulo pulmonar solitário periférico, enquanto o carcinoma de células escamosas se apresenta com maior frequência como uma lesão centralizada(13). Calcificação Calcificação é a principal característica radiológica para diferenciação de nódulos pulmonares solitários malignos e benignos(4). O padrão de calcificação benigno corresponde a distribuição central, laminado, "em pipoca" ou difuso (Figura 2). Nódulos pulmonares solitários com estas características apresentam probabilidade de benignidade próxima de 100%(8). A calcificação "em pipoca" é observada em até um terço dos hamartomas, enquanto os outros padrões são comumente encontrados em infecções granulomatosas, como histoplasmose ou tuberculose. Cabe salientar que cerca de 38% a 63% dos nódulos benignos não são calcificados(4). 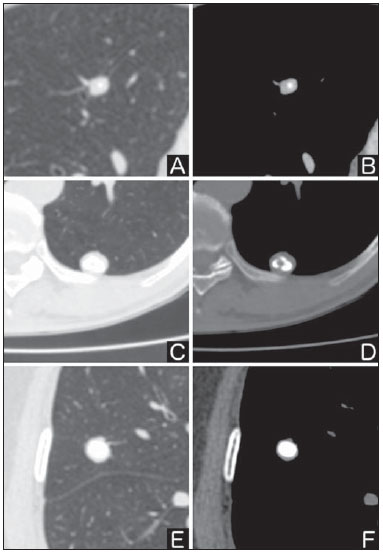 Figura 2. Padrão de calcificação benigno. TC de tórax em janela pulmonar e óssea. A,B: Calcificação central. C,D: Calcificação "em pipoca". E,F: Calcificação difusa. Alguns estudos demonstraram que até 13% das neoplasias malignas do pulmão podem apresentar algum grau de calcificação, porém, este número é reduzido para apenas 2% das lesões com menos de 3 cm de diâmetro(8). Os padrões radiológicos de calcificação excêntricos e salpicados aumentam a probabilidade de malignidade(1) (Figura 3). Essas características podem representar uma lesão maligna envolvendo um nódulo benigno calcificado ou mesmo um processo maligno com calcificação distrófica(4). Situações especiais que devem ser consideradas são pacientes portadores de tumores carcinoides ou osteossarcoma e condrossarcoma metastáticos, cujo padrão de calcificação pode ser variável(8). 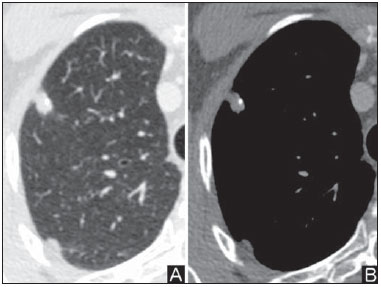 Figura 3. Padrão de calcificação maligno. TC de tórax em janela pulmonar (A) e mediastino (B). Calcificação excêntrica. Radiografia simples de tórax possui sensibilidade, especificidade e valor preditivo positivo para identificação de calcificação de, respectivamente, 50%, 87% e 93%, em comparação com a TC de tórax(1). Gordura A presença de gordura intranodular aumenta a probabilidade de benignidade, sendo o hamartoma e o lipoma (menos frequentemente) as principais causas a serem consideradas (Figura 4). Alguns processos malignos, eventualmente, podem apresentar esta característica, principalmente metástases de lipossarcoma ou carcinoma de células renais(4,8). Aproximadamente 50% dos hamartomas avaliados por TC de tórax apresentam gordura no seu interior(14). 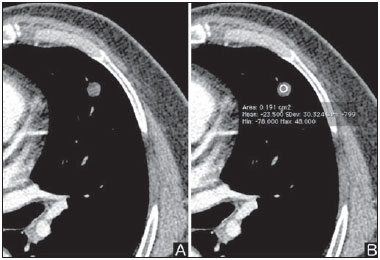 Figura 4. Gordura. Presença de gordura intranodular em hamartoma. TC de tórax em janela de mediastino (A,B). Em B nota-se região de interesse demonstrando atenuação média de - 23 UH. Atenuação Com base na TC de tórax, os nódulos pulmonares solitários podem ser classificados como sólidos, parcialmente sólidos ou não sólidos(15) (Figura 5). 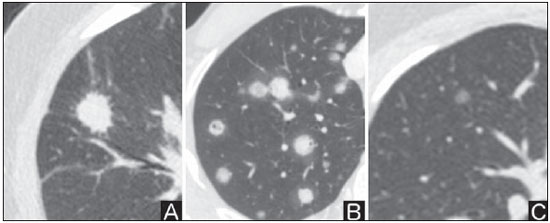 Figura 5. Atenuação. TC de tórax em janela pulmonar. A: Sólido. B: Parcialmente sólidos. C: Não sólido. Em um estudo de rastreamento populacional (screening) em indivíduos norte-americanos de alto risco para câncer de pulmão, foram avaliadas as frequências do tipo de atenuação dos nódulos e correlacionadas com o diagnóstico final de malignidade. Dos 233 achados positivos, houve a proporção de 81% de nódulos sólidos, 7% de parcialmente sólidos e 12% de não sólidos, e a frequência de malignidade correspondeu a 32%, 63% e 13% dos respectivos nódulos(16). Broncograma aéreo O achado radiológico definido como broncograma aéreo é mais frequente em neoplasias malignas do pulmão do que em nódulos benignos(14) (Figura 6). Esta característica, também referida como transparência bolhosa ou pseudocavidade, é encontrada em até 55% dos adenocarcinomas in situ (carcinomas bronquioloalveolares)(8). Porém, outras afecções podem se manifestar desta forma, como, por exemplo, linfoma, pneumonia organizante, infartos pulmonares e sarcoidose(9). 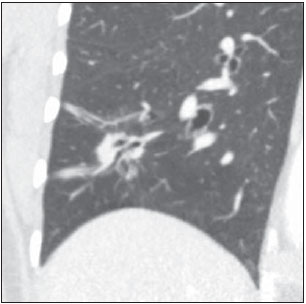 Figura 6. Broncograma aéreo. TC de tórax em janela pulmonar. Nódulo de contornos lobulados com broncogramas aéreos de permeio no lobo inferior direito. Escavação (cavidade) A escavação pode ser encontrada em nódulos pulmonares solitários benignos e malignos (Figura 7). Frequentemente este é um achado associado a lesões maiores, porém, pode ser visualizada em pequenos nódulos de até 7 mm de diâmetro(8). Um estudo(17) demonstrou que a espessura da parede da escavação pode ser útil no diagnóstico diferencial, uma vez que apenas 5% de todos os nódulos com cavidade com paredes finas (< 5 mm) eram malignos, enquanto a probabilidade de malignidade aumentava para 85% nos nódulos com maior espessamento da parede (> 15 mm). 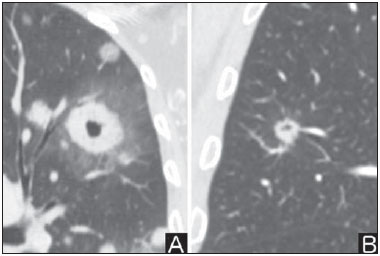 Figura 7. Escavação. TC de tórax em janela pulmonar. A: Nódulos pulmonares múltiplos, o maior deles com escavação central. B: Nódulo de contornos irregulares, com pequena escavação. PROBABILIDADE DE CÂNCER O grande desafio diagnóstico na avaliação de paciente com nódulo pulmonar solitário é estabelecer com segurança se o nódulo é maligno ou benigno. Em um paciente jovem, com nódulo pulmonar solitário de 0,4 cm, sólido, calcificado, bem definido e estável por mais de dois anos, a probabilidade de um processo benigno é extremamente alta. Já em um paciente idoso, tabagista, com nódulo pulmonar de 3 cm de diâmetro, não calcificado, espiculado e com evidência de duplicação do seu volume em seis meses, o risco de a lesão ser maligna é muito elevada. Frequentemente, os casos na prática clínica se apresentam com probabilidades para câncer de pulmão variando entre estes extremos. Atualmente, permanece a recomendação(18) de se estimar a probabilidade pré-teste de malignidade em todos os pacientes que apresentem nódulo pulmonar solitário, seja qualitativamente, a partir do julgamento clínico, ou quantitativamente, utilizando modelos validados. A análise bayesiana pode ser utilizada para estimar a probabilidade de câncer (pCa) nos nódulos pulmonares solitários indeterminados(19). O princípio consiste na utilização de razões de probabilidade (RP) em uma série de variáveis clínicas e radiológicas associadas com o nódulo pulmonar solitário. O cálculo da RP para determinada característica é o seguinte(3): 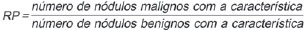 RP = 1,0 representa 50% de chance de malignidade, RPs < 1,0 indicam uma lesão benigna, e RPs > 1,0 apontam para um processo maligno. A Tabela 2 demonstra a RP para algumas características clínicas e radiológicas. 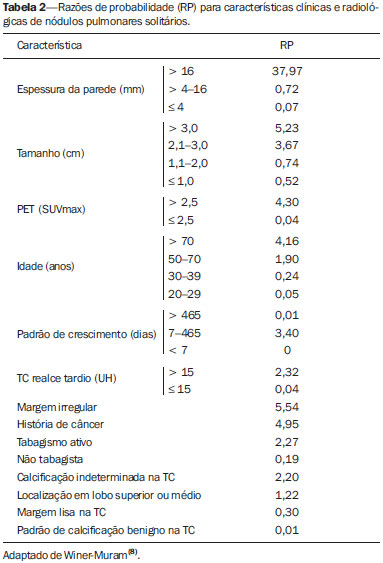 Com os valores das RPs, calcula-se a chance de malignidade (Oddsca): 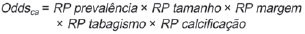 RP prevalência corresponde à prevalência local de nódulos malignos. A partir da obtenção da chance de malignidade, calcula-se a pCa: 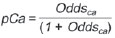 Outro modelo validado(20) foi desenvolvido a partir de um estudo com 629 pacientes com nódulos pulmonares indeterminados medindo de 0,4 a 3 cm de diâmetro detectados em radiografia de tórax. Utilizando análise de regressão logística em uma série de variáveis clínicas e radiológicas, os autores identificaram seis preditores independentes de malignidade (idade, tabagismo, história de câncer > 5 anos antes da detecção do nódulo, diâmetro, margens espiculadas e localização no lobo superior). A probabilidade de câncer é obtida de acordo com a equação incluindo as três variáveis clínicas e as três variáveis radiológicas:  sendo: x = -6,8272 + (0,0391 × idade) + (0,7917 × tabagismo) + (1,3388 × câncer) + (0,1274 × diâmetro) + (1,0407 × margem espiculada) + (0,7838 × localização), onde: e é a base do logaritmo natural, idade é a idade do paciente em anos, tabagismo = 1 se paciente tabagista ou ex-tabagista (caso contrario = 0), câncer = 1 se história de câncer > 5 anos antes da detecção do nódulo (caso contrario = 0), diâmetro corresponde ao valor em milímetros, margem espiculada = 1 (caso contrário = 0) e localização em lobo superior = 1 (caso contrário = 0). A escolha do manejo do paciente com nódulo pulmonar solitário é complexa e depende de uma série de fatores, como, por exemplo, a probabilidade clínica e radiológica de câncer, riscos dos procedimentos (biópsia/cirurgia), condições clínicas, experiência local e a preferência do indivíduo(18). Estudos clássicos(21-23) de modelos de análise de decisão sugeriram que a melhor estratégia depende diretamente da probabilidade inicial da origem do nódulo ser benigna ou maligna. Em pacientes com probabilidade baixa de malignidade (< 3%), o maior benefício foi demonstrado com a observação (watchful waiting), ou seja, realizar exames radiográficos seriados para determinar se o nódulo permanece estável ou se ocorre duplicação do seu volume dentro de dois anos. Por outro lado, nos pacientes com probabilidade alta (> 68%), a cirurgia passou a ser o método preferido, por definir a causa e, ao mesmo tempo, ser o tratamento padrão nos estágios de câncer de pulmão menos avançados. Nos casos com probabilidade intermediária, a biópsia era o método de escolha, porém, com a desvantagem de expor o paciente com um nódulo benigno a um método invasivo com seus potenciais riscos e, muitas vezes, culminando em resultados não diagnósticos, ou potencialmente falso-negativos. É importante salientar que estes antigos trabalhos não incluíram modalidades de imagem mais avançadas para caracterização dos nódulos pulmonares em suas análises. CONSIDERAÇÕES SOBRE 18F-FDG PET/CT A PET é um método de imagem da medicina nuclear que permite avaliação não invasiva de uma série de processos biológicos(24). Os equipamentos híbridos (PET/CT), idealizados em meados de 1990, tornaram-se comercialmente disponíveis no início de 2001 e o crescimento desta modalidade, desde então, compara-se com o da ressonância magnética nas décadas de 80 e 90(25). O princípio da PET assemelha-se ao da cintilografia convencional, todavia, com algumas particularidades que a tornam única. Os traçadores radioativos utilizados nesta modalidade são emissores de pósitrons, ou seja, uma partícula elementar que possui a mesma massa e magnitude de carga que um elétron, porém, com carga positiva. São formados a partir de nuclídeos que possuem excesso de prótons em relação ao número de nêutrons, afastando-se, assim, da banda de estabilidade. O próton, emitido de um núcleo instável, percorre alguns milímetros até interagir com um elétron, em um processo denominado de aniquilação. Neste fenômeno, a massa do elétron e do próton é convertida em dois raios γ que viajam em posições opostas (aproximadamente 180°) com uma energia de 511 keV. Os sistemas de PET registram um evento no momento em que dois raios γ atingem, dentro de uma janela de tempo determinada, detectores opostos, formando uma linha de projeção. As informações geradas por vários pares de detectores são reconstruídas e geram as imagens tomográficas(26,27). Muitos radionuclídeos emissores de pósitrons estão disponíveis atualmente. Enquanto alguns são produzidos por geradores nucleares (68Ga e 82Rb), outros são obtidos por cíclotrons (11C, 13N, 15O e 18F)(26). O radiofármaco mais amplamente utilizado é o 18F-FDG, um análogo da glicose ligado ao 18F, que possui um tempo de meia-vida física de aproximadamente 110 minutos(26). Este radiotraçador entra nas células por receptores de membrana (GLUT) e, no citoplasma, é convertido a 18F-FDG-6-fosfato, sendo acumulado no seu interior por não seguir a rota de metabolismo de glicose intracelular subsequente(28). A captação do 18F-FDG por uma célula é proporcional à sua atividade metabólica, por isto sua grande aplicabilidade em uma série de neoplasias(28-30). O desenvolvimento dos equipamentos híbridos PET/CT na última década propiciou reunir em um único exame a fusão de informações de alta resolução anatômica com o seu correspondente comportamento biológico. O acréscimo da informação molecular oferecida pela PET à TC é bastante vantajoso, uma vez que a alteração metabólica ocorre mais precocemente que a morfológica(31). Além disso, a incorporação da TC à PET permite a realização de exames com menor tempo de aquisição, bem como serve de parâmetro para correção de atenuação das imagens de emissão(26-28). Um exame de PET/CT de qualidade deve preencher uma série de pré-requisitos, como a obtenção das informações clínicas relevantes, adequado preparo do paciente, controle de qualidade periódico do equipamento, interpretação e elaboração do laudo(32). Um estudo recente demonstrou uma falta de padronização das atividades administradas do 18F-FDG em diferentes instituições no Brasil, justificando a necessidade de oficializar um valor de referência a ser adotado(33). A interpretação das imagens é geralmente qualitativa, com aumento focal da captação do 18F-FDG acima do pool sanguíneo sendo considerado anormal. Entretanto, é fundamental o conhecimento dos padrões de distribuição fisiológicos do radiofármaco, bem como de variantes fisiológicas e de potenciais doenças benignas para se minimizar erros de interpretação(34). Um método quantitativo frequentemente utilizado é o SUVmax (standardized uptake value), cujo cálculo corresponde a(32):  onde: Actvoi corresponde à atividade medida no volume de interesse; Actadministrada é a atividade administrada corrigida pelo decaimento físico ao início da aquisição das imagens. Muitos trabalhos têm demonstrado o desempenho diagnóstico da 18F-FDG PET e PET/CT na caracterização do nódulo pulmonar solitário em diferentes populações. CONCLUSÃO O advento de métodos de imagem como a radiografia de tórax e a TC proporcionou um grande avanço no manejo de pacientes com uma série de afecções pulmonares. Nódulos pulmonares, cujas características morfológicas muitas vezes se sobrepõem entre processos benignos e malignos, passaram a ser cada vez mais identificados e configuram um desafio diagnóstico. O conhecimento da epidemiologia, das características morfológicas e dos métodos de estimar a probabilidade de malignidade passou a ser fundamental na investigação do paciente com nódulo pulmonar solitário. Esta difícil caracterização de muitos dos nódulos pulmonares solitários determinou um campo de especial atenção para outras técnicas, como, por exemplo, 18F-FDG PET/ CT, TC dinâmica com contraste e ressonância magnética. Discute-se, ainda hoje, uma melhor forma de estratificação de risco não invasiva neste cenário, visando a uma tomada de decisão para condutas com melhor relação custo-benefício para o paciente e para o sistema de saúde. REFERÊNCIAS 1. Ost D, Fein AM, Feinsilver SH. The solitary pulmonary nodule. N Engl J Med. 2003;348:2535-42. 2. MacMahon H, Austin JHM, Gamsu G, et al. Guidelines for management of small pulmonary nodules detected on CT scans: a statement from the Fleischner Society [Editorial]. Radiology. 2005;237:395-400. 3. Erasmus JJ, McAdams HP, Connolly JE. Solitary pulmonary nodules: Part II. Evaluation of the indeterminate nodule. Radiographics. 2000;20:59-66. 4. Erasmus JJ, Connolly JE, McAdams HP, et al. Solitary pulmonary nodules: Part I. Morphologic evaluation for differentiation of benign and malignant lesions. Radiographics. 2000;20:43-58. 5. Holin SM, Dwork RE, Glaser S, et al. Solitary pulmonary nodules found in a community-wide chest roentgenographic survey: a five-year follow-up study. Am Rev Tuberc. 1959;79:427-39. 6. Henschke CI, McCauley DI, Yankelevitz DF, et al. Early Lung Cancer Action Project: overall design and findings from baseline screening. Lancet. 1999;354:99-105. 7. Gould MK, Fletcher J, Iannettoni MD, et al. Evaluation of patients with pulmonary nodules: when is it lung cancer? ACCP evidence-based clinical practice guidelines (2nd edition). Chest. 2007;132:108S-130S. 8. Winer-Muram HT. The solitary pulmonary nodule. Radiology. 2006;239:34-49. 9. Silva DR, Baglio PT, Gazzana MB. Nódulo pulmonar solitário. Rev Bras Clin Med. 2009;7:132-9. 10. Yankelevitz DF, Henschke CI. Does 2-year stability imply that pulmonary nodules are benign? AJR Am J Roentgenol. 1997;168:325-8. 11. Swensen SJ, Viggiano RW, Midthun DE, et al. Lung nodule enhancement at CT: multicenter study. Radiology. 2000;214:73-80. 12. Winer-Muran HT, Jennings SG, Tarver RD, et al. Volumetric growth rate of stage I lung cancer prior to treatment: serial CT scanning. Radiology. 2002;223:798-805. 13. Quinn D, Gianlupi A, Broste S. The changing radiographic presentation of bronchogenic carcinoma with reference to cell types. Chest. 1996;110:1474-9. 14. Zwirewich CV, Vedal S, Miller RR, et al. Solitary pulmonary nodule: high-resolution CT and radiologic-pathologic correlation. Radiology. 1991;179:469-76. 15. Silva CIS, Marchiori E, Souza Júnior AS, et al. Consenso brasileiro ilustrado sobre a terminologia dos descritores e padrões fundamentais da TC de tórax. J Bras Pneumol. 2010;36:99-123. 16. Henschke CI, Yankelevitz DF, Mirtcheva R, et al. CT screening for lung cancer: frequency and significance of part-solid and nonsolid nodules. AJR Am J Roentgenol. 2002;178:1053-7. 17. Woodring JH, Fried AM. Significance of wall thickness in solitary cavities of the lung: a follow-up study. AJR Am J Roentgenol. 1983;140:473-4. 18. Gould MK, Donington J, Lynch WR, et al. Evaluation of individuals with pulmonary nodules: when is it lung cancer? Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013;143(5 Suppl):e93S-120S. 19. Gurney JW. Determining the likelihood of malignancy in solitary pulmonary nodules with Bayesian analysis. Part I. Theory. Radiology. 1993;186:405-13. 20. Swensen SJ, Silverstein MD, Ilstrup DM, et al. The probability of malignancy in solitary pulmonary nodules. Application to small radiologically indeterminate nodules. Arch Intern Med. 1997;157:849-55. 21. Kunstaetter R, Wolkove N, Kreisman H, et al. The solitary pulmonary nodule. Decision analysis. Med Decis Making. 1985;5:61-75. 22. Lillington GA, Cummings SR. Decision analysis approaches in solitary pulmonary nodules. Semin Resp Crit Care. 1989;10:227-31. 23. Cummings SR, Lillington GA, Richard RJ. Managing solitary pulmonary nodules. The choice of strategy is a "close call". Am Rev Respir Dis. 1986;134:453-60. 24. Ell PJ. The contribution of PET/CT to improved patient management. Br J Radiol. 2006;79:32-6. 25. Townsend DW. Combined positron emission tomography-computed tomography: the historical perspective. Semin Ultrasound CT MR. 2008;29:232-5. 26. Blokland JA, Trindev P, Stokkel MP, et al. Positron emission tomography: a technical introduction for clinicians. Eur J Radiol. 2002;44:70-5. 27. Turkington TG. Introduction to PET instrumentation. J Nucl Med Technol. 2001;29:4-11. 28. Kapoor V, McCook BM, Torok FS. An introduction to PET-CT imaging. Radiographics. 2004;24:523-43. 29. Bitencourt AGV, Lima ENP, Chojniak R, et al. Correlation between PET/CT results and histological and immunohistochemical findings in breast carcinomas. Radiol Bras. 2014;47:67-73. 30. Curioni OA, Souza RP, Amar A, et al. Value of PET/CT in the approach to head and neck cancer. Radiol Bras. 2012;45:315-8. 31. Koifman ACB. And when neither CT nor MRI provide enough accuracy? The promising contribution of PET-CT to evaluate patients with malignant head and neck lesions [Editorial]. Radiol Bras. 2012;45(6):vii-viii. 32. Boellaard R, O'Doherty MJ, Weber WA, et al. FDG PET and PET/ CT: EANM procedure guidelines for tumour PET imaging: version 1.0. Eur J Nucl Med Mol Imaging. 2010;37:181-200. 33. Oliveira CM, Sá LV, Alonso TC, et al. Suggestion of a national diagnostic reference level for 18F-FDG/PET scans in adult cancer patients in Brazil. Radiol Bras. 2013;46:284-9. 34. Shreve PD, Anzai Y, Wahl RL. Pitfalls in oncologic diagnosis with FDG PET imaging: physiologic and benign variants. Radiographics. 1999;19:61-77. 1. Mestre, Médico Nuclear da Liga Norte Riograndense Contra o Câncer, Natal, RN, Brasil 2. Médicos Radiologistas da Liga Norte Riograndense Contra o Câncer, Natal, RN, Brasil 3. Doutor, Médico Nuclear da Liga Norte Riograndense Contra o Câncer, Natal, RN, Brasil 4. Pós-Doutor, Professor da Pós-Graduação em Saúde Coletiva da Universidade Federal do Rio Grande do Norte (UFRN), Natal, RN, Brasil Endereço para correspondência: Dr. Marcos Pretto Mosmann Avenida Senador Salgado Filho, 1787, Lagoa Nova Natal, RN, Brasil, 59056-000 E-mail: mosmann@gmail.com Recebido para publicação em 21/2/2014. Aceito, após revisão, em 3/9/2014. Trabalho realizado na Liga Norte Riograndense Contra o Câncer e na Universidade Federal do Rio Grande do Norte (UFRN) - Programa de Pós-Graduação em Saúde Coletiva, Natal, RN, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554