Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 48 nº 6 - Nov. / Dez. of 2015
Vol. 48 nº 6 - Nov. / Dez. of 2015
|
ARTIGOS DE REVISÃO
|
|
|
|
|
Autho(rs): Fatima Regina Silva Reis1; Patricia Prando Cardia2; Giuseppe D'Ippolito3 |
|
|
Descritores: Hemorragia gastrintestinal; Tomografia computadorizada; Angiografia; Tomografia computadorizada multidetectores. |
|
|
Resumo: INTRODUÇÃO
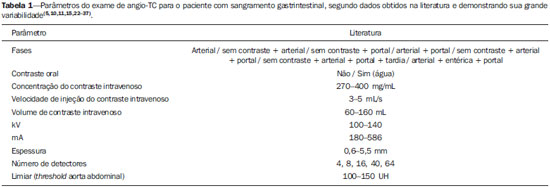
O sangramento gastrintestinal (SGI) representa uma emergência médica não infrequente, com incidência anual de 40-150 casos/100.000 pessoas apresentando SGI alto e 20-27 casos/100.000 pessoas com SGI baixo(1), sendo causa comum de internação hospitalar nos serviços de emergência. Entre as principais causas destacam-se as úlceras esofágicas e gástricas(2). O SGI é classificado em alto e baixo quando se origina acima ou abaixo do ligamento de Treitz, respectivamente. Aproximadamente 75% dos pacientes com SGI agudo apresentam hemorragia digestiva alta(3). SGI obscuro é definido como aquele sem causa determinada após endoscopia digestiva alta, colonoscopia óptica e avaliação radiológica do intestino delgado. Pode ser oculto, quando detectado apenas laboratorialmente por teste de sangramento oculto nas fezes, ou evidente, quando se manifesta clinicamente com exteriorização do sangramento ativo decorrente de hematêmese, melena, hematoquezia ou enterorragia, levando frequentemente o paciente a procurar um atendimento de urgência e podendo promover instabilidade hemodinâmica(4). Em aproximadamente 75% dos casos o sangramento cessa espontaneamente, entretanto, pode recorrer em 25% dos casos, causando mortalidade que varia de 8% a 14%, e pode chegar a 40% nos pacientes hemodinamicamente instáveis(5). Além disso, é frequente a intermitência do SGI, dificultando a identificação da sua causa. Por isso, o pronto diagnóstico é essencial para se obter um prognóstico favorável nesses pacientes(3). Nesse contexto, o papel do radiologista é o de localizar, caracterizar e, quando pertinente, tratar a lesão sangrante. ESTRATÉGIAS DE ABORDAGEM DIAGNÓSTICA Os métodos envolvidos no diagnóstico do SGI são a endoscopia digestiva alta, a colonoscopia óptica, a cápsula endoscópica, a cintilografia, a angiografia digital e a tomografia computadorizada (TC), mais recentemente configurada com múltiplos detectores (TCMD)(6). A endoscopia digestiva alta é a principal ferramenta diagnóstica no SGI alto. É um procedimento seguro e acessível, durante o qual se pode realizar biópsias e o tratamento concomitante de vasos com sangramento ativo e daqueles com risco de sangrar. Possui sensibilidade reportada de 92-98% e especificidade de 33-100%(7-9). Contudo, é um método invasivo, com risco de perfuração e de eficácia limitada nos casos de hemorragia maciça, em que o sangue em grande quantidade e a presença de coágulos podem prejudicar a detecção do local do sangramento(10,11). Em pelo menos uma série, a endoscopia digestiva alta inicial não foi diagnóstica em 24% dos casos de hemorragia digestiva alta(12). A colonoscopia óptica é muitas vezes o primeiro método diagnóstico realizado nos pacientes com SGI baixo, com sensibilidade ao redor de 50% para detecção da localização e causa do sangramento(13). É um método bastante acessível e permite realizar tratamento local e biópsias. Porém, sua implementação no cenário emergencial possui diversos obstáculos, como a necessidade de preparo intestinal e a visualização não adequada do cólon em razão da grande quantidade de sangue e coágulos, além de ser um método invasivo, não isento de complicações como o risco de perfuração intestinal(11,14). Segundo um amplo estudo realizado no contexto emergencial, a colonoscopia pode identificar a fonte definitiva do sangramento em apenas 13% dos pacientes e a fonte provável em 67%(15). A cápsula endoscópica é usada para avaliação de sangramento obscuro, sendo impraticável no cenário emergencial. Estudos mostraram que no sangramento obscuro a cápsula endoscópica pode ser diagnóstica em 50-70% dos pacientes(16). Como vantagens, pode-se citar que é um método que rastreia todo o intestino delgado, sendo mais sensível nos pacientes com sangramento visível clinicamente do que nos com sangramento oculto. Porém, não é possível realizar biópsia, e assim, como nos métodos endoscópicos, a hemorragia maciça pode obscurecer o local do sangramento ativo(3,16). A cintilografia com hemácias marcadas com tecnécio-99m é um método não invasivo que dispensa preparo intestinal e detecta sangramento arterial e venoso, com sensibilidade de até 93% e especificidade de até 95%, na presença de taxa de sangramento igual ou superior a 0,4 mL/min(10). Permite aquisição de imagens durante um longo período de tempo, sendo particularmente útil no sangramento intermitente. Sua principal limitação é definir de maneira imprecisa a localização anatômica do sangramento. Além disso, é um método diagnóstico nem sempre disponível, de longa duração para a sua execução e de difícil implementação no setor de emergência, principalmente nos períodos noturnos(3,10). A angiografia digital é um método largamente utilizado no SGI quando a endoscopia digestiva alta e a colonoscopia óptica são negativas para a identificação do sítio do sangramento ou quando é necessária uma intervenção terapêutica. Todavia, é um método invasivo, de custo elevado e que depende de profissionais especializados, o que pode limitar sua disponibilidade em determinados serviços e períodos. Além disso, possui risco de complicações inerentes ao cateterismo e pode apresentar falso-negativos diante de variações anatômicas vasculares. A taxa de sangramento necessária para detecção por esse método é de 0,5 mL/min, com sensibilidade de 63-90% para o SGI alto e 40-86% para o SGI baixo, e especificidade que pode chegar a 100%(3,10,17). Desde a sua implementação clínica, a TCMD demonstrou elevada resolução espacial e temporal(18). Pela TCMD é possível realizar estudo angiográfico com reconstruções multiplanares. Com isso, a angiotomografia computadorizada (angio-TC) tornou-se um método rápido, minimamente invasivo, bastante disponível e que permite a localização acurada do SGI alto e baixo, notadamente no íleo e jejuno, sítios de difícil acesso pela endoscopia digestiva alta e colonoscopia óptica(3,5). Revisões sistemáticas para avaliar a acurácia da angio-TC no SGI demonstraram sensibilidade de 85,2-89,0% e especificidade de 85,0-95,0%(17,19,20). Um estudo em modelo animal demonstrou que a angio-TC é capaz de detectar sangramentos de 0,3 mL/min(21). A vantagem da angio-TC sobre os procedimentos endovasculares está relacionada à sua capacidade de avaliar com precisão anormalidades extraluminais, vasos nutridores e de drenagem, anatomia regional e relação da doença com as estruturas adjacentes. Dessa forma, o adequado mapeamento arterial por meio da angio-TC, antes de um procedimento terapêutico como a angiografia digital, pode reduzir o tempo de intervenção, exposição à radiação e dose de contraste, beneficiando o paciente(3). A localização do sangramento e o diagnóstico da causa podem ter importância no manejo e tratamento desses pacientes. Por exemplo, a identificação exata do sítio de sangramento pode determinar como será a abordagem endoscópica, especialmente nos casos em que é difícil a diferenciação entre sangramento alto e baixo, baseada no quadro clínico do paciente(10) (Figura 1). 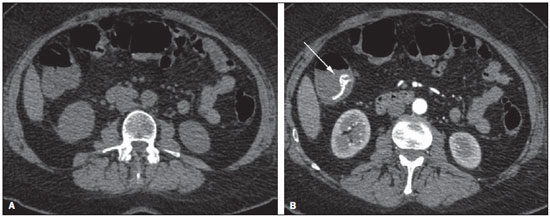 Figura 1. Paciente masculino, 60 anos. Nota-se sangramento ativo no cólon ascendente caracterizado por aumento de densidade com aspecto linear na fase arterial (seta em B), quando comparado com a imagem sem contraste (A). A angio-TC pode determinar com elevada acurácia as quatro principais causas de SGI baixo - angiodisplasia, divertículo colônico, neoplasias e colites -, direcionando o tratamento específico. Assim, a localização do sangramento no intestino delgado pode evitar o exame endoscópico desnecessário, antecipando o tratamento endovascular ou cirúrgico(10). A diferenciação entre SGI proveniente de um divertículo daquele decorrente de angiodisplasia é importante, pois na angiodisplasia não tratada o sangramento pode recorrer em até 85% dos pacientes, ao contrário da doença diverticular, em que a recorrência acomete cerca de 25% dos pacientes(22,23). Os tumores que causam hemorragia digestiva exigem preferencialmente tratamento cirúrgico. Quando realizada colectomia, sem que se conheça previamente a causa e a localização do sangramento, as taxas de mortalidade são de até 33% na colectomia total e de até 57% na colectomia parcial(24). Há diversos protocolos de exame de angio-TC na literatura para avaliação do SGI, além de muitas variáveis técnicas que podem influenciar na eficácia do exame(5,13,14,18,25-40) (Tabela 1), mas ainda não está claro como esses parâmetros podem ser combinados para a obtenção de um exame com elevada acurácia, curto tempo de execução e limitada dose de radiação, evitando-se fases de aquisição desnecessárias. Frente a isso, realizamos uma revisão crítica da literatura procurando determinar, mediante análise das variáveis técnicas adotadas, o protocolo de exame que pode apresentar os melhores resultados no diagnóstico do paciente com SGI atendido no serviço de urgência, e oferecer sugestões práticas para evitar erros comuns de execução e interpretação. VARIÁVEIS ENVOLVIDAS NO PREPARO E EXECUÇÃO DO EXAME DE ANGIO-TC Preparo do exame (jejum e contraste por via oral) O jejum não é indispensável e com frequência é impraticável, pois a necessidade diagnóstica é, em regra, emergencial e o paciente pode ter se alimentado há pouco tempo. Além disso, pela natureza intermitente da hemorragia digestiva, é importante que a angio-TC seja realizada o mais rápido possível, assim que o SGI ativo for detectado clinicamente, para maximizar a capacidade diagnóstica do método(10). O sangramento ativo é caracterizado na angio-TC pelo extravasamento do meio de contraste injetado por via intravenosa para a luz intestinal(6) (Figura 2). Por essa razão, a administração por via oral de meios de contrastes neutros (por exemplo: água) ou positivos (por exemplo: iodo diluído a 5%) deve ser evitada, pois no caso da água pode ocorrer diluição do meio de contraste injetado por via intravenosa e extravasado para o lúmen da alça intestinal, dificultando a sua detecção; por outro lado, o meio de contraste positivo ocupando o lúmen intestinal não permitirá identificar o extravasamento do meio de contraste injetado por via intravenosa, resultando em um falso-negativo (Figura 3). Também é possível agilizar a execução do exame evitando-se o preparo intestinal, antecipando, assim, o diagnóstico e uma eventual necessidade de tratamento, com indiscutíveis vantagens para o paciente(6,41). 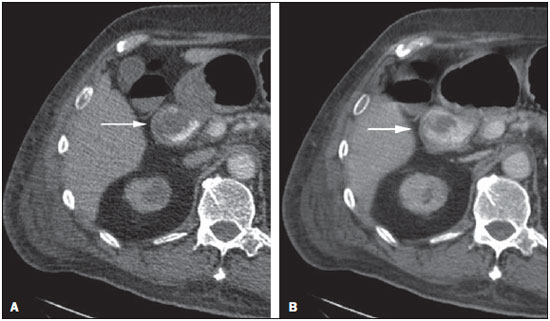 Figura 2. Paciente masculino, 63 anos, com hematêmese. Angio-TC na fase arterial (A) mostrando extravasamento ativo do meio de contraste (seta) na primeira porção do duodeno, que se acentua na fase portal (B) (seta). 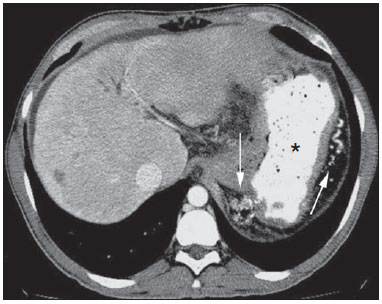 Figura 3. Paciente cirrótico, com varizes de esôfago e hematêmese. Apesar da extensa circulação colateral, bem identificada na TC (setas), não é possível apreciar um possível sangramento ativo em razão da presença do meio de contraste iodado na cavidade gástrica (asterisco). Parâmetros técnicos (kV, mAs, espessura do corte) A redução de dose de radiação tem sido preocupação constante no desenho de protocolos de TC, procurando-se limitar os níveis de utilização de kV e mAs, além de se reduzir o número de fases de aquisição do exame tomográfico em função da sua indicação clínica(42,43). Já foi demonstrado que na avaliação da aorta abdominal por angio-TC em pacientes com peso inferior a 70 kg a redução da voltagem do tubo para 90 kV mantém a eficácia diagnóstica do exame, com redução na dose de radiação(44). Em outro estudo, os autores concluíram que, ao reduzir a voltagem do tubo, o volume de contraste intravenoso também pode ser diminuído sem causar degradação da qualidade da imagem(45). No entanto, ainda não há evidências na literatura que o mesmo possa ocorrer na avaliação do SGI, e a grande maioria dos artigos que avaliaram a eficácia da angio-TC no SGI utilizou uma tensão no tubo igual ou superior a 120 kV(5,14,18,26,29,30,32,33,37-40). De maneira análoga, ainda não há estudos que tenham demonstrado o impacto direto da miliamperagem e da espessura de corte tomográfico sobre a eficácia da angio-TC no diagnóstico do SGI. Ao se analisar a literatura atual, a intensidade de corrente utilizada na pesquisa do SGI tem variado expressivamente (Tabela 1), não sendo possível estabelecer um nível mínimo de mA recomendado. A adoção de estratégias de redução da dose de radiação, entre elas o uso de novos algoritmos de reconstrução, como os iterativos (por exemplo: ASIR® ou iDose®), devem estabelecer novos padrões de miliamperagem utilizados em exames tomográficos, e entre eles, a angio-TC abdominal(46-48). Meio de contraste intravenoso (concentração, dose, velocidade de injeção) A concentração de iodo, a dose do meio de contraste e a sua velocidade de injeção são variáveis que indiscutivelmente influenciam de alguma forma na qualidade diagnóstica de muitos exames tomográficos(49,50). No entanto, não há consenso na literatura sobre o fato de a concentração de iodo do meio de contraste intravenoso influenciar ou não a qualidade do exame de angio-TC. Por outro lado, os estudos mais bem desenhados e dirigidos para essa questão apontam que os meios de contrastes iodados com alta densidade (350-400 mgI/mL) proporcionam maior realce das artérias abdominais do que os com densidade mais baixa (300-320 mgI/mL)(51-53). No exame tomográfico do abdome, a dose de iodo deve ser de 35-45 g ou cerca de 1,5-2,0 mL/kg de peso (dependendo da concentração de iodo utilizada), e para a avaliação vascular abdominal esta dose pode ser reduzida para 1,0-1,5 mL/kg(54). Considerando-se que muitos dos pacientes com SGI merecem uma avaliação visceral, além da meramente vascular, a dose do meio de contraste adotada pela maioria dos autores pesquisados encontra-se ao redor de 1,5-2,0 mL/kg (ou entre 100 e 150 mL) (Tabela 1). Sabe-se que uma alta velocidade de injeção (4-5 mL/s) é importante para a aquisição da fase arterial(55), e a maior parte dos estudos da literatura na avaliação do SGI utilizou velocidade de injeção > 4 mL/s(5,14,25,26,30-35,38,39). Fases do exame e tempos de aquisição A execução do exame de angio-TC na suspeita de SGI tem sido implementada com uma ampla variabilidade de protocolos (Tabela 1), mas com maior frequência adotando-se três fases de aquisição (sem contraste, arterial e portal)(14,25,26,28,29,31,34,35,37,39,40). É consenso que o uso da fase sem contraste é importante para evitar pitfalls, como material de sutura, clipes cirúrgicos, corpo estranho e contraste retido(3,6,10). Contudo, devese ter cautela com a dose de radiação utilizada, principalmente nos pacientes jovens, e por isso o uso de um protocolo de baixa dose para a fase sem contraste é recomendado(14). Em um estudo experimental demonstrou-se que o uso combinado da fase arterial e portal apresenta maior sensibilidade para detecção de sangramento do intestino delgado quando comparado com uma fase única(56). A fase portal pode melhorar a acurácia da fase arterial na detecção e localização do sangramento, principalmente se o sangramento é originado de tumores intestinais(11). Em outro estudo demonstrou-se que a fase arterial foi capaz de identificar o local de sangramento em todos os casos positivos e a fase portal confirmou os achados, com aumento do realce da parede e/ou do acúmulo intraluminal do meio de contraste iodado, trazendo maior confiabilidade diagnóstica; ao contrário, a adoção da fase tardia (ou de equilíbrio, realizada entre 3 e 5 minutos após o início da injeção intravenosa do meio de contraste) não contribuiu com achados adicionais e com a melhora da acurácia da angio-TC em pacientes com SGI(33). ANÁLISE DO EXAME DE ANGIO-TC E ACHADOS DE IMAGEM O critério tomográfico para o diagnóstico de sangramento digestivo ativo é o extravasamento para o lúmen do trato gastrintestinal do meio de contraste injetado por via intravenosa (Figuras 1, 2 e 4), e alguns autores utilizam uma medida de densidade objetiva no interior da luz intestinal maior que 90 unidades Hounsfield (UH)(5,29,34,35,38,40). Na nossa experiência, assim como na de outros autores(3,10), a simples comparação visual entre as imagens das fases pré- e pósinjeção intravenosa do meio de contraste para confirmação do diagnóstico é suficiente, evitando os pitfalls já mencionados. Esse extravasamento pode ter aparência linear, em jato, em redemoinho, elipsoide ou ocupar toda a espessura luminal da alça intestinal, devendo-se ter cuidado para não confundir o extravasamento intraluminal do contraste com o realce mucoso normal da alça intestinal, principalmente quando esta se encontra colabada(3,10). Achados secundários devem também ser avaliados e, quando presentes, aumentam a sensibilidade do exame. Por exemplo, o hematoma agudo na fase sem contraste indica sangramento recente(14) (Figura 5). Outros achados que podem indicar a causa do sangramento e direcionar o manejo desses pacientes são: a) hiporrealce e/ou espessamento parietal intestinal; b) presença de lesão tumoral (Figura 6); c) anomalia vascular; d) varizes de esôfago, do fundo gástrico ou retais (Figura 7); e) úlcera (Figura 8); f) pólipo ou divertículo com realce anormal(5,25,31,33-35,38). 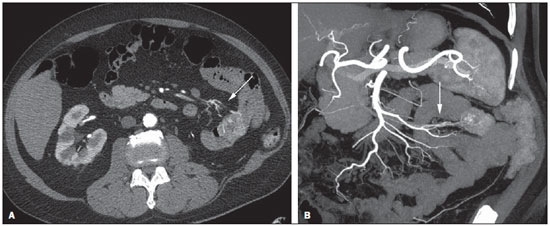 Figura 4. Angio-TC na fase arterial (A) e a correspondente reconstrução angiográfica com técnica maximum intensity projection (MIP) (B). Nota-se sangramento ativo no jejuno (seta em A). A reconstrução MIP permite identificar o ramo da artéria mesentérica superior como fonte do sangramento (seta em B). 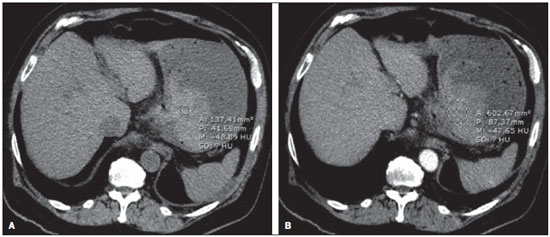 Figura 5. Angio-TC de abdome, fases sem contraste (A) e arterial (B). Nota-se grande quantidade de sangue na câmara gástrica, caracterizada por material hiperdenso na fase sem contraste (48 UH) e sem realce na fase arterial (47 UH). Não há evidência de sangramento ativo. 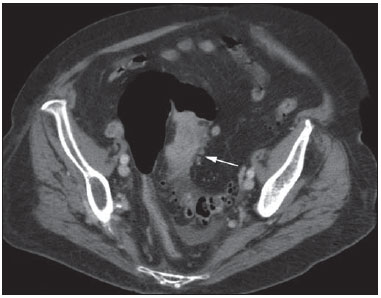 Figura 6. Paciente feminina, 78 anos, com enterorragia há dois dias. Fase portal da angio-TC mostra uma lesão estenosante no sigmoide (seta). Como achado adicional, doença diverticular do cólon. 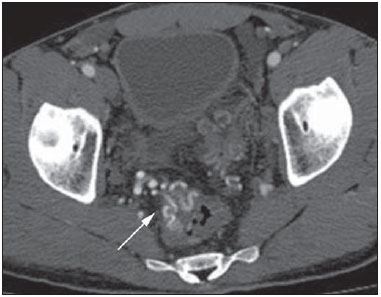 Figura 7. Angio-TC, fase arterial, em paciente cirrótico com trombose portal e sangramento retal por varizes de reto e sigmoide (seta). 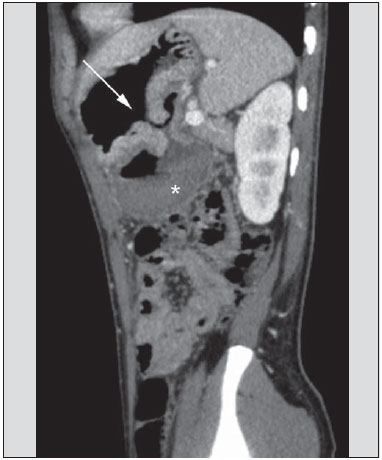 Figura 8. Paciente hemofílico, 19 anos, com dor abdominal há três dias e hematêmese. TC com contraste na fase portal demonstra volumosa úlcera na grande curvatura gástrica (seta) comunicando a luz do estômago com coleção líquida retrogástrica com densidade elevada, sugerindo origem hemática (asterisco). Não há evidência de sangramento ativo. A endoscopia digestiva alta, realizada após a TC, demonstrou na parede posterior do corpo gástrico extensa lesão ulcerada medindo cerca de 7,0 cm, com fibrina na base, e um grande orifício (4,0 cm de diâmetro) que se comunicava com uma grande cavidade, constituída por paredes revestidas de sangue e coágulos. O estudo histológico da lesão não revelou sinais de neoplasia. A análise das reformatações multiplanares pode melhorar a capacidade diagnóstica do SGI agudo, especialmente em pacientes com pequenas lesões, como a angiodisplasia e malformações arteriovenosas(33). As imagens reformatadas no plano coronal com técnica maximum intensity projection (MIP) ajudam na localização abdominal do segmento intestinal com sangramento e na avaliação da vascularização femoral proximal quando a angiografia for indicada (Figuras 4 e 9). Já as imagens reformatadas no plano sagital MIP são úteis para a avaliação do reto, da aorta e da origem das artérias mesentérica superior e mesentérica inferior(10). 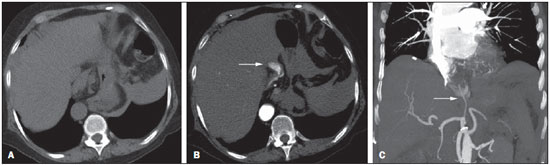 Figura 9. Angio-TC sem contraste (A), na fase arterial (B) e reconstrução MIP (C). Sinais de sangramento ativo, notando-se extravasamento do meio de contraste (seta em B) a partir da artéria gástrica esquerda (seta em C). A diverticulose colônica hemorrágica é uma causa frequente de SGI baixo. Comumente, envolve o cólon ascendente, enquanto o cólon descendente e o sigmoide são mais frequentemente associados a complicações inflamatórias/infecciosas. Seu diagnóstico prescinde de uma localização precisa do divertículo sangrante, e a presença de divertículo isolado sem evidência de sangramento ativo não é suficiente para atribuir a causa do sangramento à doença diverticular(57) (Figura 6). No nosso serviço, na avaliação do exame tomográfico do paciente com SGI, procuramos identificar os seguintes sinais: a) extravasamento de contraste para o lúmen do trato gastrintestinal; b) aumento desse extravasamento na fase portal; c) realce anormal da parede (hiporrealce), indicando isquemia ou sofrimento de alça; d) espessamento da parede intestinal (> 3 mm); e) hematoma agudo, caracterizado por área hiperatenuante na fase sem contraste com ou sem realce após injeção intravenosa do meio de contraste; f) presença de lesão tumoral na parede gastrintestinal; g) sinais de outras causas de SGI, tais como malformação vascular, pólipo ou divertículo com realce anormal e presença de úlcera. PROPOSTA DE PROTOCOLO DE EXAME Com base na revisão da literatura e na nossa experiência, propomos um protocolo específico para o paciente com história de SGI ativo (Tabela 2). Inicialmente, lembramos que pacientes hemodinamicamente instáveis não devem ser submetidos ao exame de angio-TC, em razão do seu risco clínico, antecipando-se o exame de angiografia ou endoscopia digestiva alta, pela sua capacidade terapêutica. Quando o paciente é estável, e pelo fato de, mesmo nesses casos, ser necessário executar o exame de angio-TC o mais rápido possível, nós não exigimos o jejum do paciente. Também não utilizamos nenhum tipo de contraste oral, para não diluir ou mascarar um possível extravasamento intraluminal do meio de contraste e para não postergar a realização do exame. As imagens de angio-TC abdominal são adquiridas em equipamento de 64 canais Brilliance 64® (Philips Medical Systems; Cleveland, OH), com os seguintes parâmetros: a) configuração do detector: 64 × 0,625 mm; b) espessura de corte: 1 mm; c) espessura de reconstrução: 1 e 3 mm; d) 120 kV; e) mAs dependente da modulação automática da dose de radiação (DoseRight ACS®); f) pitch de 0,67; g) tempo de rotação de 0,5 segundo. O tempo de aquisição da fase arterial é de aproximadamente 12 segundos, dependendo das dimensões do paciente.  Considerando a importância do uso racional da radiação, a fase sem contraste é adquirida com protocolo de baixa dose. Utilizamos um volume de 120 mL de meio de contraste iodado não iônico, injetado por via intravenosa, preferencialmente em veia antecubital, por meio de bomba injetora automática Injektron 82 CT/DG® (Guerbet), com velocidade de injeção de 4 mL/s, seguida de um flush de 30 mL de soro fisiológico, com a mesma velocidade. Realizamos as aquisições da fase arterial e portal, pelo fato de serem complementares e aumentarem a eficácia global do exame, como previamente mencionado. O início da aquisição da fase arterial é definido pelo programa de rastreamento automático do bolus do meio de contraste na aorta abdominal (automatic bolus-triggering) disponível no equipamento e colocando-se uma região de interesse circular no interior da aorta abdominal, imediatamente acima do tronco celíaco. Iniciamos a fase arterial 20 segundos após alcançar densidade de 100 UH na aorta descendente. A fase portal inicia-se 40 segundos após esse pico. Ao se optar por tempo fixo, podese adotar os tempos de 40 e 70 segundos após o início da injeção intravenosa do meio de contraste, para se obter as fases arterial e portal, respectivamente. Deve-se considerar que atrasar o tempo de aquisição arterial é menos prejudicial do que antecipá-lo, uma vez que um intervalo de tempo mais prolongado permite ao meio de contraste atravessar a delgada malha vascular da parede intestinal e alcançar a sua luz, quando houver um sangramento ativo. No entanto, é importante observar que os melhores resultados são obtidos ao se utilizar o programa de rastreamento automático. A análise do exame inicia-se pela fase sem contraste, procurando-se identificar pontos espontaneamente hiperatenuantes no lúmen intestinal que possam se traduzir em pitfalls nas fases contrastadas e a presença de áreas de densidade elevada, na parede intestinal, sugerindo o diagnóstico de um hematoma agudo (Figura 10). Em seguida, essas imagens são cuidadosamente comparadas com as obtidas nas fases arterial e portal, buscando identificar áreas de extravasamento do meio de contraste na luz gastrintestinal (Figura 10) e sinais secundários, como os supramencionados. Finalmente, mediante reconstruções angiográficas multiplanares com técnica MIP, procura-se identificar com maior precisão não somente a origem do sangramento, mas também, se possível, o vaso nutridor (Figuras 4 e 9) e eventuais variantes anatômicas vasculares. Essas informações poderão auxiliar no planejamento e execução da angiografia terapêutica. 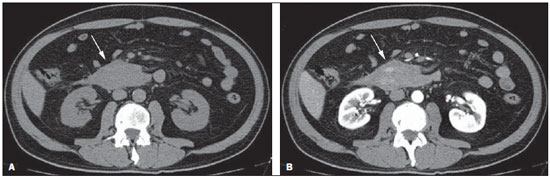 Figura 10. Úlcera de parede posterior da terceira porção do duodeno com sinais de sangramento ativo caracterizado pelo extravasamento do meio de contraste identificado pela diferença de densidade entre a fase sem contraste (A) (seta) e a com contraste intravenoso (B) (seta) e pelo aspecto do realce. CONCLUSÃO O SGI é uma emergência médica frequente, com importantes taxas de morbimortalidade, que necessita de uma ferramenta diagnóstica rápida que localize o sítio e a causa de sangramento, permitindo instaurar o tratamento adequado o mais breve possível. A angio-TC de abdome é um método rápido, minimamente invasivo, bastante disponível, que pode determinar com precisão e elevada acurácia o local e a causa da hemorragia digestiva. A eficácia do exame é otimizada ao se implementar um protocolo de estudo que leve em consideração as diversas variáveis técnicas que, de alguma forma, influenciam na detecção do local de sangramento, sem negligenciar fatores que podem limitar a dose de radiação utilizada. Com base nessas considerações, nós sugerimos que, no paciente apresentando SGI ativo e hemodinamicamente estável, a angio-TC seja realizada como ferramenta diagnóstica de primeira linha e o quanto antes, para maximizar a capacidade de detecção do sangramento e auxiliar no planejamento terapêutico. REFERÊNCIAS 1. Manning-Dimmitt LL, Dimmitt SG, Wilson GR. Diagnosis of gastrointestinal bleeding in adults. Am Fam Physician. 2005;71:1339-46. 2. Bezerra KB, Bacelar Jr EA, Pereira NCS, et al. Gastric arteriovenous malformation: treatment by embolization. Radiol Bras. 2012;45:126-8. 3. Geffroy Y, Rodallec MH, Boulay-Coletta I, et al. Multidetector CT angiography in acute gastrointestinal bleeding: why, when, and how. Radiographics. 2011;31:E35-46. 4. Singh V, Alexander JA. The evaluation and management of obscure and occult gastrointestinal bleeding. Abdom Imaging. 2009;34:311-9. 5. Jaeckle T, Stuber G, Hoffmann MH, et al. Detection and localization of acute upper and lower gastrointestinal (GI) bleeding with arterial phase multi-detector row helical CT. Eur Radiol. 2008;18:1406-13. 6. Stuber T, Hoffmann MH, Stuber G, et al. Pitfalls in detection of acute gastrointestinal bleeding with multi-detector row helical CT. Abdom Imaging. 2009;34:476-82. 7. Barbano PR, Coviello D, Mariani M, et al. Hemorrhages of the upper gastrointestinal tract. A comparison of the diagnostic accuracy between endoscopic and radiological examinations. Minerva Chir. 1990;45:1003-8. 8. Silverstein FE, Gilbert DA, Tedesco FJ, et al. The national ASGE survey on upper gastrointestinal bleeding. I. Study design and baseline data. Gastrointest Endosc. 1981;27:73-9. 9. Salvador Añez M, González Guerra H, Pacheco JL, et al. Value of emergency endoscopy in upper digestive hemorrhage. G E N. 1990;44:125-33. 10. Laing CJ, Tobias T, Rosenblum DI, et al. Acute gastrointestinal bleeding: emerging role of multidetector CT angiography and review of current imaging techniques. Radiographics. 2007;27:1055-70. 11. Jaeckle T, Stuber G, Hoffmann MH, et al. Acute gastrointestinal bleeding: value of MDCT. Abdom Imaging. 2008;33:285-93. 12. Vreeburg EM, Snel P, de Bruijne JW, et al. Acute upper gastrointestinal bleeding in the Amsterdam area: incidence, diagnosis, and clinical outcome. Am J Gastroenterol. 1997;92:236-43. 13. Frattaroli FM, Casciani E, Spoletini D, et al. Prospective study comparing multi-detector row CT and endoscopy in acute gastrointestinal bleeding. World J Surg. 2009;33:2209-17. 14. Martí M, Artigas JM, Garzón G, et al. Acute lower intestinal bleeding: feasibility and diagnostic performance of CT angiography. Radiology. 2012;262:109-16. 15. Angtuaco TL, Reddy SK, Drapkin S, et al. The utility of urgent colonoscopy in the evaluation of acute lower gastrointestinal tract bleeding: a 2-year experience from a single center. Am J Gastroenterol. 2001;96:1782-5. 16. Graça BM, Freire PA, Brito JB, et al. Gastroenterologic and radiologic approach to obscure gastrointestinal bleeding: how, why, and when? Radiographics. 2010;30:235-52. 17. García-Blázquez V, Vicente-Bártulos A, Olavarria-Delgado A, et al. Accuracy of CT angiography in the diagnosis of acute gastrointestinal bleeding: systematic review and meta-analysis. Eur Radiol. 2013;23:1181-90. 18. Yoon W, Jeong YY, Shin SS, et al. Acute massive gastrointestinal bleeding: detection and localization with arterial phase multi-detector row helical CT. Radiology. 2006;239:160-7. 19. Chua AE, Ridley LJ. Diagnostic accuracy of CT angiography in acute gastrointestinal bleeding. J Med Imaging Radiat Oncol. 2008; 52:333-8. 20. Wu LM, Xu JR, Yin Y, et al. Usefulness of CT angiography in diagnosing acute gastrointestinal bleeding: a meta-analysis. World J Gastroenterol. 2010;16:3957-63. 21. Kuhle WG, Sheiman RG. Detection of active colonic hemorrhage with use of helical CT: findings in a swine model. Radiology. 2003;228:743-52. 22. Elta GH. Approach to the patient with gross gastrointestinal bleeding. In: Yamada T, editor. Textbook of gastroenterology. 4th ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2003. p. 698-723. 23. Schuetz A, Jauch KW. Lower gastrointestinal bleeding: therapeutic strategies, surgical techniques and results. Langenbecks Arch Surg. 2001;386:17-25. 24. Zuckerman GR, Prakash C, Askin MP, et al. AGA technical review on the evaluation and management of occult and obscure gastrointestinal bleeding. Gastroenterology. 2000;118:201-21. 25. Ernst O, Bulois P, Saint-Drenant S, et al. Helical CT in acute lower gastrointestinal bleeding. Eur Radiol. 2003;13:114-7. 26. Miller FH, Hwang CM. An initial experience: using helical CT imaging to detect obscure gastrointestinal bleeding. Clin Imaging. 2004;28:245-51. 27. Tew K, Davies RP, Jadun CK, et al. MDCT of acute lower gastrointestinal bleeding. AJR Am J Roentgenol. 2004;182:427-30. 28. Sabharwal R, Vladica P, Chou R, et al. Helical CT in the diagnosis of acute lower gastrointestinal haemorrhage. Eur J Radiol. 2006;58:273-9. 29. Scheffel H, Pfammatter T, Wildi S, et al. Acute gastrointestinal bleeding: detection of source and etiology with multi-detector-row CT. Eur Radiol. 2007;17:1555-65. 30. Zink SI, Ohki SK, Stein B, et al. Noninvasive evaluation of active lower gastrointestinal bleeding: comparison between contrast-enhanced MDCT and 99mTc-labeled RBC scintigraphy. AJR Am J Roentgenol. 2008;191:1107-14. 31. Lee S, Welman CJ, Ramsay D. Investigation of acute lower gastrointestinal bleeding with 16- and 64-slice multidetector CT. J Med Imaging Radiat Oncol. 2009;53:56-63. 32. Kennedy DW, Laing CJ, Tseng LH, et al. Detection of active gastrointestinal hemorrhage with CT angiography: a 4(1/2)-year retrospective review. J Vasc Interv Radiol. 2010;21:848-55. 33. Al-Saeed O, Kombar O, Morsy M, et al. Sixty-four multi-detector computerised tomography in the detection of lower gastrointestinal bleeding: a prospective study. J Med Imaging Radiat Oncol. 2011;55:252-8. 34. Chang WC, Tsai SH, Chang WK, et al. The value of multidetectorrow computed tomography for localization of obscure acute gastrointestinal bleeding. Eur J Radiol. 2011;80:229-35. 35. Sun H, Jin Z, Li X, et al. Detection and localization of active gastrointestinal bleeding with multidetector row computed tomography angiography: a 5-year prospective study in one medical center. J Clin Gastroenterol. 2012;46:31-41. 36. Yen HH, Chen YY, Yang CW, et al. Clinical impact of multidetector computed tomography before double-balloon enteroscopy for obscure gastrointestinal bleeding. World J Gastroenterol. 2012;18:692-7. 37. Fung HS, Kwok PC, Lau S, et al. 64-Slice multi-detector computed tomography for detection of acute gastrointestinal bleeding. J HK Coll Radiol. 2008;11:13-8. 38. Heiss P, Zorger N, Hamer OW, et al. Optimized multidetector computed tomographic protocol for the diagnosis of active obscure gastrointestinal bleeding: a feasibility study. J Comput Assist Tomogr. 2009;33:698-704. 39. Palma J, Mihaila M, Pilleul F. Multidetector computed tomography in acute lower gastrointestinal bleeding. Reports in Medical Imaging. 2010;3:107-13. 40. Kim JW, Shin SS, Yoon W, et al. Diagnosis of acute gastrointestinal bleeding: comparison of the arterial, the portal, and the combined set using 64-section computed tomography. J Comput Assist Tomogr. 2011;35:206-11. 41. Horton KM, Jeffrey RB, Federle MP, et al. Acute gastrointestinal bleeding: the potential role of 64 MDCT and 3D imaging in the diagnosis. Emerg Radiol. 2009;16:349-56. 42. Costa DMC, Salvadori PS, Monjardim RF, et al. When the non-contrast-enhanced phase is unnecessary in abdominal computed tomography scans? A retrospective analysis of 244 cases. Radiol Bras. 2013;46:197-202. 43. Salvadori PS, Costa DMC, Romano RFT, et al. What is the real role of the equilibrium phase in abdominal computed tomography? Radiol Bras. 2013;46:65-70. 44. Nakayama Y, Awai K, Funama Y, et al. Lower tube voltage reduces contrast material and radiation doses on 16-MDCT aortography. AJR Am J Roentgenol. 2006;187:W490-7. 45. Nakayama Y, Awai K, Funama Y, et al. Abdominal CT with low tube voltage: preliminary observations about radiation dose, contrast enhancement, image quality, and noise. Radiology. 2005;237:945-51. 46. Suzuki S, Nishiyama Y, Kuwahara S, et al. Adaptive statistical iterative reconstruction algorithm for measurement of vascular diameter on computed tomographic angiography in vitro. J Comput Assist Tomogr. 2013;37:311-6. 47. Martillotti J, Silva N, Chhabra J, et al. Dose of reduced z-axis length of computed tomography angiography (CTA) of the chest for pulmonary embolism using 64-detector rows and adaptive iterative reconstruction techniques. Emerg Radiol. 2013;20:39-44. 48. Cornfeld D, Israel G, Detroy E, et al. Impact of Adaptive Statistical Iterative Reconstruction (ASIR) on radiation dose and image quality in aortic dissection studies: a qualitative and quantitative analysis. AJR Am J Roentgenol. 2011;196:W336-40. 49. Rubin GD. Techniques for performing multidetector-row computed tomographic angiography. Tech Vasc Interv Radiol. 2001;4:2-14. 50. Capuñay C, Carrascosa P, Martín López E, et al. Multidetector CT angiography and virtual angioscopy of the abdomen. Abdom Imaging. 2009;34:81-93. 51. Loewe C, Becker CR, Berletti R, et al. 64-Slice CT angiography of the abdominal aorta and abdominal arteries: comparison of the diagnostic efficacy of iobitridol 350 mgI/ml versus iomeprol 400 mgI/ ml in a prospective, randomised, double-blind multi-centre trial. Eur Radiol. 2010;20:572-83. 52. Behrendt FF, Mahnken AH, Keil S, et al. Contrast enhancement in multidetector-row computed tomography (MDCT) of the abdomen: intraindividual comparison of contrast media containing 300 mg versus 370 mg iodine per ml. Eur Radiol. 2008;18:1199-205. 53. Sahani DV, Soulez G, Chen KM, et al. A comparison of the efficacy and safety of iopamidol-370 and iodixanol-320 in patients undergoing multidetector-row computed tomography. Invest Radiol. 2007;42:856-61. 54. Hammerstingl RM, Vogl TJ. Abdominal MDCT: protocols and contrast considerations. Eur Radiol. 2005;15 Suppl 5:E78-90. 55. Brink JA. Contrast optimization and scan timing for single and multidetector-row computed tomography. J Comput Assist Tomogr. 2003;27 Suppl 1:S3-8. 56. Dobritz M, Engels HP, Schneider A, et al. Detection of intestinal bleeding with multi-detector row CT in an experimental setup. How many acquisitions are necessary? Eur Radiol. 2009;19:2862-9. 57. Duchat F, Soyer P, Boudiaf M, et al. Multi-detector row CT of patients with acute intestinal bleeding: a new perspective using multiplanar and MIP reformations from submillimeter isotropic voxels. Abdom Imaging. 2010;35:296-305. 1. Mestre pelo Programa de Mestrado Profissional Associado à Residência Médica (Meparem), Médica Radiologista do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil 2. Doutora, Médica Radiologista do Centro Radiológico Campinas, Hospital Vera Cruz, Campinas, SP, Brasil 3. Livre-docente, Professor Adjunto do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil Endereço para correspondência: Dra. Fatima Regina Silva Reis Rua Jorge Chammas, 224, ap. 41, Torre Centenary, Vila Mariana São Paulo, SP, Brasil, 04016-070 E-mail: fatima.rsreis@gmail.com Recebido para publicação em 25/2/2014. Aceito, após revisão, em 18/7/2014. Trabalho realizado no Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554