Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 48 nº 6 - Nov. / Dez. of 2015
Vol. 48 nº 6 - Nov. / Dez. of 2015
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Bruno Hochhegger1; Vinícius Valério Silveira de Souza2; Edson Marchiori3; Klaus Loureiro Irion4; Arthur Soares Souza Jr.5; Jorge Elias Junior6; Rosana Souza Rodrigues7; Miriam Menna Barreto7; Dante Luiz Escuissato8; Alexandre Dias Mançano9; César Augusto Araujo Neto10; Marcos Duarte Guimarães11 ; Carlos Schuler Nin2; Marcel Koenigkam Santos12; Jorge Luiz Pereira e Silva13 |
|
|
Descritores: Ressonância magnética; Pulmão; Tórax; Protocolo; Sequências. |
|
|
Resumo: INTRODUÇÃO
A aquisição de imagens do parênquima pulmonar representa um desafio peculiar para imagem de ressonância magnética (RM). A limitação da intensidade de sinal é causada por baixa densidade de prótons e artefatos de suscetibilidade devem-se a diferenças entre o tecido e o ar, além de artefatos de movimentos fisiológicos (pulsação cardíaca, respiração). Recentemente, outras melhorias nas técnicas de RM elevaram o potencial de investigação de doenças do parênquima pulmonar. Tais técnicas incluem tempos de eco muito curtos, aquisições turbo-spin-eco ultrarrápidas, técnica de reconstrução de projeções, aquisição de imagens em apneia, e agentes de contraste recentemente desenvolvidos (para imagem com perfusão e ventilação)(1-3). Em pulmões saudáveis, a densidade do tecido é de 0,1 g/cm3, correspondendo a aproximadamente 10 vezes menos do que em outros órgãos de tecidos moles. Como a intensidade de sinal da RM é diretamente proporcional à densidade de prótons no tecido, mesmo sob condições perfeitas de aquisição de imagem (isto é, desconsiderando os efeitos de relaxação), o sinal de RM do pulmão é 10 vezes mais fraco do que o dos tecidos adjacentes. A baixa relação sinal-ruído faz com que o estudo da microestrutura dos pulmões pela espectroscopia por RM seja um desafio. A ponderação de sinal pode ser empregada para melhorar a relação sinal-ruído, mas isto prolonga os tempos de aquisição de imagens por mais de 10 minutos por conjunto de dados, o que tornaria os protocolos inadequados para a rotina clínica. A relação sinalruído pode ser melhorada com o aumento do tamanho dos voxels; entretanto, lesões menores como metástases pulmonares periféricas podem não estar visíveis devido aos efeitos de volume parcial(1-3). Para obter uma ampla aceitação clínica, a RM de pulmão tem de ser prática, robusta e reproduzível. Além dos aspectos de fluxo de trabalho, a RM deve proporcionar uma qualidade de imagem consistentemente alta, assim como precisão diagnóstica e um impacto terapêutico positivo. Os diferentes fabricantes de equipamentos de RM já fornecem as sequências necessárias para aquisição de imagens de RM dos pulmões(1-3). No presente artigo, os autores analisam os aspectos técnicos e clínicos do método e sugerem um protocolo a ser usado na rotina clínica para RM de tórax. INDICAÇÕES CLÍNICAS DA RM DE PULMÃO Detecção e caracterização de nódulos pulmonares Uma recente meta-análise relatou que tomografia computadorizada (TC) dinâmica e RM - ambas modalidades não invasivas - são igualmente precisas para fazer a distinção entre nódulos pulmonares solitários malignos e benignos, e as diferenças entre os dois métodos são insignificantes(4). Os autores da meta-análise relataram que para os 10 exames com TC dinâmica, a RM teve sensibilidade combinada de 93% (IC 95%: 0,88-0,97) e especificidade combinada de 76% (IC 95%: 0,68-0,97)(5). Koyama et al.(4) relataram que a RM de pulmão sem contraste é tão eficiente quanto a TC com multidetectores em cortes finos para detectar nódulos malignos. Os autores também observaram que a taxa global de detecção em cada sequência de RM (82,5%) foi significativamente mais baixa do que a da TC com multidetectores (97,0%), embora não tenha havido nenhuma diferença significativa entre as duas técnicas em termos de taxa de detecção de nódulos malignos. Também, há relatos de detecção de gordura em hamartomas pulmonares por meio de RM com deslocamento químico (chemical shift)(5) (Figura 1). A RM com difusão pode ser apropriada para substituir a PET/TC com 18FDG para distinguir nódulos/massas pulmonares malignos(as) de benignos(as) com menos resultados falso-positivos quando comparada à PET/TC com 18FDG(6). 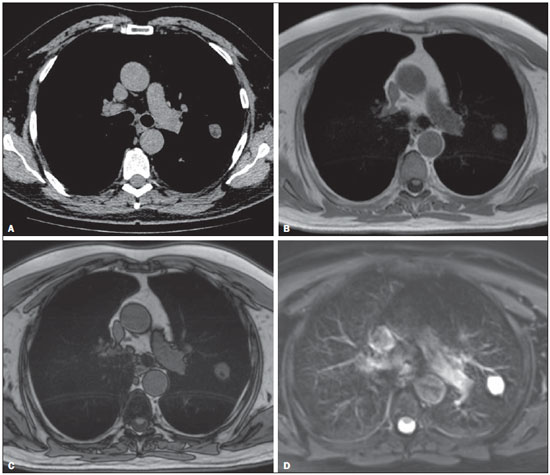 Figura 1. Paciente de 56 anos de idade com câncer pancreático. A: Imagem axial de TC mostrando áreas de baixa atenuação dentro do nódulo. Este nódulo apresentou atenuação média de –33 HU. Imagens em fase (B) e fora de fase (C) mostrando perda de sinal no nódulo, sugerindo hamartoma. D: Sequência ponderada em T2 mostrando alta intensidade de sinal do nódulo. Estadiamento da neoplasia No sistema TNM (tumor/linfonodo/metástase) de estadiamento, o estágio T (tamanho do tumor e grau de invasão) é o principal determinante da gravidade da neoplasia(7). A RM é superior à TC para demonstrar pericárdio, coração e vasos mediastinais e, portanto, pode ser indicada em situações específicas, tais como obstrução da veia cava, invasão do miocárdio ou disseminação de um tumor para o átrio esquerdo pelas veias pulmonares(8). Além disso, a RM permite a distinção entre câncer de pulmão e alterações secundárias decorrentes de atelectasia ou pneumonite(7). Nas sequências ponderadas em T2, a atelectasia e a pneumonite pós-obstrução frequentemente mostram maior intensidade de sinal quando comparadas ao tumor central(7). Ohno et al.(9) conduziram um estudo prospectivo de 115 pacientes consecutivos com câncer de pulmão submetidos a TC, RM com sequência short-tau inversion-recovery turbo spin-echo (STIR-TSE) (Figura 2) e tomografia por emissão de pósitrons com 18-fluordesoxiglicose (FDG-PET/TC), assim como exame cirúrgico e análise patológica. Os autores observaram que, em cada um dos pacientes, a sensibilidade e precisão quantitativas das imagens em STIR-TSE (90,1% e 92,2%, respectivamente) foram significativamente maiores do que a sensibilidade quantitativa, sensibilidade qualitativa, precisão quantitativa e precisão qualitativa das imagens obtidas por FDG-PET/TC (76,7%, 74,4%, 83,5%, e 82,6%, respectivamente). Estudos anteriores demonstraram que a RM de corpo inteiro proporciona um grau de precisão aceitável e que sua eficácia no estadiamento do câncer de pulmão é comparável à da PET/TC(8,9). Cada uma das duas modalidades de imagem mostrou ter suas vantagens(7); a RM de corpo inteiro é superior na detecção de metástases cerebrais e hepáticas, enquanto a PET/TC apresenta melhor desempenho na detecção de metástases linfonodais e em tecidos moles. Para avaliar áreas que tenham sido submetidas a radioterapia, a RM ponderada em difusão é uma técnica promissora(7). A RM de corpo inteiro pode ser usada para avaliação de estágio M (metástase) em pacientes com câncer de pulmão de células não pequenas e tem mostrado ser tão precisa como a PET/TC(9). 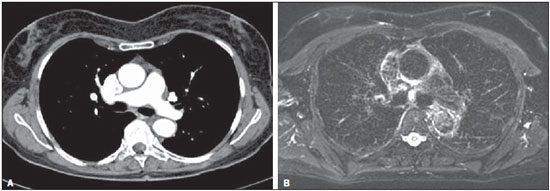 Figura 2. A: Imagem axial de TC mostrando um linfonodo medindo 8 mm na estação subcarinal. B: Imagem axial ponderada em T2 com saturação de gordura mostrando alta intensidade de sinal neste linfonodo, sugerindo a presença de doença metastática. Doença tromboembólica pulmonar Embolia pulmonar é a terceira causa mais comum de doença cardiovascular (após infarto miocárdico e acidente vascular cerebral). Frequentemente, essa doença passa despercebida e, por isso, é responsável por milhares de mortes todos os anos(10). Em 2003, Stein et al.(11) conduziram uma meta-análise do uso de RM contrastada com gadolínio na investigação de embolia pulmonar. Os autores usaram angiografia pulmonar convencional como padrão de referência. Observaram que a sensibilidade do procedimento relatada variava consideravelmente (77-100%) e que a especificidade relatada era uniformemente alta (95-98%)(11) (Figura 3). No estudo mais recente avaliado nesta meta-análise, Oudkerk et al.(12) mostraram que a sensibilidade da RM contrastada para embolia pulmonar foi 100% em artérias centrais e lobares, 84% em artérias segmentares e apenas 40% nos ramos subsegmentares. No geral, o protocolo combinado de RM revelou-se mais confiável e sensível do que a TC com multidetectores de 16 fileiras(13). Observou-se que a duração média do exame de RM é de aproximadamente 10 minutos(13). 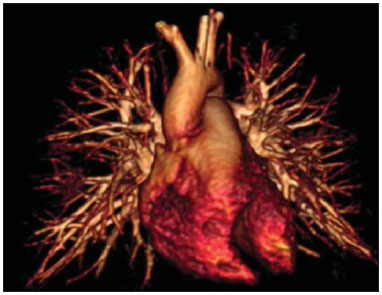 Figura 3. Reconstrução 3D (volume rendering) de imagem de angiografia por RM mostrando resolução subsegmentar. Hipertensão pulmonar O uso da RM permite uma avaliação abrangente da hipertensão pulmonar, especialmente quando se realizam angiorressonância e RM com sequências de perfusão, sendo possível diferenciar entre hipertensão tromboembólica pulmonar crônica e hipertensão arterial pulmonar(14,15). Além disso, a angiorressonância permite uma avaliação detalhada da localização do material tromboembólico, e para o planejamento cirúrgico é igualmente tão útil quanto a angiografia por subtração digital e a angiografia por TC(16,17). Na RM, sequências podem ser avaliadas quantitativamente, permitindo a avaliação da gravidade da doença de pequenos vasos. Imagens estruturais do pulmão permitirão a exclusão de doenças do parênquima pulmonar. Medidas de fluxo sanguíneo e pressão cardíaca direita permitem que se estimem a pressão arterial pulmonar e o stress cardíaco, além de facilitar a identificação de doença valvular concomitante(17). Pacientes com fibrose cística As ferramentas radiológicas padrão para monitoramento da doença pulmonar em pacientes com fibrose cística são a radiografia de tórax e a TC de alta resolução (TCAR), e para tal propósito diferentes sistemas de pontuação são propostos(18). Exames obtidos com cortes finos fornecem imagens da estrutura do pulmão com resolução em escala micrométrica, e os achados da TCAR e/ou da RM podem também constituir medidas de resultados úteis para o estudo da doença pulmonar em pacientes com fibrose cística(19,20). Além disso, a RM pode ser usada para avaliar os vários aspectos da função pulmonar, incluindo a perfusão pulmonar (Figura 4)(21,22), o fluxo sanguíneo(23), a mecânica respiratória(24,25) e, com a administração de agentes de contraste inaláveis, a ventilação pulmonar(26). Estudos recentes mostraram que a RM é altamente capaz de revelar a bronquiectasia típica da fibrose cística, assim como o tampão mucoso, e que a RM tem um valor diagnóstico igual à da TC na avaliação da gravidade da doença com o sistema de pontuação de Bhalla ou de Helbich(27). 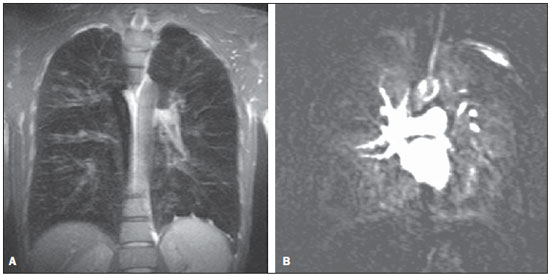 Figura 4. Paciente de 32 anos de idade com fibrose cística. A: Sequência coronal gradiente-eco (VIBE) ponderada em T1 com espessura de corte de 2 mm. Observar a presença de bronquiectasia com impacto mucoide. B: Perfusão pulmonar mostrando múltiplas falhas de perfusão, caracterizando melhor a gravidade da doença. Pacientes com pneumonia As várias características da pneumonia, tais como nódulos mal definidos, opacidades em vidro fosco e consolidações, podem ser facilmente detectadas e diferenciadas pela RM (Figura 5). Na RM de tórax, opacidades e calcificações extremamente pequenas representam um grande desafio devido aos cortes mais finos e à baixa intensidade de sinal. Como ferramenta de seguimento, recomenda-se a RM em vez de TC para evitar exposição excessiva à radiação ionizante. A sensibilidade das sequências ponderadas em T2 e o potencial das sequências ponderadas em T1 realçadas por contraste podem facilitar sobremaneira o diagnóstico diferencial(28). Além disso, complicações incipientes como derrame pericárdico, derrame pleural, empiema e abscesso pulmonar são facilmente reconhecidas em imagens de RM(28). Em pacientes imunodeprimidos, a RM é quase tão precisa quanto a TC na detecção de anormalidades pulmonares associadas com infecção(29-31). 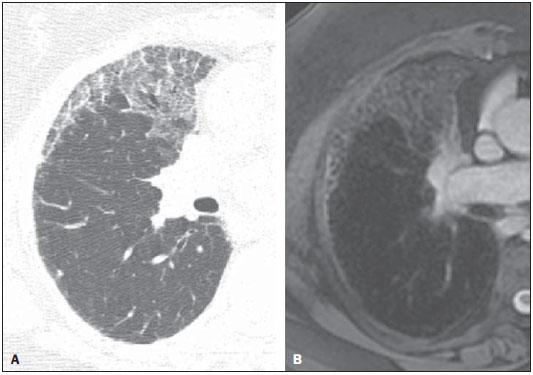 Figura 5. A: Imagem axial de TCAR mostrando opacidades em vidro fosco homogêneas segmentares no córtex pulmonar. B: Imagem axial ponderada em T2 demonstrando claramente a lesão. ASPECTOS TÉCNICOS E SUGESTÃO DE PROTOCOLO Para a RM de tórax, recomenda-se o uso de equipamentos padrão com energia de campo de 1,5 tesla (T) e capacidade total de imageamento paralelo(2,3,32). Embora uma energia de campo mais alta, isto é, 3 T, teoricamente aumente a relação sinal ruído, o decaimento mais rápido do sinal causado por artefatos de suscetibilidade magnética representa obstáculo adicional à aquisição de imagens do pulmão. Grandes esforços são necessários para se obter resultados similares com 3 T, quando comparado a 1,5 T, na aquisição de imagens de nódulos, por exemplo(33). O oxigênio no ar é paramagnético e o tecido é diamagnético, o que leva a diferença de suscetibilidade magnética da massa (Δχ = 8 ppm) nas interfaces pulmão-ar. Em cada interface tecidual, a diferença de suscetibilidade forma um gradiente de campo local estático. Assim, as múltiplas superfícies microscópicas apresentadas pelas vias aéreas e alvéolos nos pulmões criam gradientes de campo magnético local altamente não homogêneos em uma escala espacial menor do que o tamanho de um típico voxel de imagem (2-5 mm)(1-3). Esses gradientes de campo microscópicos levam a uma rápida defasagem na imagem de gradiente-eco; tal decaimento de sinal é tipicamente descrito por um tempo de relaxação transversal aparente T2* que pode ser tão curto quanto 2 ms ou menos em B0 = 1,5 T. Assim, a RM de pulmão com sequência gradiente-eco torna-se um grande desafio e requer sequências de pulso com tempos de eco curtos (TE < 1-2 ms)(1-3). Quando a não homogeneidade do campo magnético aumenta com B0, T2* ainda mais curtos, de cerca de 0,5 ms, são achados em 3 T. Frequentemente, o ganho esperado de 3 T sobre 1,5 T na relação sinal-ruído não pode ser realizado, pois isto requer que o TE seja consequentemente encurtado. Com sequências de pulso idênticas, um TE mais curto só pode ser conseguido se sistemas de gradiente mais poderosos forem utilizados; entretanto, os atuais sistemas de RM de 3,0T frequentemente utilizam as mesmas unidades de gradiente usadas pelos sistemas de 1,5T de ponta. Um protocolo básico é baseado principalmente em sequências sem contraste e com apneia e imagem ponderada em difusão com respiração livre (Tabela 1). Durante esse tempo, sequência tridimensional (3D) gradiente-eco ponderada em T1, sequência fast-spin-eco ponderada em T2, assim como sequência STIR podem ser usadas. A questão dos movimentos respiratórios, vasculares e cardíacos pode ser resolvida com o uso das técnicas de imagem rápida, sincronização (gates respiratório e cardíaco) e triggering, respectivamente (Figura 6 - A-F)(34).  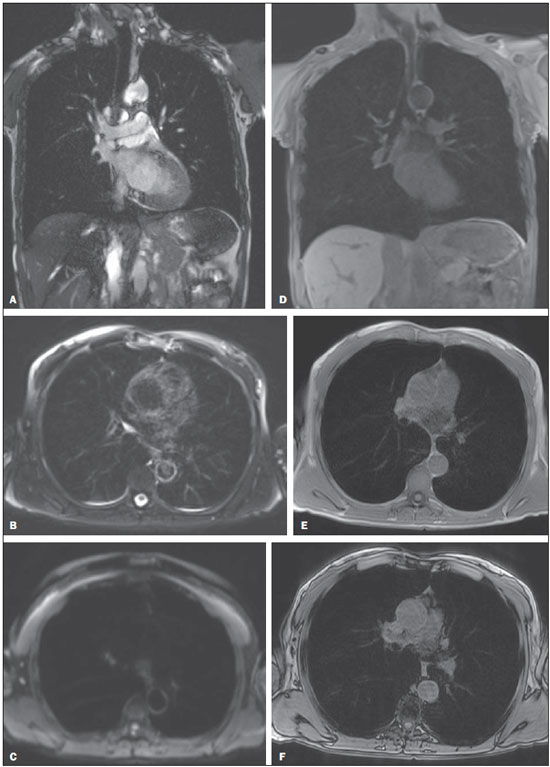 Figura 6 (A–F). Exemplos de imagens para o protocolo sugerido. A: Sequência coronal FSE TrueFisp ponderada em T2 (4 mm). B: Sequência axial ponderada em T2 Blade axial (4 mm). C: Imagem axial ponderada em difusão (5 mm). D: Sequência coronal VIBE ponderada em T1 com supressão de gordura (4 mm). E,F: Sequência ponderada em T1 em fase e fora de fase. Aquisições half-Fourier e tempos de eco ultracurtos são recomendados(32). O protocolo básico deve ser estendido com aquisição de imagens realçadas por contraste com alta resolução espacial (angiografia por RM de fase única) ou alta resolução temporal, como no estudo de perfusão com resolução temporal (Figura 6 - G,H). Sequências complicadas e de execução demorada exigindo gate cardíaco devem ser reservadas para cenários clínicos específicos. Sequências gradiente-eco 3D ponderadas em T1, tais como volume interpolated breath-hold examination (VIBE) são recomendadas para avaliação do mediastino, nódulos pulmonares, massas e consolidações, e devem ser repetidas com saturação de gordura após administração de agente de contraste. Na doença obstrutiva pulmonar crônica, por exemplo, o agente de contraste compensa a diminuição da intensidade de sinal devida às propriedades da minus-pathology(32) (Figura 6I). 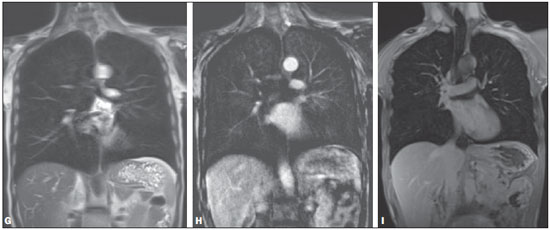 Figura 6 (G–I). Exemplos de imagens para o protocolo sugerido. G: Sequência coronal HASTE ponderada em T2. H: Sequência de perfusão coronal ponderada em T1. I: Sequência VIBE ponderada em T1 com supressão de gordura. Uma sequência half-Fourier spin-eco ponderada em T2 pode facilmente visualizar infiltrados pulmonares, espessamento inflamatório de paredes brônquicas, assim como acúmulo de muco e líquido. Um estudo experimental mostrou que a sensibilidade de sequências ponderadas em T2 com apneia ou gate respiratório para infiltrados é no mínimo igual à sensibilidade da radiografia de tórax e TC com multidetectores(13). O uso de sequência ponderadas em difusão na avaliação de massas ou envolvimento de nódulos linfáticos ainda requer avaliação, mas também tem mostrado resultados promissores para estadiamento de corpo inteiro do câncer de pulmão(34-36). Porém, sugere-se o uso da RM de corpo inteiro com modernas técnicas de aquisição rápida como ferramenta diagnóstica para estadiamento M que pode ser implementada em um amplo protocolo de estadiamento de câncer de pulmão. Tal técnica já provou ser sensível para detecção de disseminação extratorácica de câncer de pulmão. Uma comparação direta entre RM de corpo inteiro e FDG-PET/TC mostrou que a RM de corpo inteiro apresenta sensibilidade significativamente mais alta para detecção de doença metastática, principalmente pela maior precisão na determinação do grau de envolvimento do cérebro, pescoço e ossos(37-39). O estudo contrastado de perfusão por RM é uma técnica objetiva e de fácil implementação. Sequências tridimensionais gradiente-eco ponderadas em T1 com eco duplo e aquisição paralela de imagens proporcionam tempos curtos de aquisição de aproximadamente 1,5 s para um conjunto de dados 3D (assim chamado 4D ou 3D + t) necessário para visualizar a perfusão durante o pico de realce pelo contraste do parênquima pulmonar. CONCLUSÃO Com o seu rápido desenvolvimento nos últimos anos, a RM de pulmão encontra-se de fato na iminência de ampla aplicação clínica. Doenças das vias aéreas e da vasculatura, bem como nódulos e câncer de pulmão, constituem agora o principal foco. Por oferecer diversas vantagens quando comparada com as técnicas convencionais de medicina nuclear, a RM compete com a TC com multidetectores em muitas aplicações. O fato de não envolver o uso de radiação ionizante coloca a RM de tórax na linha de frente de todos os métodos de imagem transversal, particularmente em casos envolvendo pacientes jovens. A combinação peculiar de dados funcionais e estruturais faz da RM um método atraente para uso em todas as doenças em que a escolha entre opções de tratamento inovadoras e dispendiosas realmente necessitará e se beneficiará de um grande número de parâmetros mensuráveis. REFERÊNCIAS 1. Wild JM, Marshall H, Bock M, et al. MRI of the lung (1/3): methods. Insights Imaging. 2012;3:345-53. 2. Biederer J, Beer M, Hirsch W, et al. MRI of the lung (2/3). Why ... when ... how? Insights Imaging. 2012;3:355-71. 3. Koenigkam Santos M, Elias Júnior J, Mauad FM, et al. Ressonância magnética do tórax: aplicações tradicionais e novas, com ênfase em pneumologia. J Bras Pneumol. 2011;37:242-58. 4. Koyama H, Ohno Y, Kono A, et al. Quantitative and qualitative assessment of non-contrast-enhanced pulmonary MR imaging for management of pulmonary nodules in 161 subjects. Eur Radiol. 2008;18:2120-31. 5. Hochhegger B, Marchiori E, dos Reis DQ, et al. Chemical-shift MRI of pulmonary hamartomas: initial experience using a modified technique to assess nodule fat. AJR Am J Roentgenol. 2012;199:W331-4. 6. Mori T, Nomori H, Ikeda K, et al. Diffusion-weighted magnetic resonance imaging for diagnosing malignant pulmonary nodules/masses: comparison with positron emission tomography. J Thorac Oncol. 2008;3:358-64. 7. Hochhegger B, Marchiori E, Sedlaczek O, et al. MRI in lung cancer: a pictorial essay. Br J Radiol. 2011;84:661-8. 8. Hochhegger B, Marchiori E, Souza LS Jr, et al. Magnetic resonance in N staging of lung cancer. Eur J Radiol. 2013;82:193. 9. Ohno Y, Koyama H, Onishi Y, et al. Non-small cell lung cancer: whole-body MR examination for M-stage assessment - utility for whole-body diffusion-weighted imaging compared with integrated FDG PET/CT. Radiology. 2008;248:643-54. 10. Hochhegger B, Ley-Zaporozhan J, Marchiori E, et al. Magnetic resonance imaging findings in acute pulmonary embolism. Br J Radiol. 2011;84:282-7. 11. Stein PD, Woodard PK, Hull RD, et al. Gadolinium-enhanced magnetic resonance angiography for detection of acute pulmonary embolism: an in-depth review. Chest. 2003;124:2324-8. 12. Oudkerk M, van Beek EJ, Wielopolski P, et al. Comparison of contrast-enhanced magnetic resonance angiography and conventional pulmonary angiography for the diagnosis of pulmonary embolism: a prospective study. Lancet. 2002;359:1643-7. 13. Kluge A, Luboldt W, Bachmann G. Acute pulmonary embolism to the subsegmental level: diagnostic accuracy of three MRI techniques compared with 16-MDCT. AJR Am J Roentgenol. 2006;187:W7-14. 14. Junqueira FP, Lima CMAO, Coutinho AC Jr, et al. Pulmonary arterial hypertension: an imaging review comparing MR pulmonary angiography and perfusion with multidetector CT angiography. Br J Radiol. 2012;85:1446-56. 15. Hochhegger B, Irion K, Marchiori E. Radiation-free method to diagnosis of pulmonary embolism. AJR Am J Roentgenol. 2013;200:W398. 16. Junqueira FP, Lima CM, Coutinho AC Jr, et al. Magnetic resonance as an alternative imaging method for the evaluation of patients with pulmonary hypertension. Eur J Radiol. 2013;82:195-6. 17. Kreitner KF, Kunz RP, Ley S, et al. Chronic thromboembolic pulmonary hypertension - assessment by magnetic resonance imaging. Eur Radiol. 2007;17:11-21. 18. Bhalla M, Turcios N, Aponte V, et al. Cystic fibrosis: scoring system with thin-section CT. Radiology. 1991;179:783-8. 19. Brody AS, Molina PL, Klein JS, et al. High-resolution computed tomography of the chest in children with cystic fibrosis: support for use as an outcome surrogate. Pediatr Radiol. 1999;29:731-5. 20. Hochhegger B, Irion KL, Marchiori E. Chest MRI in patients with cystic fibrosis: a radiation-free method. Thorax. 2013;68:105-6. 21. Levin DL, Chen Q, Zhang M, et al. Evaluation of regional pulmonary perfusion using ultrafast magnetic resonance imaging. Magn Reson Med. 2001;46:166-71. 22. Sridharan S, Derrick G, Deanfield J, et al. Assessment of differential branch pulmonary blood flow: a comparative study of phase contrast magnetic resonance imaging and radionuclide lung perfusion imaging. Heart. 2006;92:963-8. 23. Levin DL, Hatabu H. MR evaluation of pulmonary blood flow. J Thorac Imaging. 2004;19:241-9. 24. Chen Q, Mai VM, Bankier AA, et al. Ultrafast MR grid-tagging sequence for assessment of local mechanical properties of the lungs. Magn Reson Med. 2001;45:24-8. 25. Sundaram TA, Gee JC. Towards a model of lung biomechanics: pulmonary kinematics via registration of serial lung images. Med Image Anal. 2005;9:524-37. 26. Middleton H, Black RD, Saam B, et al. MR imaging with hyperpolarized 3He gas. Magn Reson Med. 1995;33:271-5. 27. Puderbach M, Eichinger M, Haeselbarth J, et al. Assessment of morphological MRI for pulmonary changes in cystic fibrosis (CF) patients: comparison to thin-section CT and chest x-ray. Invest Radiol. 2007;42:715-25. 28. Eibel R. Pulmonary infections - Pneumonia. In: Kauczor HU, editor. MRI of the lung. Heidelberg: Springer Berlin Heidelberg; 2009. p. 255-77. 29. Eibel R, Herzog P, Dietrich O, et al. Pulmonary abnormalities in immunocompromised patients: comparative detection with parallel acquisition MR imaging and thin-section helical CT. Radiology. 2006;241:880-91. 30. Marchiori E, Zanetti G, Rafful PP, et al. Pleural endometriosis and recurrent pneumothorax: the role of magnetic resonance imaging. Ann Thorac Surg. 2012;93:696-7. 31. Hochhegger B, Marchiori E, Souza AS Jr, et al. MRI and CT findings of metastatic pulmonary calcification. Br J Radiol. 2012;85:e69-72. 32. Hochhegger B, Marchiori E, Irion K. Acute pulmonary embolism. N Engl J Med. 2010;363:1972-5. 33. Fink C, Puderbach M, Biederer J, et al. Lung MRI at 1.5 and 3 Tesla: observer preference study and lesion contrast using five different pulse sequences. Invest Radiol. 2007;42:377-83. 34. Puderbach M, Hintze C, Ley S, et al. MR imaging of the chest: a practical approach at 1.5T. Eur J Radiol. 2007;64:345-55. 35. Ohno Y, Koyama H, Nogami M, et al. Whole-body MR imaging vs. FDG-PET: comparison of accuracy of M-stage diagnosis for lung cancer patients. J Magn Reson Imaging. 2007;26:498-509. 36. Razek AA. Diffusion magnetic resonance imaging of chest tumors. Cancer Imaging. 2012;12:452-63. 37. Hochhegger B, Marchiori E, Irion K, et al. Magnetic resonance of the lung: a step forward in the study of lung disease. J Bras Pneumol. 2012;38:105-15. 38. Hochhegger B, Irion K, Marchiori E. Whole-body magnetic resonance imaging: a viable alternative to positron emission tomography/CT in the evaluation of neoplastic diseases. J Bras Pneumol. 2010;36:396. 39. Barreto MM, Rafful PP, Rodrigues RS, et al. Correlation between computed tomographic and magnetic resonance imaging findings of parenchymal lung diseases. Eur J Radiol. 2013;82:e492-501. 1. Doutor, Professor Associado da Universidade Federal de Ciências da Saúde de Porto Alegre (UFCSPA), Porto Alegre, RS, Brasil 2. Médico Residente em Radiologia e Diagnóstico por Imagem da Irmandade Santa Casa de Misericórdia de Porto Alegre, Porto Alegre, RS, Brasil 3. Doutor, Professor Titular Emérito da Universidade Federal Fluminense (UFF), Niterói, RJ, Brasil 4. Doutor, Radiologista Consultor do Liverpool Heart and Chest Hospital NHS Trust, Liverpool, Reino Unido 5. Doutor, Professor da Faculdade de Medicina de São José do Rio Preto (Famerp), São José do Rio Preto, SP, Brasil 6. Doutor, Professor Associado do Centro de Ciências das Imagens e Física Médica (CCIFM) da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP), Ribeirão Preto, SP, Brasil 7. Doutoras, Professoras do Programa de Pós-Graduação em Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil 8. Doutor, Professor Associado do Departamento de Clínica Médica da Universidade Federal do Paraná (UFPR), Curitiba, PR, Brasil 9. Médico Radiologista da Radiologia Anchieta, Taguatinga, DF, Brasil 10. Doutor, Professor Associado da Universidade Federal da Bahia (UFBA), Salvador, BA, Brasil 11. Doutor, Professor do Programa de Pós-Graduação stricto sensu do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 12. Doutor, Médico Atendente do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (HCFMRP-USP), Ribeirão Preto, SP, Brasil 13. Doutor, Professor Associado do Departamento de Medicina e Apoio Diagnóstico da Universidade Federal da Bahia (UFBA), Salvador, BA, Brasil Endereço para correspondência: Dr. Vinícius Valério Silveira de Souza Rua José do Patrocínio, 111, ap. 12, Cidade Baixa Porto Alegre, RS, Brasil, 90050-001 E-mail: viniciusvss@gmail.com Recebido para publicação em 11 de março de 2014. Aceito, após revisão, em 28 de julho de 2014. Trabalho realizado na Irmandade Santa Casa de Misericórdia de Porto Alegre, Porto Alegre, RS, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554