Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 48 nº 6 - Nov. / Dez. of 2015
Vol. 48 nº 6 - Nov. / Dez. of 2015
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Rafael Dahmer Rocha1; André Ricardo Girardi2; Renata Reis Pinto3; Viviane Aguilera Rolim de Freitas4 |
|
|
Descritores: Ultrassonografia; Punção aspirativa por agulha fina; Linfonodo axilar; Câncer de mama. |
|
|
Resumo: INTRODUÇÃO
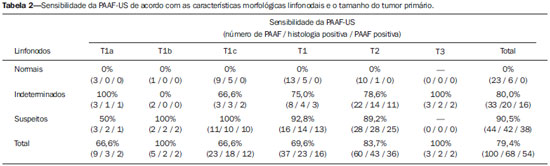
A neoplasia maligna da mama é a principal causa de morte por câncer em mulheres no mundo. O advento de novas técnicas possibilitou o diagnóstico de lesões em fases precoces e tratamentos mais conservadores. Atualmente, o diagnóstico histopatológico do câncer de mama é realizado de forma minimamente invasiva, sempre que possível por meio de biópsias percutâneas guiadas por imagem(1). A avaliação do estadiamento linfonodal axilar, por sua vez, constitui um dos indicadores prognósticos mais relevantes em pacientes com câncer de mama(2-8), visto que a axila é receptora de aproximadamente 95% da drenagem linfática mamária(9,10). Por conseguinte, o esvaziamento axilar vem sendo considerado, há muitos anos, o método "padrão ouro" no diagnóstico e tratamento das metástases linfonodais. Nas últimas décadas, outros procedimentos têm sido empregados na predição da positividade linfonodal axilar, como, por exemplo, a biópsia do linfonodo sentinela e a punção aspirativa por agulha fina guiada por ultrassonografia (PAAF-US). Primeiramente praticada por Krag et al.(11) em 1993, a técnica de biópsia do linfonodo sentinela mostrou-se equivalente ao esvaziamento axilar, com expressiva redução dos índices de morbidade(12). A linfadenectomia sentinela, embora esteja associada a uma menor morbidade do que o esvaziamento axilar, é um procedimento igualmente invasivo, moroso e com possíveis complicações. Por outro lado, a PAAF-US surge como uma opção de rápida execução, com índices muito baixos de complicações. Em casos de pacientes com resultados positivos na PAAF-US, a biópsia do linfonodo sentinela pode ser omitida e a paciente pode ser encaminhada diretamente para esvaziamento axilar ou, ainda, para quimioterapia (QT) neoadjuvante(4,7,13,14). Apesar das potenciais vantagens da PAAF-US sobre a linfadenectomia sentinela, algumas instituições não têm adotado a PAAF-US de forma rotineira para o estadiamento axilar inicial em câncer de mama(4). Alguns autores a recomendam apenas em tumores primários maiores que 1,0 cm. A justificativa alegada é que os sinais de comprometimento linfonodal axilar em tumores primários de mama invasivos de tamanhos inferiores a 1,0 cm seriam menos definidos(15,16). O objetivo do presente estudo é propor um algoritmo de quando a PAAF-US deve ser utilizada no estadiamento linfonodal axilar pré-operatório em pacientes com câncer de mama invasivo. MATERIAIS E MÉTODOS Desenho do estudo Após aprovação do Comitê de Ética, o estudo foi conduzido no Serviço de Radiologia Mamária do Hospital do Câncer III - Instituto Nacional de Câncer (INCA). Participaram da amostra pacientes do sexo feminino portadoras de câncer de mama invasivo confirmado por exame histopatológico - seja mediante biópsia percutânea a vácuo, por agulha grossa ou por biópsia cirúrgica - e que foram direcionadas para estadiamento axilar por meio de PAAF-US. Foram incluídas somente pacientes candidatas a linfadenectomia sentinela, as quais apresentavam estadiamento tumoral (classificação de TNM)(17) até T3 e axilas clinicamente negativas. As pacientes foram encaminhadas por médicos mastologistas e radiologistas da referida instituição, nas situações em que havia dúvida de comprometimento linfonodal no exame clínico (linfonodos aumentados, mas não aderidos), ou então, presença de alteração morfológica linfonodal suspeita em algum exame de imagem - mamografia, US ou ressonância magnética. Os seguintes critérios foram utilizados para exclusão da amostra: tumores multifocais ou multicêntricos; pacientes com antecedentes de tratamento cirúrgico, quimioterápico ou radioterápico para o respectivo câncer; pacientes que não foram submetidas a avaliação axilar cirúrgica posteriormente (linfadenectomia sentinela ou esvaziamento axilar); e pacientes cuja análise citopatológica sugeriu metástase linfonodal de subtipo histopatológico diferente do mamário. No período de janeiro de 2011 a agosto de 2013, foram selecionadas, prospectivamente, as 100 primeiras pacientes que preencheram os critérios supramencionados. Todas as pacientes foram submetidas à avaliação ultrassonográfica da axila ipsilateral ao câncer, com caracterização morfológica dos linfonodos e realização da PAAF em um mesmo momento. Os resultados citopatológicos foram comparados aos dos histopatológicos, obtidos por avaliação da linfadenectomia sentinela ou do esvaziamento axilar, considerados como "padrão ouro". As pacientes com resultados citopatológicos negativos ou insuficientes submeteram-se, primeiramente, à linfadenectomia sentinela, por meio de injeção peripapilar de radiofármaco. As pacientes com citopatologia positiva prosseguiram diretamente para o esvaziamento axilar ou QT neoadjuvante. As análises citopatológicas foram realizadas por três médicos patologistas com ao menos cinco anos de experiência. Seleção e caracterização do linfonodo à US As PAAF-USs foram realizadas por dois dos autores (R.D.R. e R.R.P) com ao menos dois anos de experiência neste procedimento. Utilizando-se transdutor linear de alta frequência (11 MHz) e aparelho GE Logic E9®, procurou-se identificar os linfonodos com alterações morfológicas, e assim o aspirado era obtido de apenas um deles, de acordo com os seguintes critérios decrescentes de suspeição: a) linfonodo com hilo ausente; b) linfonodo com espessamento cortical > 3 mm e hilo excêntrico (periférico); c) linfonodo com qualquer área de espessamento cortical > 3 mm e hilo central. A espessura do córtex linfonodal era sempre mensurada em sua porção mais espessa. Os linfonodos "a" e "b" foram categorizados como suspeitos, enquanto os linfonodos "c" foram categorizados como indeterminados. Na ausência das alteração morfológicas supracitadas, a PAAF-US era realizada do linfonodo morfologicamente normal identificado ao nível axilar mais inferior. Nas Figuras 1 e 2 exemplificam-se alguns linfonodos de cada categoria da classificação morfológica ultrassonográfica utilizada. 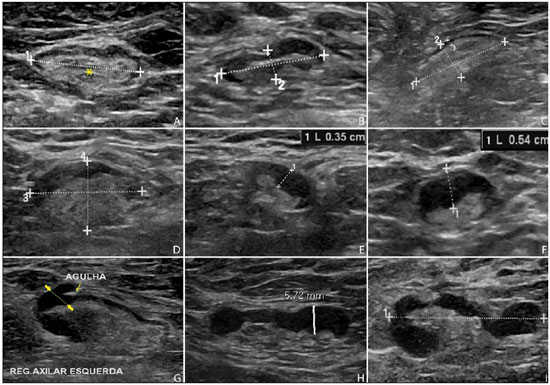 Figura 1. Cortes ultrassonográficos demonstrando alguns linfonodos classificados morfologicamente como normais (A–C) e indeterminados (D–I). Linfonodos normais apresentam, caracteristicamente, hilo gorduroso central (asterisco) e espessura cortical < 3 mm difusamente. Os linfonodos indeterminados apresentam hilo central, porém alguma área com espessura cortical > 3 mm (entre setas). Os linfonodos A–C tiveram resultados histopatológicos negativos, enquanto os linfonodos D–I foram positivos. 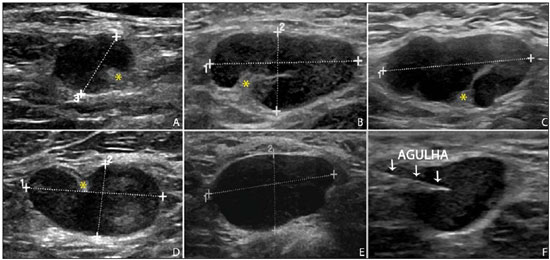 Figura 2. Cortes ultrassonográficos demonstrando alguns linfonodos classificados morfologicamente como suspeitos. Os linfonodos A–D apresentam espessamento cortical acentuado, determinando substituição e marginalização do hilo gorduroso (asteriscos). Em casos mais avançados alguns linfonodos podem apresentar ausência total de seu hilo (E,F). Procedimento da PAAF Inicialmente, explicava-se à paciente o motivo e a técnica do procedimento, os riscos e benefícios, a existência de técnicas opcionais, e então era obtido o consentimento informado. Prosseguia-se com a antissepsia da região axilar e anestesia da pele com cerca de 3 mL de lidocaína a 2%. A punção era realizada com agulha de 21-gauge conectada a uma seringa de 10 mL. Para a obtenção do material citológico, movia-se a agulha em várias direções (em leque), mantendo um vácuo que era desfeito antes da remoção da agulha. Nos linfonodos com espessamento cortical focal buscou-se fazer o aspirado, preferencialmente, da região alterada (Figura 1G). Uma imagem ultrassonográfica era adquirida mostrando a ponta da agulha dentro do alvo (Figura 2F). Obtinham-se aspirados suficientes para confeccionar duas lâminas, as quais eram fixadas com etanol 95,6%, sendo posteriormente encaminhadas para análise citológica. Análises estatísticas Para os procedimentos de PAAF-US, assim como para a US axilar isolada, foram calculadas as taxas de sensibilidade, especificidade, valor preditivo positivo, valor preditivo negativo e acurácia. Avaliaram-se, ainda, as sensibilidades da PAAF-US de acordo com a morfologia linfonodal à US axilar e com o tamanho do tumor primário (estádio T). Os fatores associados ao comprometimento linfonodal axilar e ao aumento da sensibilidade da PAAF-US também foram estimados. Finalmente, foi estabelecida a porcentagem de linfadenectomias sentinelas evitadas nas pacientes da amostra. O programa utilizado para tais análises foi o Epi Info 7®. Na estimativa das variáveis de risco associadas a positividade linfonodal axilar e sensibilidade da PAAF-US, os seguintes fatores foram considerados para análise de regressão logística univariada: idade; hilo ausente ou excêntrico; espessamento cortical > 3 mm; estádio > T2; diâmetro longitudinal > 2,0 cm; diâmetro transverso > 1,0 cm; relação diâmetro longitudinal/transverso < 1,5; positividade do receptor de estrogênio; positividade do receptor de progesterona; positividade do receptor Her-2. Em seguida, apenas as variáveis com valores de p < 0,1 foram incluídas na análise multivariada. A estimativa de risco das variáveis foi expressa em odds ratio (OR), com intervalo de confiança de 95% (IC 95%). O valor de p < 0,05 foi considerado como estatisticamente significante. RESULTADOS Os dados demográficos e as características tumorais da amostra estão explanados na Tabela 1. A idade média das pacientes foi 53,7 anos (intervalo de 27 a 86). O carcinoma ductal foi o tipo histológico mais prevalente, identificado em 80% dos casos. A medida tumoral mais frequente, estabelecida por revisão das imagens mamográficas ou aferição ultrassonográfica no mesmo tempo da PAAF-US, foi entre 2,0 e 5,0 cm (estádio T2). Somente 3% das pacientes apresentaram tumores maiores que 5,0 cm (T3). Excluídas as pacientes que foram submetidas a QT neoadjuvante, a média de tempo entre a PAAF-US e a cirurgia foi 65 dias (intervalo de 18 a 185).  Desempenho da PAAF-US e sua correlação com as características morfológicas dos linfonodos e tamanho do tumor primário A positividade tumoral histopatológica dos linfonodos da amostra foi 68%. Em 18 casos (29% das axilas comprometidas) havia apenas 1 linfonodo com resultado positivo no esvaziamento axilar. O fluxograma das pacientes submetidas à PAAF-US está representado na Figura 3. 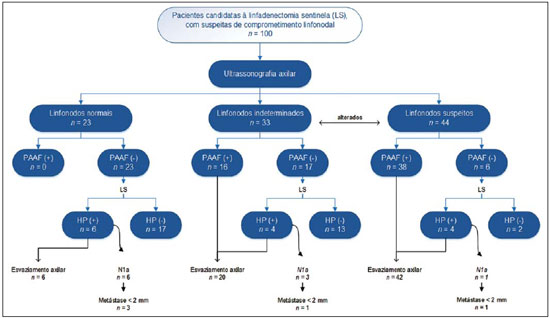 Figura 3. Fluxograma das pacientes submetidas à ultrassonografia axilar e punção aspirativa por agulha fina (PAAF) linfonodal, de acordo com sua caracterização morfológica e correlação com resultado histopatológico (HP). Os resultados da PAAF-US foram considerados positivos em 54 pacientes (54%), negativos em 38 (38%) e insuficientes em 8 (8%). Para fins estatísticos, as amostras insuficientes foram agrupadas às negativas, visto que não evitaram a abordagem da linfadenectomia sentinela. A sensibilidade total da PAAF-US na amostra foi estabelecida em 79,4% (54/68). A sensibilidade da PAAF-US para linfonodos considerados normais foi 0% (0/6), ao passo que para os indeterminados foi 80% (16/20) e para os suspeitos foi 90,5% (38/42). Na Tabela 2 pode-se observar a sensibilidade da PAAF-US de acordo com as características morfológicas linfonodais e o tamanho do tumor primário (estádio T da classificação TNM). Quando considerados os linfonodos indeterminados e suspeitos em um mesmo grupo ("alterados"), a sensibilidade da PAAF-US foi calculada em 87,1% (54/62). Não foi identificado nenhum resultado falso-positivo da PAAF-US, caracterizando a taxa de especificidade e o valor preditivo positivo em 100%. Por outro lado, a PAAFUS demonstrou 14 resultados falso-negativos, determinando um valor preditivo negativo de 69,5%. Destes, 10 pacientes (71,4%) apresentavam apenas de 1 a 3 linfonodos comprometidos (estadiamento linfonodal N1a). Pôde-se observar, ainda, que em 5 casos (35,7%) houve unicamente micrometástases linfonodais (< 2 mm). A acurácia da PAAF-US foi avaliada em 86%. A QT neoadjuvante foi instituída em 14 (25,9%) das 54 pacientes com resultados citopatológicos positivos. Não foi realizada nenhuma QT neoadjuvante em pacientes com PAAF negativa. Dez pacientes (71,4%) tiveram laudos histopatológicos relatando linfonodos com sinais de resposta à QT (fibrose, esclerose, hialinização, infiltrado linfoplasmocitário), dos quais 6 (42,8%) foram considerados como resposta completa, ou seja, sem evidência de comprometimento tumoral. Observou-se também que a QT neoadjuvante foi eficiente em regredir o estadiamento tumoral (T) em 64,2% dos casos (9/14), com duas respostas completas. Todos os 6 casos com resposta linfonodal completa à QT neoadjuvante apresentaram ótima resposta na lesão primária. Os valores da sensibilidade da PAAF-US em tumores com estadiamento T1, T2 e T3 foram 69,6%, 83,7% e 100%, respectivamente. Fatores associados a malignidade e aumento da sensibilidade da PAAF-US Na regressão logística e análise multivariada, os subsequentes fatores de risco estiveram associados ao comprometimento linfonodal: presença de espessamento cortical > 3 mm (OR = 3,9; IC 95%: 1,13-13,3; p = 0,03); hilo ausente ou excêntrico (OR = 9,23; IC 95%: 1,76-48,3; p = 0,008). O diâmetro transverso > 1,0 cm foi o único fator associado a um aumento da sensibilidade da PAAF-US na amostra (OR = 5,68; IC 95%: 1,08-29,8; p = 0,04). US axilar isolada A sensibilidade da US axilar isolada foi 91,2% (62/68), apresentando valor preditivo positivo de 80,5% (62/77). A especificidade foi 53,1% (17/32) e o valor preditivo negativo foi 73,9% (17/23). A acurácia da US axilar isolada foi avaliada em 79% (79/100). Linfonodos sentinelas evitados A realização da PAAF-US conseguiu evitar a biópsia do linfonodo sentinela em 54% das pacientes da amostra. Ao serem analisadas apenas as punções aspirativas de pacientes com linfonodos alterados (suspeitos ou indeterminados), possibilitou-se evitar a avaliação dos linfonodos sentinelas em 70,1% das vezes (54/77). DISCUSSÃO A literatura radiológica brasileira vem, recentemente, mostrando interesse na avaliação ultrassonográfica dos linfonodos axilares(18), bem como em estabelecer se o método da PAAF é eficaz em predizer o acometimento linfonodal em pacientes com câncer de mama(19). Embora a utilização da US axilar associada à PAAF seja capaz de evitar grande parcela das biópsias de linfonodos sentinelas, ainda não há consenso de quando ela deve ser indicada. Entre os principais questionamentos sobre o tema destaca-se a dificuldade em se definir se a US axilar deve ser realizada em todas as pacientes com tumor mamário invasivo ou se há um tamanho tumoral mínimo para sua recomendação. Muitos autores apoiam a utilização da US axilar para todas as pacientes com câncer de mama, independentemente do tamanho tumoral(4,20-23). Por outro lado, Mainiero et al.(13) e de Kanter et al.(24) recomendam a US axilar apenas para tumores maiores que 1,0 cm. O presente estudo mostrou que a sensibilidade da PAAFUS aumentou de forma diretamente proporcional ao tamanho do tumor primário, em concordância com o demonstrado por Koelliker et al.(4), Mainiero et al.(13) e Somasundar et al.(16). A taxa de positividade linfonodal encontrada em pacientes com tumores estádio T1 (< 2,0 cm) foi 62,1%, enquanto para os subgrupos T1a e T1b (< 1,0 cm) foi 35,7%. Observou-se também que 71,5% das pacientes com tumores menores que 1,0 cm apresentavam linfonodos morfologicamente alterados, sendo a sensibilidade da PAAF-US calculada em 80% neste subgrupo. Ainda que apenas 10-30% das pacientes com tumores menores que 2,0 cm apresentem envolvimento axilar(25-27), os resultados acima constatados sugerem que os fatores mais importantes para a predição de malignidade e positividade da PAAF-US são as alterações morfológicas linfonodais, independentemente do tamanho do tumor primário. É necessário um estudo de amostragem maior nesta população (estádio T1), uma vez que vem sendo discutida a necessidade de esvaziamento axilar em pacientes com carcinoma invasivo mesmo quando a linfadenectomia sentinela é positiva neste subgrupo específico(28). Outra indagação envolve se a PAAF-US deve ser feita em todos os linfonodos, invariavelmente se apresentarem alterações morfológicas ou não. Alguns autores recomendam a utilização da PAAF-US de forma rotineira na abordagem inicial(20,29). No presente estudo não se obteve nenhum resultado de PAAF-US positiva em linfonodos morfologicamente normais. Constatou-se, ainda, que em 6 dos 14 resultados falso-negativos não havia nenhum linfonodo morfologicamente alterado na US. Encontraram-se, unicamente, micrometástases linfonodais em 35,7% dos casos falso-negativos, taxa semelhante à de outros estudos(4,7,10,20,30). Ao se avaliar os possíveis preditores de malignidade, constatou-se que os achados ultrassonográficos demonstrando espessamento cortical maior que 3 mm (especialmente > 6 mm) e alteração no hilo gorduroso apresentaram forte associação com malignidade, em concordância com outros trabalhos(4,21,31). Segundo Deurloo et al.(21) e Mainiero(32), o espessamento cortical focal maior que 3 mm é o melhor indicador de malignidade. A ausência de hilo gorduroso parece ser o fator preditivo mais específico para malignidade, embora seja um achado tardio(4,32). Na presente amostra, em 23 casos de linfonodos com hilo ausente, apenas 1 mostrou-se negativo na histologia (valor preditivo positivo de 95,6%), o qual sugeriu o diagnóstico de histoplasmose. Outros fatores preditivos de malignidade já foram descritos por alguns autores, como a hipoecogenicidade do córtex e a ausência de fluxo central no linfonodo com a utilização do Doppler(4), fatores estes não avaliados no presente estudo. A lobulação ou assimetria hipoecogênica do córtex, mesmo quando menor que 3 mm, também já foi citada como sinal precoce de malignidade(13,33), ainda que não tenha sido identificada em nenhum dos 100 casos do estudo. Por outro lado, o tamanho linfonodal também não tem provado ser um critério útil para distinguir linfonodos normais dos anormais(4,7,9,24,33). Entretanto, a avaliação preliminar deste estudo mostrou que o diâmetro transverso linfonodal > 1 cm foi o único fator que apontou aumentar a sensibilidade da PAAF-US. Provavelmente, estes resultados refletem o fato de que em linfonodos comprometidos de menores tamanhos houve maior dificuldade em se realizar a PAAF-US da região alterada, ou então, as alterações eram tão precoces que não determinavam distorção da morfologia tumoral. Uma limitação do presente estudo foi a forma de seleção das pacientes submetidas à PAAF-US, visto que foram incluídas apenas as com alguma suspeita clínica ou radiológica de comprometimento axilar. A forma adotada de seleção das pacientes pode ter sido responsável pelas altas taxas de prevalência de malignidade tumoral axilar (68%). Apesar disso, não acreditamos que a inclusão de pacientes sem suspeita clínica ou radiológica possa alterar a sensibilidade da PAAF-US, uma vez que o presente estudo sugere que apenas linfonodos alterados devem ser submetidos a avaliação citopatológica. CONCLUSÃO A decisão sobre quais pacientes devem realizar US axilar ainda permanece indefinida. As alterações morfológicas linfonodais são um dos principais fatores preditores de malignidade, sendo a US o método preferível para sua avaliação, em virtude do baixo custo, fácil acessibilidade e boa reprodutibilidade. Diante dos resultados encontrados, propõe-se que a US axilar deve estar inclusa no estadiamento pré-operatório de todas as pacientes com câncer de mama invasivo e que sejam candidatas a biópsia do linfonodo sentinela, independentemente do tamanho tumoral e da avaliação clínica da axila. Dessa forma, possibilita-se otimizar a detecção de envolvimento axilar tumoral. Para maximizar a positividade da PAAF-US, aconselha-se realizá-la somente nas pacientes com linfonodos morfologicamente alterados. A Figura 4 mostra um algoritmo recomendado pelos autores deste estudo. Os resultados confirmam que a adição da PAAF à US em um mesmo tempo pode evitar mais de 50% das linfadenectomias sentinelas, com mínima incidência de complicações e, muito provavelmente, redução importante no custo e no intervalo de tempo até a adoção da terapêutica definitiva. 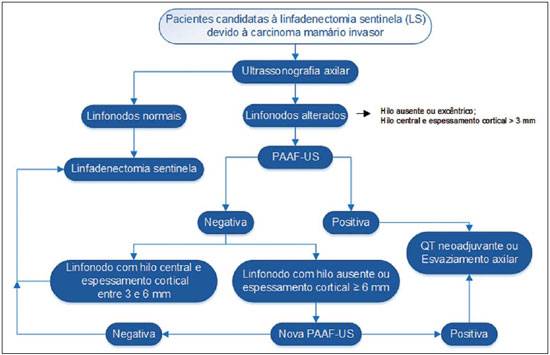 Figura 4. Algoritmo para a utilização da ultrassonografia axilar e da punção aspirativa por agulha fina (PAAF-US) na avaliação pré-operatória de pacientes com câncer de mama invasivo. REFERÊNCIAS 1. Rocha RD, Pinto RR, Tavares DPBA, et al. Step-by-step of ultrasound-guided core-needle biopsy of the breast: review and technique. Radiol Bras. 2013;46:234-41. 2. Purushotham AD, Upponi S, Klevesath MB, et al. Morbidity after sentinel lymph node biopsy in primary breast cancer: results from a randomized controlled trial. J Clin Oncol. 2005;23:4312-21. 3. Cox CE, Salud CJ, Cantor A, et al. Learning curves for breast cancer sentinel lymph node mapping based on surgical volume analysis. J Am Coll Surg. 2001;193:593-600. 4. Koelliker SL, Chung MA, Mainiero MB, et al. Axillary lymph nodes: US-guided fine-needle aspiration for initial staging of breast cancer - correlation with primary tumor size. Radiology. 2008;246:81-9. 5. Alvarez S, Añorbe E, Alcorta P, et al. Role of sonography in the diagnosis of axillary lymph node metastases in breast cancer: a systematic review. AJR Am J Roentgenol. 2006;186:1342-8. 6. Moore A, Hester M, Nam MW, et al. Distinct lymph nodal sonographic characteristics in breast cancer patients at high risk for axillary metastases correlate with the final axillary stage. Br J Radiol. 2008;81:630-6. 7. Krishnamurthy S, Sneige N, Bedi DG, et al. Role of ultrasound-guided fine-needle aspiration of indeterminate and suspicious axillary lymph nodes in the initial staging of breast carcinoma. Cancer. 2002;95:982-8. 8. Holwitt DM, Swatske ME, Gillanders WE, et al. Scientific Presentation Award: The combination of axillary ultrasound and ultrasound-guided biopsy is an accurate predictor of axillary stage in clinically node-negative breast cancer patients. Am J Surg. 2008; 196:477-82. 9. Jung J, Park H, Park J, et al. Accuracy of preoperative ultrasound and ultrasound-guided fine needle aspiration cytology for axillary staging in breast cancer. ANZ J Surg. 2010;80:271-5. 10. Gilissen F, Oostenbroek R, Storm R, et al. Prevention of futile sentinel node procedures in breast cancer: ultrasonography of the axilla and fine-needle aspiration are obligatory. Eur J Surg Oncol. 2008;34:497-500. 11. Krag DN, Weaver DL, Alex JC, et al. Surgical resection and radio-localization of the sentinel lymph node in breast cancer using a gamma probe. Surg Oncol. 1993;2:335-9. 12. Giuliano AE, Han SH. Local and regional control in breast cancer: role of sentinel node biopsy. Adv Surg. 2011;45:101-16. 13. Mainiero MB, Cinelli CM, Koelliker SL, et al. Axillary ultrasound and fine-needle aspiration in the preoperative evaluation of the breast cancer patient: an algorithm based on tumor size and lymph node appearance. AJR Am J Roentgenol. 2010;195:1261-7. 14. Park SH, Kim MJ, Park BW, et al. Impact of preoperative ultrasonography and fine-needle aspiration of axillary lymph nodes on surgical management of primary breast cancer. Ann Surg Oncol. 2001;18:738-44. 15. Oruwari JU, Chung MA, Koelliker S, et al. Axillary staging using ultrasound-guided fine needle aspiration biopsy in locally advanced breast cancer. Am J Surg. 2002;184:307-9. 16. Somasundar P, Gass J, Steinhoff M, et al. Role of ultrasound-guided axillary fine-needle aspiration in the management of invasive breast cancer. Am J Surg. 2006;192:458-61. 17. Singletary SE, Connolly JL. Breast cancer staging: working with the sixth edition of the AJCC Cancer Staging Manual. CA Cancer J Clin. 2006;56:37-47. 18. Pinheiro DJPC, Elias S, Nazário ACP. Axillary lymph nodes in breast cancer patients: sonographic evaluation. Radiol Bras. 2014;47: 240-4. 19. Pessoa EC, Rodrigues JRP, Pessoa CPKC, et al. Punção aspirativa de linfonodo axilar guiada pela ultrassonografia é eficaz como método de predição de acometimento linfonodal em pacientes com câncer de mama? Rev Bras Ginecol Obstet. 2014;36:118-23. 20. Kuenen-Boumeester V, Menke-Pluymers M, de Kanter AY, et al. Ultrasound-guided fine needle aspiration cytology of axillary lymph nodes in breast cancer patients. A preoperative staging procedure. Eur J Cancer. 2003;39:170-4. 21. Deurloo EE, Tanis PJ, Gilhuijs KG, et al. Reduction in the number of sentinel lymph node procedures by preoperative ultrasonography of the axilla in breast cancer. Eur J Cancer. 2003;39:1068-73. 22. van Rijk MC, Deurloo EE, Nieweg OE, et al. Ultrasonography and fine-needle aspiration cytology can spare breast cancer patients unnecessary sentinel lymph node biopsy. Ann Surg Oncol. 2006;13: 31-5. 23. Sapino A, Cassoni P, Zanon E, et al. Ultrasonographically-guided fine-needle aspiration of axillary lymph nodes: role in breast cancer management. Br J Cancer. 2003;88:702-6. 24. de Kanter AY, van Eijck CH, van Geel AN, et al. Multicentre study of ultrasonographically guided axillary node biopsy in patients with breast cancer. Br J Surg. 1999;86:1459-62. 25. Specht MC, Fey JV, Borgen PI, et al. Is the clinically positive axilla in breast cancer really a contraindication to sentinel lymph node biopsy? J Am Coll Surg. 2005;200:10-4. 26. Vidal-Sicart S, Valdés Olmos R. Sentinel node mapping for breast cancer: current situation. J Oncol. 2012;2012:361341. 27. Bojic T, Djordjevic N, Karanikolic A, et al. Assessment of axillary lymph nodes involvement in patients with breast cancer depending on the tumor size and its histological and nuclear grades. Vojnosanit Pregl. 2012;69:414-9. 28. Giuliano AE, McCall L, Beitsch P, et al. Locoregional recurrence after sentinel lymph node dissection with or without axillary dissection in patients with sentinel lymph node metastases: the American College of Surgeons Oncology Group Z0011 randomized trial. Ann Surg. 2010;252:426-33. 29. Jain A, Haisfield-Wolfe ME, Lange J, et al. The role of ultrasound-guided fine-needle aspiration of axillary lymph nodes in the staging of breast cancer. Ann Surg Oncol. 2008;15:462-71. 30. Altomare V, Guerriero G, Carino R, et al. Axillary lymph node echo-guided fine-needle aspiration cytology enables breast cancer patients to avoid a sentinel lymph node biopsy. Preliminary experience and a review of the literature. Surg Today. 2007;37:735-9. 31. Choi YJ, Ko EY, Han BK, et al. High-resolution ultrasonographic features of axillary lymph node metastasis in patients with breast cancer. Breast. 2009;18:119-22. 32. Mainiero MB. Regional lymph node staging in breast cancer: the increasing role of imaging and ultrasound-guided axillary lymph node fine needle aspiration. Radiol Clin North Am. 2010;48:989-97. 33. Krishnamurthy S. Current applications and future prospects of fine-needle aspiration biopsy of locoregional lymph nodes in the management of breast cancer. Cancer. 2009;117:451-62. 1. Médico Radiologista, Aprimorando em Radiologia Intervencionista no Hospital Israelita Albert Einstein, São Paulo, SP, Brasil 2. Médico Radiologista, Aperfeiçoando em Radiologia Geral na Med Imagem - Real e Benemérita Sociedade Portuguesa de Beneficência, São Paulo, SP, Brasil 3. Médica Mastologista do Hospital do Câncer III - Instituto Nacional de Câncer/ Ministério da Saúde (INCA/MS), Rio de Janeiro, RJ, Brasil 4. Médica Radiologista do Hospital do Câncer III - Instituto Nacional de Câncer/ Ministério da Saúde (INCA/MS), Rio de Janeiro, RJ, Brasil Endereço para correspondência: Dr. Rafael Dahmer Rocha Rua Nelson Gama de Oliveira, 739, ap. 62A, Vila Andrade São Paulo, SP, Brasil, 05734-150 E-mail: rafaeldrocha@gmail.com Recebido para publicação em 17/11/2014. Aceito, após revisão, em 23/4/2015. Trabalho realizado no Instituto Nacional de Câncer (INCA), Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554