Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 48 nº 4 - Jul. / Ago. of 2015
Vol. 48 nº 4 - Jul. / Ago. of 2015
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Flávia Angélica Ferreira Francisco1; Rosana Souza Rodrigues2; Miriam Menna Barreto3; Dante Luiz Escuissato4; Cesar Augusto Araujo Neto5; Jorge Luiz Pereira e Silva5; Claudio S. Silva6; Bruno Hochhegger7; Arthur Soares Souza Jr.8; Gláucia Zanetti9; Edson Marchiori10 |
|
|
Descritores: Microlitíase alveolar pulmonar; Tomografia computadorizada de alta resolução; Calcificações pulmonares. |
|
|
Resumo: INTRODUÇÃO
Microlitíase alveolar pulmonar (MAP) é uma doença autossômica recessiva rara caracterizada pelo acúmulo intra-alveolar de concreções esféricas calcificadas (chamadas de calciferitos, calcosferitos ou microlitos), na ausência de qualquer doença conhecida do metabolismo do cálcio. A maioria dos pacientes é assintomática no momento do diagnóstico e a doença é geralmente detectada incidentalmente durante exames de rotina, embora o diagnóstico possa ser feito durante a investigação da história familiar de um indivíduo com MAP(1,2). A MAP é descrita em pacientes de diferentes faixas etárias e possui curso longo e progressivo, que pode resultar na deterioração da função pulmonar(2). Os indivíduos afetados geralmente tornam-se sintomáticos na terceira ou quarta décadas de vida. A doença pode ocorrer de forma esporádica ou familiar, sendo que cerca de 33% dos casos são hereditários, com padrão de herança autossômica recessiva(1,2). A patogenia da MAP tem sido atribuída à mutação no gene que codifica o co-transportador sódio-fosfato do tipo IIb (SLC34A2), envolvido na homeostase de fosfato em vários órgãos, incluindo os pulmões, o que induz ao acúmulo de fosfato em excesso, favorecendo a formação de microlitos(3). Devido à marcada dissociação entre os aspectos radiológicos e a apresentação clínica da MAP, o diagnóstico é às vezes realizado com base apenas nos achados radiológicos(1). A tomografia computadorizada de alta resolução (TCAR) tem grande importância no diagnóstico de pacientes com suspeita de MAP, uma vez que os achados neste método são tão característicos, que mais investigações diagnósticas, como exames histopatológicos, são geralmente desnecessárias, especialmente em pacientes cujas famílias apresentam outro membro com a doença(1). O objetivo deste trabalho foi analisar, por meio das TCARs de 13 pacientes com MAP, os achados tomográficos mais frequentes e sua distribuição no parênquima pulmonar. MATERIAIS E MÉTODOS Foi realizado estudo descritivo e retrospectivo das TCARs de tórax de 13 pacientes com MAP reunidos aleatoriamente por meio de contatos pessoais com radiologistas de dez diferentes instituições em sete Estados brasileiros e uma instituição do Chile, no período de 2007 a 2014. Desses pacientes, 9 eram do sexo feminino (69,2%) e 4 do sexo masculino (30,8%), com idades variando de 9 a 59 anos (média de 34,5 anos) e mediana de 31 anos. O estudo foi avaliado e aprovado pelo Comitê de Ética e Pesquisa do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro. O diagnóstico foi feito a partir de TCARs do tórax com base na observação de padrões típicos da doença. Contudo, 6 pacientes foram também submetidos a biópsia pulmonar, o que permitiu confirmação histopatológica nestes casos. As tomografias de tórax, em função das múltiplas instituições envolvidas, foram realizadas em diferentes tomógrafos, sendo que em todos os casos foi utilizada a técnica de alta resolução, com cortes desde os ápices até as bases pulmonares. Foram feitos cortes axiais finos, de 1 a 2 mm de espessura, com o paciente em decúbito dorsal, em inspiração, utilizando-se filtro de alta resolução espacial para reconstrução das imagens, com incremento de 10 mm, sem a administração intravenosa de meio de contraste iodado. As imagens foram obtidas e reconstruídas em matriz de 512 × 512, digitalizadas e fotografadas para avaliação dos campos pulmonares com aberturas de janela variando de 1.000 a 1.500 unidades Hounsfield (UH) e nível entre -650 e -750 UH. Para a avaliação do mediastino, a largura das janelas variou de 350 a 400 UH, e de centro entre 40 e 60 UH. A análise das TCARs foi realizada por dois experientes radiologistas torácicos, de forma independente, e os resultados discordantes foram resolvidos por consenso. As seguintes características tomográficas foram analisadas: opacidades em vidro fosco, calcificações lineares subpleurais, pequenos nódulos parenquimatosos, calcificação ao longo dos septos interlobulares, pequenos nódulos subpleurais, fissuras nodulares, cistos subpleurais, consolidações densas e padrão de pavimentação em mosaico. Foi também avaliada a distribuição das lesões no sentido craniocaudal (superior, médio e inferior) e no sentido axial (central, periférico, sem predomínio). O pulmão foi dividido no eixo craniocaudal em: terço superior, indo dos ápices até o nível da crossa da aorta; terço médio, indo da crossa da aorta até 2 cm abaixo da carina; e terço inferior, indo de 2 cm abaixo da carina até os seios costofrênicos. As lesões foram definidas como centrais, se predominavam no terço interno dos pulmões, e periféricas, se predominavam no terço externo, ou ainda sem predomínio, quando as duas localizações ocorreram simultaneamente. Opacidade em vidro fosco foi definida como aumento da atenuação pulmonar, com preservação das margens brônquicas e vasculares. Calcificações lineares subpleurais foram assim descritas nos pacientes com opacidades lineares contínuas, calcificadas, justapleurais, visíveis na janela de mediastino. Pequenos nódulos parenquimatosos foram caracterizados como opacidades focais redondas com menos de 10 mm de diâmetro. Calcificação ao longo dos septos interlobulares foi caracterizada quando opacidades lineares finas calcificadas, desenhando a periferia do lóbulo pulmonar secundário, foram visualizadas nas janelas para mediastino. Pequenos nódulos subpleurais foram designados como pequenos nódulos ao longo da superfície pleural, e fissuras nodulares, como pequenos nódulos distribuídos ao longo das fissuras pulmonares. Consolidações foram definidas como sendo um aumento homogêneo no coeficiente de atenuação do parênquima pulmonar, levando à perda da individualização das estruturas vasculares e da parede das vias respiratórias. As consolidações foram designadas como densas quando apresentavam densidade maior do que os tecidos moles, quando avaliada na janela de mediastino. O padrão de pavimentação em mosaico foi definido como superposição de opacidades em vidro fosco e espessamento dos septos interlobulares. Cistos subpleurais foram definidos como estruturas redondas hipodensas, com diâmetro inferior a 10 mm, alinhadas ao lado da pleura. Os critérios de definição destes achados foram os relatados no Glossário de Termos da Sociedade Fleischner(4) e a terminologia utilizada é a apresentada nos consensos de terminologia do Colégio Brasileiro de Radiologia(5) e da Comissão de Imagem da Sociedade Brasileira de Pneumologia e Tisiologia(6,7). RESULTADOS Os achados tomográficos observados, em ordem decrescente de frequência, foram: opacidades em vidro fosco (n = 13; 100%) (Figura 1), pequenos nódulos parenquimatosos (n = 13; 100%), pequenos nódulos subpleurais (n = 12; 92,3%), cistos subpleurais (n = 11; 84,6%) (Figura 2), calcificações lineares subpleurais (n = 9; 69,2%) (Figura 3), padrão de pavimentação em mosaico (n = 9; 69,2%), fissura nodular (n = 7; 53,8%), calcificação ao longo dos septos interlobulares (n = 6; 46,2%) e consolidações densas (n = 6; 46,2%). Nestes 6 casos de consolidações densas foram identificados broncogramas aéreos de permeio (Figura 4). Quanto à distribuição dos achados, houve acometimento preferencial dos terços inferiores. Não foi observado predomínio de distribuição dos sentidos axial e anteroposterior. 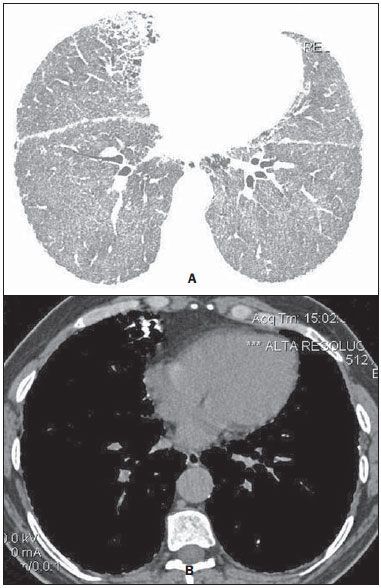 Figura 1. TCAR com janela para parênquima pulmonar (A) mostrando opacidades em vidro fosco distribuídas difusamente pelos pulmões, com consolidação no lobo médio, além de cissuras nodulares. Na janela para mediastino (B) observam-se calcificações na região da consolidação. 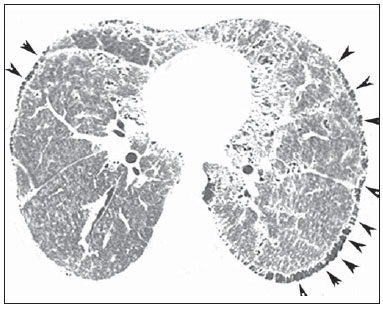 Figura 2. TCAR mostrando extensas opacidades em vidro fosco bilaterais, distribuídas difusamente. Além disso, há pequenos cistos subpleurais, mais evidentes à esquerda (cabeças de setas). 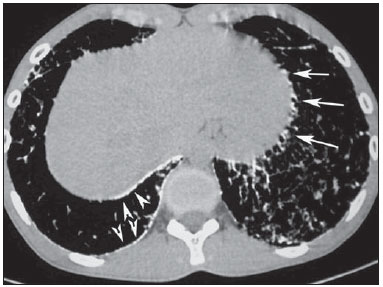 Figura 3. TCAR com janela para mediastino demonstrando pequenos nódulos calcificados de distribuição subpleural (setas) e calcificações lineares subpleurais (cabeças de setas). 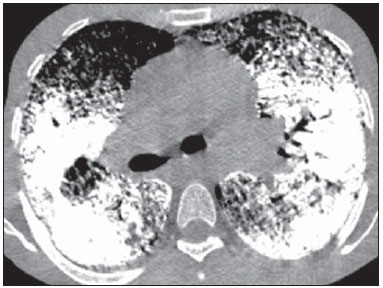 Figura 4. TCAR com janela para mediastino demonstrando extensas consolidações com densidade cálcica e broncogramas aéreos de permeio distribuídas bilateralmente pelos pulmões. DISCUSSÃO A avaliação do tórax por métodos de imagem tem sido motivo de uma série de publicações recentes na literatura radiológica nacional(8-18). Em relação à MAP, estudos que analisaram grande amostra de pacientes não observaram predominância de gênero(2). Na nossa casuística, 9 pacientes (69,2%) eram mulheres e 4 (30,8%) eram homens. Esta discordância deve-se provavelmente ao limitado número de pacientes estudados. Quanto à idade do diagnóstico da MAP, estudos mostraram que a doença já foi descrita em pacientes em diversas faixas etárias, desde crianças com meses de vida até idosos(2,19). Foi observado que 35,8% dos pacientes descritos na literatura tinham menos de 20 anos de idade e que 88,2% tinham menos de 50 anos(2). No nosso trabalho, as idades variaram de 9 a 59 anos, com média de 34,5 anos e mediana de 31 anos. Portanto, bem semelhante aos dados encontrados na literatura. É difícil estabelecer a idade de início da MAP, uma vez que a época de seu diagnóstico não reflete necessariamente o período em que a doença se iniciou. Isto porque uma importante característica desta doença é a dissociação clinicorradiológica, o que significa que há escassez de sintomas em contraste com os achados de imagem(20). Com isso, muitos casos são diagnosticados em exames de imagem realizados por outros motivos, até mesmo em pacientes assintomáticos ou, quando sintomáticos, já apresentam doença em estágios mais avançados(2,21). Os indivíduos afetados geralmente tornam-se sintomáticos na terceira ou quarta décadas de vida. Com a evolução da doença, que geralmente ocorre dentro de 10 a 20 anos, cianose e baqueteamento digital são sinais comumente detectados. O sintoma mais comum é a dispneia, seguida por tosse seca, dor torácica, hemoptise e astenia, podendo ocorrer pneumotórax(2,10,22-24). Pode ocorrer deterioração progressiva da função pulmonar nos adultos, e óbito, em geral, acontece em meados da vida adulta por insuficiência respiratória com cor pulmonale(14). Por outro lado, já foram descritos casos com evolução estática ou muito indolente(2). A MAP apresenta incidência familiar em aproximadamente um terço dos casos, visto que é uma doença de herança autossômica recessiva, o que indica a importância dos fatores genéticos na sua gênese(1). Todos os casos de MAP - tanto os de ocorrência familiar quanto os outros dois terços que apresentam a forma de aquisição esporádica - apresentam mutação no gene SLC34A2, que está envolvido na patogênese da doença(3,24,25). No exame histopatológico observam-se microlitos intraalveolares. Células inflamatórias crônicas às vezes estão presentes, podendo induzir fibrose intersticial(26). Microlitos podem ser encontrados em alguns casos no escarro ou no lavado broncoalveolar, o qual pode conter macrófagos alveolares com ou sem partículas de carbono(27). É possível confirmar o diagnóstico de MAP pelos achados na TCAR, muitas vezes dispensando a realização de biópsia(2,28-31). Em nossa casuística, o diagnóstico foi baseado nos achados radiológicos típicos na TCAR de tórax. Entretanto, 6 pacientes foram submetidos a biópsia pulmonar a céu aberto, o que possibilitou a confirmação histopatológica. A partir do diagnóstico de MAP em um determinado paciente, os familiares devem ser rastreados por radiografias de tórax e os pais devem ser informados de que futuros filhos também estão em risco de desenvolver esta doença(28). Os achados mais frequentes relatados na literatura são áreas de atenuação em vidro fosco difusas e calcificações lineares subpleurais. Outras alterações encontradas são pequenos nódulos parenquimatosos, calcificações ao longo de septos interlobulares, às vezes determinando o padrão de pavimentação em mosaico, pequenos nódulos subpleurais, fissuras nodulares, cistos subpleurais e consolidações densas(29). Opacidades em vidro fosco são um achado comum na literatura e ocorrem, provavelmente, em consequência de pequenos microlitos no espaço aéreo(29,32). Este foi um dos principais achados na nossa amostra, presentes em todos os 13 casos (100%). Pequenos nódulos parenquimatosos também foram identificados em todos os 13 pacientes (100%). Os pequenos nódulos na TCAR correspondem, geralmente, a micronódulos densos (menores que 3 mm), difusamente distribuídos pelo parênquima, tornando os pulmões hipotransparentes, caracterizando o padrão descrito por alguns autores como "tempestade de areia", que é considerado típico da doença. Na TCAR, muitas vezes é impossível definir a densidade de cálcio dos nódulos, em razão das suas pequenas dimensões. Porém, quando os microlitos confluem formando consolidação parenquimatosa, a densidade cálcica pode ser mais bem caracterizada, sendo maior do que a de partes moles(23,29). Pequenos nódulos subpleurais foram observados em 12 dos casos (92,3%) e fissura nodular em 7 pacientes (53,8%). Estas alterações representam o acúmulo de microlitos intraalveolares na periferia dos lóbulos pulmonares secundários, junto às superfícies pleurais, determinando o aspecto de calcificações pseudopleurais(33,34). Outro achado bastante referido em estudos que utilizaram a TCAR é o de cistos subpleurais. Estes pequenos cistos de paredes finas, localizados nos espaços subpleurais, podem determinar a presença de uma faixa periférica radiotransparente entre o parênquima calcificado e as costelas, o que é descrito em radiografias de tórax como o sinal da "pleura negra"(29,35). Em nossa casuística, observamos cistos subpleurais em 11 pacientes (84,6%). Calcificações lineares subpleurais foram encontradas em 9 (69,2%) dos pacientes analisados neste estudo. Este achado, apesar de comumente visto em tomografias de pacientes com MAP, é controverso na literatura. Apesar de alguns autores descreverem como calcificações pleurais, nenhuma pesquisa relatou a confirmação histopatológica de calcificação pleural. Por isso, a melhor explicação parece ser que decorram do acúmulo de microlitos intra-alveolares na periferia dos lóbulos pulmonares secundários, próximo às superfícies pleurais, e que, dessa maneira, produzem o aspecto de calcificações pseudopleurais(33,34). Calcificação ao longo dos septos interlobulares foram observadas em 6 pacientes, o que corresponde a 46,2% da amostra. Este padrão ocorre em função do acúmulo de microlitos na periferia do lóbulo pulmonar secundário, uma vez que não há confirmação histopatológica de calcificações nos septos interlobulares ou de acometimento intersticial nas fases iniciais da doença(29,36). O padrão de pavimentação em mosaico foi observado em 9 pacientes, o que representa 69,2% da nossa amostra. Este padrão é definido como áreas de atenuação em vidro fosco associadas a espessamento dos septos interlobulares. Também pode ser visto em imagens na janela de mediastino devido à presença de calcificações ao longo dos septos interlobulares. Não há relato, na literatura, de nenhuma outra doença com manifestações tomográficas semelhantes. Desta maneira, estes achados na TCAR são considerados muito específicos e até mesmo patognomônicos de MAP(29,36). A confluência dos pequenos nódulos pode formar áreas de consolidação no parênquima, que, devido à presença de cálcio, podem ter maior densidade do que as partes moles. As consolidações densas ocorrem predominantemente nas bordas cardíacas, bem como nas regiões inferiores e posteriores dos pulmões, tendendo a ser simétricas(23,34,35). Consolidações densas com aerobroncogramas de permeio foram encontradas em 6 dos nossos pacientes (46,2%). Portanto, a MAP deve ser considerada um diagnóstico diferencial para o padrão de consolidações densas(23,29,34,35), juntamente com a toxicidade pulmonar por amiodarona(37), calcificação pulmonar metastática(38-41), silicoproteinose(42,43), talcose(44-46) e amiloidose(47-49). As lesões da MAP podem ser limitadas a determinadas áreas ou apresentar distribuição difusa e simétrica pelos pulmões(21,23,29,34,35). Depósitos de cálcio nos alvéolos geralmente se iniciam nos lobos inferiores e se distribuem por todo o pulmão por um período de anos, com evolução para os terços médios e depois para as porções superiores dos pulmões(2). As alterações tomográficas são predominantes nas porções inferiores e posteriores dos pulmões(29,34-36). Além disso, as porções centrais dos pulmões apresentam-se mais comprometidas que a periferia(35). Em nossa casuística, todos os pacientes apresentaram distribuição bilateral das alterações tomográficas, sem predomínio por lateralidade. Além disso, em todos os lobos pulmonares foram encontradas lesões parenquimatosas compatíveis com MAP. Os trabalhos que descreveram os aspectos tomográficos da MAP restringem-se a relatos de casos isolados ou com poucos pacientes, não havendo estudos disponíveis que tenham avaliado os achados radiográficos da MAP em uma grande série de pacientes. Nosso trabalho teve algumas limitações. O estudo foi retrospectivo e a análise foi transversal, sem avaliação de dados clínicos e evolutivos. As técnicas de TCAR variaram segundo o protocolo de cada instituição envolvida na pesquisa. Entretanto, estes fatores não prejudicaram a análise dos aspectos de imagem, que foi o objetivo do estudo. A despeito das limitações, não encontramos na literatura trabalhos sobre MAP que tenham atingido o número de casos do nosso estudo. Em conclusão, os achados tomográficos mais frequentes foram as áreas de atenuação em vidro fosco difusas e os pequenos nódulos parenquimatosos, seguidos de pequenos nódulos subpleurais, cistos subpleurais, calcificações lineares subpleurais, padrão de pavimentação em mosaico, fissura nodular, calcificação ao longo dos septos interlobulares e consolidações densas. No geral, os achados predominaram nos terços inferiores dos pulmões. Os achados típicos de MAP vistos na TCAR são tão característicos que, quando presentes, podem dispensar a realização de biópsia pulmonar. REFERÊNCIAS 1. Castellana G, Lamorgese V. Pulmonary alveolar microlithiasis. World cases and review of the literature. Respiration. 2003;70:549-55. 2. Mariotta S, Ricci A, Papale M, et al. Pulmonary alveolar microlithiasis: report on 576 cases published in the literature. Sarcoidosis Vasc Diffuse Lung Dis. 2004;21:173-81. 3. Huqun, Izumi S, Miyazawa H, et al. Mutations in the SLC34A2 gene are associated with pulmonary alveolar microlithiasis. Am J Respir Crit Care Med. 2007;175:263-8. 4. Hansell DM, Bankier AA, MacMahon H, et al. Fleischner Society: glossary of terms for thoracic imaging. Radiology. 2008;246:697-722. 5. Souza Jr AS, Araujo Neto CA, Jasinovodolinsky D, et al. Terminologia para a descrição de tomografia computadorizada do tórax (sugestões iniciais para um consenso brasileiro). Radiol Bras. 2002; 35:125-8. 6. Pereira-Silva JL, Kavakama J, Terra Filho M, et al. Consenso Brasileiro sobre Terminologia dos Descritores de Tomografia Computadorizada do Tórax. J Bras Pneumol. 2005;32:149-56. 7. Silva CIS, Marchiori E, Souza Jr AS, et al. Consenso brasileiro ilustrado sobre a terminologia dos descritores e padrões fundamentais da TC de tórax. J Bras Pneumol. 2010;36:99-123. 8. Amorim VB, Rodrigues RS, Barreto MM, et al. Computed tomography findings in patients with H1N1 influenza A infection. Radiol Bras. 2013;46:299-306. 9. Agnollitto PM, Barreto ARF, Barbieri RFP, et al. Rendu-Osler-Weber syndrome: what radiologists should know. Literature review and three cases report. Radiol Bras. 2013;46:168-72. 10. Marcos L, Bichinho GL, Panizzi EA, et al. Classification of chronic obstructive pulmonary disease based on chest radiography. Radiol Bras. 2013;46:327-32. 11. Koenigkam-Santos M, Paula WD, Gompelmann D, et al. Endobronchial valves in severe emphysematous patients: CT evaluation of lung fissures completeness, treatment radiological response and quantitative emphysema analysis. Radiol Bras. 2013;46:15-22. 12. Cerci JJ, Takagaki TY, Trindade E, et al. 2-[18F]-fluoro-2-deoxy-D-glucose positron-emission tomography is cost-effective in the initial staging of non-small cell lung cancer patients in Brazil. Radiol Bras. 2012;45:198-204. 13. Canellas R, Kanaan D, Martins PHR, et al. Spontaneous regression of pulmonary alveolar proteinosis: a case report. Radiol Bras. 2012;45:294-6. 14. Koenigkam-Santos M, Barreto ARF, Chagas Neto FA, et al. Neuroendocrine tumors of the lung: major radiologic findings in a series of 22 histopathologically confirmed cases. Radiol Bras. 2012; 45:191-7. 15. Zanetti G, Nobre LF, Mançano AD, et al. Pulmonary paracoccidioidomycosis. Radiol Bras. 2014;47(1):xi-xiii. 16. Fernandes MC, Zanetti G, Hochhegger B, et al. Rhodococcus equi pneumonia in an AIDS patient. Radiol Bras. 2014;47(3):xi-xiii. 17. Mançano AD, Santos Neto RC, Silva KCC. Williams-Campbell syndrome. Radiol Bras. 2014;47(2):xi-xii. 18. Ceratti S, Pereira TR, Velludo SF, et al. Pulmonary tuberculosis in a patient with rheumatoid arthritis undergoing immunosuppressive treatment: case report. Radiol Bras. 2014;47:60-2. 19. Dahabreh M, Najada A. Pulmonary alveolar microlithiasis in an 8-month-old infant. Ann Trop Paediatr. 2009;29:55-9. 20. Shah M, Joshi JM. Bone scintigraphy in pulmonary alveolar microlithiasis. Indian J Chest Dis Allied Sci. 2011;53:221-3. 21. Lauta VM. Pulmonary alveolar microlithiasis: an overview of clinical and pathological features together with possible therapies. Respir Med. 2003;97:1081-5. 22. Borrelli R, Fossi A, Volterrani L, et al. Right single-lung transplantation for pulmonary alveolar microlithiasis. Eur J Cardiothorac Surg. 2014;45:e40. 23. Korn MA, Schurawitzki H, Klepetko W, et al. Pulmonary alveolar microlithiasis: findings on high-resolution CT. AJR Am J Roentgenol. 1992;158:981-2. 24. Tachibana T, Hagiwara K, Johkoh T. Pulmonary alveolar microlithiasis: review and management. Curr Opin Pulm Med. 2009;15: 486-90. 25. Senyigit A, Yaramis A, Gürkan F, et al. Pulmonary alveolar microlithiasis: a rare familial inheritance with report of six cases in a family. Contribution of six new cases to the number of case reports in Turkey. Respiration. 2001;68:204-9. 26. Wallis C, Whitehead B, Malone M, et al. Pulmonary alveolar microlithiasis in childhood: diagnosis by transbronchial biopsy. Pediatr Pulmonol. 1996;21:62-4. 27. Monabati A, Ghayumi MA, Kumar PV. Familial pulmonary alveolar microlithiasis diagnosed by bronchoalveolar lavage. A case report. Acta Cytol. 2007;51:80-2. 28. Helbich TH, Wojnarovsky C, Wunderbaldinger P, et al. Pulmonary alveolar microlithiasis in children: radiographic and high-resolution CT findings. AJR Am J Roentgenol. 1997;168:63-5. 29. Marchiori E, Gonçalves CM, Escuissato DL, et al. Pulmonary alveolar microlithiasis: high-resolution computed tomography findings in 10 patients. J Bras Pneumol. 2007;33:552-7. 30. Abdalla G, Marchiori E, Zanetti G, et al. Pulmonary alveolar microlithiasis: a case report with emphasis on imaging findings. Case Rep Med. 2010;2010:819242. 31. Ferreira Francisco FA, Pereira e Silva JL, Hochhegger B, et al. Pulmonary alveolar microlithiasis. State-of-the-art review. Respir Med. 2013;107:1-9. 32. Schmidt H, Lörcher U, Kitz R, et al. Pulmonary alveolar microlithiasis in children. Pediatr Radiol. 1996;26:33-6. 33. Hoshino H, Koba H, Inomata S, et al. Pulmonary alveolar microlithiasis: high-resolution CT and MR findings. J Comput Assist Tomogr. 1998;22:245-8. 34. Cluzel P, Grenier P, Bernadac P, et al. Pulmonary alveolar microlithiasis: CT findings. J Comput Assist Tomogr. 1991;15:938-42. 35. Deniz O, Ors F, Tozkoparan E, et al. High resolution computed tomographic features of pulmonary alveolar microlithiasis. Eur J Radiol. 2005;55:452-60. 36. Gasparetto EL, Tazoniero P, Escuissato DL, et al. Pulmonary alveolar microlithiasis presenting with crazy-paving pattern on high resolution CT. Br J Radiol. 2004;77:974-6. 37. Hochhegger B, Soares Souza A Jr, Zanetti G, et al. An enlarged heart with hyperdense consolidation. Neth J Med. 2013;71:317-21. 38. Marchiori E, Müller NL, Souza AS Jr, et al. Unusual manifestations of metastatic pulmonary calcification: high-resolution CT and pathological findings. J Thorac Imaging. 2005;20:66-70. 39. Hochhegger B, Marchiori E, Souza Jr AS, et al. MRI and CT findings of metastatic pulmonary calcification. Br J Radiol. 2012;85: e69-72. 40. Bozi LCF, Melo ASA, Marchiori E. Pulmonary metastatic calcification: a case report. Radiol Bras. 2012;45:297-9. 41. Belém LC, Zanetti G, Souza AS Jr, et al. Metastatic pulmonary calcification: state-of-the-art review focused on imaging findings. Respir Med. 2014;108:668-76. 42. Marchiori E, Souza CA, Barbassa TG, et al. Silicoproteinosis: high-resolution CT findings in 13 patients. AJR Am J Roentgenol. 2007; 189:1402-6. 43. Souza CA, Marchiori E, Gonçalves LP, et al. Comparative study of clinical, pathological and HRCT findings of primary alveolar proteinosis and silicoproteinosis. Eur J Radiol. 2012;81:371-8. 44. Marchiori E, Souza Júnior AS, Müller NL. Inhalational pulmonary talcosis: high-resolution CT findings in 3 patients. J Thorac Imaging. 2004;19:41-4. 45. Marchiori E, Lourenço S, Gasparetto TD, et al. Pulmonary talcosis: imaging findings. Lung. 2010;188:165-71. 46. Pereira Faria H, de Souza Veiga A, Coutinho Teixeira L, et al. Talcosis in soapstone artisans: high-resolution CT findings in 12 patients. Clin Radiol. 2014;69:e136-9. 47. Marchiori E, Zanetti G, Hochhegger B, et al. Cystic amyloidosis or lymphoid interstitial pneumonia associated with amyloidosis? A diagnostic challenge. Ann Thorac Surg. 2012;94:1041-2. 48. Vieira IG, Marchiori E, Zanetti G, et al. Pulmonary amyloidosis with calcified nodules and masses - a six-year computed tomography follow-up: a case report. Cases J. 2009;2:6540. 49. Marchiori E, Franquet T, Gasparetto TD, et al. Consolidation with diffuse or focal high attenuation: computed tomography findings. J Thorac Imaging. 2008;23:298-304. 1. Doutoranda do Programa de Pós-Graduação em Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil 2. Doutora, Professora do Programa de Pós-Graduação em Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Médica do Serviço de Radiologia do Hospital Universitário Clementino Fraga Filho e do Instituto D'Or de Pesquisa e Educação, Rio de Janeiro, RJ, Brasil 3. Doutora, Professora do Programa de Pós-Graduação em Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Médica do Serviço de Radiologia do Hospital Universitário Clementino Fraga Filho, Rio de Janeiro, RJ, Brasil 4. Doutor, Professor Adjunto de Radiologia do Departamento de Clínica Médica da Universidade Federal do Paraná (UFPR), Curitiba, PR, Brasil 5. Doutores, Professores Associados do Departamento de Medicina e Apoio Diagnóstico da Universidade Federal da Bahia (UFBA), Salvador, BA, Brasil 6. Médico, Radiology Department, Facultad de Medicina Clinica Alemana, Universidad del Desarrollo Santiago, Chile 7. Doutor, Professor Adjunto de Diagnóstico por Imagem da Universidade Federal de Ciências da Saúde de Porto Alegre (UFCSPA), Porto Alegre, RS, Brasil 8. Doutor, Professor da Faculdade de Medicina de São José do Rio Preto (Famerp), São José do Rio Preto, SP, Brasil 9. Doutora, Professora do Programa de Pós-Graduação em Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Professora de Clínica Médica da Faculdade de Medicina de Petrópolis, Petrópolis, RJ, Brasil 10. Doutor, Professor Titular Emérito da Universidade Federal Fluminense (UFF), Niterói, RJ, Professor Associado da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil Endereço para correspondência: Dr. Edson Marchiori Rua Thomaz Cameron, 438, Valparaíso Petrópolis, RJ, Brasil, 25685-120 E-mail: edmarchiori@gmail.com Recebido para publicação em 17/11/2014. Aceito, após revisão, em 13/2/2015. Trabalho realizado no Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554