Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 48 nº 3 - Maio / Jun. of 2015
Vol. 48 nº 3 - Maio / Jun. of 2015
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Patrícia Lima Falcão1; Bárbara Miranda Motta2; Fernanda Castro de Lima3; Celso Vieira Lima4; Tarcísio Passos Ribeiro Campos5 |
|
|
Descritores: Radiação; MDA-MB-231; PBMC; LET; Dose; Taxa de dose. |
|
|
Resumo: INTRODUÇÃO
A carcinogênese é um processo no qual a função fisiológica das células vivas é alterada, resultando em crescimento anormal e incontrolável de determinado órgão ou tecido(1). A noção de que o câncer provém do descontrole dos mecanismos de divisão celular é relativamente recente. Sabe-se que a divisão celular é controlada por uma rede de sinais que atuam em sinergia, determinando o momento exato da divisão, a sua frequência e como os erros ocorridos podem ser reparados. Mutações em um ou mais segmentos dessa rede podem desencadear crescimentos anormal neoplásico. No entanto, é pouco provável que uma única alteração genética ou um único agente explique o câncer. Os estudos sobre o câncer de mama são caracterizados por esforços prodigiosos e enormes gastos públicos e privados. No que se refere aos estudos de suas causas, têm sido, em grande parte, de caráter epidemiológico, com o suporte de técnicas experimentais em biologia celular e molecular(2,3). A radioterapia representa parte integrante do tratamento primário conservador do carcinoma mamário, com o objetivo de se obter um melhor controle tumoral in situ(4,5). O objetivo da radioterapia moderna é alcançar um índice terapêutico favorável, levando células malignas a perderem a sua clonogenicidade, ao mesmo tempo em que preserva as funções dos tecidos normais. Nos protocolos de radioterapia utilizados no tratamento do câncer de mama está a exposição da mama a dois campos opostos tangenciais, em frações de 1,8 a 2,0 Gy diários, cinco dias semanais, em múltiplas frações até o acúmulo de 45 a 50 Gy(6). Os espectros energéticos empregados envolvem feixes gerados de aceleradores lineares de 4 e 6 MV, ou por Co-60. O Co-60 decai em emissão beta em Ni-60, com uma meia-vida de 5,2714 anos, emitindo raios gamas com energias de 1,17 MeV e 1,33 MeV(6). Após uma década, a taxa de dose reduz para um quarto. Em razão das dificuldades encontradas na substituição da fonte selada de Co-60 nos sistemas de cobaltoterapia, é comum encontrarmos centros de radioterapia cujo aparelho tem sua atividade, e consequentemente, a taxa de dose reduzida pelo tempo de uso do aparelho. Na cobaltoterapia, a dose prescrita do tratamento pode ser ajustada com o tempo de exposição; entretanto, não é possível corrigir a taxa de dose durante o tratamento. Já é conhecido na literatura que a sobrevida das linhagens cancerosas imortalizadas altera não só com a cinética de dose, mas também com a variação da taxa de dose. É consenso dos físicos médicos que variações da taxa de dose encontradas na aplicação da cobaltoterapia no período de uma década não influenciariam o tratamento, apesar de que, em termos radiobiológicos, alteração na clonogenicidade celular é observada em função da taxa da dose absorvida(6). As radiações podem ser classificadas de acordo com a densidade de eventos ionizantes que provocam em um volume de tecido. A radiação gama é considerada de baixa transferência linear de energia (linear energy transference - LET), ou seja, possui uma densidade de ionização esparsa. O uso de radiação de baixa LET é um importante instrumento no tratamento do câncer. Os mecanismos de reparo do DNA, consequentemente recuperação da habilidade clonogênica, após irradiação com baixa LET devem ser investigados para o entendimento dos resultados da radioterapia clínica(7). A radiação ionizante, empregada na radioterapia de mama, ao interagir com os tecidos vivos, causa diversos danos celulares. Os danos podem ser adequadamente reparados, tornando-se inócuos, ou inapropriadamente levando a mutações com seus possíveis efeitos carcinogênicos, ou ser tão graves que levem à morte celular(8). Uma melhor compreensão dos mecanismos subjacentes de reparação do DNA após radiações de baixa e alta LET representa uma prioridade de investigação que visa melhorar o resultado da radioterapia clínica(9). Uma ampla variedade de sistemas bioquímicos celulares é ativada pela radiação ionizante. É provável que lesões do DNA desencadeiem uma expressão gênica alterada(10,11). Por exemplo, alterações na cinética do ciclo celular ocorrem, e células podem ser induzidas à paralisação do ciclo e mesmo à apoptose(1,10). As alterações genéticas e metabólicas produzidas pela radiação ionizante em células cancerosas são complexas e ainda necessitam maior entendimento. Conforme se amplia a compreensão do efeito biológico molecular das radiações, também se aumenta a capacidade de manipular esse processo para obtenção de vantagem terapêutica, com a identificação de alvos moleculares específicos ou alteração dos agentes exógenos como dose, taxa de dose e escolha de partículas de diferentes LETs(7). Vale a pena mencionar que a resposta clínica da radioterapia está relacionado a radiossensibilidade e resistência das células alvos, que está associada à atividade clonogênica das linhagens em estudo e sua sensibilidade à radiação(7,12). Quanto mais indiferenciado e proliferativo o tecido, mais sensível à radiação, e no outro extremo, quanto mais diferenciado e estável o tecido, mais resistente. Neste contexto, eritroblastos e espermatogônias são mais sensíveis e células musculares e nervosas são mais resistentes. Entretanto, contrapondo a este conceito, linfócitos são células diferenciadas não clonogênicas, sendo uma das mais radiossensíveis do organismo, em razão da sua suscetibilidade à apoptose radioinduzida(7). Dentro desse contexto, é importante avaliar a variação da resposta clonogênica de células cancerosas irradiadas, em modelo in vitro sensível e radiorresistente, em função da dose de radiação recebida e da taxa de dose, no intervalo do domínio da cobaltoterapia. Dessa forma, é possível verificar os efeitos deletérios das radiações ionizantes, de modo a auxiliar no equacionamento da radioterapia a ser seguido. A resolução nº 20 de 2006 da Agência Nacional de Vigilância Sanitária (Anvisa) regulamenta o funcionamento de serviços de radioterapia, visando a defesa da saúde dos pacientes, dos profissionais e do público em geral(13). Ela estabelece que equipamentos de telecobalto com taxa de dose inferior a 50 cGy.min-1 devem ser desativados. Está também vedada a instalação de fontes de Co-60 com taxa de dose absorvida inferior a 150 cGy.min-1, em um meio aquoso a 0,5 cm de profundidade, com distância fonte-superfície igual à distância fonte-isocentro, para um campo de 10 cm × 10 cm na superfície(13). A investigação do comportamento in vitro de linhagem de radiorresistente e de radiossensível frente a diferentes doses de radiação e taxas de dose é pertinente considerando o interesse para a radioterapia clínica, principalmente próximas às faixas de aceitabilidade dos aparelhos de cobaltoterapia. O presente estudo foi subdividido em duas etapas, referente aos dois tipos de linhagens empregados. A primeira foi constituída por experimentos utilizando-se o modelo de cultura celular in vitro, com células mononucleares do sangue periférico (peripheral blood mononuclear cells - PBMC), que conferiu boa eficiência para demonstrar a cinética de viabilidade celular e monitoramento de proliferação celular frente a diferentes doses submetidas a duas taxas de dose de radiação. Simultaneamente, os experimentos utilizaram a linhagem de câncer de mama MDA-MB-231, também frente a diferentes doses de radiação e duas taxas de dose, sendo uma o quarto da primeira. Os estudos foram complementados com análises morfológicas em microscopia de luz das linhagens, controle e irradiadas. MATERIAIS E MÉTODOS Linhagens pré-estabelecidas e manutenção das culturas - Foram empregadas PBMCs e linhagem de adenocarcinoma de mama MDA-MB-231. A linhagem de mama de origem de adenocarcinoma tem morfologia epitelial, derivada de um sítio metastático. As PBMCs foram obtidas de voluntários saudáveis. As culturas celulares foram mantidas em meio de cultura RPMI-1640 suplementado com 10% de soro fetal bovino e antibióticos gentamicina (50 µg.µL-1) e estreptomicina (500 mg.mL-1), em frascos de cultura T-25 em atmosfera úmida contendo 5% de CO2 a 37ºC. A MDA-MB-231 confluiu de forma aderente no frasco de cultura. Separação das células PBMC - As PBMCs de pacientes foram separadas segundo procedimento descrito por Gazzinelli et al.(14). O sangue heparinizado foi aplicado em tubos de 15 mL, siliconizados, contendo uma mistura de Ficoll-diatrozato, obtida comercialmente (Organon Teknika Corporation; Durham, NC), na proporção de uma parte de Ficoll-diatrozato para duas partes de sangue. A preparação era submetida a centrifugação por 30 minutos, a 1.400 rpm à temperatura ambiente. Ao final da centrifugação obteve-se um anel de células mononucleares na interface entre o Ficoll e o plasma, o qual foi cuidadosamente removido com o auxílio de pipeta Pasteur e transferido para tubos de fundo cônico de 15 mL estéreis (Falcon nº 2070). O volume foi completado para 15 mL com solução RPMI-1640 (Gibco®) não suplementado e fez-se outra centrifugação (10 minutos, 1.200 rpm). As células foram lavadas por mais duas vezes (10 minutos, 1.200 rpm). Ao final, uma alíquota da suspensão de células foi coletada e diluída (1:20) em tubo Eppendorf contendo 90 µL de solução de Turck, e o número de células determinado por contagem em câmara de Neubauer, com o auxílio de um microscópio ótico. A concentração de células foi ajustada para uma suspensão contendo 1,0 × 106 células.mL-1 de RPMI-1640 suplementado. Toda manipulação das células foi realizada em condições estéreis, em capela de fluxo laminar (Biological Cabinet BBL modelo 60474). Controle - O controle foi feito com culturas de PBMCs e MDA-MB-231 não irradiadas, mantidas em cultura como descrito. Irradiação - As garrafas T-25 contendo as células foram vedadas com parafilme e transportadas dentro de um frasco plástico rígido tampado, previamente descontaminado com álcool a 70%, até o local de irradiação. Uma placa de 4 cm de material tecido equivalente foi colocada abaixo do frasco T-25, bem como o meio de cultura foi preenchido até 5 mm de altura, em relação à superfície das células aderidas. Este procedimento foi necessário para alcançar o equilíbrio eletrônico e garantir as doses prescritas nas células aderentes. Frascos T-25 de cultura confluentes foram submetidos a irradiação com Co-60, aparelho de radioterapia Gammatron 580. O campo foi 35 × 35 cm2 anterior à temperatura ambiente. Após a exposição, as células retornaram à incubadora de CO2. Cinética de dose - Foram utilizadas doses de 2 e 10 Gy para células mononucleares do sangue periférico (PBMCs) e para a linhagem MDA-MB-231. O valor elevado de 10 Gy foi adotado para que fossem efetivamente observadas variações clonogênicas na linhagem radiorresistente MDA-MB-231, na cinética de tempo e taxa de dose. Cinética de taxa de dose - Foram empregadas duas taxas de dose. Uma foi tomada o quarto da primeira, obtidas pela aproximação da amostra a ser irradiada da fonte de Co-60. Assim, uma amostra foi irradiada a uma distância fonte-superfície de 103 cm e a outra a 51,5 cm. Duas distâncias foram estabelecidas para gerar duas doses distintas, pelo fato que a intensidade do feixe é reduzida com o aumento da distância fonte-superfície. Tempos de exposições distintos definem a dose experimental requerida. As taxas de dose variam diariamente e suavemente na cobaltoterapia. No caso, as amostras foram irradiadas ao mesmo tempo, no mesmo dia. Coleta de amostras - Alíquotas de células irradiadas, homogeneizadas e em suspensão, das culturas de PBMCs e MDA-MB-231 foram coletadas de garrafas (T-25) confluentes, em triplicatas. As triplicatas de alíquotas de 500 µL foram coletadas das garrafas T-25 e transferidas para tubos Eppendorf utilizando-se pipeta automática. Os tubos Eppendorf foram identificados para realização do teste de MTT (3-(4,5 dimethylthiazol-2yl) 2,5-diphenyltetrazolium bromide). Um segundo grupo de amostras foi estocado a -20ºC para posterior investigação do perfil de citosinas/fatores de crescimento. Cinética no tempo - Os frascos de culturas in vitro que foram submetidos às doses e taxas de dose supracitadas retornaram para estufa de CO2 a 37ºC após a irradiação. Alíquotas de células irradiadas e não irradiadas (controle) foram coletadas em tempos pré-estabelecidos, em 24, 48 e 72 horas pós-irradiação, respectivamente. Avaliação de viabilidade - Das triplicatas de alíquotas de distintos tempos de irradiação, foram plaqueados 100 µL de amostra em cada poço, em placas de ELISA-fundo plano (12 × 8) - e mantidas em incubação por 24 horas. Foram adicionados 20 µL (5 mg.mL-1) de MTT em cada poço e as amostras retornaram para a incubadora onde permaneceram metabolizando o MTT por 4 horas. Após a metabolização, 80 µL foram descartados de cada poço e foram adicionados 80 µL de isopropanol (0,04 M). As placas foram incubadas por mais 18 horas. A viabilidade celular foi mensurada pela medida da densidade óptica (DO) utilizando a leitora de análise de imunoabsorção por ligação enzimática (enzyme-linked immunosorbent assay - ELISA) no comprimento de onda de 595 nm. A primeira fileira corresponde ao branco da leitora de ELISA. As placas foram lidas com o comprimento de onda de 595 nm em aparelho de ELISA Elx800. O teste de viabilidade celular pelo MTT teve como princípio a verificação da viabilidade e quantificação da proliferação celular baseada na clivagem do sal tetrazólio (MTT). Após a incubação das células submetidas a esse ensaio, formou-se uma solução corante, que é medida por meio da leitora de ELISA, e dessa forma foi possível correlacionar a absorbância com o número de células. Análise estatística - Foi feita comparação intragrupos, de acordo com duas doses (2 e 10 Gy) e duas taxas de dose diferentes para cada uma dessas doses. Utilizou-se o teste t de Student para obtenção da média de DO obtidas nas leituras. Foi adotado nível de significância de 5%. O software utilizado para as análises foi o SPSS para Windows 7(15). RESULTADOS Viabilidade de PBMCs após 2 e 10 Gy por Co-60 De acordo com os cálculos realizados, no dia de irradiação das amostras, as taxas de dose utilizadas foram: taxa padrão de 339,56 cGy.min-1 (X) e um quarto da padrão, de 84,89 cGy.min-1 (X/4). Foi realizada uma avaliação quantitativa da viabilidade celular utilizando as linhagens radiossensível e radiorresistente, respectivamente, com o intuito de demonstrar que a células viáveis após a irradiação foram capazes de formar cristais de formazan em torno delas pela clivagem do sal tetrazólio. Após a incubação das células submetidas a este ensaio, formou-se uma solução corante, que foi visualizada em microscópio de luz, conforme pode ser observado na Figura 1.  Figura 1. Fotografia das culturas submetidas ao teste do MTT apresentando duas fileiras de poços com presença da formação do cristal de formazan e imagem de um dos poços indicando a formação de cristais superpostos às células inviáveis. Dose de 2 Gy nas taxas padrão e um quarto da padrão - A Figura 2 mostra a curva de viabilidade celular avaliada pelo teste de MTT para a cultura de PBMCs in vitro, de suspensão homogeneizada de células de frascos (T-25) de cultura de PBMCs que foram irradiadas com 2 Gy na taxa de dose padrão de 339,56 cGy.min-1 e de 84,89 cGy.min-1. Os dados mostram uma diminuição estatisticamente significativa (p < 0,05) da DO na dose de 2 Gy em relação ao controle em todos os tempos estudados. Pode-se mostrar também uma equivalência da redução da sobrevida da linhagem no tempo de 24 horas para ambas as taxas de dose. É interessante notar que nos tempos pré-estabelecidos foi observado aumento da proliferação celular no controle (não irradiado), que pode ser decorrente do processo fisiológico de replicação celular (mitose). Entretanto, no tempo de 48 horas, comparando a viabilidade celular na taxa de dose padrão e um quarto desta, sugere-se que na linhagem radiossensível os efeitos da taxa de dose de radiação já podem ser percebidos pela alteração da viabilidade, mostrando que a redução da taxa de dose induz maior viabilidade. O mesmo efeito pode ser observado no tempo de 72 horas, entretanto, de forma menos pronunciada. 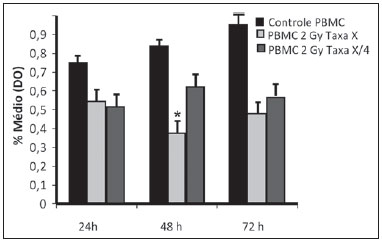 Figura 2. Curva de sobrevivência determinada pelo teste de MTT, antes e após exposição de cultura in vitro de PBMCs na dose de 2 Gy. A barra preta representa o controle de células não irradiadas e a barra cinza claro representa cultura irradiada com 2 Gy. As células foram irradiadas com a taxa de dose X = 339,56 cGy/min e X/4. As barras expressam a média de triplicatas e o desvio-padrão para culturas de PBMCs, irradiadas na dose de 2 Gy e também para o respectivo controle (não irradiado). O sinal * representa diferença estatisticamente significativa em relação às barras sem o *. (p < 0,05). Dose de 10 Gy nas taxas padrão e um quarto da padrão - A diminuição da viabilidade celular foi extremamente significativa (p < 0,05) nos tempos de 24, 48 e 72 horas, não somente em relação ao controle não irradiado, mas também de forma equivalente para as duas taxas de dose, conforme pode-se observar na Figura 3, tendo o percentual médio de DO sido reduzido a 7% a 15%, principalmente no tempo de 72 horas, sugerindo que alta dose potencializa a morte celular em cultura, com uma tendência de irreversibilidade na viabilidade celular quando a dose foi aplicada com a taxa de 339,56 cGy.min-1. Entretanto, a um quarto da taxa de dose, apesar da redução da DO, pode ser verificado um efeito de reversibilidade no decréscimo da viabilidade celular em 48 horas e mesmo 72 horas. 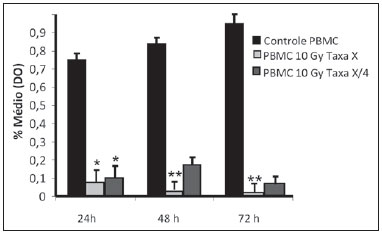 Figura 3. Curva de sobrevivência determinada pelo teste de MTT, antes e após exposição de cultura in vitro de PBMCs de indivíduo sadio na dose de 10 Gy. A barra preta representa o controle de células não irradiadas e a barra cinza claro representa cultura irradiada com 10 Gy. As células foram irradiadas com a taxa de dose X = 339,56 cGy/min e X/4. As barras expressam a média de triplicatas e o desvio-padrão para culturas de PBMCs que foram irradiadas na dose de 10 Gy e também para o respectivo controle (não irradiado). O sínal * representa diferença estatisticamente significativa em relação somente à barra sem o *. (p < 0,05). O sinal ** representa diferença estatisticamente significativa em relação às barras vizinhas sem o *. Viabilidade da linhagem MDA-MB-231 após 2 e 10 Gy por Co-60 Dose de 2 Gy nas taxas padrão e um quarto da padrão - As viabilidades celulares pelo teste de MTT de suspensões de células MDA-MB-231 in vitro irradiadas com 2 Gy na taxa de dose de 339,56 cGy.min-1 e um quarto da dose padrão foram avaliadas, conforme apresentadas na Figura 4. O experimento controle mostrou a capacidade das células MDA-MB-231 preencherem o frasco T-25 e manterem-se clonogênicas além de 48 horas pós-confluentes sem troca de meio, conforme se pode observar na curva de viabilidade do controle (Figura 4). O experimento controle mostrou, também, que após 72 horas a concentração de células é alta e a densidade celular leva a um elevado consumo de nutrientes do meio suplementado, tornando-o ácido devido aos subprodutos excretados em período de tempo de 70-120 horas, nas condições de não troca de meio. Considerando uma baixa dose de radiação, os resultados observados neste ensaio foram opostos às observações feitas para as PBMCs em cultura, nas mesmas condições de exposição e doses correlatas. Os dados, além de não apontarem diminuição da viabilidade celular após a irradiação com 2 Gy, mostraram um aumento dessa viabilidade, sugerindo uma expansão clonal nessa dose, principalmente após 48 horas em cultura. As mesmas observações foram feitas para a dose de 2 Gy na taxa de um quarto da taxa de dose, sugerindo também uma radiorresistência quando a dose foi reduzida (Figura 4). Pode-se observar que a redução da taxa de dose não impactou significativamente na sobrevivência a 24 horas, mas tornou-se impactante na viabilidade a 48 e 72 horas, sendo que a taxa menor leva a um aumento na sobrevivência celular ao longo do tempo. 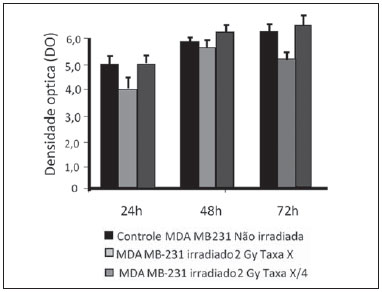 Figura 4. Curva de sobrevivência determinada pelo teste de MTT, antes e após exposição de cultura in vitro de células MDA-MB-231 na dose de 2 Gy. A barra preta representa o controle de células não irradiadas e a barra cinza claro representa cultura irradiada com 2 Gy, com a taxa de dose X = 339,56 cGy/min e X/4. As barras expressam a média de triplicatas e o desvio-padrão para culturas de células MDA-MB-231 irradiadas na dose de 2 Gy e também para o respectivo controle (não irradiado). O sinal * representa diferença estatisticamente significativa em relação às barras sem o * (p < 0,05). Dose de 10 Gy nas taxas padrão e um quarto da padrão - A Figura 5 mostra uma diminuição significativa (p < 0,05) da viabilidade celular quando a suspensão de células recebeu a dose de 10 Gy mensurados a 24 horas após a exposição na taxa de 339,56 cGy.min-1 em relação ao controle não irradiado. A diminuição da viabilidade celular com esta dose acompanhou a cinética de tempo de forma crescente, em contraste com o efeito observado quando a suspensão de células recebeu a dose de 2 Gy na mesma taxa. Da mesma forma que células radiossensíveis, o comportamento dos clones radiorresistentes de MDA-MB-231 mostra recuperação da viabilidade na taxa reduzida, enquanto na taxa padrão esta recuperação não é perceptível. 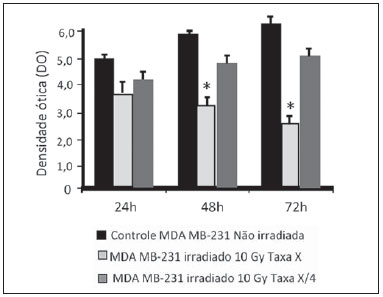 Figura 5. Curva de sobrevivência determinada pelo teste de MTT, antes e após exposição de cultura in vitro de células MDA-MB-231 na dose de 10 Gy. A barra preta representa o controle de células não irradiadas e a barra cinza claro representa cultura irradiada com 10 Gy, com a taxa de dose X = 339,56 cGy/min e X/4. As barras expressam a média de triplicatas e o desvio-padrão para culturas de células MDA-MB-231 irradiadas na dose de 10 Gy e também para o respectivo controle (não irradiado). O sinal * representa diferença estatisticamente significativa em relação às barras sem o * (p < 0,05). Morfologia de linhagens irradiadas A Figura 6 mostra células MDA-MB-231 não irradiadas obtidas do frasco controle, além de poços de cultura de MDA-MB-231 irradiadas em tempos de exposição distintos. As células apoptóticas apresentam uma morfologia diferenciada em relação ao tamanho e granulosidade, sendo muito mais granulosas do que as que não sofreram os danos decorrentes da radiação. Há indícios de presença de vacúolos e corpos apoptóticos existentes. Há também a presença de células disformes com possível indicação de necrose. É interessante notar que os aspectos morfológicos de células em cultura da linhagem de adenocarcinoma mamário MDA-MB-231 já haviam sido abordados anteriormente em outro estudo, sugerindo efeitos deletérios nas doses mais elevadas (10 Gy). Estudos de Campos et al.(16), que corroboram nossas observações, mostraram a análise de imagens providas de frascos com células da linhagem MDA-MB-231 durante a irradiação e sugeriram a existência de processos apoptóticos. 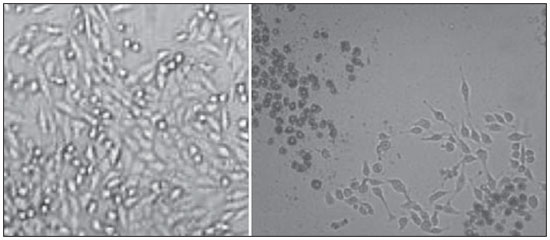 Figura 6. Morfologia das células MDA-MB-231 não irradiadas, previamente ao experimento e pós-irradiadas a 10 Gy, em um campo em que aparecem corpos apoptóticos e células ainda viáveis. DISCUSSÃO Em nosso estudo, foi demonstrado que as viabilidades de linhagem proveniente de adenocarcinoma mamário radiorresistente MDA-MB-231 e radiossensível PBMC foram influenciadas pela dose, taxa de dose e pela cinética de tempo pós-experimento, de forma significativa. O efeito da taxa de dose pôde ser reconhecido pela análise de viabilidade nos tempos intermediários de 48 e 72 horas que se seguiram após a exposição à radiação. A redução de viabilidade celular com a dose confirma os achados de Cockerham et al.(17), que sugerem que os efeitos tóxicos da radiação sobre linhagens celulares dependem da dose total absorvida. Muito embora seja óbvio que o efeito da dose em si foi considerado impactante para indução de morte celular, levando, provavelmente, ao desbalanço entre proliferação e apoptose, a influência deste processo com variações da taxa de dose em cinética de tempo pós-radiação também pode ser observada e considerada relevante. No presente estudo, células que apresentam padrão radiossensível foram irradiadas com doses (2 e 10 Gy) que potencialmente interferiram na clonogenicidade desta linhagem. As PBMCs estão envolvidas na resposta imunológica ao próprio tratamento, estando intimamente associadas à capacidade respondedora do paciente. Podemos também incluir que a taxa de dose influenciou significativamente neste contexto. No caso das PBMCs irradiadas, podemos sugerir que a alteração observada na diminuição da proliferação após a dose de 2 Gy poderia ser devida ao papel que a radiação ionizante possivelmente exerce, deflagrando alterações biomoleculares, muito provavelmente ativando a fosforilação de quinases responsáveis pela cascata de apoptose na linhagem que apresenta radiossensibilidade(9), e que esse efeito já pôde ser observado numa dose considerada baixa, se compararmos com as doses observadas de 2 e 10 Gy. Na dose de 2 Gy, o efeito da aplicação diluída no tempo parece reconhecível se compararmos o percentual médio de DO para PBMCs. A diminuição da curva de viabilidade foi bem menos perceptível com a taxa reduzida a um quarto, nos tempos de 24, 48 e 72 horas, muito embora tenhamos observado diferença do controle não irradiado. Reportamos a importância do impacto desse tempo na recuperação dessas células, na indução do processo fisiológico de replicação e/ou na mutagênese celular. Além disso, observamos diminuição (embora não significativa) da viabilidade celular, refletida pelo percentual médio de DO nas primeiras 24 horas, quando a cultura de células foi irradiada também com doses intermediárias (dados não mostrados). Essa queda foi significativa nas 48 horas seguintes em relação ao tempo de 24 horas, sugerindo que as funções vitais das PBMCs já parecem ter sido afetadas após a exposição com essa dose. Em contrapartida ao estudo com células radiossensíveis, a viabilidade de uma linhagem de adenocarcinoma de mama MDA-MB-231, radiorresistente, mostra comportamento distinto. Mesmo com a dose de 10 Gy pôde ser observado que uma taxa reduzida a um quarto conferiu à linhagem MDA-MB-231 um maior potencial de recuperação a partir de 48 horas pós-irradiação. Estudos em modelo experimental têm demonstrado que as linhagens MDA-MB-231, MDA-MB-435S e U251 apresentam perfil biomolecular diferenciado quando tratadas e não tratadas terapeuticamente, apresentando elevada expressão de mRNA e de proteínas. No estudo de De Bacco et al.(18), a expressão de proteínas e a transdução de sinal foram comparadas em células irradiadas e não irradiadas. A capacidade invasiva de células foi associada a não inibição de quinases de siRNA (silenciamento de RNA) PHA665752 ou JNJ-38877605 e também em ensaios de viabilidade e clonogênese(19). Linhagens como a MDA-MB-231 tornam-se alvo da radioterapia de câncer de mama. De acordo com estudo em modelo experimental, doses ou taxas de doses ineficientes de radiação poderiam definir o destino de linhagens de células malignas, como a MDA-MB-231, em resposta à cobaltoterapia. Vários fatores podem influenciar nos efeitos radiobiológicos, tais como a qualidade da energia ionizante, a intensidade da radiação (efeito reversível e irreversível), a maneira da exposição - isto é, se de corpo inteiro ou de parte dele, se externa ou interna, se simples, continuada ou fracionada -, o tempo de exposição e a distribuição de doses entre os diversos tecidos. O efeito da dose crescente diluída no tempo com a taxa reduzida a um quarto sugeriu que o processo fisiológico de replicação foi influenciado com o tempo de exposição, uma vez que parece ter havido uma recuperação significativa do percentual de DO. Sugere-se, então, que a taxa de dose parece exercer papel importante na forma como esses danos são potencializados na célula e, possivelmente, que a própria indução da cinética de morte celular possa ser desencadeada por vias de sinalização alternativas em função da dose administrada. Em contrapartida, quando essa mesma dose foi administrada à cultura, num intervalo de tempo maior, em taxa de dose reduzida a um quarto, observamos que o efeito sobre a curva de sobrevivência foi melhor reconhecível a partir das 48 horas, se considerarmos a dose de 2 Gy. No entanto, vale a pena ressaltar que com 72 horas pudemos atestar uma diminuição significativa (p < 0,05) da viabilidade celular. Vale a pena lembrar que o efeito de doses fracionadas de radiação já havia sido demonstrado anteriormente por Soto et al.(19), utilizando uma linhagem de câncer mamário com resistência intermediária, na qual foi avaliada a proliferação de fibroblastos submetidos a doses muito mais baixas do que a utilizada no presente estudo. Vale ressaltar que a dose é a quantidade total de energia absorvida por unidade de massa, enquanto a taxa de dose reflete a cinética de como essa dose é absorvida ao longo do tempo. Por sua vez, o terceiro parâmetro, retratado pela cinética de tempo pós-radiação, reflete a habilidade de reparo e repopulação da linhagem in vitro. Em radiobiologia, tanto a dose como a taxa da dose têm importância crucial, ou seja, doses elevadas podem ter efeitos diminutos se aplicados com taxas extraordinariamente diluídas, da mesma forma que doses reduzidas podem ter efeitos reconhecidos se dadas em taxas de dose elevadas, em tempos muito curtos(8). Na verdade, a taxa de dose reflete a maneira como os danos subletais são distribuídos e reparados ao longo do tempo. Estudo pioneiro de Kaplan et al.(20), em modelo experimental in vitro, demonstrou que a radiação ionizante pode exercer efeito prometastático paradoxal. Este efeito foi observado após doses consideradas insuficientes para induzir a morte de células malignas no tumor primário em experimentos com animais e raramente após tratamento com radiação curativa. Estudos recentes têm indicado que a radiação ionizante pode promover a seleção positiva de tumor pré-existente, intrinsecamente radiorresistente, sugerindo uma explicação mecanicista atraente para a progressão do tumor induzido por radiação(7,18,21,22). No entanto, há também evidências de que a radiação é capaz de induzir um fenótipo adaptativo destinado à regeneração de tecidos, que pode dar suporte ao comportamento metastático(17,19). Esta alteração de fenótipo pode ser compreendida como uma resposta do estresse gerado pela radiação e pela tentativa de reparos dos danos ao DNA(23). Em células individuais, danos ao DNA induzem mecanismos moleculares específicos, principalmente orquestrados pelo eixo telangiectasia mutada, ataxia-p53, que são capazes de bloquear a replicação e reparação do DNA(23,24). Se tal reparação falhar, uma célula normal é programada para executar a apoptose ou sofrer supressão proliferativa pelo processo de senescência. No entanto, após a morte das células danificadas por radiação, os tecidos devem restabelecer o seu número padrão adequado de células, em função da regeneração e/ou cicatrização pelas células sobreviventes, normais ou neoplásicas. Uma dose mais elevada (10 Gy) pode ter produzido um impacto sobre as vias enzimáticas que levam as células a entrar em apoptose numa cinética de tempo mais rápido, o que reflete a baixa DO observada nos três tempos de coleta (24, 48 e 72 horas), com start de TNF-α e presença de ROS (espécies reativas de oxigênio)(11,25). Embora tenha ficado claro que o efeito da dose em si foi considerado impactante para indução de morte celular, levando ao desbalanço entre proliferação e apoptose, seria interessante que, num momento posterior, fossem marcados os receptores dessa linhagem radiossensível para apoptose, de acordo com De Bacco et al.(18). A radioterapia conduz o paciente a um índice terapêutico favorável, levando o tumor a perder a sua clonogenicidade, ao mesmo tempo em que se possam preservar ao máximo os tecidos normais adjacentes a ele(26). Portanto, a radioterapia deve ser utilizada com sucesso para o tratamento local do câncer primário(19). Porém, algumas linhagens tumorais submetidas ao tratamento se tornam potencialmente mais agressivas, no caso produzindo recidivas. Nesse contexto, um dos questionamentos levantados diz respeito ao planejamento do tratamento e de sua própria eficiência, considerando a relação entre efeito da taxa de dose na cobaltoterapia, visto que o Co-60 tem meia-vida de 5 anos, e após duas meias-vidas (10 anos) a atividade atinge um quarto da inicial e, consequentemente, a radioterapia aplicada na mesma dose terá taxa de dose reduzida para um quarto. Esta é uma situação presente nos centros de radioterapia e, consequentemente, pelos resultados radiobiológicos aqui apresentados, pode-se confirmar com estudos radiobiológicos que a cobaltoterapia será influenciada pelo tempo de decaimento da fonte primária, mesmo que a quantidade de ionização seja ajustada. Os achados experimentais de viabilidade celular e repopulação das linhagens estudadas no tempo de 72 horas para taxas reduzidas de 85 cGy.min-1 demonstram a importância de atender a norma RDC-20 estabelecida pela Anvisa, que limita o uso de fontes de Co-60 a taxas de dose inferior a 50 cGy.min-1. CONCLUSÃO Células PBMC a doses de 2 e 10 Gy, independentemente da taxa de dose, apresentaram diminuição de viabilidade. Células de câncer de mama, menos sensíveis, apresentaram diminuição da viabilidade apenas após alta taxa de dose e dose de 10 Gy. Tais achados podem ter impacto na radioterapia e influenciar na qualidade do tratamento. Em cinética de tempo pós-radiação, linhagens sensível e radiorresistente, em duas taxas de dose, demonstraram ampliação da viabilidade de clones radiossensível (PBMC) e radiorresistente (MDA-MB-231) pós 48-72 horas em taxa de dose reduzida em período de duas meias-vidas do Co-60, tendo como possível impacto clínico a redução do controle tumoral em cobaltoterapia. REFERÊNCIAS 1. Pollock RE, Doroshow JH, Khayat D, et al. UICC Manual de oncologia clínica. 8ª ed. São Paulo, SP: John Wiley, Fundação Oncocentro de São Paulo; 2006. 2. Fentiman I. Diagnóstico e tratamento do câncer inicial de mama. Porto Alegre, RS: Artes Médicas; 1993. 3. Santos CER, Mello ELR. Manual de cirurgia oncológica. 2ª ed. São Paulo, SP: Tecmedd; 2008. 4. Veronesi U, Luini A, Andreoli C. A conservação da mama: indicações e técnicas da quadrantectomia, dissecção e radioterapia no câncer de mama. São Paulo, SP: Editora Ícone; 1992. 5. Liu Y, Appleyard MV, Coates PJ, et al. p53 and gamma radiation in the normal breast. Int J Radiat Biol. 2009;85:1026-31. 6. Khan FM. The physics of radiation therapy. 4th ed. Baltimore, MD: Lippincott Williams & Wilkins; 2010. 7. Hall EJ, Giaccia AJ. Radiobiology for the radiologist. 7th ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2011. 8. Murad AM, Katz A. Oncologia: bases clínicas do tratamento. Rio de Janeiro, RJ: Guanabara Koogan; 1996. 9. Vandersickel V, Mancini M, Slabbert J, et al. The radiosensitizing effect of Ku70/80 knockdown in MCF10a cells irradiated with X-rays and p(66)+Be(40) neutrons. Radiat Oncol. 2010;5:30. 10. Toledo JM, Siqueira SL, Campos TPR, et al. Phenotypic behavior of PBMCs from irradiated dogs based on flow cytometry. J Biol Regul Homeost Agents. 2013;27:309-17. 11. Falcão PL, Cuperschmid EM, Trindade BM, et al. Transforming growth factor-β and matrix metalloproteinase secretion in cell culture from ex-vivo pbmc after exposure to uv radiation. J Biol Regul Homeost Agents. 2014;28:333-40. 12. Andrade LM, Leite MF, Goes A, et al. Cellular viability and apoptosis of human breast cancer MDAMB-231 cell line after Co-60 irradiation. Acta Microsc. 2003;12:43-8. 13. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução nº 20 de 02/02/2006 / ANVISA - Agência Nacional de Vigilância Sanitária (D.O.U. 06/02/2006). [acessado em 1º de setembro de 2014]. Disponível em: www.diariodasleis.com.br/busca/exibelink.php?numlink=1-9-34-2006-02-02-20. 14. Gazzinelli G, Katz N, Rocha RS, et al. Immune responses during human schistosomiasis mansoni. X. Production and standardization of an antigen-induced mitogenic activity by peripheral blood mononuclear cells from treated, but not active cases of schistosomiasis. J Immunol. 1983;130:2891-5. 15. IBM Software. SPSS software. [acessado em 1º de setembro de 2014]. Disponível em: http://www-01.ibm.com/software/analytics/spss. 16. Campos TPR, Valença PLF, Cuperschmid EM, et al. Efeito das radiações emitidas por sementes de hólmio-166 de baixa atividade em cultivo celular MDAMB231. In: COLAOB 2010 - 6º Congresso Latino Americano de Órgãos Artificiais; 2010, Gramado, RS. Anais do COLAOB. 2010;1:1-7. 17. Cockerham KP, Kennerdell JS. Does radiotherapy have a role in the management of thyroid orbitopathy? View 1. Br J Ophthalmol. 2002;86:102-4. 18. De Bacco F, Luraghi P, Medico E, et al. Induction of MET by ionizing radiation and its role in radioresistance and invasive growth of cancer. J Natl Cancer Inst. 2011;103:645-61. 19. Soto J, Quindós LS, Cos S, et al. Influence of low doses of radiation due to 222Rn on proliferation of fibroblasts and MCF-7 human breast cancer cells in vitro. Sci Total Eviron. 1996;181:181-5. 20. Kaplan HS, Murphy ED. The effect of local roentgen irradiation on the biological behavior of a transplantable mouse carcinoma; increased frequency of pulmonary metastasis. J Natl Cancer Inst. 1949;9:407-13. 21. Bernier J, Hall EJ, Giaccia A. Radiation oncology: a century of achievements. Nat Rev Cancer. 2004;4:737-47. 22. Huber SM, Butz L, Stegen B, et al. Ionizing radiation, ion transports, and radioresistance of cancer cells. Front Physiol. 2013;4:212. 23. Von Essen CF. Radiation enhancement of metastasis: a review. Clin Exp Metastasis. 1991;9:77-104. 24. Lövey J, Fazekas K, Ladányi A, et al. Low-dose irradiation and short-exposure suboptimal-dose paclitaxel adversely modulate metastatic potential of squamous carcinoma cells. Strahlenther Onkol. 2003;179:812-8. 25. Harada H. How can we overcome tumor hypoxia in radiation therapy? J Radiat Res. 2011;52:545-56. 26. Tamamoto T, Ohnishi K, Takahashi A, et al. Correlation between gamma-ray-induced G2 arrest and radioresistance in two human cancer cells. Int J Radiat Oncol Biol Phys. 1999;44:905-9. 1. Pós-doutora, Professora Adjunta da Universidade Federal do Amazonas (UFAM), Manaus, AM, Brasil 2. Mestre, Professora da rede particular de ensino em Belo Horizonte, Belo Horizonte, MG, Brasil 3. Mestranda em Medicina Veterinária da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil 4. Mestre, Doutorando em Ciências e Técnicas Nucleares da Escola de Engenharia da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil 5. Pós-doutor, Professor Associado da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil Endereço para correspondência: Dra. Patrícia Lima Falcão Departamento de Técnicas Nucleares, Prédio PCA1, Engenharia - UFMG Avenida Antônio Carlos, 6627, Pampulha Belo Horizonte, MG, Brasil, 31270-901 E-mail: patricialfalcao@gmail.com Recebido para publicação em 20/3/2014. Aceito, após revisão, em 10/11/2014. Trabalho realizado no Departamento de Engenharia Nuclear da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554