Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 48 nº 2 - Mar. / Abr. of 2015
Vol. 48 nº 2 - Mar. / Abr. of 2015
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Marli Batista Fernandes Vermelho1; Ademir Silva Correia1; Tânia Cibele de Almeida Michailowsky1; Elizete Kazumi Kuniyoshi Suzart1; Aline Santos Ibanês2; Lanamar Aparecida Almeida3; Zarifa Khoury4; Mário Flores Barba5 |
|
|
Descritores: Paracoccidioidomicose; Paracoccidioidomicose disseminada; Tomografia computadorizada de abdome. |
|
|
Resumo: INTRODUÇÃO
A paracoccidioidomicose (PCM), doença de Lutz ou blastomicose sul-americana é uma micose sistêmica causada por fungo patogênico primário, termicamente dimórfico, de reprodução assexuada - o Paracoccidioides brasiliensis -, saprófita de plantas e solo descoberto em 1908(1-6). Em meio de cultura e à temperatura ambiente, assim como na natureza, encontra-se na forma de hifas septadas ou micélios, que se reproduzem assexuadamente com a liberação de clamidósporos. Em culturas a 37°C ou nos tecidos parasitados encontram-se na forma de leveduras que se reproduzem assexuadamente por brotamento, facilmente identificáveis ao microscópio óptico(1-3,6-8). No continente americano pode ser encontrado do sul dos Estados Unidos até a Argentina(9). Aproximadamente 80% dos casos relatados se concentram no Brasil. O Estado com maior prevalência é São Paulo, seguido por Rio de Janeiro, Minas Gerais e Paraná, e também nas regiões Sul e Centro-Oeste, sendo a micose endêmica mais frequente nas Américas Central e do Sul(2,6,7,10). No Brasil a doença constitui importante problema de saúde pública. Estudos mostram que cerca de 75% da população adulta foi exposta ao fungo, porém, só em torno de 2% desenvolverão a doença(2). Os indivíduos acometidos necessitam de assistência e acompanhamento médico de longo prazo, e como se encontram na fase economicamente mais produtiva da vida, a PCM doença pode levar a impacto social e econômico(5,6). A população mais acometida é de homens entre 30 e 60 anos de idade (proporção de 13 homens : 1 mulher)(5,6,9). Na préadolescência a proporção é de aproximadamente 1 homem : 1 mulher(9). A classificação clínica adotada pelo Consenso Brasileiro de Paracoccidioidomicose contempla as seguintes formas clínicas(5): - PCM infecção. - PCM doença: a) forma aguda/subaguda; b) forma crônica - unifocal ou multifocal; c) forma sequelar. A PCM infecção é assintomática ou oligossintomática. Após a infecção, a progressão para doença clinicamente aparente depende da virulência da amostra inalada, da quantidade e presença de mecanismos de defesa do indivíduo infectado(5-7,11). A PCM doença pode evoluir de duas maneiras: - Forma aguda/subaguda: responsável por 3% a 5% dos casos da doença, predomina em crianças e adolescentes. Caracteriza-se por evolução rápida, e a procura de atendimento médico ocorre entre 4 e 12 semanas, cursando com linfonodomegalias, hepatoesplenomegalia, manifestações digestivas (diarreia, constipação intestinal, ascite, síndrome de má-absorção, etc.), envolvimento osteoarticular e lesões cutâneas(5,12). - Forma crônica: 90% dos casos, predominando em adultos do sexo masculino. Progride lentamente, podendo levar anos até se fazer o diagnóstico. As manifestações pulmonares são comuns. Existem dois subtipos: unifocal, que é limitada a um órgão; e multifocal, quando acomete mais que um órgão simultaneamente(5-7,11). A PCM pode se disseminar no organismo por vias hematogênica, linfática, canalicular e por contiguidade(4,6). - Forma sequelar: são manifestações cicatriciais que se seguem ao tratamento da doença(5,6). Considerando-se que algumas das possíveis manifestações abdominais da PCM podem não ser caracterizadas pelo exame físico, é necessária a avaliação por exames de imagem para melhor definição de órgãos acometidos, incluindo-se a tomografia computadorizada (TC). MATERIAIS E MÉTODOS Estudo retrospectivo realizado no Instituto de Infectologia Emílio Ribas (IIER) de São Paulo, SP, Brasil, em 26 pacientes com diagnóstico confirmado de PCM disseminada, entre usuários que passaram em consulta médica e foram encaminhados para exame de TC de abdome, no período estimado de 24 meses, a partir de 1º de junho de 2010. Foi realizado termo de confiabilidade dos dados obtidos mediante análise dos exames dos pacientes, conforme normas do Comitê de Ética em Pesquisa do IIER. Os exames foram realizados em tomógrafo multislice de 8 canais modelo Light Speed (GE Healthcare; Wisconsin, EUA), com aquisição de imagens segundo protocolos estabelecidos pelo nosso serviço de radiologia. Nos exames tomográficos abdominais os pacientes realizaram uma fase inicial sem uso de contraste iodado e fases após uso de meio de contraste iodado OptirayTM 320 (Mallinckrodt do Brasil; São Paulo, Brasil), por vias oral e intravenosa em três etapas - arterial, portal e equilíbrio -, sendo documentados em janelas e níveis adequados para avaliação dos órgãos abdominais, com espessura de corte padrão de 7,5 mm e intervalos de 7,5 mm, tendo sido realizadas, quando necessárias, reformatações do segmento nos planos coronal e sagital. Foram incluídos pacientes das unidades de internação e do ambulatório de micoses sistêmicas da nossa instituição, independentemente de relato de sintomas abdominais, sendo 20 do sexo masculino e 6 do sexo feminino, com idade mínima de 18 anos e sem limite de idade máxima, incluindo pacientes soropositivos para o vírus HIV, excluindo-se mulheres gestantes. Foram abrangidos, indistintamente, pacientes em uso atual ou anterior de medicação específica para esta micose profunda. Achados característicos de envolvimento abdominal da PCM, tais como organomegalias, linfonodomegalias, lesões parenquimatosas focais, acometimento gastrintestinal, compressão de vias biliares ou da veia cava e ascite(5,6), foram demonstrados pela TC. RESULTADOS No presente estudo foram detectadas alterações tomográficas abdominais em 18 dos pacientes da série, correspondendo a 69,2% dos casos analisados. Nos outros 8 pacientes (30,8%) a TC foi normal. Os achados tomográficos foram classificados em resultados negativos para a presença de alterações e em achados identificáveis ao exame, estes subclassificados em sete categorias, conforme representados na Tabela 1. 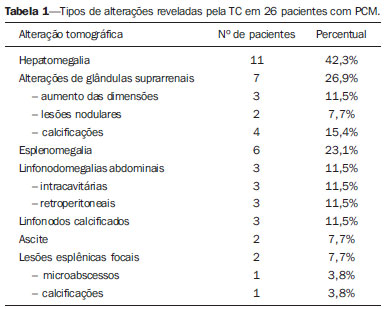 Hepatomegalia foi definida como maior eixo longitudinal do lobo direito do fígado maior que 15,5 cm na linha hepática média(13), ou 16,0 cm na linha hemiclavicular(14), e esplenomegalia como índice esplênico aumentado, ou seja, igual ou maior que 480(15), sendo que o aumento das dimensões destes órgãos foram achados comuns na nossa casuística, com predomínio de hepatomegalia, detectada em 11 (42,3%) dos pacientes, evento de maior incidência. A hepatomegalia e a esplenomegalia, em todos os casos, foram relatadas como discretas a moderadas. A esplenomegalia foi detectada em 6 (23,1%) dos exames analisados nesta série, na maioria das vezes discreta pelos critérios preconizados, e de densidade homogênea. Pequeno percentual destes pacientes (7,7 %) apresentou lesões focais esplênicas, representadas por pequenas calcificações periféricas em um caso (3,8%) e por pequenas lesões hipodensas esparsas e sem realce por contraste, sugestivas de microabscessos, identificadas em um indivíduo da série (3,8%). O mesmo paciente que apresentou pequenas calcificações esplênicas também apresentava diminutas calcificações hepáticas periféricas e era portador de co-infecção pelo vírus HIV, não se podendo estabelecer a natureza exata desses achados, se secundários a uma infecção oportunista prévia relacionada ao HIV, ou se pela infecção concomitante pela PCM disseminada. As alterações nas glândulas suprarrenais (Figuras 1 e 2) foram encontradas em 7 dos nossos 28 casos (26,9%), notando-se uma distribuição equilibrada entre aumento das dimensões da glândula (11,5%) e presença de calcificações (15,4%). Um percentual menor de pacientes apresentava lesões nodulares sólidas (7,7 %), totalizando dois casos, sendo que em um deles a densidade do nódulo na fase pré-contraste foi sugestiva de adenoma, e o segundo paciente apresentou nódulo com características de impregnação atípicas. O tamanho máximo dos nódulos encontrados foi 24 mm. As calcificações de suprarrenais variaram entre granulares finas e grosseiras focais. 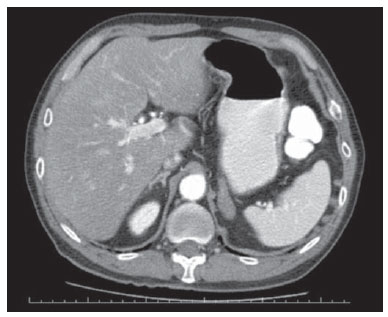 Figura 1. TC de abdome na fase portal demonstrando aumento das dimensões da suprarrenal esquerda. 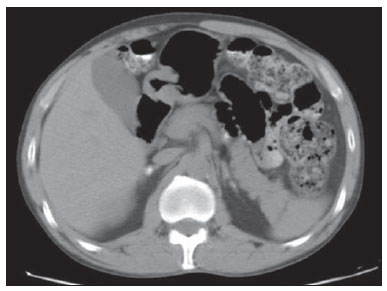 Figura 2. TC de abdome sem contraste intravenoso identificando calcificações em glândulas suprarrenais. O quarto achado mais prevalente foi linfonodomegalias (11,5%), com distribuição similar entre os sítios intracavitários e retroperitoneais, sendo que os mesmos pacientes apresentaram, simultaneamente, envolvimento de diferentes cadeias linfonodais (Figura 3). Linfonodos calcificados foram observados em três pacientes (11,5%). As linfonodomegalias não ultrapassaram 30 mm nos casos descritos, sendo que em um caso foram observados linfonodos com centro hipodenso. As calcificações nodais apresentaram-se de aspecto grosseiro de modo geral. Na Figura 3 ilustramos caso de TC de abdome na fase portal identificando conglomerado linfonodal com áreas hipodensas sugestivas de necrose ou liquefação em região peripancreática, associado a esplenomegalia. 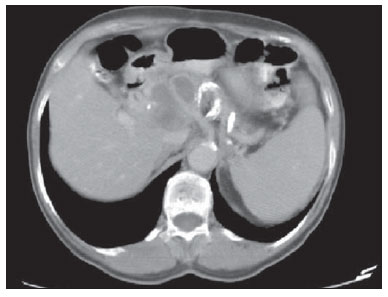 Figura 3. TC de abdome na fase portal revelando conglomerado linfonodal com áreas hipodensas sugestivas de necrose ou liquefação em região peripancreática, associado a esplenomegalia. Ascite foi encontrada em dois casos (7,7 %), sendo classificada como de pequeno volume. Outros achados incluíram um nódulo hepático hipervascular (interpretado como hemangioma), cistos hepáticos e calcificações focais hepáticas, consideradas residuais. Considerando-se a frequência de alterações tomográficas de acordo com as formas clínicas da doença, 10 casos (38,5%) foram classificados com a forma disseminada aguda/subaguda da doença, sendo que, destes, 9 pacientes (90%) tinham achados positivos e 1 (10%) não tinha alterações detectáveis. Outros 16 indivíduos da série (61,5%) foram portadores da forma disseminada crônica, notando-se alterações tomográficas em 9 destes (56,2%), e não se constatando alterações no exame em 7 dos casos (43,8%). Quanto aos tipos das alterações encontradas, de acordo com a forma clínica da PCM, nos pacientes com a forma disseminada aguda/subaguda, 9 (34,6%) eram portadores de hepatomegalia, 3 (11,5%) apresentavam esplenomegalia, 2 (7,7%) mostravam linfonodos calcificados, 2 (7,7%) tinham aumento de suprarrenais, em 1 (3,8 %) foram identificados microabscessos esplênicos, 1 (3,8%) revelava sinais de linfonodomegalias intracavitárias, 1 (3,8%) apresentava linfonodomegalias retroperitoneais, 1 (3,8%) possuía calcificações esplênicas, e em 1 (3,8%) foram descritas calcificações de suprarrenais. Nos casos com diagnóstico da forma disseminada crônica da doença, as distribuições foram: em 3 casos (11,5%) constataram-se calcificações de suprarrenais; em 2 (7,7%), linfonodomegalias intracavitárias; em 2 (7,7%), linfonodomegalias retroperitoneais; em 2 (7,7%), nódulo de suprarrenal; em 2 (7,7%), esplenomegalia; em 2 (7,7%), ascite; em 1 (3,8%), aumento de suprarrenais; em 1 (3,8%), linfonodos calcificados; e em 1 caso (3,8%), hepatomegalia. DISCUSSÃO O acometimento abdominal pela PCM doença pode ser oligo ou assintomático, mas dificilmente diagnosticado ao exame clínico, sendo de frequência subestimada(12,16,17). No presente trabalho foram encontradas alterações tomográficas abdominais em 18 pacientes (69,2%), ou seja, um número significativo de casos. Foi possível observar que o achado de manifestações abdominais da PCM foi frequente, mesmo com os tratamentos e drogas atuais, corroborando estudos anteriores(12,17), sendo mais comum o achado de alterações tomográficas na sua forma aguda/subaguda de apresentação, visualizado em 90% dos casos, do que na sua forma crônica, na qual se detectaram alterações por imagem em 56,2% dos indivíduos, concordando-se com a literatura(12). Hepatoesplenomegalia representou percentual significativo dos achados na presente série, sendo mais frequentemente encontrada na forma disseminada aguda/subaguda da doença do que na forma crônica, compatível com relatos anteriores(5,11,12). O comprometimento suprarrenal e linfonodal observado reforça o envolvimento importante desses sítios nas formas disseminadas da doença, como já descrito em outros trabalhos(1,4,12,16). O achado de nódulos de suprarrenais (7,7%) não foi considerado específico para a doença pelos critérios tomográficos utilizados. A forma mais típica de acometimento de suprarrenais é descrita como massa com realce heterogêneo por contrate e com área central de baixa densidade representada por necrose caseosa(15-17).Calcificações estão presentes em cerca da metade dos casos de acometimento de suprarrenais por PCM, segundo a literatura(15,16), e atrofia glandular é vista no estágio crônico da doença(16). Foram encontrados 15,4% de calcificações no presente estudo, numa prevalência menor que a descrita nesta doença, tendo sido este o achado mais frequente nos casos da forma crônica. O aumento bilateral das suprarrenais em pacientes com alterações radiográficas torácicas concomitantes e sugestivas de PCM é altamente indicativo da doença(15,16), e este foi achado em 11,5% dos casos desta série, visto numa frequência maior em pacientes que se apresentavam na fase aguda/subaguda. A forma disseminada aguda/subaguda da doença caracteriza-se pela disseminação da infecção para o sistema reticuloendotelial, resultando em linfadenopatia e esplenomegalia(11). Foi descrito, em relato anterior, percentual significativo de linfonodomegalias em pacientes com PCM(12), superior à metade dos casos daquela série, atribuível à disseminação preferencial do P. brasiliensis por via linfática(4,16). Na presente casuística tal percentual se mostrou menor (11,5%), fato que pode decorrer de um viés de seleção, uma vez que a maioria dos pacientes nesta série (61,5%) apresentava-se na fase crônica da doença. Apesar disso, notou-se frequência ligeiramente maior de caracterização de linfonodomegalias nos casos na fase crônica (12,5%) do que nos da fase aguda/subaguda (10,0%). A ascite foi um dos achados tomográficos menos frequentes (7,7%), sendo também descrita em casos de PCM disseminada em estudos anteriores(5,8), e presente nesta série apenas em portadores da forma crônica da doença. Dilatação de vias biliares intra e extra-hepáticas foi descrita como frequente em trabalho anterior(12), porém não identificada na presente série, provavelmente pelo motivo de que uma proporção menor dos nossos pacientes se apresentaram nas fases aguda e subaguda da doença. Soma-se a isto o fato de que as linfonodomegalias descritas não foram superiores a 30 mm, com menor risco de compressão secundária das vias biliares. CONCLUSÃO A casuística aqui apresentada, embora limitada, mostra a importância dos achados tomográficos para o estadiamento do envolvimento abdominal da PCM, uma vez que 69,2% dos nossos pacientes em tratamento atual ou prévio para esta micose sistêmica apresentaram alterações na TC de abdome, sendo esta frequência alta e concordante com dados da literatura, destacando-se os achados de hepatoesplenomegalia, linfonodomegalias e alterações de suprarrenais. Agradecimentos Os autores agradecem a colaboração do médico radiologista Rodrigo Delfino Nascimento, pertencente à nossa Instituição, pela revisão do texto. REFERÊNCIAS 1. Restrepo A, Tobón AM, Agudelo CA. Paracoccidioidomycosis. In: Hospenthal DR, Rinaldi MG, editors. Diagnosis and treatment of human mycoses. 1st ed. Totowa, NJ: Humana Press; 2008. p. 331-42. 2. Travassos LR, Taborda CP, Colombo AL. Treatment options for paracoccidioidomycosis and new strategies investigated. Expert Rev Anti Infect Ther. 2008;6:251-62. 3. Carmo Junior J, Rodrigues JHL, Adad SJ, et al. Paracoccidioidomicose: formas abdominais abordadas cirurgicamente. Rev Med Minas Gerais. 1991;1:3-5. 4. Costa MAB, Carvalho TN, Araújo Júnior CR, et al. Manifestações extrapulmonares da paracoccidioidomicose. Radiol Bras. 2005;38:45-52. 5. Shikanai-Yasuda MA, Telles Filho FQ, Mendes RP, et al. Consenso em paracoccidioidomicose. Rev Soc Bras Med Trop. 2006;39:297-310. 6. Veronesi R, Focaccia R, Dietze R. Doenças infecciosas e parasitárias. 9ª ed. Rio de Janeiro, RJ: Guanabara Koogan; 2008. 7. Goldani LZ. Gastrointestinal paracoccidioidomycosis: an overview. J Clin Gastroenterol. 2011;45:87-91. 8. Fonseca LC, Mignone C. Paracoccidioidomicose do intestino delgado: aspectos anátomo-clínicos e radiológicos em 125 casos. Rev Hosp Clin Fac Med S Paulo. 1976;31:199-207. 9. Blotta MH, Mamoni RL, Oliveira SJ, et al. Endemic regions of paracoccidioidomycosis in Brazil: a clinical and epidemiologic study of 584 cases in the southeast region. Am J Trop Med Hyg. 1999;61:390-4. 10. Brummer E, Castaneda E, Restrepo A. Paracoccidioidomycosis: an update. Clin Microbiol Rev. 1993;6:89-117. 11. Franco M, Montenegro MR, Mendes RP, et al. Paracoccidioidomycosis: a recently proposed classification of its clinical forms. Rev Soc Bras Med Trop. 1987;20:129-32. 12. Martinez R, Bellucci AD, Fiorillo AM. A tomografia computadorizada na avaliação do comprometimento abdominal na paracoccidioidomicose. Rev Soc Bras Med Trop. 1988;21:47-50. 13. Gosink BB, Leymaster CE. Ultrasonic determination of hepatomegaly. J Clin Ultrasound. 1981;9:37-44. 14. Kratzer W, Fritz V, Mason RA, et al. Factors affecting liver size: a sonographic survey of 2080 subjects. J Ultrasound Med. 2003;22:1155-61. 15. Goldman SM, Kenney PJ. The adrenal gtlands. In: Lee JKT, Sagel SS, Stanley RJ, et al., editors. Computed body tomography with MRI correlation. 4th ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2006. p. 1312-73. 16. Marsiglia I, Pinto J. Adrenal cortical insufficiency associated with paracoccidioidomycosis (South American blastomycosis). Report de four patients. J Clin Endocrinol Metab. 1966;26:1109-15. 17. Silva AL, Giacomin RT, Silva BD. Paracoccidioidomicose ganglionar abdominal calcificada. Rev Soc Bras Med Trop. 1991;24:253-5. 1. Membros Titulares do Colégio Brasileiro de Radiologia e Diagnóstico por Imagem (CBR), Médicos Radiologistas do Setor de Tomografia Computadorizada do Instituto de Infectologia Emílio Ribas (IIER), São Paulo, SP, Brasil 2. Médica Residente em Infectologia do Instituto de Infectologia Emílio Ribas (IIER), São Paulo, SP, Brasil 3. Mestre, Diretora Técnica da Divisão de Apoio Diagnóstico e Terapêutico do Instituto de Infectologia Emílio Ribas (IIER), São Paulo, SP, Brasil 4. Doutora, Médica Infectologista do Setor de Micoses Profundas do Instituto de Infectologia Emílio Ribas (IIER), São Paulo, SP, Brasil 5. Pós-Doutor, Médico Radiologista do Setor de Tomografia Computadorizada do Instituto de Infectologia Emílio Ribas (IIER), São Paulo, SP, Brasil Endereço para correspondência: Dra. Marli Batista Fernandes Vermelho Divisão de Apoio Diagnóstico e Terapêutico - Instituto de Infectologia Emílio Ribas Avenida Doutor Arnaldo, 165, Cerqueira César São Paulo, SP, Brasil, 01246-900 E-mail: marlivermelho@globo.com Recebido para publicação em 13/12/2013. Aceito, após revisão, em 20/8/2014. Trabalho realizado no Instituto de Infectologia Emílio Ribas (IIER), São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554