Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 48 nº 2 - Mar. / Abr. of 2015
Vol. 48 nº 2 - Mar. / Abr. of 2015
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Sara Reis Teixeira1; Jorge Elias Junior2; Marcello Henrique Nogueira-Barbosa3; Marcos Duarte Guimarães4; Edson Marchiori5; Marcel Koenigkam Santos1 |
|
|
Descritores: Ressonância magnética; Ressonância magnética de corpo inteiro; Difusão; Pediatria. |
|
|
Resumo: INTRODUÇÃO
Até recentemente, imagem de corpo inteiro em crianças era realizada apenas com radiografias simples, cintilografia e tomografia por emissão de pósitrons (PET) combinada ou não à tomografia computadorizada (CT). Porém, estes métodos de imagem apresentam a desvantagem de exposição à radiação ionizante, principalmente para as crianças, que são mais suscetíveis aos efeitos carcinogênicos mesmo com baixas doses de radiação ionizante(1). A ressonância magnética (RM) vem, cada vez mais, ganhando importância na avaliação dos pacientes pediátricos, uma vez que não utiliza radiação ionizante. Além disso, o desenvolvimento das técnicas de RM, o aumento da disponibilidade de equipamentos de alto campo, o aprimoramento das bobinas corpóreas e o aparecimento de novos softwares reduziram o tempo de exame e permitiram que esta ferramenta também pudesse ser empregada na avaliação do corpo inteiro(2,3). A RM de corpo inteiro (RMCI) em pediatria foi inicialmente usada para estadiamento de linfoma(4), mas atualmente seu uso está sendo expandido para avaliação de outras doenças sistêmicas. Além da avaliação oncológica pediátrica, destaca-se o uso da RMCI em processos inflamatórios e/ou infecciosos(5,6), osteonecrose(7), lesões de tecidos moles como miosites(8,9), neurofibromatose(10), malformações vasculares e angiomatoses múltiplas(11,12), trauma não acidental(13), composição corporal de gordura(14) e autópsia virtual(15,16). A RMCI é um exame realizado com sequências rápidas adquiridas habitualmente apenas em um ou dois planos com o objetivo primário de rastreamento e não é, portanto, utilizada para mostrar detalhes anatômicos como um exame dedicado e específico para determinada região(17). Por meio da interpretação de sequências tradicionais rápidas morfológicas ponderadas em T1, T2 ou sequências com inversãorecuperação como short tau inversion-recovery (STIR), em conjunto com sequências funcionais como a difusão (diffusion weighted imaging - DWI), é possível obter um mapeamento morfológico/funcional do corpo inteiro fornecendo informações relevantes sobre o nível de comprometimento e atividade de determinada doença(18-20). O objetivo deste artigo é apresentar uma revisão atualizada sobre a utilização da RMCI na população pediátrica. CONSIDERAÇÕES TÉCNICAS RMCI é habitualmente realizada com aquisição de um, dois, três ou mais blocos de imagens, a depender do tamanho do paciente e da região a ser examinada, porém não há consenso a este respeito. Posteriormente, as imagens são alinhadas por meio de softwares específicos, adquirindo a forma de corpo inteiro(21,22) (Figura 1). Reposicionamentos dos pacientes às vezes são necessários, dependendo do tipo de bobina e tamanho do paciente a ser examinado. Os exames de RMCI devem ser realizados em aparelhos de RM preferencialmente de alto campo (1,5 T ou mais) com o uso de bobina de superfície ou corpórea. A utilização de um tabletop móvel, mesa extensora, bobinas integradas(3,23) ou bobina de superfície de corpo com espaçadores(24) é preferível, pois reduz drasticamente o tempo de exame e a necessidade de reposicionamento. O uso de bobinas integradas é o que apresenta melhor sinal/ruído, homogeneidade de campo e permite o exame dedicado para uma região específica ao mesmo tempo(25). 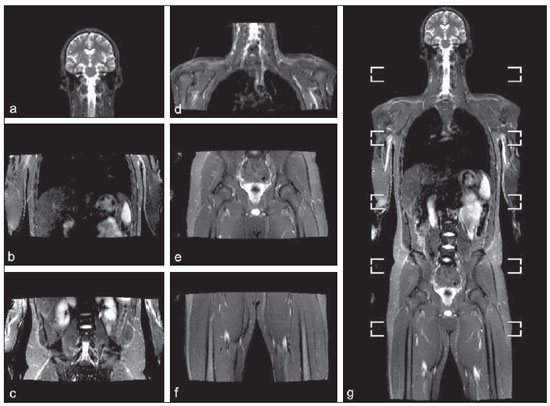 Figura 1. Aquisição da imagem. RMCI em um paciente masculino de 18 anos, re-estadiamento de linfoma. Sequência STIR, aquisição coronal em blocos (a-f) e reformatação pela técnica mobiview (g). Sedação ou imobilização dos recém-nascidos e lactentes e outros pacientes não colaborativos devem seguir as normas da instituição. Os pacientes devem ser examinados da cabeça aos pés, em posição supina, com os braços alinhados junto ao corpo e as pernas fechadas (Figura 2). No caso de o paciente ser maior, artefatos nas extremidades do campo de visão podem reduzir a qualidade das imagens, sendo muitas vezes necessária a realização das imagens dos membros superiores com estes posicionados acima da cabeça e sequências específicas para avaliação dos pés(3) (Figura 2). A sincronização dos movimentos respiratório e cardíaco empregando-se gates externos pode ser útil para se evitar os artefatos de movimentos fisiológicos no tórax e abdome(21,26). 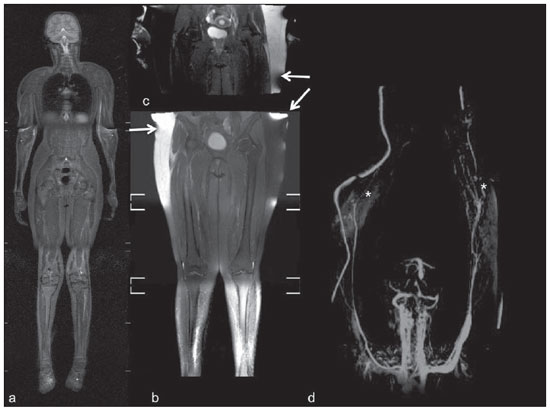 Figura 2. Posicionamento do paciente. A figura a (coronal STIR, reformatação mobiview) mostra o posicionamento habitual de um paciente com as pernas fechadas e membros superiores adjacentes ao corpo. Nas figuras b (coronal STIR, reformatação dos blocos dos membros inferiores) e c (um bloco da pelve) há muitos artefatos de extremidades (setas). Os membros superiores (asterisco) tiveram que ser posicionados acima da cabeça para melhor avaliação (d, angiografia pós-injeção de gadolínio) nesta paciente de 16 anos, encaminhada por malformações vasculares periféricas. O plano de aquisição preferencial das sequências básicas do exame de RMCI é o plano coronal, pois, além da aquisição ser mais rápida, os ossos longos são muito bem avaliados. O plano coronal apresenta, porém, algumas limitações, como na avaliação do gradil costal, esterno, crânio e coluna vertebral(27) e menor sensibilidade para detecção de lesões alvos quando comparado ao plano axial(28). Portanto, sequências adicionais adquiridas nos planos sagital da coluna e pés ou axial do tórax e abdome podem ser necessárias, dependendo da indicação clínica. A escolha do tipo de sequência é determinada pela indicação clínica e os tecidos alvos principais a serem estudados para determinadas situações clínicas. Como sequências básicas primárias na maioria dos serviços, são realizadas sequências rápidas de eco de spin (TSE - turbo spin-echo) ponderadas em T2 com saturação de gordura ou com pulsos de inversão recuperação (STIR) no plano coronal. A técnica de STIR é preferida, pois apresenta maior homogeneidade de sinal e tem maior sensibilidade na detecção de lesões metastáticas do que TSE(4,29-31), já que suprime não apenas o tecido gorduroso, mas também o tecido estacionário(4). Quando necessário, as sequências TSE ponderadas em T2 são realizadas no plano axial por serem mais rápidas que inversão recuperação. Para aumentar a especificidade do exame, as sequências TSE ponderadas em T1 também devem ser adquiridas no plano coronal. Imagens T1 de eco de gradiente são mais rápidas e podem auxiliar no diagnóstico de lesões metastáticas na medula óssea, porém sua sensibilidade e resolução de contraste são menores em relação à sequência TSE(23). Para a correta interpretação dos exames de RMCI ou RM de qualquer região do corpo em pediatria, é de extrema importância o conhecimento e familiarização com as áreas de medula óssea hematopoiética e transformação gordurosa(3,32). Neste sentido, em pediatria a realização das sequências ponderadas em T1 é fundamental para avaliação da conversão medular óssea normal e na diferenciação entre lesões metastáticas ou medula óssea normal(33). Sequências ponderadas em T1 após a administração intravenosa de gadolínio são usadas por alguns grupos na avaliação oncológica, porém não são realizadas rotineiramente na prática clínica, já que prolongam o tempo de exame, e ainda não foi comprovado que sua utilização aumenta a acurácia do método(3,34). Todavia, nos exames em que são necessários estudos angiográficos, o uso do meio de contraste intravenoso é recomendado(35) (Figura 3). 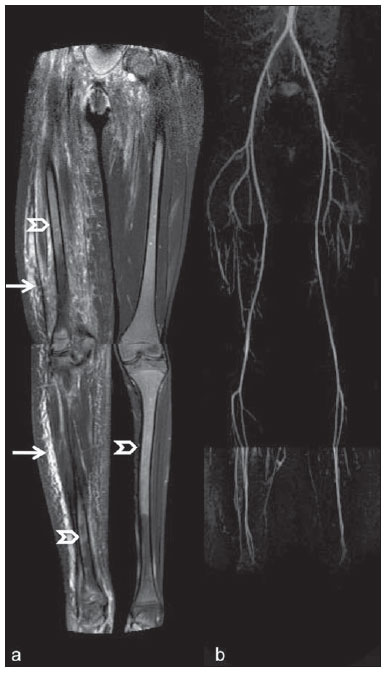 Figura 3. Blocos dos membros inferiores, coronal STIR (a) e angiografia fase arterial após administração de gadolínio (b) de uma paciente do sexo feminino, 14 anos, para avaliação da extensão de malformações vasculares. No estudo angiográfico, ausência de fístulas ou malformações arteriovenosas confirmando a hipótese de malformações vasculares de baixo fluxo. Nota-se hipersinal difuso de tecidos moles, mais acentuado à direita (setas), e da medula óssea (cabeças de setas) nos membros inferiores, que não era evidente por outros métodos de imagem, sugestivo de acometimento ósseo e dos tecidos adjacentes. Sequências funcionais como a DWI têm sido cada vez mais empregadas em RMCI. DWI com imagem single-shot spin-echo planar (SSh EPI) pode fornecer informações sobre a celularidade e necrose tecidual(36). Estas sequências baseiam-se no movimento aleatório dos prótons das moléculas de água através dos tecidos biológicos, que leva à dispersão fásica dos spins, resultando em perda do sinal na sequência sensível à difusão. Esta intensidade de sinal da região objeto de estudo pode ser analisada quantitativamente pelo cálculo do coeficiente aparente de difusão (apparent diffusion coefficient - ADC), expresso em milímetros ao quadrado por segundo (mm2/s)(18,37). A DWI associada à saturação de gordura e aquisição em múltiplos cortes axiais com elevado número de excitações (DWIBS)(37) é, atualmente, a técnica mais empregada em RMCI e objeto de estudo em múltiplos cenários(38,39) (Figura 4). 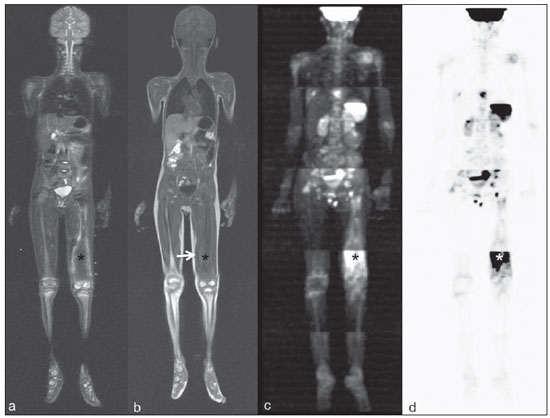 Figura 4. Estadiamento de osteossarcoma osteoblástico na diáfise distal do fêmur esquerdo (asterisco) em paciente do sexo masculino de 6 anos. A lesão apresenta importante reação periosteal (seta) caracterizada nas radiografias simples como "em raios de sol", com componente de tecidos moles e restrição nas sequências de difusão (c,d). Ausência de lesões secundárias a distância ou skip lesions. a: Coronal STIR; b: coronal T1; c: coronal DWIBS; d: DWIBS, invertido. Independentemente da indicação clínica, o exame de RMCI deve ser rápido, com o máximo de acurácia possível, não excedendo 50 minutos no total(26). Idealmente, o exame deve ser realizado com o mínimo de sequências, se possível com apenas uma, tendo como preferência em pediatria a sequência STIR no plano coronal(4,6,31) (Figura 4). PRINCIPAIS INDICAÇÕES DE RMCI EM PEDIATRIA Paciente pediátrico oncológico A capacidade de se detectar lesões primárias ou secundárias em diversos sítios como encéfalo, região cervical, órgãos torácicos, abdominais, medula óssea e sistema musculoesquelético por meio de um mesmo exame foi um dos fatores que impulsionaram o desenvolvimento da RMCI em pediatria(3,26). As indicações da RMCI dependem do tipo de neoplasia e da etapa de avaliação da doença. Diversas doenças oncológicas incluem a RMCI na sua avaliação inicial(22,40,41), rastreamento, estadiamento, avaliação de resposta e no seguimento pós-terapêutico(22,26,42). A sensibilidade da RMCI é semelhante à da PET/CT no estadiamento de diferentes neoplasias e superior a outros métodos como a TC, a cintilografia com gálio ou a cintilografia óssea, tanto na avaliação de metástases ósseas como de metástases extraósseas(41,43-45). A RMCI tem a capacidade de realizar uma avaliação adequada da medula óssea corporal e detectar sítios neoplásicos comprometidos, seja pelo tumor primário ou por metástases decorrentes da disseminação(46) (Figura 5). 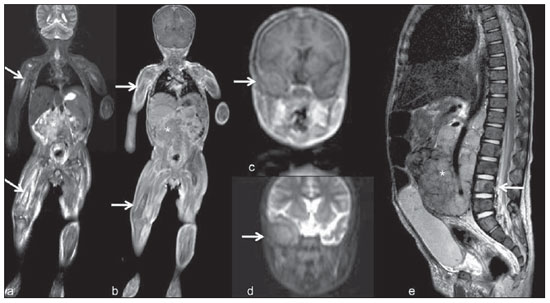 Figura 5. Estadiamento de neuroblastoma abdominal (asteriscos) em paciente do sexo masculino, de 1 ano e 7 meses. Há múltiplas metástases ósseas (setas) nos membros superiores, inferiores, crânio e coluna vertebral. a e d: Coronal STIR; b e c: coronal T1 GE; e: sagital TSE T2 da coluna vertebral. A RMCI tem boa acurácia diagnóstica na avaliação de resposta terapêutica de pacientes oncológicos(47,48). O aumento do valor de ADC sugere boa resposta após quimioterapia ou radioterapia e já foi descrito em estudos incluindo neoplasias cerebrais, tumores hepáticos e sarcomas(36,48). Nos linfomas há redução do volume tumoral nas sequências morfológicas e aumento do ADC nas sequências de DWI(41,43) (Figura 6). 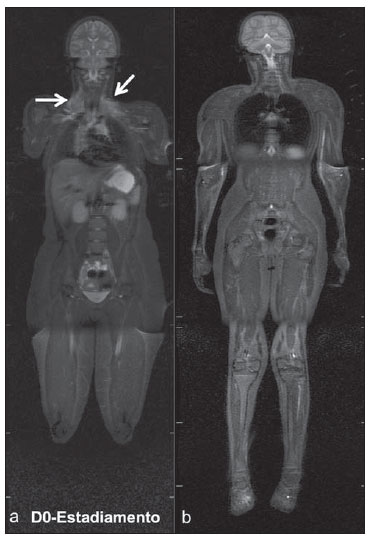 Figura 6. Coronal STIR, reformatação mobiview. Paciente de 17 anos com linfoma, apresentando múltiplas linfadenopatias cervicais (setas) e mediastinais no exame de estadiamento (a) e regressão das massas no D180 (b) após início do tratamento. A RMCI também pode ser usada na distinção entre alteração cicatricial, recidiva no seguimento pós-terapêutico(49) e na detecção de complicações. Rastreamento oncológico em populações de risco O objetivo do rastreamento de tumores é detectar o câncer em um estágio inicial, quando ainda pode ser tratável e curável(50). O rastreamento deve ser empregado em uma população aparentemente saudável com alto risco para o desenvolvimento de tumores, como é o caso de algumas síndromes hereditárias. Como exemplos, temos a neoplasia endócrina múltipla (NEM) I e II, a síndrome de von Hippel-Lindau, a polipose adenomatosa familiar e a síndrome de Li-Fraumeni(51,52). Lesões não neoplásicas ósseas multifocais e de tecidos moles A RMCI permite definir o padrão de distribuição de lesões, quantificá-las e mostrar o melhor local para biópsias. Na histiocitose de células de Langerhans, a RMCI pode ser usada para avaliação da extensão do comprometimento ósseo e seguimento do paciente, com sensibilidade, especificidade e acurácia semelhantes ou superiores aos métodos tradicionais, como a cintilografia óssea, a TC, a metaiodobenzilguanidina e a PET/CT(22,53). A RMCI também é muito útil no diagnóstico e seguimento de pacientes com osteomielite multifocal(54) (Figura 7) e osteonecrose multifocal, que ocorre geralmente secundária a efeitos colaterais do uso de altas doses de quimioterápicos e medicamentos do grupo dos corticoides. A RMCI pode mostrar múltiplas lesões em pacientes assintomáticos(7), auxiliando no tratamento precoce do paciente e, desta forma, na prevenção de complicações. 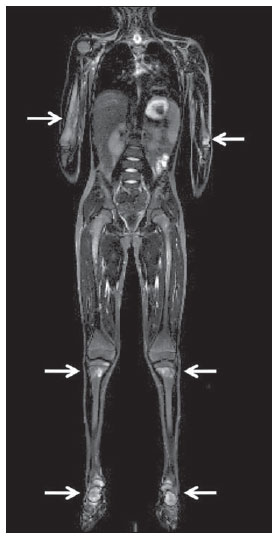 Figura 7. Osteomielite multifocal recorrente em paciente de 8 anos, do sexo masculino. Múltiplas lesões ósseas com hipersinal (setas), além de remodelamento ósseo no úmero direito. Visão corpo inteiro, coronal STIR. Em pacientes com alto risco de lesões multifocais (pós-transplante, falcêmicos, recém-nascidos) ou em casos de processos infecciosos graves, como fasciites necrosantes ou choque séptico em pacientes inconscientes ou sedados em que o acompanhamento clínico é difícil, a RMCI tem papel importante(55). Além da avaliação precisa das lesões ósseas, o método permite igualmente detectar lesões extraósseas associadas, como êmbolos sépticos pulmonares, abscessos esplênicos e coleções em tecidos moles(55). Apesar de as radiografias simples ainda serem o padrão ouro para avaliação de traumatismos não acidentais, a RMCI pode auxiliar na detecção de edema medular ósseo, com maior especificidade, lesões traumáticas hepáticas, hemotórax e coleções extra-axiais cranianas(13). Miopatias como miosites, polimiosites, dermatopolimiosites e distrofias musculares também podem se beneficiar da RMCI, que mostrará adequadamente o padrão de distribuição da doença, o melhor local para biópsias e o seguimento pós-tratamento(8,9). O seguimento de pacientes com neurofibromatoses vem sendo estudado por vários grupos, já que RMCI mostra com precisão a extensão dos neurofibromas plexiformes e permite acurado cálculo volumétrico(10) (Figura 8). 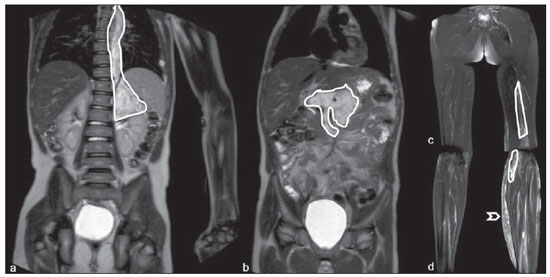 Figura 8. Avaliação da extensão de neurofibromas (contornos) em paciente com neurofibromatose. Há edema (cabeça de seta) no membro inferior esquerdo decorrente de compressão vascular pelos neurofibromas. a e b: Bloco do tronco, coronal T2 TSE; c e d: blocos dos membros inferiores, coronal STIR. Malformações vasculares Malformações difusas do desenvolvimento vascular (Figura 3) venoso ou linfático, como hemangiomatoses e linfangiomatoses (Figura 9), são bem avaliadas pela RMCI. Como estas lesões podem acometer diferentes compartimentos, incluindo planos corporais superficiais como pele, tecido celular subcutâneo e grupos musculares, e planos corporais profundos como estruturas ósseas, torácicas e abdominais, a RMCI possibilita não somente a identificação destas lesões, mas também uma avaliação panorâmica da sua distribuição e dos sítios comprometidos(11). É um excelente método de avaliação pós-terapêutica e seguimento(12). 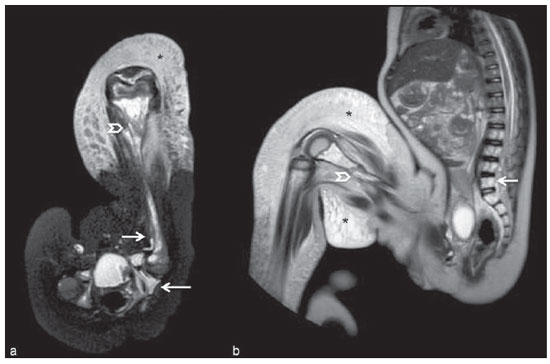 Figura 9. Avaliação do comprometimento ósseo e visceral em um paciente de três anos com linfangiomatose difusa (doença de Gorham). Em razão da posição viciosa do paciente, secundária a deformidades causadas pela doença, o plano sagital do corpo foi o mais adequado. Há extensa lesão com hipersinal nas sequências T2 e STIR de tecidos moles (asteriscos) no membro inferior esquerdo, além do comprometimento ósseo difuso (setas), inclusive da coluna vertebral, e uma fratura patológica na diáfise femoral (cabeça de seta). a: Coronal STIR do membro inferior esquerdo; b: sagital T2 TSE do corpo inteiro. Autópsia virtual Nos períodos fetal e neonatal as autópsias são essenciais em predizer riscos futuros. A RMCI pode atuar como ferramenta alternativa, permitindo uma avaliação corporal total menos invasiva e com alta acurácia(15,16). Entretanto, apesar de ser mais aceita e fornecer informações importantes, a técnica não pode ainda substituir a autópsia tradicional(3) (Figura 10). 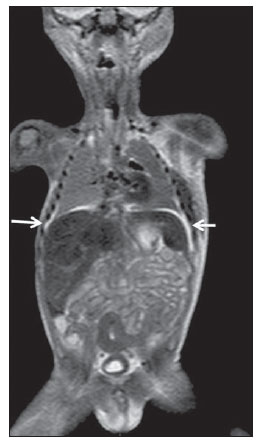 Figura 10. Autópsia virtual (coronal T2 TSE) em um feto de 26 semanas, que apresentava agenesia de corpo caloso. Tórax e abdome normais. A presença de derrame pleural (setas) é normal no estudo post-mortem. (Figura gentilmente cedida pela Dra. Catherine Garel, do Hôpital Armand-Trousseau, Paris, França). LIMITAÇÕES DA RMCI Algumas limitações podem dificultar o emprego da RMCI na prática clínica pediátrica. O longo período de tempo para realização do exame, podendo variar entre 20 e 60 minutos, faz com que seja necessário o emprego de sedação em parte dos pacientes, sobretudo naqueles com menos idade. Artefatos relacionados aos movimentos respiratórios, batimentos cardíacos e peristalse intestinal podem também degradar as imagens(56). Para minimizar a ocorrência desses artefatos, é recomendável a utilização de técnicas rápidas de aquisição de imagens, com equipamentos de múltiplos canais, bobinas corpóreas e imagem paralela(56). Para a detecção de lesões pequenas menores que 6 mm no plano coronal - plano básico e mais utilizado em RMCI -, principalmente pulmonares ou ganglionares, a RMCI ainda apresenta baixa sensibilidade(43,57). Portanto, sequências adicionais no plano axial ou DWI podem ser necessárias, o que leva ao aumento do tempo de exame. A utilização do contraste intravenoso paramagnético deve ser feita com cautela, uma vez que o risco de reações alérgicas, embora pequeno, está presente, e o risco de fibrose sistêmica nefrogênica não pode ser menosprezado nos pacientes pediátricos(3,22). A interpretação do exame de RMCI pode ser difícil e também é um fator limitante em pediatria. Para examinadores pouco familiarizados, não só os artefatos das extremidades do campo de visão e de movimentos respiratórios, cardíacos e peristálticos, mas a heterogeneidade fisiológica da medula óssea em crianças, tanto nas sequências morfológicas como funcionais(55), são um problema. RECENTES AVANÇOS O desenvolvimento de RM de alto campo de 3 T e de bobinas de superfície corporal tem proporcionado melhor resolução espacial e relação sinal/ruído, fornecendo imagens de melhor qualidade. O incremento da técnica e a popularização permitirão que a RMCI substitua aos poucos os métodos convencionais na avaliação de corpo inteiro, principalmente em oncologia(22). Porém, nos equipamentos de 3 T há um aumento de artefatos de suscetibilidade magnética, principalmente nas sequências de DWI, além do aumento da razão específica de absorção limitar sequências com supressão de gordura(39). Tracking only navigator é também uma nova técnica desenvolvida para reduzir artefatos de movimento a um discreto aumento do tempo, porém ainda precisa de estudos clínicos para se estabelecer definitivamente na rotina(39). CONCLUSÃO Apesar de ainda não existir padronização para avaliação de lesões multifocais em pediatria, a RMCI figura entre os exames de escolha. É um método isento dos riscos da radiação ionizante e de elevada acurácia quando comparado aos métodos tradicionais de imagem de corpo inteiro. A capacidade de fornecer informações morfológicas e funcionais em um único exame torna este método bastante atraente e promissor no manejo de pacientes pediátricos. Porém, deve-se considerar que ainda é usado não para avaliação anatômica detalhada, mas sim como screening de lesões multifocais. Agradecimentos À Dra. Catherine Garel, que gentilmente cedeu a imagem da Figura 10, autópsia virtual. REFERÊNCIAS 1. Brenner DJ. Estimating cancer risks from pediatric CT: going from the qualitative to the quantitative. Pediatr Radiol. 2002;32:228-31; discussion 242-4. 2. Atri M. New technologies and directed agents for applications of cancer imaging. J Clin Oncol. 2006;24:3299-308. 3. Darge K, Jaramillo D, Siegel MJ. Whole-body MRI in children: current status and future applications. Eur J Radiol. 2008;68:289-98. 4. Kellenberger CJ, Miller SF, Khan M, et al. Initial experience with FSE STIR whole-body MR imaging for staging lymphoma in children. Eur Radiol. 2004;14:1829-41. 5. Fritz J, Tzaribatchev N, Claussen CD, et al. Chronic recurrent multifocal osteomyelitis: comparison of whole-body MR imaging with radiography and correlation with clinical and laboratory data. Radiology. 2009;252:842-51. 6. Goo HW, Yang DH, Ra YS, et al. Whole-body MRI of Langerhans cell histiocytosis: comparison with radiography and bone scintigraphy. Pediatr Radiol. 2006;36:1019-31. 7. Castro TC, Lederman H, Terreri MT, et al. The use of joint-specific and whole-body MRI in osteonecrosis: a study in patients with juvenile systemic lupus erythematosus. Br J Radiol. 2011;84:621-8. 8. O'Connell MJ, Powell T, Brennan D, et al. Whole-body MR imaging in the diagnosis of polymyositis. AJR Am J Roentgenol. 2002;179:967-71. 9. Schmidt GP, Reiser MF, Baur-Melnyk A. Whole-body imaging of the musculoskeletal system: the value of MR imaging. Skeletal Radiol. 2007;36:1109-19. 10. Cai W, Kassarjian A, Bredella MA, et al. Tumor burden in patients with neurofibromatosis types 1 and 2 and schwannomatosis: determination on whole-body MR images. Radiology. 2009;250:665-73. 11. Stein-Wexler R. MR imaging of soft tissue masses in children. Magn Reson Imaging Clin N Am. 2009;17:489-507, vi. 12. Sermon A, Gruwez JA, Lateur L, et al. The importance of magnetic resonance imaging in the diagnosis and treatment of diffuse lymphangioma. Acta Chir Belg. 1999;99:230-5. 13. Perez-Rossello JM, Connolly SA, Newton AW, et al. Whole-body MRI in suspected infant abuse. AJR Am J Roentgenol. 2010;195:744-50. 14. Thomas EL, Saeed N, Hajnal JV, et al. Magnetic resonance imaging of total body fat. J Appl Physiol. 1998;85:1778-85. 15. Alderliesten ME, Peringa J, van der Hulst VP, et al. Perinatal mortality: clinical value of postmortem magnetic resonance imaging compared with autopsy in routine obstetric practice. BJOG. 2003;110:378-82. 16. Thayyil S, Sebire NJ, Chitty LS, et al. Post-mortem MRI versus conventional autopsy in fetuses and children: a prospective validation study. Lancet. 2013;382:223-33. 17. Kavanagh E, Smith C, Eustace S. Whole-body turbo STIR MR imaging: controversies and avenues for development. Eur Radiol. 2003;13:2196-205. 18. Eiber M, Dütsch S, Gaa J, et al. Diffusion-weighted magnetic resonance imaging (DWI-MRI): a new method to differentiate between malignant and benign cervical lymph nodes. Laryngorhinootologie. 2008;87:850-5. 19. Koh DM, Padhani AR. Diffusion-weighted MRI: a new functional clinical technique for tumour imaging. Br J Radiol. 2006;79:633-5. 20. Vilanova JC, Barcelo J. Diffusion-weighted whole-body MR screening. Eur J Radiol. 2008;67:440-7. 21. Schaefer JF, Kramer U. Whole-body MRI in children and juveniles. Rofo. 2011;183:24-36. 22. Goo HW. Regional and whole-body imaging in pediatric oncology. Pediatr Radiol. 2011;41 Suppl 1:S186-94. 23. Chavhan GB, Babyn PS. Whole-body MR imaging in children: principles, technique, current applications, and future directions. Radiographics. 2011;31:1757-72. 24. Takahara T, Kwee T, Kibune S, et al. Whole-body MRI using a sliding table and repositioning surface coil approach. Eur Radiol. 2010;20:1366-73. 25. Schaefer JF, Schlemmer HP. Total-body MR-imaging in oncology. Eur Radiol. 2006;16:2000-15. 26. Ley S, Ley-Zaporozhan J, Schenk JP. Whole-body MRI in the pediatric patient. Eur J Radiol. 2009;70:442-51. 27. Koh DM, Collins DJ. Diffusion-weighted MRI in the body: applications and challenges in oncology. AJR Am J Roentgenol. 2007;188:1622-35. 28. Hirsch W, Krohmer S, Kluge R, et al. Preliminary results in wholebody MRI in children - a prospective study [abstr]. Pediatr Radiol. 2005;35(Suppl):S89. 29. Mazumdar A, Siegel MJ, Narra V, et al. Whole-body fast inversion recovery MR imaging of small cell neoplasms in pediatric patients: a pilot study. AJR Am J Roentgenol. 2002;179:1261-6. 30. Daldrup-Link HE, Franzius C, Link TM, et al. Whole-body MR imaging for detection of bone metastases in children and young adults: comparison with skeletal scintigraphy and FDG PET. AJR Am J Roentgenol. 2001;177:229-36. 31. Kellenberger CJ, Epelman M, Miller SF, et al. Fast STIR wholebody MR imaging in children. Radiographics. 2004;24:1317-30. 32. Siegel MJ, Luker GG. Bone marrow imaging in children. Magn Reson Imaging Clin N Am. 1996;4:771-96. 33. Meyer JS, Siegel MJ, Farooqui SO, et al. Which MRI sequence of the spine best reveals bone-marrow metastases of neuroblastoma? Pediatr Radiol. 2005;35:778-85. 34. Goo HW. Whole-body MRI of neuroblastoma. Eur J Radiol. 2010;75:306-14. 35. Hansen T, Wikström J, Eriksson MO, et al. Whole-body magnetic resonance angiography of patients using a standard clinical scanner. Eur Radiol. 2006;16:147-53. 36. Padhani AR, Liu G, Koh DM, et al. Diffusion-weighted magnetic resonance imaging as a cancer biomarker: consensus and recommendations. Neoplasia. 2009;11:102-25. 37. Takahara T, Imai Y, Yamashita T, et al. Diffusion weighted whole body imaging with background body signal suppression (DWIBS): technical improvement using free breathing, STIR and high resolution 3D display. Radiat Med. 2004;22:275-82. 38. Kwee TC, Takahara T, Ochiai R, et al. Whole-body diffusionweighted magnetic resonance imaging. Eur J Radiol. 2009;70:409-17. 39. Murtz P, Krautmacher C, Traber F, et al. Diffusion-weighted wholebody MR imaging with background body signal suppression: a feasibility study at 3.0 Tesla. Eur Radiol. 2007;17:3031-7. 40. Siegel MJ, Acharyya S, Hoffer FA, et al. Whole-body MR imaging for staging of malignant tumors in pediatric patients: results of the American College of Radiology Imaging Network 6660 Trial. Radiology. 2013;266:599-609. 41. Goo HW, Choi SH, Ghim T, et al. Whole-body MRI of paediatric malignant tumours: comparison with conventional oncological imaging methods. Pediatr Radiol. 2005;35:766-73. 42. Ballon D, Watts R, Dyke JP, et al. Imaging therapeutic response in human bone marrow using rapid whole-body MRI. Magn Reson Med. 2004;52:1234-8. 43. Punwani S, Taylor SA, Bainbridge A, et al. Pediatric and adolescent lymphoma: comparison of whole-body STIR half-Fourier RARE MR imaging with an enhanced PET/CT reference for initial staging. Radiology. 2010;255:182-90. 44. Kumar J, Seith A, Kumar A, et al. Whole-body MR imaging with the use of parallel imaging for detection of skeletal metastases in pediatric patients with small-cell neoplasms: comparison with skeletal scintigraphy and FDG PET/CT. Pediatr Radiol. 2008;38:953-62. 45. Daldrup-Link HE, Franzius C, Link TM, et al. Whole-body MR imaging for detection of bone metastases in children and young adults: comparison with skeletal scintigraphy and FDG PET. AJR Am J Roentgenol. 2001;177:229-36. 46. Karmazyn B, Cohen MD, Jennings SG, et al. Marrow signal changes observed in follow-up whole-body MRI studies in children and young adults with neurofibromatosis type 1 treated with imatinib mesylate (Gleevec) for plexiform neurofibromas. Pediatr Radiol. 2012;42:1218-22. 47. Li SP, Padhani AR. Tumor response assessments with diffusion and perfusion MRI. J Magn Reson Imaging. 2012;35:745-63. 48. Padhani AR, Khan AA. Diffusion-weighted (DW) and dynamic contrast-enhanced (DCE) magnetic resonance imaging (MRI) for monitoring anticancer therapy. Target Oncol. 2010;5:39-52. 49. Herman M, Paucek B, Raida L, et al. Comparison of magnetic resonance imaging and (67)gallium scintigraphy in the evaluation of posttherapeutic residual mediastinal mass in the patients with Hodgkin's lymphoma. Eur J Radiol. 2007;64:432-8. 50. Ducreux M, Mateus C, Planchard D, et al. Screening and early diagnosis of other cancers (non-small cell lung carcinoma, urologic cancers, liver cancer and melanoma). Rev Prat. 2010;60:219-23. 51. Testa JR, Malkin D, Schiffman JD. Connecting molecular pathways to hereditary cancer risk syndromes. Am Soc Clin Oncol Educ Book. 2013:81-90. 52. Villani A, Tabori U, Schiffman J, et al. Biochemical and imaging surveillance in germline TP53 mutation carriers with Li-Fraumeni syndrome: a prospective observational study. Lancet Oncol. 2011;12:559-67. 53. Krohmer S, Sorge I, Krausse A, et al. Whole-body MRI for primary evaluation of malignant disease in children. Eur J Radiol. 2010;74:256-61. 54. Butter F, Pohle C, Girschick H, et al. Chronic non-bacterial osteomyelitis (CNO): findings in the initial diagnostic imaging [conference paper]. Eur Radiol. 2004;B775(14S). 55. Alison M, Tilea B, Azoulay R, et al. IRM corps entier en pédiatrie: quand, comment, pourquoi? XXXIIIèmes Journées de Trousseau - 2011. [acessado em 2 de setembro de 2013. Disponível em: www.sfip-radiopediatrie.org/images/stories/Textes_reference/ref_locomoteur/alison_trousseau_2011.pdf. 56. Koh DM, Blackledge M, Padhani AR, et al. Whole-body diffusionweighted MRI: tips, tricks, and pitfalls. AJR Am J Roentgenol. 2012;199:252-62. 57. Frericks BB, Meyer BC, Martus P, et al. MRI of the thorax during whole-body MRI: evaluation of different MR sequences and comparison to thoracic multidetector computed tomography (MDCT). J Magn Reson Imaging. 2008;27:538-45. 1. Doutores, Médicos Assistentes do Centro de Ciências das Imagens e Física Médica (CCIFM) do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (HCFMRP-USP), Ribeirão Preto, SP, Brasil 2. Doutor, Professor Associado do Centro de Ciências das Imagens e Física Médica (CCIFM) do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (HCFMRP-USP), Ribeirão Preto, SP, Brasil 3. Doutor, Professor do Centro de Ciências das Imagens e Física Médica (CCIFM) do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (HCFMRP-USP), Ribeirão Preto, SP, Brasil 4. Doutor, Médico Assistente do Hospital Heliópolis e do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 5. Doutor, Professor Titular Departamento de Radiologia da Universidade Federal Fluminense (UFF), Niterói, RJ, Brasil Endereço para correspondência: Dra. Sara Reis Teixeira CCIFM - FMRP Avenida Bandeirantes, 3900, Monte Alegre Ribeirão Preto, SP, Brasil, 14049-900 E-mail: steixeira@hcrp.usp.br Recebido para publicação em 3/2/2014. Aceito, após revisão, em 24/3/2014. Trabalho realizado no Centro de Ciências das Imagens e Física Médica (CCIFM) do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (HCFMRP-USP), Ribeirão Preto, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554