Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 48 nº 2 - Mar. / Abr. of 2015
Vol. 48 nº 2 - Mar. / Abr. of 2015
|
ENSAIO ICONOGRÁFICO
|
|
|
|
|
Autho(rs): Eric Mendonça Bimbato1; Amanda Gontijo Carvalho2; Fabiano Reis3 |
|
|
Descritores: Ressonância magnética; Intoxicação; Encefalopatia; Doenças metabólicas. |
|
|
Resumo: INTRODUÇÃO
As doenças toxicometabólicas são condições que levam, por diferentes fisiopatologias, a alterações agudas ou crônicas do funcionamento do sistema nervoso central (SNC). Existem diferentes situações que podem modificar de algum modo esse funcionamento, dentre as quais se incluem o uso de drogas e substâncias recreacionais, as síndromes carenciais e os distúrbios metabólicos sistêmicos(1). Essas doenças, em algumas situações, podem assumir características neurorradiológicas típicas. O diagnóstico definitivo depende da correlação clínica e laboratorial. Este ensaio iconográfico, com casos do nosso arquivo didático, de exames realizados nos últimos 15 anos, tem como objetivo ilustrar os achados neurorradiológicos em afecções toxicometabólicas que permitem diagnosticar a sua causa específica. Características de imagem, como os sítios anatômicos acometidos e o padrão de sinal e realce em ressonância magnética (RM), podem ser úteis para definir a causa, em associação com dados clínicos e laboratoriais. O projeto foi aprovado pelo Comitê de Ética da Universidade Estadual de Campinas. ENCEFALOPATIA DE WERNICKE A encefalopatia de Wernicke é um quadro agudo, neuropsiquiátrico, que resulta da deficiência de tiamina. A tríade clássica de anormalidade ocular, ataxia e confusão mental é observada em somente 16% dos pacientes. A tiamina é essencial em diversas vias bioquímicas do cérebro. Embora a deficiência de tiamina seja classicamente associada ao alcoolismo, qualquer condição com desbalanço nutricional que dure mais que 2-3 semanas pode levar à depleção das reservas de tiamina, ocasionando lesões cerebrais em regiões de vulnerabilidade (as que têm alto teor de tiamina), como diencéfalo e tronco cerebral. Outras condições, além do alcoolismo, que podem cursar com déficits de tiamina são: hiperêmese gravídica, anorexia nervosa, realimentação após jejum, tireotoxicose, síndrome disabsortivas (inclusive as decorrentes de gastroplastia redutora), hemodiálise, diálise peritoneal, síndrome da imunodeficiência adquirida, gastroplastia com vômitos no pós-operatório(1,2). O diagnóstico presuntivo pode ser feito analisando-se os níveis de tiamina por análise direta do pirofosfato de tiamina em eritrócitos, cromatografia líquida de alta performance do sangue total ou pelo teste de ativação de eritrócito transquetolase. Pode-se também analisar, por cromatografia, os níveis de tiamina, monofosfato de tiamina e difosfato de tiamina em eritrócitos humanos. A RM é considerada o método mais importante para confirmar o diagnóstico, com sensibilidade de 53% e especificidade de 93%. Tipicamente, em T2/FLAIR, há hipersinal em regiões paraventriculares dos tálamos, do hipotálamo, dos corpos mamilares, da região periaquedutal, do assoalho do quarto ventrículo e da região paravermiana cerebelar (Figura 1); na sequência ponderada em difusão pode-se notar restrição nos tálamos. Lesões mais atípicas podem ser vistas no córtex e no esplênio do corpo caloso(2,3). 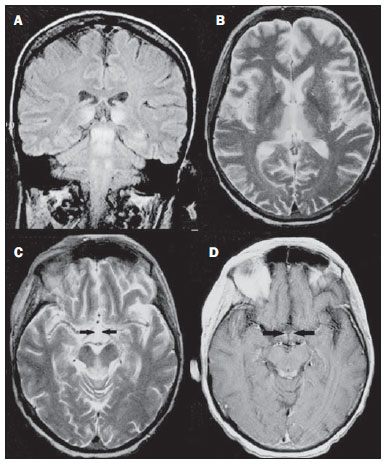 Figura 1. Síndrome de Wernicke. Paciente do sexo feminino, 47 anos. Coronal FLAIR (A) e axial T2 (B,C) mostram focos de hipersinal na substância cinzenta periaquedutal, tálamos em região paramediana, corpos mamilares (setas), tecto e tegmento do mesencéfalo. Em T1 após contraste (D) observa-se realce em corpos mamilares (setas) e tecto do mesencéfalo. ENCEFALOPATIA HEPÁTICA Síndrome neuropsiquiátrica potencialmente reversível que pode surgir em pacientes portadores de hepatopatia crônica avançada ou mesmo na insuficiência hepática aguda. Na RM, nas sequências ponderadas em T1, destaca-se o efeito paramagnético do manganês. Ocorre hipersinal bilateral e simétrico nos globos pálidos, putâmens, regiões subtalâmicas, substância negra e adeno-hipófise(4) (Figura 2). 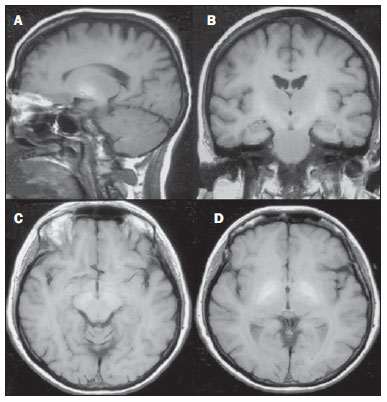 Figura 2. Encefalopatia hepática por vírus C. Paciente do sexo feminino, 69 anos. Em T1 sem contraste visualizam-se áreas de hipersinal na região dos globos pálidos, subtálamos e base dos pedúnculos cerebrais. SÍNDROME DA DESMIELINIZAÇÃO OSMÓTICA Doença desmielinizante geralmente associada com distúrbio hidroeletrolítico, particularmente à correção rápida de hiponatremia. Pacientes em uso crônico de álcool, uso prolongado de diuréticos, queimaduras extensas, hepatopatas graves, entre outros, apresentam fatores de risco para o seu desenvolvimento(5). Na sequência T1 da RM pode haver discreto hipossinal nos núcleos da base e na região central da ponte, preservando sua periferia(1). Nas sequências T2/FLAIR há hipersinal na porção central da ponte, preservando a periferia (Figura 3); além disso, podem ser observados focos de hipersinal nos núcleos da base, tálamos e substância branca dos hemisférios cerebrais(1,5). Esses achados, quando associados a aspectos clínicos e laboratoriais favoráveis à desmielinização osmótica, permitem o seu diagnóstico com segurança. 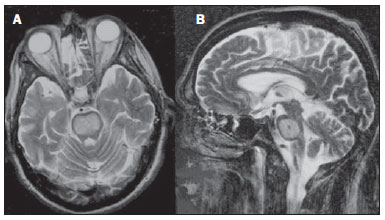 Figura 3. Síndrome da desmielinização osmótica. Paciente do sexo masculino, 49 anos. Em T2 axial (A) e sagital (B) observa-se área de hipersinal na ponte, com preservação do sinal na periferia. METANOL A intoxicação por metanol decorre da ingestão da substância de maneira acidental ou como forma de tentativa de suicídio. O produto final de sua metabolização é o ácido fórmico, principal responsável pelas lesões causadas nos nervos ópticos e cérebro(6,7). Na suspeita de intoxicação aguda, uma avaliação minuciosa do grau de acometimento ou de possíveis sequelas requer o uso da RM, incluindo o estudo das vias ópticas(1). Como achado mais característico, porém não específico, nota-se a presença de necrose putaminal bilateral, com hipersinal simétrico nas sequências T2/FLAIR(1,6) (Figura 4). Alguns casos podem apresentar hemorragias associadas. Outros achados que podem estar presentes na intoxicação grave incluem hemorragia intraventricular, necrose cerebelar, edema cerebral difuso e necrose do nervo óptico(1). À espectroscopia de prótons, observou-se pico invertido em 1.3 ppm (atribuível ao lactato) e redução do N-acetilaspartato (em decorrência do dano neuronal/axonal nesta área). 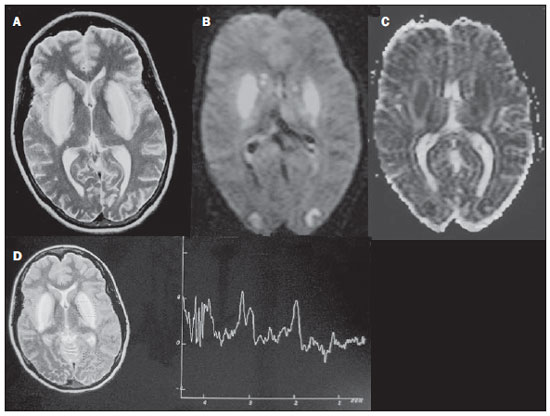 Figura 4. Intoxicação por metanol. Paciente do sexo feminino, 25 anos. Hipersinal simétrico e bilateral putaminal em T2/FLAIR (A) que restringe a difusão, hipersinal em difusão (B) e hipossinal no mapa de ADC (C). Notam-se lesões córtico-subcorticais em lobos occipitais, hiperintensas, que restringem a difusão. Espectroscopia com prótons com TE de 135 ms mostra pico invertido em torno de 1,3 ppm, atribuível ao lactato, além de redução do N-acetilaspartato (NAA) em 2,0 ppm. DOENÇA DE WILSON Anomalia hereditária transmitida de forma autossômica recessiva caracterizada pelo acúmulo tóxico de cobre no organismo. Pode haver depósitos desse metal no SNC. Os achados de imagem na RM do crânio são variáveis, entretanto, os mais comumente encontrados são alterações, na maioria das vezes simétricas, envolvendo os putâmens (sobretudo na porção mais externa), com hipersinal em T2(8) (Figura 5). Em alguns pacientes, áreas de hipossinal em T2 spin eco podem ser observadas nestes núcleos de substância cinzenta, que estão relacionadas, em estudos histopatológicos, a depósitos de compostos férricos. Outros sítios de substância cinzenta que podem ser acometidos são globo pálido, claustrum e núcleos subtalâmicos. 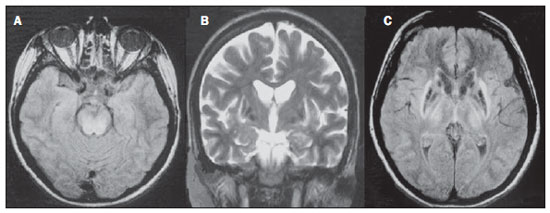 Figura 5. Doença de Wilson. Paciente do sexo feminino, 20 anos. Lesões com hipersinal em FLAIR (A) no tegmento do mesencéfalo e região periaquedutal e de colículos. Há também focos de hipossinal em FLAIR e T2 nos putâmens e cabeça dos núcleos caudados. Em alguns casos podemos encontrar o "sinal do rosto do panda" no mesencéfalo, caracterizado por lesões hiperintensas no tegmento associadas a sinal normal dos núcleos rubros e hipossinal nos colículos superiores(9). Além disso, nos casos que cursam com insuficiência hepática, pode-se ter o hipersinal espontâneo em T1 nos globos pálidos (em decorrência do acúmulo de manganês). Lesões em substância branca podem ser observadas, principalmente na transição córtico-subcortical nos lobos frontais e parietais. COCAÍNA O abuso de cocaína pode levar a uma destruição da mielina, com formação de vacúolos. Nestes casos, pode haver extenso envolvimento da substância branca dos hemisférios cerebrais, e cerebelo, que pode se estender pelos tratos de substância branca do tronco cerebral. Contudo, o abuso da cocaína, muito mais frequentemente está associado a complicações vasculares, como vasoespasmo e vasculite, podendo causar lesões isquêmicas na região dos núcleos da base(10). Cronicamente, usuários podem apresentar atrofia e lesões microvasculares não sintomáticas múltiplas que se caracterizam por focos hiperintensos em T2/FLAIR na substância subcortical das ínsulas e pequenos focos lacunares sequelares no território da artéria cerebral média (Figura 6). 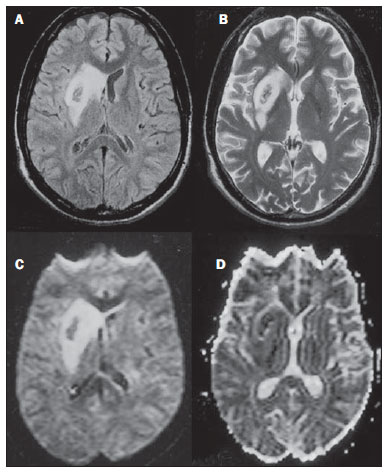 Figura 6. Acidente vascular encefálico isquêmico/arterite com infarto por uso de cocaína. Paciente do sexo masculino, 21 anos. Lesões presentes no putâmen, cabeça do núcleo caudado e braço anterior da cápsula interna à direita. Presença de área de hipersinal em T2/FLAIR, com foco de hipointensidade putaminal (hemorragia) (A,B). Na difusão há hipersinal (C) e no mapa de ADC (D) há hipossinal, exceto na área putaminal de transformação hemorrágica, que tem hipossinal na difusão e no mapa de ADC. DEFICIÊNCIA DE VITAMINA B12 As manifestações da deficiência de vitamina B12 podem estar associadas a um quadro clássico caracterizado por anemia megaloblástica associada a sintomas neurológicos decorrentes de ingestão inadequada da vitamina, da má-absorção (sobretudo em pacientes com alterações gástricas) ou outras condições que levam à sua deficiência. Os sintomas neurológicos incluem polineuropatia, mielopatia e neuropatia óptica. O diagnóstico laboratorial é feito dosando-se a cianocobalamina ou a homocisteína sérica e excreção urinária de ácido metilmalônico(11,12). Na microscopia do estudo anatomopatológico nota-se a vacuolização da mielina e de axônios. Ocorre degeneração seletiva dos funículos laterais e posteriores, acometendo mais comumente a coluna cervical e/ou torácica(1). Nas sequências em T1 da RM há discreto espessamento da medula espinal e em T2 nota-se hipersinal simétrico dos funículos posteriores e laterais da medula espinal, ou de pelo menos um dos funículos isoladamente(1,11) (Figura 7). Neste contexto, a correlação dos achados de imagem da RM com os dados clinicolaboratoriais é útil para o diagnóstico. 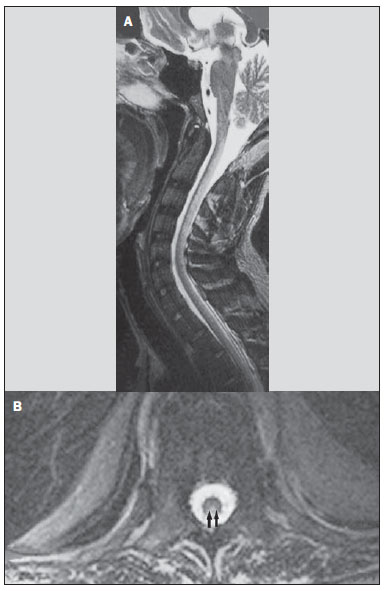 Figura 7. Deficiência de vitamina B12. Imagem sagital T2 (A) com hipersinal posterior na medula, estendendo-se continuamente em toda a medula cervical e visto em T2 axial (B) no funículo posterior (setas). ACÚMULO DE MANGANÊS NA TERAPÊUTICA DIALÍTICA PROLONGADA Os níveis normalmente relatados de manganês no cérebro excedem os do plasma em mais de 100 vezes e os canais transportadores deste metal incluem, entre outros, receptores de ligação transferrina dependentes. A principal via de eliminação do manganês no organismo parece ser a via biliar, sendo a excreção urinária praticamente desprezível. O achado mais frequentemente visto na RM nos pacientes com acúmulo de manganês é o hipersinal, em T1, bilateral e relativamente simétrico nos núcleos da base, especialmente no globo pálido e no núcleo estriado. Isto pode estar relacionado com o fato de, particularmente, os núcleos da base serem locais abundantes de receptores de transferrina. Os sintomas relacionados podem variar, sendo o parkinsonismo mais comumente observado, além de mioclonias(13). O acúmulo de manganês no SNC está também frequentemente presente em pacientes com encefalopatia hepática, nos submetidos a nutrição parenteral e nos com shunt venoso portossistêmico (congênito ou adquirido). Estudos têm relacionado o acúmulo de manganês no SNC (hipersinal em T1 nos núcleos da base - Figura 8) e seus sintomas em pacientes com insuficiência renal crônica submetidos a diálise prolongada. A razão para este acúmulo ainda é incerta, mas parece haver correlação com a disfunção de canais transportadores de manganês, facilitada pela terapêutica dialítica. A ingestão aumentada de compostos com este elemento também pode ser observada nesses pacientes(13). 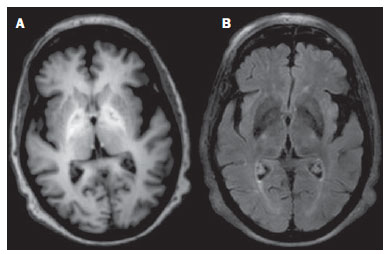 Figura 8. Paciente com insuficiência renal crônica em terapêutica dialítica prolongada, não apresentava hepatopatia. Axial T1 (A) identificando focos confluentes de hipersinal em T1 nos globos pálidos. Axial FLAIR (B) com hipossinal nos núcleos lentiformes. CONCLUSÃO A RM é uma ferramenta bastante útil para estreitar os possíveis diagnósticos diferenciais (inclusive, em alguns casos, define a causa específica) em pacientes com doenças toxicometabólicas e com comprometimento do SNC. O reconhecimento destes padrões de imagem é bastante útil para o médico radiologista, permitindo que o diagnóstico e a terapêutica sejam feitos precocemente. Além disso, orienta o clínico a solicitar os exames laboratoriais apropriados que possam corroborar o diagnóstico. REFERÊNCIAS 1. Silva CJ, Rocha A.J. Encefalopatias tóxicas, nutricionais e neurometabólicas adquiridas. In: Rocha AJ, Vedolin L, Mendonça RA, organizadores. Encéfalo. 1ª ed. Rio de Janeiro, RJ: Elsevier; 2012. p. 247-88. 2. Zuccoli G, Siddiqui N, Cravo I, et al. Neuroimaging findings in alcohol-related encephalopathies. AJR Am J Roentgenol. 2010;195:1378-84. 3. Zuccoli G, Pipitone N. Neuroimaging findings in acute Wernicke's encephalopathy: review of the literature. AJR Am J Roentgenol. 2009;192:501-8. 4. Rovira A, Alonso J, Córdoba J. MR imaging findings in hepatic encephalopathy. AJNR Am J Neuroradiol. 2008;29:1612-21. 5. Howard SA, Barletta JA, Klufas RA, et al. Best cases from the AFIP: osmotic demyelination syndrome. Radiographics. 2009;29:933-8. 6. Blanco M, Casado R, Vázquez F, et al. CT and MR imaging findings in methanol intoxication. AJNR Am J Neuroradiol. 2006;27:452-4. 7. Arora V, Nijjar IBS, Multani AS, et al. MRI findings in methanol intoxication: a report of two cases. Br J Radiol. 2007;80:e243-6. 8. King AD, Walshe JM, Kendall BE, et al. Cranial MRI imaging in Wilson's disease. AJR Am J Roentgenol. 1996;167:1579-84. 9. Sinha S, Taly AB, Prashanth LK, et al. Sequential MRI changes in Wilson's disease with de-coppering therapy: a study of 50 patients. Br J Radiol. 2007;80:744-9. 10. Filley CM, Kleinschmidt-DeMasters BK. Toxic leukoencephalopathy. N Engl J Med. 2001;345:425-32. 11. Ravina B, Loevner LA, Bank W. MR findings in subacute combined degeneration of the spinal cord: a case of reversible cervical myelopathy. AJR Am J Roentgenol. 2000;174:863-5. 12. Naidich MJ, Ho SU. Case 87: Subacute combined degeneration. Radiology. 2005;237:101-5. 13. da Silva CJ, da Rocha AJ, Jeronymo S, et al. A preliminary study revealing a new association in patients undergoing maintenance hemodialysis: manganism symptoms and T1 hyperintense changes in the basal ganglia. AJNR Am J Neuroradiol. 2007;28:1474-9. 1. Médico Residente de Radiologia e Diagnóstico por Imagem da Universidade Estadual de Campinas (Unicamp), Campinas, SP, Brasil 2. Acadêmica de Medicina da Faculdade de Ciências Médicas da Universidade Estadual de Campinas (FCM-Unicamp), Campinas, SP, Brasil 3. Doutor, Professor do Departamento de Radiologia e Diagnóstico por Imagem, Docente Responsável pela Divisão de Neurorradiologia do Departamento de Radiologia e Diagnóstico por Imagem da Universidade Estadual de Campinas (Unicamp), Campinas, SP, Brasil Endereço para correspondência: Dr. Fabiano Reis FCM-Unicamp - Departamento de Radiologia Rua Tessália Vieira de Camargo, 126, Cidade Universitária Zeferino Vaz Caixa Postal: 6111. Campinas, SP, Brasil, 13083-887 E-mail: fabianoreis2@gmail.com Recebido para publicação em 16/9/2013. Aceito, após revisão, em 10/2/2014. Trabalho realizado na Universidade Estadual de Campinas (Unicamp), Campinas, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554