Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 48 nº 1 - Jan. / Fev. of 2015
Vol. 48 nº 1 - Jan. / Fev. of 2015
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Agnes Araujo Valadares1; Paulo Schiavom Duarte2; Eduardo Bechtloff Woellner1; George Barberio Coura-Filho2; Marcelo Tatit Sapienza3; Carlos Alberto Buchpiguel4 |
|
|
Descritores: 18F-NaF PET/CT; SUV; Corrente de tubo; mAs. |
|
|
Resumo: INTRODUÇÃO
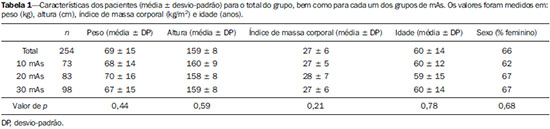
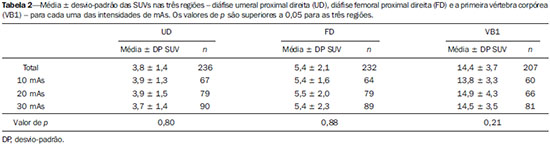
Fluoreto de sódio (18F-NaF) é um traçador muito sensível com alta afinidade pelos ossos utilizado para tomografia de emissão de pósitrons (PET) na identificação de anormalidades esqueléticas. O mecanismo de absorção do fluoreto-F18 se assemelha ao do 99mTc-MDP, com melhores características farmacocinéticas, incluindo mais rápido clareamento sanguíneo e uma absorção duas vezes maior nos ossos(1). Nos últimos anos houve um ressurgimento no interesse clínico para o uso do 18F-NaF como um traçador ósseo(2). As razões para esse ressurgimento incluem recente e periódicas diminuições de 99mTc no mundo, necessidade de agentes convencionais de investigação óssea(3), aumento de sensibilidade(4-6) e potencial quantitativo do PET/CT com 18F-NaF(7,8) comparado com a cintilografia óssea convencional utilizando os radiofármacos marcados com 99mTc. Em equipamentos de PET/CT, as imagens de tomografia computadorizada (CT) podem ser realizadas para correção de atenuação das imagens de emissão, localização de achados cintilográficos e caracterização radiográfica de anormalidades(9). O protocolo de CT depende da indicação do estudo e a probabilidade dos achados radiográficos adicionar informação diagnóstica. No entanto, a necessidade de informação diagnóstica deve ser balanceada contra o aumento da exposição à radiação da CT e os parâmetros de dose devem ser consistentes com os princípios ALARA (as low as reasonably achievable). Devido à alta razão entre atividade do 18F-NaF nos ossos em relação à dos tecidos moles em cintilografias ósseas, imagens de alta qualidade podem ser obtidas mesmo sem CT para correção de atenuação(10,11). No entanto, a adição da CT parece melhorar a especificidade da PET com 18F-NaF e permite o cálculo do valor padronizado de captação (SUV - standardized uptake value)(12). O SUV, que considera absorção do localizador com relação à dose injetada e a massa corpórea, é o índice mais usado de PET para avaliação de absorção do localizador na prática clínica rotineira porque não exige amostra de sangue e é obtido por aquisições estatísticas da PET(12-14). Existem publicações científicas demonstrando que SUVs podem detectar mudanças metabólicas significantes em lesões metastáticas individuais mesmo quando a avaliação visual revela pouca ou nenhuma diferença(7). Além do mais, no campo da oncologia, a identificação precoce de envolvimento ósseo metastático é possível e, nas situações em que é relevante avaliar a resposta terapêutica, a quantificação pode fornecer tal informação(7,8). A intensidade de corrente do tubo (mAs) a ser usada em pacientes que realizam estudos de PET/CT com 18F-NaF é assunto para debate. O guideline americano da Society of Nuclear Medicine para cintilografia óssea com PET/CT 18F-fluoreto estabeleceu 30 mAs como uma intensidade de corrente adequada para CT do corpo inteiro(1). No entanto, estudos que avaliam a corrente mAs mais adequada são raros. Na literatura é possível encontrar valores que vão de 15 mAs(15) até 95 mAs(16). Portanto, é necessário avaliar o mAs adequado levando em conta os avanços tecnológicos recentes, bem como os princípios ALARA. O objetivo do presente estudo foi analisar os SUVs utilizando três intensidades de mAs na CT para correção de atenuação nos estudos de PET/CT com 18F-NaF. MATERIAIS E MÉTODOS Pacientes Neste estudo transversal, as imagens dos primeiros 254 pacientes submetidos ao exame de PET/CT 18F-NaF no nosso departamento foram analisadas. Os pacientes foram aleatoriamente alocados para realização dos estudos utilizando três intensidades de mAs. As características peso, altura, índice de massa corporal, idade e sexo dos pacientes foram analisadas. Também foram analisadas as diferenças estatísticas dessas características nos grupos de mAs. Aquisição de imagem de PET/CT Os pacientes foram injetados com 111 a 203 MBq (média de 141MBq) de 18F-NaF. Cerca de 60 minutos depois da injeção, todos os pacientes foram submetidos a PET/CT 3D de corpo inteiro (vértex aos dedos do pé). As imagens foram obtidas em equipamento Discovery 690 GE com time of flight (General Electric). Imagens de transmissão de CT com doses baixas foram obtidas usando uma das três intensidades de mAs (10, 20 ou 30 mAs) para correção de atenuação. Outros parâmetros das imagens de CT foram: 120 kVp, tempo de rotação de 0,5 s, pitch de 1,375 e espessura do corte axial de 3.,5 mm. As imagens de emissão de PET foram obtidas com 1 minuto por bed position de 15 cm com 3 cm de sobreposição, e com 13 a 15 bed position por estudo. A reconstrução das imagens do PET foi realizada usando a técnica iterativa com 24 subsets em todos os estudos. Análise de imagem Um total de 254 estudos de PET/CT foram analisados: 73 com 10 mAs, 83 com 20 mAs e 98 com 30 mAs. Os valores de SUVs foram calculados em volumes de interesse (VOIs) obtidos em três regiões ósseas: diáfise proximal do úmero direito (UD), diáfise femoral proximal direita (FD) e o primeiro corpo vertebral lombar (VB1), totalizando 712 VOIs (Figura 1). As regiões foram investigadas para presença de alterações ósseas e as que foram classificadas como anormais foram excluídas da análise. Portanto, 675 regiões foram classificadas com normais e foram analisadas (236, 232 e 207 na UD, FD e VB1, respectivamente). Todos os SUVs foram baseados em peso corporal. 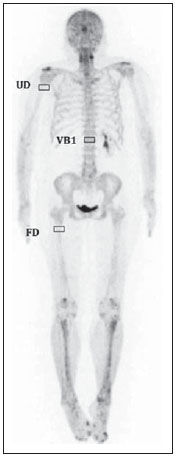 Figura 1. Volumes de interesse (VOIs) obtidos de três regiões corpóreas: diáfise umeral proximal direita (UD), diáfise femoral proximal direita (FD)e a primeira vértebra corpórea (VB1). Análise estatística Foi usada ANOVA para avaliar a presença de diferenças estatisticamente significantes nos valores de SUVs entre os grupos de três intensidades de mAs para cada uma das três regiões. ANOVA também foi usada (variáveis contínuas), juntamente com qui-quadrado (variáveis dicotômicas), para investigar a presença de diferenças estatisticamente significantes em características de pacientes dentro dos grupos de mAs. As análises foram feitas usando Excel® e SPSS®. RESULTADOS Não foram encontradas diferenças nas características dos pacientes (peso, altura, índice de massa corporal, idade e sexo) entre os grupos (p > 0,05) (Tabela 1). Tanto a média de SUV para cada região óssea quanto o número de pacientes analisados em cada grupo de mAs são mostrados na Tabela 2. ANOVA não mostrou diferença estatisticamente significante entre as intensidades dos grupos mAs para nenhuma das três regiões ósseas (Tabela 2). DISCUSSÃO O 18F-NaF foi introduzido como um radiofármaco para lesões ósseas por Blau et al.(17) em 1962. Dados de múltiplos pequenos estudos tem mostrado que o PET com 18F-NaF produz imagens ósseas com maior sensibilidade e especificidade do que imagens com radiofármacos marcados com 99mTc(18-22) e também se mostra superior ao uso de PET/CT com 18F-FDG e RM.(23) A técnica de correção de atenuação é normalmente usada em estudos com PET para melhorar tanto a quantificação quanto a uniformidade do campo de visão. As desvantagens da correção de atenuação incluem erros surgindo de posicionamento equivocado causado por movimentação do paciente ou diferenças na respiração, enquanto seus efeitos na detecção da lesão permanecem incertos. Em razão da baixa radiação de fundo, poucas são as vantagens da correção de atenuação na cintilografia óssea(10,11). A CT permanece muito útil para localização anatômica de lesões(4,5) e também para calcular o SUV(12). No entanto, o nível de mAs nos estudos de PET/CT com 18F-NaF ou 18F-FDG ainda não é consensual e uma gama grande de valores podem ser encontrados na literatura(15,16). Alguns pesquisadores têm demonstrado, utilizando análise de phantoms, que uma intensidade do tubo de corrente de CT baixa, como 10 mAs, pode ser adequada para realizar correção por atenuação em estudos de PET/CT(24,25). Porém, análises em estudos clínicos são raras. Levando em consideração a análise de phantoms, Fahey et al.(24) avaliaram a dose a partir da CT da PET/CT para determinar os parâmetros mínimos de aquisição que promovem correção de atenuação adequada. A conclusão foi que para pacientes pediátricos, uma correção de atenuação adequada pode ser obtida com uma dose bem baixa de CT (80 kVp e 5 mAs), e que tal correção leva a uma redução relativa de 100 vezes em relação a uma CT diagnóstica. Para adultos submetidos a uma CT com 5 mAs, a voltagem de tubo precisa ser aumentada para 120 kVp para prevenir uma subcorreção. Alessio et al.(25) também usaram phantoms para analisar o impacto de mAs e kVp na exposição à radiação. Para os pacientes menores eles decidiram usar 10 mAs, que é o valor mais próximo da menor corrente de tubo permitida (5 mAs) no equipamento de PET/CT disponível naquele departamento. A possibilidade de mAs muito pequenos para calcular SUV em teste clínicos usando PET/CT com FDG foi avaliada por Kamel et al.(26). Esses autores mediram o efeito da diminuição da corrente de tubo (de 10 até 120 mAs) na adequação da correção de atenuação baseada em CT e seu efeito na quantificação de tumores em estudos de PET com FDG. Eles mostraram que não havia uma mudança substancial na estimativa de absorção de 18F-FDG ou no tamanho do tumor variando as correntes de tubo. É válido dizer que apesar das implicações nas diminuições de dose de radiação, o uso de valores de pequenos de mAs pode também ajudar a reduzir custos uma vez que a diminuição da intensidade de corrente aumenta a meia vida do tubo, a parte mais cara do equipamento de CT. Essa redução é particularmente importante na PET/CT com 18F-NaF, na qual as imagens de CT são feitas por toda a extensão corporal e não somente da base do crânio até a parte superior das coxas como nos estudos de PET/CT com 18F-FDG. Em conclusão, as três intensidades de mAs analisadas parecem ser similares para correção de atenuação com respeito ao cálculo do SUV nos estudos de PET/CT com 18F-NaF e o uso de correntes de tubo muito baixas como as de 10 mAs é adequada para calcular esse parâmetro. REFERÊNCIAS 1. Segall G, Delbeke D, Stabin MG, et al. SNM practice guideline for sodium 18F-fluoride PET/CT bone scans 1.0. J Nucl Med. 2010;51:1813-20. 2. Grant FD, Fahey FH, Packard AB, et al. Skeletal PET with 18F-fluoride: applying new technology to an old tracer. J Nucl Med. 2008;49:68-78. 3. Perkins A, Hilson A, Hall J. Global shortage of medical isotopes threatens nuclear medicine services. BMJ. 2008;337:a1577. 4. Even-Sapir E, Metser U, Flusser G, et al. Assessment of malignant skeletal disease: initial experience with 18F-fluoride PET/CT and comparison between 18F-fluoride PET and 18F-fluoride PET/CT. J Nucl Med. 2004;45:272-8. 5. Even-Sapir E, Metser U, Mishani E, et al. The detection of bone metastases in patients with high-risk prostate cancer: 99mTc-MDP Planar bone scintigraphy, single- and multi-field-of-view SPECT, 18F-fluoride PET, and 18F-fluoride PET/CT. J Nucl Med. 2006;47:287-97. 6. Kruger S, Buck AK, Mottaghy FM, et al. Detection of bone metastases in patients with lung cancer: 99mTc-MDP planar bone scintigraphy, 18F-fluoride PET or 18F-FDG PET/CT. Eur J Nucl Med Mol Imaging. 2009;36:1807-12. 7. Cook G Jr, Parker C, Chua S, et al. 18F-fluoride PET: changes in uptake as a method to assess response in bone metastases from castrate-resistant prostate cancer patients treated with 223Ra-chloride (Alpharadin). EJNMMI Res. 2011;1:4. 8. Doot RK, Muzi M, Peterson LM, et al. Kinetic analysis of 18Ffluoride PET images of breast cancer bone metastases. J Nucl Med. 2010;51:521-7. 9. Delbeke D, Coleman RE, Guiberteau MJ, et al. Procedure guideline for tumor imaging with 18F-FDG PET/CT 1.0. J Nucl Med. 2006;47:885-95. 10. Nagarajah J, Dannat T, Hartung V. et al. 18F-fluoride PET/CT for bone scanning. Role of attenuation correction. Nuklearmedizin. 2012;51:84-7. 11. Tayama Y, Takahashi N, Oka T, et al. Clinical evaluation of the effect of attenuation correction technique on 18F-fluoride PET images. Ann Nucl Med. 2007;21:93-9. 12. Brenner W, Vernon C, Muzi M, et al. Comparison of different quantitative approaches to 18F-fluoride PET scans. J Nucl Med. 2004;45:1493-500. 13. Puri T, Blake GM, Frost ML, et al. Comparison of six quantitative methods for the measurement of bone turnover at the hip and lumbar spine using 18F-fluoride PET-CT. Nucl Med Commun. 2012;33:597-606. 14. Even-Sapir E, Mishani E, Flusser G, et al. 18F-Fluoride positron emission tomography and positron emission tomography/computed tomography. Semin Nucl Med. 2007;37:462-9. 15. Suenaga H, Yokoyama M, Yamaguchi K, et al. Time course of bone metabolism at the residual ridge beneath dentures observed using (1)(8)F-fluoride positron emission computerized-tomography/computed tomography (PET/CT). Ann Nucl Med. 2012;26:817-22. 16. Chen CJ, Ma SY. Prevalence of clinically significant extraosseous findings on unenhanced CT portions of (1)(8)F-fluoride PET/CT bone scans. ScientificWorldJournal. 2012;2012:979867. 17. Blau M, Nagler W, Bender MA. Fluorine-18: a new isotope for bone scanning. J Nucl Med. 1962;3:332-4. 18. Hetzel M, Arslandemir C, Konig HH, et al. F-18 NaF PET for detection of bone metastases in lung cancer: accuracy, cost-effectiveness, and impact on patient management. J Bone Miner Res. 2003;18:2206-14. 19. Hoh CK, Hawkins RA, Dahlbom M, et al. Whole body skeletal imaging with [18F]fluoride ion and PET. J Comput Assist Tomogr. 1993;17:34-41. 20. Langsteger W, Heinisch M, Fogelman I. The role of fluorodeoxyglucose, 18F-dihydroxyphenylalanine, 18F-choline, and 18F-fluoride in bone imaging with emphasis on prostate and breast. Semin Nucl Med. 2006;36:73-92. 21. Schirrmeister H, Guhlmann A, Kotzerke J, et al. Early detection and accurate description of extent of metastatic bone disease in breast cancer with fluoride ion and positron emission tomography. J Clin Oncol. 1999;17:2381-9. 22. Schirrmeister H, Glatting G, Hetzel J, et al. Prospective evaluation of the clinical value of planar bone scans, SPECT, and (18)F-labeled NaF PET in newly diagnosed lung cancer. J Nucl Med. 2001;42:1800-4. 23. Iagaru A, Young P, Mittra E, et al. Pilot prospective evaluation of 99mTc-MDP scintigraphy, 18F NaF PET/CT, 18F FDG PET/CT and whole-body MRI for detection of skeletal metastases. Clin Nucl Med. 2013;38:e290-e296. 24. Fahey FH, Palmer MR, Strauss KJ, et al. Dosimetry and adequacy of CT-based attenuation correction for pediatric PET: phantom study. Radiology. 2007;243:96-104. 25. Alessio AM, Kinahan PE, Manchanda V, et al. Weight-based, low-dose pediatric whole-body PET/CT protocols. J Nucl Med. 2009;50:1570-7. 26. Kamel E, Hany TF, Burger C. et al. CT vs 68Ge attenuation correction in a combined PET/CT system: evaluation of the effect of lowering the CT tube current. Eur J Nucl Med Mol Imaging. 2002;29:346-50. 1. Médicos Nucleares pelo Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP), São Paulo, SP, Brasil 2. Doutores, Médicos Assistentes do Instituto do Câncer do Estado de São Paulo Octavio Frias de Oliveira (Icesp), São Paulo, SP, Brasil 3. Livre-docente, Professor do Departamento de Radiologia e Oncologia da Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brasil 4. Livre-docente, Professor Titular do Departamento de Radiologia e Oncologia da Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brasil Endereço para correspondência: Dra. Agnes Araujo Valadares Departamento de Medicina Nuclear – Icesp Avenida Doutor Arnaldo, 251, 4º Subsolo, Cerqueira César São Paulo, SP, Brasil, 01246-000 E-mail: agnesvaladares@me.com Recebido para publicação em 22/4/2014. Aceito, após revisão, em 8/7/2014. Trabalho realizado no Serviço de Medicina Nuclear do Instituto do Câncer do Estado de São Paulo Octavio Frias de Oliveira (Icesp), São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554