Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 48 nº 1 - Jan. / Fev. of 2015
Vol. 48 nº 1 - Jan. / Fev. of 2015
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Marcos Duarte Guimaraes1; Bruno Hochhegger2; Marcel Koenigkam Santos3; Pablo Rydz Pinheiro Santana4; Arthur Soares Sousa Júnior5; Luciana Soares Souza6; Edson Marchiori7 |
|
|
Descritores: Ressonância magnética; Difusão; Tórax; Lesões torácicas; Oncologia. |
|
|
Resumo: INTRODUÇÃO
A incidência das neoplasias vem progredindo universalmente e hoje o câncer é uma das principais causas de morte natural no mundo(1). As neoplasias torácicas, sejam elas primárias ou metastáticas, representam parcela significativa dos óbitos provocados pelo câncer(2). Após a confirmação diagnóstica, o paciente portador de neoplasia torácica maligna deve ser submetido a uma avaliação adequada com o objetivo de classificar corretamente a doença e, consequentemente, receber a opção terapêutica mais apropriada(3). Um número significativo dos pacientes oncológicos apresenta doença maligna avançada, reduzindo as chances de sucesso terapêutico na época do diagnóstico. Os pacientes com doença avançada devem ser poupados de tratamentos invasivos e que tragam pouco benefício. Porém, os pacientes com doença localizada devem ser submetidos a tratamentos que ofereçam reais possibilidades de cura(4,5). Portanto, é fundamental que as ferramentas de diagnóstico por imagem sejam capazes de fornecer informações precisas sobre a localização do tumor, quantidade de lesões, extensão tumoral, atividade da doença e, se possível, informações sobre biomarcadores(6). Atualmente, o conjunto destas informações é indispensável para o manejo mais apropriado dos pacientes oncológicos, incluindo os portadores de neoplasias torácicas malignas(6,7). A ressonância magnética (RM) se desenvolveu significativamente e se popularizou ao longo dos últimos 25 anos(8). É um método de imagem disponível em diversos centros especializados e não especializados e vem sendo cada vez mais empregado na avaliação das lesões torácicas malignas por apresentar diversas vantagens. É capaz de fornecer imagens com elevada resolução de contraste e espacial, facilitando a reconhecimento dos planos anatômicos e a identificação de anormalidades(9). A aquisição de imagens multiplanares e o recurso da reconstrução tridimensional possibilitam uma avaliação abrangente do tórax, contribuindo de forma decisiva para o planejamento terapêutico. Aliado a isto, destaca-se o fato de ser uma ferramenta isenta dos riscos da irradiação ionizante(10,11). Portanto, quando bem indicada, a RM pode atuar como ferramenta complementar ou alternativa na avaliação das neoplasias torácicas, com performance comparável aos métodos de diagnóstico por imagem convencionais como a cintilografia óssea, a tomografia computadorizada (TC) e a PET/CT(12). O presente artigo de revisão tem como finalidade abordar aspectos relevantes da RM na avaliação de pacientes portadores de neoplasias torácicas malignas, sejam elas primárias ou secundárias. Serão apresentados e discutidos os recentes avanços em oncologia, a questão da radiação ionizante, os aspectos técnicos, as indicações e as limitações deste método. AVANÇOS EM ONCOLOGIA As características biológicas das neoplasias influenciam o espectro de sua apresentação(13). Existem lesões torácicas malignas que apresentam comportamento biológico benigno, indolente ou de baixa agressividade, sem a ocorrência de manifestações clínicas. Neste contexto, as alterações morfológicas costumam ser de difícil reconhecimento, podem passar despercebidas ou serem identificadas de forma incidental, sobretudo quando a neoplasia se encontra em estádio inicial, com nenhum ou com poucos sintomas. Por outro lado, existem lesões torácicas malignas com sinais evidentes de destruição, com enorme potencial de disseminação e frequentemente associadas a manifestações clínicas como astenia, dor e perda de peso. Habitualmente, estas lesões apresentam comportamento biológico agressivo, facilitando o reconhecimento das alterações morfológicas e dos órgãos comprometidos(14). Os métodos funcionais de imagem costumam detectar sinais de atividade de doença em um momento que antecede as manifestações morfológicas(15). Com o desenvolvimento e a popularização da PET/CT, as ferramentas funcionais ganharam maior destaque nos últimos anos(16). Por meio deste método, foi possível o reconhecimento de regiões com avidez ao consumo de moléculas da glicose e seus análogos, como a fluordeoxiglicose (18-FDG) (Figura 1)(17). Estas áreas podem corresponder a sítios de comprometimento tumoral, e quando analisadas em conjunto com métodos morfológicos convencionais, como a TC ou a RM, obtém-se uma avaliação mais detalhada, melhorando a qualidade da informação e o manejo destes pacientes(18-20). 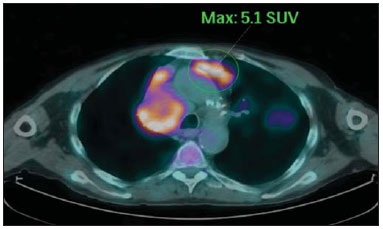 Figura 1. Paciente do sexo feminino, 64 anos, com diagnóstico de adenocarcinoma pulmonar no lobo superior direito. Observa-se intensa captação (hipersinal) do radiofármaco FDG na lesão pulmonar direita e nos linfonodos contralaterais para-aórticos, estes últimos com valor padrão de captação (SUV) de 5,1, configurando estadiamento clínico linfonodal N3. Nos últimos anos houve um desenvolvimento significativo dos métodos propedêuticos torácicos invasivos, minimante invasivos e não invasivos(21). A evolução de técnicas como a broncoscopia, videotoracoscopia, mediastinoscopia, ultrassonografia endoscópica endobrônquica e dos procedimentos transtorácicos guiados por métodos de imagem melhoraram significativamente a avaliação dos pacientes portadores de neoplasias torácicas(22). Houve também importante avanço no manejo terapêutico locorregional e sistêmico desses pacientes, mediante o aprimoramento das técnicas de radioterapia e o advento de novas drogas quimioterápicas, com impacto na qualidade de vida e aumento das taxas de sobrevida deles(21). Vivenciamos a era da terapia personalizada, conhecida também como terapia alvo, baseada no tratamento individual(23). Atualmente, a análise exclusiva do tipo histológico não é suficiente para o manejo oncológico mais apropriado. Cada paciente e cada lesão apresentam as suas próprias características, a sua identidade. É necessária a análise conjunta destes elementos para determinar a opção terapêutica mais adequada(24). Passamos de uma era terapêutica predominantemente morfológica, fundamentada no tipo histológico e morte celular, para uma era terapêutica predominantemente molecular, fundamentada nos aspectos funcionais, perfil de biomarcadores e interrupção da proliferação celular(23,24). O avanço terapêutico foi acompanhado pelo surgimento de novas tecnologias de diagnóstico por imagem(25). Houve uma evolução significativa da RM com base no desenvolvimento dos equipamentos de alto campo, novos hardwares e softwares, técnicas paralelas ultrarrápidas, sincronização dos movimentos respiratórios e cardíacos e de novas sequências dinâmicas e funcionais, possibilitando um salto significativo na qualidade das imagens fornecidas(9). Este ganho de qualidade representou uma evolução na performance diagnóstica, proporcionando uma avaliação mais adequada das le-sões torácicas, bem diferente do que ocorria no passado(8,9). A avaliação dos parâmetros morfológicos tradicionais, como tamanho, forma, contornos e relação com estruturas adjacentes, evoluiu significativamente, melhorando o planejamento terapêutico(6). O advento de parâmetros dinâmicos como a cine-RM trouxe novas informações a respeito de infiltrações de parede torácica, de estruturas mediastinais e vasculares, fortalecendo os critérios de ressecabilidade durante o planejamento terapêutico(26). Por outro lado, o advento de parâmetros metabólicos e funcionais, como a perfusão e a difusão, foi capaz de acrescentar informações relevantes relacionadas à atividade tumoral, podendo tais parâmetros serem empregados em diferentes etapas do manejo oncológico, como o diagnóstico, a avaliação de resposta terapêutica e o seguimento pós-terapêutico(27). RADIAÇÃO IONIZANTE Vários trabalhos na literatura estudaram os riscos da exposição à radiação ionizante empregada por diferentes métodos de diagnóstico por imagem(28-30). Esses estudos demonstraram grande variação na dose acumulada, dependendo da frequência e da intensidade da exposição. Identificou-se também a necessidade de redução da dose aos menores níveis possíveis sem causar prejuízo na avaliação e interpretação dos métodos de imagem, segundo o princípio ALARA (as low as reasonably achievable)(29,30). Considerando-se pacientes pediátricos, jovens e gestantes, esta preocupação deve ser destacada por causa dos riscos do efeito acumulativo da radiação ionizante(30,31). Esses riscos são maiores quanto mais sensível for o tecido biológico exposto e quanto maior for a frequência e a intensidade da exposição(28). O acúmulo de radiação ao longo da vida será maior quanto mais precocemente o indivíduo for exposto. A possibilidade do desenvolvimento de um segundo tumor primário, como leucemia ou tumor cerebral decorrente de uma exposição precoce e inadvertida, não é desprezível, sobretudo nos pacientes pediátricos, que estão em fase de desenvolvimento(31-33). Portanto, esforços no sentido de reduzir ao mínimo a exposição à radiação ionizante sem prejuízo na qualidade dos exames são o objetivo primordial de quem trabalha com métodos de imagem(34). Isto pode ser conseguido com a utilização de softwares disponíveis comercialmente, confeccionados especificamente para redução de dose. Ou, simplesmente, pela adequação dos parâmetros técnicos, otimização do número de cortes e sequências, e redução da kV e da mAs(34). Outra possibilidade é a utilização de ferramentas diagnósticas isentas do risco da radiação ionizante, como a RM, por exemplo, no lugar dos métodos radiológicos convencionais(11). É importante destacar que os recentes avanços da RM propiciaram o advento de biomarcadores radiológicos que, quando empregados de forma apropriada, contribuem decisivamente para o diagnóstico, estadiamento e predição de resposta terapêutica. A depender da indicação clínica ou da etapa do manejo oncológico, os métodos radiológicos convencionais emissores de radiação ionizante podem ser substituídos ou complementados pela RM, o que contribui para a redução dos riscos da radiação(11). ASPECTOS TÉCNICOS Os exames devem ser preferencialmente realizados com o paciente na posição supina, em aparelhos de pelo menos 1,5 tesla, com bobina de corpo, poder de gradiente máximo de 33 mT/m e taxa de pulso de 160 mT/m/s(9). As imagens devem ser adquiridas preferencialmente em apneia ou com o paciente mantendo respiração calma, especialmente quando são realizadas sequências mais longas(9,10). Em pacientes pouco colaborativos, agitados, claustrofóbicos ou crianças, recomenda-se a realização do exame de RM sob sedação ou anestesia. O tempo de exame costuma variar entre 15 e 30 minutos. As técnicas funcionais e o emprego do meio de contraste intravenoso costumam ser os responsáveis pelo aumento no tempo de exame(9,10). Para minimizar os artefatos causados pelos movimentos respiratórios devem ser realizadas aquisições de sequências ultrarrápidas por meio de imagens ecoplanares (EPI) ou turbo-FLASH, evitando, assim, interferências durante a reconstrução das imagens. Estas técnicas são muito rápidas e conseguem adquirir imagens em 50 ms, promovendo literalmente um "congelamento" do movimento fisiológico, sendo amplamente utilizadas nas sequências de imagens de difusão. Este cuidado técnico tem como finalidade evitar que os artefatos de movimentação comprometam a qualidade dos exames a serem analisados(6,9,10,35). Protocolo A depender do fabricante e dos softwares disponíveis, do objetivo do estudo e da localização da lesão, diferentes tipos de sequências podem ser realizadas e adquiridas em diferentes planos(6,9). É recomendável realizar sequências T1 em fase e fora de fase e com técnica de supressão de gordura. A depender da indicação do estudo, esta sequência pode ser realizada também após a administração de contraste paramagnético. As sequências ponderadas em T2 devem ser realizadas de rotina, com e sem a supressão do sinal de gordura(10). A análise conjunta dessas sequências permite um contraste maior entre as estruturas anatômicas normais e as áreas comprometidas pelo tumor, elevando o grau de confiança do método(9,10,35). O advento de novas técnicas morfológicas e funcionais também contribuiu significativamente para o manejo adequado dos pacientes oncológicos. Técnicas como a difusão, a perfusão e a cine-RM vêm ampliando o uso da RM na avaliação das lesões torácicas malignas(26,36-38). Elas podem ser indicadas a depender da localização da lesão, da extensão da doença, das opções terapêuticas disponíveis, assim como na avaliação de resposta terapêutica e detecção de recidivas após o término do tratamento(7,24,27). Difusão A sequência de difusão permite avaliar aspectos biomoleculares do comportamento tumoral, à semelhança do que ocorre com a PET/CT, por intermédio de parâmetros qualitativos e quantitativos(39,40). Os critérios utilizados para classificar as lesões como malignas ou benignas habitualmente utilizados nesta sequência são dois: o critério qualitativo, relacionado à intensidade do sinal (brilho), e o critério quantitativo, definido pelo valor absoluto do coeficiente aparente de difusão (ADC) no interior da lesão(41,42). Com base nestas características é possível estimar a celularidade da lesão e indicar se este parâmetro favorece o diagnóstico de benignidade ou de malignidade. As lesões benignas geralmente não costumam apresentar sinal de restrição à difusão das moléculas de água e, consequentemente, apresentam baixo sinal nesta sequência e níveis de ADC superiores a 1,0 × 10-3 mm2/s (Figura 2). Por outro lado, as neoplasias malignas geralmente apresentam sinal de restrição à difusão das moléculas de água secundária a proliferação celular, ocorrendo geralmente aumento do sinal na imagem de difusão e níveis de ADC inferiores a 1,0 × 10-3 mm2/s (Figura 3)(39-42). O cálculo do ADC é realizado por análise de regressão linear do log natural da intensidade de sinal versus o fator de gradiente, de acordo com a seguinte equação: 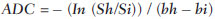 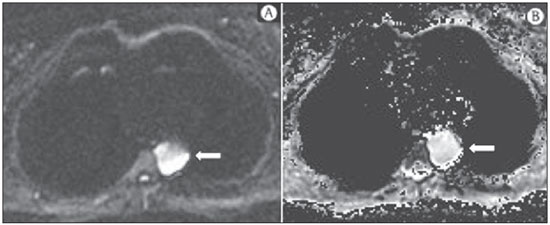 Figura 2. Paciente do sexo feminino, 23 anos, portadora de neurofibromatose, apresentando lesão paravertebral esquerda em amplo contato com o forame neural. Em A, nota-se elevado sinal na imagem ponderada em difusão (seta). Em B, observa-se a mesma lesão (seta) no exame de mapa de ADC, apresentando valores maiores que 1 mm2/s (não demonstrado), denotando menor celularidade e pouca restrição à movimentação das moléculas de água. Esta lesão foi considerada como de baixa agressividade, provável schwannoma, corroborado pelos achados das demais sequências. Por se tratar de paciente jovem e a lesão apresentar aspecto de benignidade/baixa agressividade, optou-se por se realizar o seguimento semestral das lesões por meio da RM. 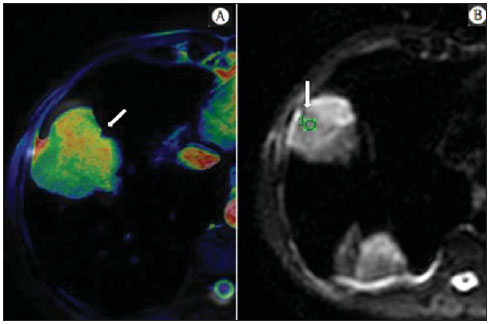 Figura 3. Paciente do sexo masculino, 54 anos, portador de adenocarcinoma de cólon evoluindo com massa pulmonar suspeita para metástase. O exame de RM de tórax mostra massa sólida no lobo superior direito. Em A, a massa apresenta hiperintensidade heterogênea (seta) do sinal na sequência de difusão. Em B, no mapa de ADC observa-se no interior da lesão (seta) valores menores que 1 mm2/s, denotando elevada celularidade e restrição à movimentação das moléculas de água, suspeita para malignidade. A massa foi biopsiada, sendo confirmado o diagnóstico de metástase. onde: Sh e Si são as intensidades de sinais na região de interesse obtidas pela diferença entre dois fatores de gradientes (bh e bi); o fator de gradiente máximo (bh) no valor de 600 s/mm2 e o fator de gradiente mínimo (bi) no valor de 00 s/mm2 são valores habitualmente suficientes para um estudo adequado de difusão das doenças oncológicas do tórax(9,10,40-42). As imagens são analisadas para definição das áreas de interesse e submetidas ao estudo da difusão com base em critérios adotados. A intensidade do sinal e o valor do ADC em mm2/s das lesões devem ser analisados levando em consideração a localização, o tamanho das lesões e as áreas de tumor viável, mediante seleção de regiões de interesse (ROIs) de acordo com a interpretação das imagens obtidas pelo radiologista que interpreta o exame. Sempre deve ser escolhida a ROI mais representativa da lesão, excluindo-se áreas de necrose, calcificações, material gasoso ou áreas que sofram interferência de algum tipo de volume parcial adjacente à lesão(40-42). As imagens devem ser arquivadas utilizando sistema digital e transferidas para a estação de trabalho. A sequência de difusão deve ser pós-processada utilizando softwares disponíveis comercialmente, com o objetivo de se obter os mapas de ADC. Os mapas de ADC podem ser representados por tonalidades de cores como, por exemplo, o preto e o branco. Se for esta a opção selecionada, habitualmente a cor preta representa difusão restrita e a cor branca representa ausência de restrição. O mesmo acontece para as demais cores. Perfusão A sequência de perfusão oferece a possibilidade de avaliar a perfusão do leito vascular pulmonar por imagens de eco de gradiente ponderadas em T1 mediante aquisições ultrarrápidas durante a injeção de meio de contraste paramagnético (quelatos de gadolínio)(37,43). Isto permite a visualização do fluxo sanguíneo regional, com a possibilidade de várias formas de quantificação deste fluxo. As sequências tridimensionais após o uso de contraste intravenoso possibilitam a caracterização de vasos de diferentes calibres, podendo ser empregadas na avaliação da perfusão pulmonar(38,44). Vários estudos já demonstraram a viabilidade desta técnica para avaliação dos processos normais e patológicos. Esta técnica tem sido usada no tórax para avaliar perfusão de maneira subjetiva, principalmente no estudo da embolia pulmonar e fibrose cística(44-46). Tecidos com alta vascularização e alta permeabilidade capilar, ou seja, suspeitos de malignidade, tendem a se opacificar pelo contraste de forma intensa e precoce em comparação com tecidos que têm poucos vasos e que se relacionam mais frequentemente com lesões de menor agressividade(45,46). Com esta técnica, lesões tumorais podem ser avaliadas qualitativamente pelas curvas de intensidade de sinal em relação ao tempo e quantitativamente calculando-se o valor numérico da curva em porcentagem de aumento de sinal por minuto. É possível estimar o padrão de angiogênese tumoral considerando o tempo que o contraste levou para percorrer a lesão nesta sequência. O padrão de curvas de realce e perfusão fornece informações relevantes sobre o comportamento biológico do tumor (Figura 4)(44-46). 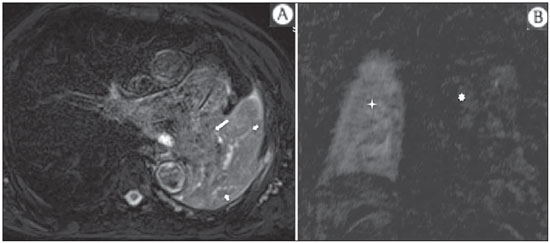 Figura 4. Paciente do sexo masculino, 75 anos, portador de doença pulmonar obstrutiva crônica com antecedente de ressecção de câncer de pulmão há dois anos. Atualmente encontra-se com suspeita de recidiva. Em A, RM T2 fatsat foi capaz de distinguir a massa central à esquerda (seta longa) da área de pneumonite pós-obstrutiva (setas curtas). Em B, a sequência de perfusão pulmonar mostra ausência de perfusão no pulmão esquerdo remanescente. Cine-RM A cine-RM advém dos estudos para avaliação cardíaca e nada mais é do que uma avaliação dinâmica do tórax levando em conta os movimentos respiratórios e cardíacos. As imagens podem ser obtidas por meio da sincronização dos movimentos cardíacos e respiratórios(25). Esta técnica possibilita o estudo dos grandes vasos com enorme propriedade, permitindo a avaliação dinâmica do fluxo vascular, sobretudo na aorta, artérias supra-aórticas, artérias pulmonares e seus principais ramos, veia cava superior e veias braquiocefálicas. A cine-RM acrescenta acurácia diagnóstica na predição de invasão da parede torácica, de estruturas broncovasculares hilares e de estruturas mediastinais quando da presença de neoplasias torácicas (Figura 5)(26,47). 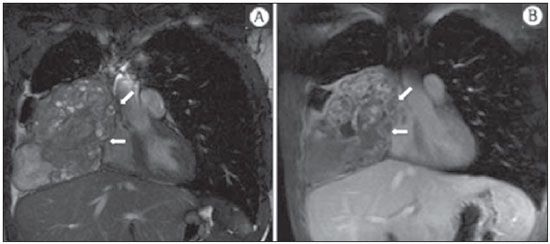 Figura 5. Paciente do sexo masculino, 22 anos, com tumor maligno de células germinativas não seminomatoso. Em A e B, observa-se massa mediastinal anterior heterogênea com áreas de necrose estendendo-se para o átrio direito e veia cava superior, com sinais de invasão dessas estruturas (setas), contraindicando a ressecção cirúrgica. Foi realizado estudo complementar com cine-RM, que confirmou a fixação/infiltração da veia cava superior e do átrio direito pela massa. INDICAÇÕES Uma variedade de lesões tumorais pode acometer o tórax, desde os tumores de origem epitelial, como os carcinomas de mama, pulmão, traqueia, esôfago, timo, carcinomas embrionários e de células germinativas, até tumores de origem mesenquimal, incluindo os lipossarcomas, osteossarcomas, leiomiossarcomas e linfomas(15,35,36,40,41,43,48,49). O tórax também é sítio frequente de implantes metastáticos de tumores originalmente primários ou de tumores extratorácicos, seja por disseminação linfática, hematogênica ou por contiguidade(40-42). A RM permite uma avaliação adequada do tórax, podendo ser empregada para avaliação de lesões de diferentes estruturas anatômicas, sobretudo incluindo lesões de parede torácica (Figura 6), coluna vertebral (Figura 7), pleura, parênquima pulmonar (Figura 3), mediastino (Figura 8), coração (Figura 7), esôfago (Figura 9) e linfonodos (Figura 9). A avaliação de estruturas comprometidas por lesões neoplásicas, suas relações anatômicas e características morfológicas e funcionais podem ser determinadas em diversas etapas do manejo oncológico, seja no diagnóstico, na orientação de biópsia (Figura 10), no estadiamento locorregional, no planejamento terapêutico clínico, cirúrgico ou radioterápico (Figura 11), na avaliação de resposta terapêutica (Figura 12), ou no seguimento pós-terapêutico(40-42). 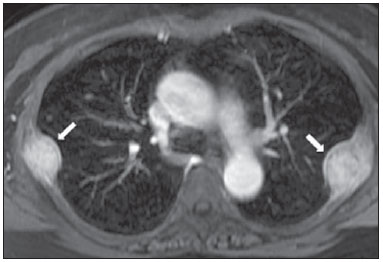 Figura 6. Paciente de 49 anos, portador de neoplasia renal evoluindo com dor torácica bilateral. Exame de RM ponderada na sequência T1 com supressão de gordura demonstra lesões costais com intensidade de sinal de partes moles e intenso realce pelo meio de contraste paramagnético (setas), suspeitas para metástases. O diagnóstico foi confirmado, posteriormente, por estudo histopatológico. 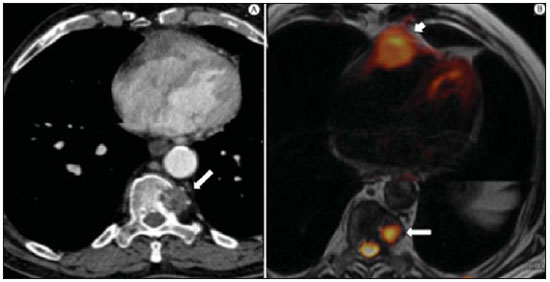 Figura 7. Paciente do sexo masculino, 71 anos, portador de carcinoma espinocelular do pulmão. Em A, TC de tórax mostra lesão lítica com componente de partes moles no hemicorpo vertebral esquerdo (seta) de vértebra torácica inferior. Em B, observa-se fusão de imagem anatômica ponderada em T2 de fundo, sobreposta pela sequência de difusão, evidenciando marcante hipersinal na lesão vertebral torácica (seta longa) e também na parede anterior do ventrículo direito (seta curta), compatíveis com áreas de intensa celularidade, sugestivas de malignidade. 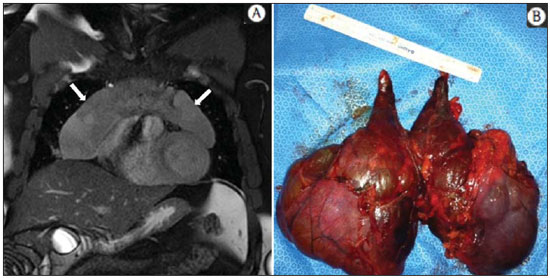 Figura 8. Paciente do sexo feminino, 21 anos, com volumosa lesão expansiva mediastinal anterior. Em A, imagem ponderada em T2, a lesão (setas) apresenta contornos regulares, bordas bem definidas e com sinal discretamente elevado, finamente heterogêneo, nesta sequência. Houve aumento do sinal de forma homogênea, difuso na sequência de difusão, e o mapa de ADC revelou valores maiores que 1 mm2/s (não demonstrado) no interior da lesão, denotando baixa celularidade e pouca restrição à movimentação das moléculas de água. Em B, observa-se a peça cirúrgica. O resultado histopatológico confirmou o diagnóstico de tumor bem diferenciado: timoma B1. 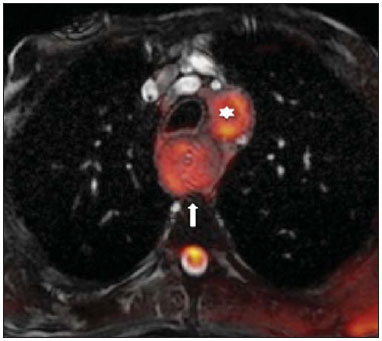 Figura 9. Paciente do sexo masculino, 71 anos, etilista e tabagista de longa data, desenvolveu um carcinoma espinocelular de esôfago. Nesta figura houve a fusão da imagem anatômica de fundo ponderada em T2 com a imagem proveniente da sequência de difusão. Observar que a lesão expansiva esofagiana (seta) e a linfonodomegalia paratraqueal esquerda (asterisco) apresentam hipersinal na sequência de difusão, compatíveis com elevada celularidade. O diagnóstico de malignidade foi confirmado, posteriormente, por estudo histopatológico. 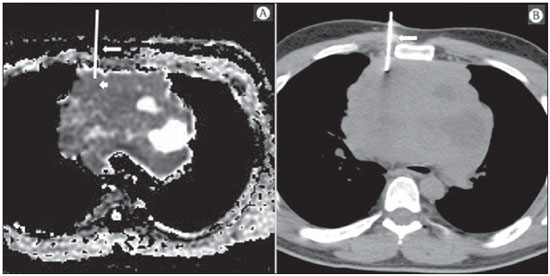 Figura 10. Paciente de 14 anos, assintomático, apresentando massa mediastinal anterior detectada em achado de exame. Em A, observa-se exame de RM mapa de ADC, realizado para ajudar no planejamento de biópsia, definição de trajetória de agulha (seta longa) e escolha de área para coleta de material apontada para a região de valores inferiores a 1 mm2/s no interior da lesão (seta curta). Em B, nota-se a trajetória da agulha grossa de biópsia em exame de TC. Observar que a trajetória na TC (seta) é coincidente com a trajetória planejada pela RM. Foram coletados cinco fragmentos e o resultado anatomopatológico confirmou o diagnóstico de timoma B3. 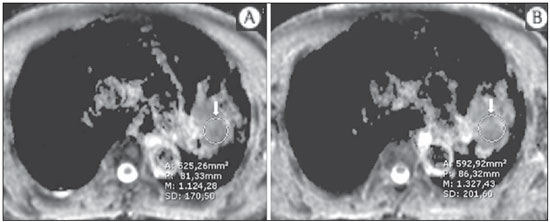 Figura 11. Paciente do sexo masculino, 73 anos, com massa central à esquerda associada a atelectasia secundária. A biópsia transbrônquica confirmou o diagnóstico de adenocarcinoma pulmonar estádio clínico IIIa. Realizou-se RM de tórax incluindo a sequência mapa de ADC, sendo medidos os valores de ADC no interior da região de interesse (círculo). Em A, o mapa de ADC (seta) realizado antes da quimioterapia neoadjuvante, e em B, o mapa de ADC (seta) realizado após a quimioterapia neoadjuvante. Observar que houve aumento dos valores de ADC (sinal de boa resposta, necrose celular), mesmo sem mudança significativa das dimensões da massa. A lesão foi ressecada sem complicações e confirmado o diagnóstico de adenocarcinoma predominantemente micropapilar (tumor T3N2). 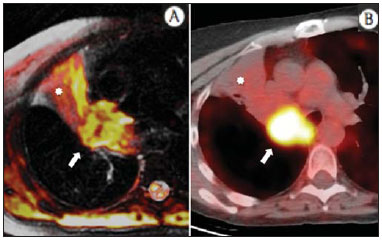 Figura 12. Paciente do sexo masculino, 68 anos, com diagnóstico de adenocarcinoma do lobo superior direito. Em A, exame de RM de tórax incluindo a fusão da imagens anatômica (T2) com a imagem funcional (difusão), à semelhança do que ocorre com o exame de PET/CT. Observar a lesão central associada a intenso brilho (seta branca) promovendo pneumonite pós-obstrutiva caracterizada pela área de atelectasia com menor brilho (asterisco). Em B, o exame de PET/CT destaca a lesão central associada a intensa captação (seta branca), promovendo pneumonite pós-obstrutiva caracterizada pela área de atelectasia, sem captação (asterisco). Os pacientes portadores de lesão torácica maligna devem ser submetidos a uma avaliação detalhada pelos métodos de imagem. A RM evoluiu muito nos últimos anos e quando bem indicada tem demonstrado ser uma opção promissora, bastante atraente, sendo capaz de melhorar a performance da avaliação oncológica, contribuindo para uma conduta mais apropriada. LIMITAÇÕES E CONTRAINDICAÇÕES Os significativos avanços obtidos nos últimos anos fizeram com que a RM fornecesse imagens de excelente qualidade na avaliação do parênquima pulmonar, mesmo nos casos de doenças infecciosas, inflamatórias e pneumopatias intersticiais, frequentemente comparáveis às imagens da TC(50). Tais avanços contribuíram para o diagnóstico diferencial, detecção de achados secundários e de comorbidades, quando da avaliação de neoplasias torácicas(50). Entretanto, algumas limitações ainda são obstáculos para uma maior popularização deste método e precisam ser destacadas. Em relação ao equipamento, é necessário o emprego de alto campo, com pelo menos 1,5 tesla, incluindo softwares modernos e bobinas adequadas, o que eleva significativamente os custos do exame. O tempo de exame é outro fator limitante, que costuma ser realizado em torno de 15 minutos, podendo ultrapassar os 30 minutos quando da utilização de técnicas funcionais e do emprego do meio de contraste intravenoso(9,10). Ou seja, um tempo muito maior que o tempo despendido no exame de TC. Tratando-se de pacientes idosos, gravemente enfermos, portadores de alterações ósseas degenerativas, portadores de bronquite ou enfisema e nos tossidores crônicos, existe uma dificuldade natural de eles se manterem em repouso absoluto, em posição supina por muitos minutos, ou de obedecerem a certos comandos respiratórios. Também existe a questão da claustrofobia, em que o paciente não consegue adentrar ou permanecer por determinado tempo no interior do equipamento. Nessas situações, é recomendável a realização do exame sob sedação ou anestesia, o que aumenta os riscos de complicações(9,10). A presença de artefatos de suscetibilidade magnética, como materiais metálicos de próteses ou corpos estranhos, e a presença de artefatos de movimentos acabam degradando as imagens, o que pode ser um fator limitante para a interpretação dos achados ou até mesmo para a realização do exame. Em relação à equipe radiológica, é necessário que haja treinamento específico para a realização dos exames de RM de tórax e elaboração de protocolos adequados para a avaliação oncológica. A presença de um radiologista experiente que atue de forma multidisciplinar com as equipes de oncologia clínica, radioterapia, cirurgia torácica e pneumologia potencializam a performance da RM, aumentando a confidência do método e seu emprego na rotina oncológica(31-33). As contraindicações para realização da RM do tórax são semelhantes às da RM de outras partes do corpo. É sempre necessária uma avaliação rigorosa antes da realização deste exame. A equipe multidisciplinar deve sempre verificar a condição clínica do doente e decidir se este é capaz de suportar o tempo de exame, ou se será necessário o emprego de sedação ou anestesia, ponderando os riscos e benefícios. Outra questão muito importante é verificar se o paciente é portador de materiais metálicos como implantes, próteses, cateteres, marca-passos ou se tem algum corpo estranho desta natureza em seu organismo. A depender do modelo, estes materiais podem sofrer algum tipo de dano ou deslocamento se submetidos aos efeitos do campo magnético. É dever da equipe radiológica evitar situações como estas(6,9,10,50). CONCLUSÃO A RM é um método de imagem disponível em diversos centros de saúde especializados e não especializados e vem sendo cada vez mais empregada na avaliação das neoplasias torácicas por apresentar algumas vantagens. A excelente resolução de contraste e espacial, a possibilidade do emprego de técnicas dinâmicas e funcionais e a inexistência dos riscos da radiação ionizante tornam esta ferramenta bastante atraente e promissora no manejo do paciente oncológico. Agradecimentos As Figuras 4 e 11 foram cedidas gentilmente pelo Departamento de Radiologia Diagnóstica e Intervencionista da Universidade de Heidelberg, Alemanha, cortesia do Prof. Hans-Ulrich Kauczor. REFERÊNCIAS 1. Ott JJ, Ullrich A, Mascarenhas M, et al. Global cancer incidence and mortality caused by behavior and infection. J Public Health (Oxf). 2011;33:223-33. 2. Schottenfeld D, Beebe-Dimmer JL, Buffler PA, et al. Current perspective on the global and United States cancer burden attributable to lifestyle and environmental risk factors. Annu Rev Public Health. 2013;34:97-117. 3. Bragg DG. State-of-the-art assessment. Diagnostic oncologic imaging. Cancer. 1989;64(Suppl):261-5; discussion 269-71. 4. López-Encuentra A, García-Luján R, Rivas JJ, et al. Comparison between clinical and pathologic staging in 2,994 cases of lung cancer. Ann Thorac Surg. 2005;79:974-9. 5. Adsay NV, Basturk O, Saka B. Pathologic staging of tumors: pitfalls and opportunities for improvements. Semin Diagn Pathol. 2012;29:103-8. 6. Hochhegger B, Marchiori E, Irion K, et al. Magnetic resonance of the lung: a step forward in the study of lung disease. J Bras Pneumol. 2012;38:105-15. 7. García Figueiras R, Padhani AR, Vilanova JC, et al. Functional imaging of tumors. Part 1. Radiologia. 2010;52:115-25. 8. Kauczor HU, Ley S. Thoracic magnetic resonance imaging 1985 to 2010. J Thorac Imaging. 2010;25:34-8. 9. Kauczor HU, Ley-Zaporozhan J, Ley S. Imaging of pulmonary pathologies: focus on magnetic resonance imaging. Proc Am Thorac Soc. 2009;6:458-63. 10. Puderbach M, Hintze C, Ley S, et al. MR imaging of the chest: a practical approach at 1.5T. Eur J Radiol. 2007;64:345-55. 11. Guimaraes MD, Gross JL, Chojniak R, et al. MRI-guided biopsy: a valuable procedure alternative to avoid the risks of ionizing radiation from diagnostic imaging methods. Cardiovasc Intervent Radiol. 2014;37:858-60. 12. Takenaka D, Ohno Y, Matsumoto K, et al. Detection of bone metastases in non-small cell lung cancer patients: comparison of whole-body diffusion-weighted imaging (DWI), whole-body MR imaging without and with DWI, whole-body FDG-PET/CT, and bone scintigraphy. J Magn Reson Imaging. 2009;30:298-308. 13. Richman SD, Chambers P, Seymour MT, et al. Intra-tumoral heterogeneity of KRAS and BRAF mutation status in patients with advanced colorectal cancer (aCRC) and cost-effectiveness of multiple sample testing. Anal Cell Pathol (Amst). 2011;34:61-6. 14. Chowdhury S, Ongchin M, Sharratt E, et al. Intra-tumoral heterogeneity in metastatic potential and survival signaling between isoclonal HCT116 and HCT116b human colon carcinoma cell lines. PLoS One. 2013;8:e60299. 15. Nava D, Oliveira HC, Luisi FA, et al. Aplicação da ressonância magnética de corpo inteiro para o estadiamento e acompanhamento de pacientes com linfoma de Hodgkin na faixa etária infanto-juvenil: comparação entre diferentes sequências. Radiol Bras. 2011;44:29-34. 16. Asai N, Ohkuni Y, Shoji K, et al. Efficacy of 18F-fluorodeoxyglucose positron emission tomography/computed tomography in evaluating lung cancer recurrence. J Bras Pneumol. 2013;39:242-4. 17. Dias OM, Lombardi EM, Canzian M, et al. 18F-fluorodeoxyglucose positron emission tomography as a noninvasive method for the diagnosis of primary pulmonary artery sarcoma. J Bras Pneumol. 2011;37:817-22. 18. Schwenzer NF, Pfannenberg C, Reischl G, et al. Application of MR/PET in oncologic imaging. Rofo. 2012;184:780-7. 19. Berker Y, Franke J, Salomon A, et al. MRI-based attenuation correction for hybrid PET/MRI systems: a 4-class tissue segmentation technique using a combined ultrashort-echo-time/Dixon MRI sequence. J Nucl Med. 2012;53:796-804. 20. Yankeelov TE, Peterson TE, Abramson RG, et al. Simultaneous PET-MRI in oncology: a solution looking for a problem? Magn Reson Imaging. 2012;30:1342-56. 21. Vallières E, Peters S, Van Houtte P, et al. Therapeutic advances in non-small cell lung cancer. Thorax. 2012;67:1097-101. 22. Campo-Cañaveral de la Cruz JL, Herrero Collantes J, Sánchez Lorente D, et al. Chest wall surgery. Arch Bronconeumol. 2011;47 Suppl 3:15-24. 23. Kalia M. Personalized oncology: recent advances and future challenges. Metabolism. 2013;62 Suppl 1:S11-4. 24. Figueiras RG, Padhani AR, Goh VJ, et al. Novel oncologic drugs: what they do and how they affect images. Radiographics. 2011;31:2059-91. 25. Goldfarb R, Ongseng F, Finestone H, et al. Oncologic imaging: state of the art and research priorities. Am J Clin Oncol. 1989;12:178. 26. Kajiwara N, Akata S, Uchida O, et al. Cine MRI enables better therapeutic planning than CT in cases of possible lung cancer chest wall invasion. Lung Cancer. 2010;69:203-8. 27. Martí-Bonmatí L, Sopena R, Bartumeus P, et al. Multimodality imaging techniques. Contrast Media Mol Imaging. 2010;5:180-9. 28. Chawla SC, Federman N, Zhang D, et al. Estimated cumulative radiation dose from PET/CT in children with malignancies: a 5-year retrospective review. Pediatr Radiol. 2010;40:681-6. 29. Calegaro JUM. Baixos níveis de radiação ionizante causam câncer? Radiol Bras. 2007;40(4):ix-x. 30. Hall EJ, Brenner DJ. Cancer risk from diagnostic radiology: the impact of new epidemiological data. Br J Radiol. 2012;85:e1316-7. 31. Brenner DJ, Hall EJ. Cancer risk from CT scans: now we have data, what next? Radiology. 2012;265:330-1. 32. Brenner DJ. Effective dose: a flawed concept that could and should be replaced. Br J Radiol. 2008;81:521-3. 33. Sachs RK, Brenner DJ. Solid tumor risks after high doses of ionizing radiation. Proc Natl Acad Sci U S A. 2005;102:13040-5. 34. O'Neill SB, O'Connor OJ, McWilliams SR, et al. Minimization of radiation exposure due to computed tomography in inflammatory bowel disease. Clin Res Hepatol Gastroenterol. 2011;35:105-10. 35. Santos MK, Elias J Jr, Mauad FM, et al. Magnetic resonance imaging of the chest: current and new applications, with an emphasis on pulmonology. J Bras Pneumol. 2011;37:242-58. 36. Hochhegger B, Marchiori E, Irion K, et al. MRI in assessment of lung cancer. Thorax. 2011;66:357. 37. Razek AA. Diffusion magnetic resonance imaging of chest tumors. Cancer Imaging. 2012;12:452-63. 38. Ley S, Mereles D, Risse F, et al. Quantitative 3D pulmonary MR-perfusion in patients with pulmonary arterial hypertension: correlation with invasive pressure measurements. Eur J Radiol. 2007;61:251-5. 39. Testa ML, Chojniak R, Sene LS, et al. Ressonância magnética com difusão: biomarcador de resposta terapêutica em oncologia. Radiol Bras. 2013;46:178-80. 40. Koh DM, Takahara T, Imai Y, et al. Practical aspects of assessing tumors using clinical diffusion-weighted imaging in the body. Magn Reson Med Sci. 2007;6:211-24. 41. Padhani AR, Liu G, Koh DM, et al. Diffusion-weighted magnetic resonance imaging as a cancer biomarker: consensus band recommendations. Neoplasia. 2009;11:102-25. 42. Padhani AR, Koh DM. Diffusion MR imaging for monitoring of treatment response. Magn Reson Imaging Clin N Am. 2011;19:181-209. 43. Hochhegger B, Marchiori E, Sedlaczek O, et al. MRI in lung cancer: a pictorial essay. Br J Radiol. 2011;84:661-8. 44. Ohno Y, Hatabu H, Murase K, et al. Primary pulmonary hypertension: 3D dynamic perfusion MRI for quantitative analysis of regional pulmonary perfusion. AJR Am J Roentgenol. 2007;188:48-56. 45. Hopkins SR, Garg J, Bolar DS, et al. Pulmonary blood flow heterogeneity during hypoxia and high-altitude pulmonary edema. Am J Respir Crit Care Med. 2005;171:83-7. 46. Hochhegger B, Ley-Zaporozhan J, Marchiori E, et al. Magnetic resonance imaging findings in acute pulmonary embolism. Br J Radiol. 2011;84:282-7. 47. Akata S, Kajiwara N, Park J, et al. Evaluation of chest wall invasion by lung cancer using respiratory dynamic MRI. J Med Imaging Radiat Oncol. 2008;52:36-9. 48. Vilela TT, Daher RT, Nóbrega MDA, et al. Cistos congênitos do mediastino: aspectos de imagem. Radiol Bras. 2009;42:57-62. 49. Marques EF, Medeiros MLL, Souza JA, et al. Indicações de ressonância magnética das mamas em um centro de referência em oncologia. Radiol Bras. 2011;44:363-6. 50. Barreto MM, Rafful PP, Rodrigues RS, et al. Correlation between computed tomographic and magnetic resonance imaging findings of parenchymal lung diseases. Eur J Radiol. 2013;82:e492-501. 1. Doutor, Especialista em Medicina Interna, Médico Radiologista Responsável pelos Setores de Imagem Torácica do Hospital Heliópolis e do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 2. Doutor, Professor Adjunto da Universidade Federal de Ciências da Saúde de Porto Alegre (UFCSPA), Porto Alegre, RS, Brasil 3. Doutor, Médico Radiologista do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (HCFMRP-USP), Ribeirão Preto, SP, Brasil 4. Membro Titular do Colégio Brasileiro de Radiologia e Diagnóstico por Imagem (CBR), Médico Radiologista Torácico da Beneficência Portuguesa de São Paulo, São Paulo, SP, Brasil 5. Livre-docente, Professor Orientador da Pós-Graduação da Faculdade de Medicina de São José do Rio Preto (Famerp), São José do Rio Preto, SP, Brasil 6. Médica Radiologista da Faculdade de Medicina de São José do Rio Preto (Famerp), São José do Rio Preto, SP, Brasil 7. Doutor, Coordenador Adjunto do Curso de Pós-Graduação da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil Endereço para correspondência: Dr. Marcos Duarte Guimaraes Rua Paulo Orozimbo, 726, Aclimação São Paulo, SP, Brasil, 01535-001 E-mail: marcosduarte500@yahoo.com.br Recebido para publicação em 13/9/2013. Aceito, após revisão, em 7/2/2014. Trabalho realizado no Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554