Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 48 nº 1 - Jan. / Fev. of 2015
Vol. 48 nº 1 - Jan. / Fev. of 2015
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Renata Lilian Bormann1; Eduardo Lima da Rocha1; Marcelo Longo Kierzenbaum1; Bruno Cheregati Pedrassa1; Lucas Rios Torres2; Giuseppe D'Ippolito3 |
|
|
Descritores: Ressonância magnética; Gadolínio; Fígado; Meios de contraste. |
|
|
Resumo: INTRODUÇÃO
Atualmente, apesar de a ultrassonografia (US) e a tomografia computadorizada (TC) serem as principais ferramentas utilizadas para o rastreio de lesões hepáticas focais (LHFs), a ressonância magnética (RM) desempenha papel-chave na caracterização destas lesões, especialmente graças ao avanço técnico deste método, com o desenvolvimento de sequências rápidas e novas técnicas como a difusão e, mais recetemente, a introdução de contrastes hepatoespecíficos(1-4). Os agentes de contraste em RM têm demonstrado sua utilidade clínica em uma variedade de órgãos, para uma melhor detecção e caracterização de diversas lesões e anormalidades funcionais, uma vez que o estudo realizado com o meio de contraste agrega informações morfológicas e funcionais ao estudo sem o meio de contraste(1,5,6). Atualmente, uma variedade de agentes de contraste tem sido utilizada para o estudo por RM do fígado, sendo a maioria à base de quelatos do íon paramagnético gadolínio, que vem sendo utilizado desde o final da década de 1980(7,8). Os tipos de meio de contraste à base de gadolínio que existem no mercado podem ser divididos em duas categorias - extracelular inespecífico e intracelular específico -, sendo que a principal diferença está na molécula quelante que carrega o gadolínio(8). O gadolínio extracelular inespecífico foi a primeira categoria de agentes de contraste de RM aprovado para o uso clínico, tendo excelente perfil de segurança em pacientes com função renal normal(1). Mais recentemente, agentes de contraste intracelular específicos têm sido desenvolvidos para o estudo de RM do fígado, para superar as limitações dos gadolínios extracelulares quelatos, sendo então chamados contastes hepatoespecíficos(7). As duas principais classes de contrastes hepatoespecíficos são o óxido de ferro superparamagnético, que apresenta captação seletiva pelo sistema reticuloendotelial, principalmente fígado e baço, e os contrastes hepatobiliares, que são captados pelos hepatócitos e exibem excreção por via renal e biliar(7,9,10). Dessa forma, os contrastes hepatobiliares fornecem, inicialmente, informações perfusionais semelhantes ao gadolínio extracelular inespecífico (excreção renal), e mais tardiamente, informações hepatócito-seletivas (excreção biliar), permitindo assim a diferenciação entre lesões que contêm hepatócitos e lesões que não contêm hepatócitos funcionantes(9,10). Recentemente, no Brasil, foram aprovadas pela Agência Nacional de Vigilância Sanitária a utilização e a comercialização de um agente de contraste hepatobiliar, o gadolínio etoxibenzil dimeglumine (Gd-EOB-DTPA, gadoxetato dissódico, ácido dissódico gadoacético, Primovist®), conhecido genericamente como ácido gadoxético. Este meio de contraste, que já é utilizado nos Estados Unidos (Eovist®), Europa (Primovist®) e Ásia, tem demonstrado ser útil em melhorar a detecção e caracterização de LHFs(4,10-15). Entre outubro de 2012 e fevereiro de 2013, realizamos em nosso serviço 20 exames de RM para avaliação hepatobiliar com o uso do ácido gadoxético. A partir destes, selecionamos alguns casos que entendemos serem ilustrativos e úteis para a compreensão do comportamento, uso e valor do ácido gadoxético no estudo da LHF. CARACTERÍSTICAS FARMACOLÓGICAS O ácido gadoxético é um meio de contraste paramagnético usado em exames de RM, cujo efeito de realce é mediado pelo gadoxetato, um complexo iônico formado por gadolínio e o ligante ácido etoxibenzil-dietilenotriamina-pentacético (EOB-DTPA). Em razão da propriedade lipofílica do componente etoxibenzil, o gadoxetato dissódico exibe um modo de ação bifásico ou de distribuição bicompartimental: após sua injeção intravenosa, o Gd-EOB-DTPA se distribui no interior dos vasos e no espaço extracelular (espaço vásculo-intersticial) durante as fases dinâmicas de contrastação (arterial, portal e de equilíbrio ou tardia), e posteriormente sofre captação progressiva pelos hepatócitos normofuncionantes, sendo completamente eliminado pelas vias renal e hepatobiliar, em quantidade semelhante (50% cada), quando a função destes orgãos se encontra preservada(11,12,16,17). Por esta modalidade de ação, o ácido gadoxético é considerado um meio de contraste de ação mista: extracelular e hepatobiliar. O ácido gadoxético é um meio de contraste iônico e com estrutura molecular linear. A captação pelos hepatócitos se dá principalmente por meio de uma proteína de transporte presente na membrana sinusoidal (OATP1B1 e B3), e posteriormente a excreção biliar é obtida por proteínas localizadas na membrana canalicular (MRP2). Em virtude dessas características, o Gd-EOB-DTPA comporta-se de modo análogo aos quelatos de gadolínio inespecíficos (ou extracelulares) durante as fases dinâmicas e adiciona informações durante a fase de excreção hepatobiliar. Nesta fase, o parênquima hepático com hepatócitos funcionantes capta ou concentra o meio de contraste; as lesões que não possuem hepatócitos funcionantes não o captam (p.ex.: metástases), permitindo, assim, uma melhor avaliação e caracterização da LHF(11,12). O Gd-EOB-DTPA tem elevada capacidade de ligação às proteínas que aumentam significativamente a relaxação T1 do ácido gadoxético, o que confere bom efeito de realce dos vasos e do fígado, permitindo uma redução da dose em relação aos outros meios de contraste não específicos tambem à base de gadolínio. No entanto, o efeito resultante de encurtamento de T1 para imagens dinâmicas é mais tênue, em particular para o realce vascular, quando comparado aos gadolínios quelatos não específicos, o que não o torna ideal para estudos angiográficos(11,12,18). O ácido gadoxético deve ser utilizado por via intravascular (arterial ou venosa) em bolo, na dose de 0,025 mmol/kg de peso corporal (0,1 mL/kg), o que corresponde à metade da dose de gadolínio extravascular inespecífico usualmente utilizado em estudos abdominais(12). O ácido gadoxético não é metabolizado, sendo igualmente eliminado por vias renal e hepatobiliar em pacientes saudáveis. Em pacientes com disfunção renal em estágio terminal, pode ser eliminado via diálise. Embora a exposição sistêmica corporal ao gadolínio seja baixa, em função da dose utilizada e da sua eliminação por dupla via (renal e hepatobiliar), existe a possibilidade de ocorrência de fibrose sistêmica nefrogênica. Portanto, o ácido gadoxético somente pode ser utilizado em pacientes com disfunção renal grave após cuidadosa avaliação do seu risco-benefício. Sua meiavida é de cerca 2 horas, o pico de acúmulo no hepatócito ocorre entre 20 e 40 minutos e o início da concentração hepatocítica e excreção biliar ocorrem, respectivamente, após 3 minutos e 10 minutos. O composto não atravessa a barreira hematoencefálica intacta e se difunde pela barreira placentária somente em uma pequena concentração(16,17). Como ocorre com outros meios de contraste administrados por via intravenosa, o Gd-EOB-DTPA pode estar associado a reações anafilactoides/hipersensibilidade ou a outras reações idiossincráticas, caracterizadas por manifestações cardiovasculares, respiratórias ou cutâneas, podendo, em alguns casos, ocasionar reações graves, incluindo choque. O ácido gadoxético é bem tolerado, com efeitos adver-sos similares aos reportados com o uso de gadolínio quelado inespecífico, sendo os principais efeitos colaterais relatados em estudos: náuseas (1,0%), cefaleia (0,9%), lombalgia (0,5%), vertigens (0,4%), vasodilatação (0,6%), alteração do paladar e dor no local da injeção(7,11,13,15-17,19). Na nossa experiência, não observamos casos de efeitos adversos ou limitações ao uso do etoxibenzil. Não há dados disponíveis de estudos clínicos sobre a exposição ao ácido gadoxético durante a gravidez. Em doses clínicas, nenhum efeito ao lactente é esperado, podendo ser usado durante a amamentação. Em pacientes idosos (> 65 anos), pacientes com disfunção hepática e pacientes com disfunção renal não há necessidade de ajuste de dose. Níveis elevados de bilirrubina (> 3 mg/dL) ou de ferritina podem reduzir o efeito do contraste no fígado(16,17). PROTOCOLO DE EXAME O protocolo de exame recomendado inclui sequências sem contraste, gradiente eco ponderadas em T1 em fase e fora de fase, sequências rápidas ponderadas em T2 com saturação de gordura e fase com injeção intravenosa do meio de contraste, usando dose de 0,1 mL/kg de peso de Gd-EOBDTPA (equivalente a 0,025 mmol/kg) em bolo, manualmente ou por meio de injetora automática, velocidade de 1 mL/s, seguido de um flush de 20 mL de solução salina na mesma velocidade de infusão(20). Após a injeção do meio de contraste, obtém-se a sequência gradiente eco ponderada em T1 com saturação de gordura, nas fases arterial (15 a 20 segundos após o início da injeção intravenosa), portal (50 a 60 segundos) e de equilíbrio (120 segundos) e na fase hepatobiliar (10 e 20 minutos após o início da injeção intravenosa)(4,12). O tempo total de exame é de cerca de 30 a 40 minutos, mas pode ser reduzido realizando-se a sequência ponderada em T2 e a sequência de difusão entre a fase de equilíbrio e a hepatobiliar(4,21). Na RM do fígado, a sequência de difusão é geralmente adicionada aos protocolos de rotina, sendo usualmente realizada antes da administração intravenosa de agentes de contraste. No entanto, tem sido demonstrado que a sequência de difusão pode ser realizada após a injeção do ácido gadoxético, antes da obtenção da fase hepatobiliar, reduzindo o tempo de exame, sem comprometer os valores do coeficiente de difusão aparente e a relação contraste-ruído da lesão(22). Além disso, diversos estudos têm constatado que em pacientes não cirróticos a fase hepatobiliar pode ser realizada mais precocemente, isto é, 10 minutos após a injeção intravenosa do meio de contraste, sem afetar o resultado do exame de RM(4,21). No nosso serviço temos utilizado equipamentos de RM operando em 1,5 tesla, com bobinas de sinergia (Magnetom Sonata®; Siemens, Erlangen, Alemanha, e Gyroscan Intera®; Phillips Medical Systems, Best, Holanda). INDICAÇÕES A aplicação clínica desses novos agentes de contraste deve ser entendida como uma ferramenta para resolução de problemas em pacientes com LHF com características atípicas, na suspeita de pequenos tumores hepáticos primários ou secundários, não claramente identificados com outros métodos, e para complementar as informações fornecidas pelo uso de quelatos de gadolínio não específico extracelular ou pelaTC contrastada(1). Uma das principais indicações para a utilização do ácido gadoxético é na diferenciação das LHFs hepatocelulares e não hepatocelulares. Neste sentido, pode ser utilizado para distinguir lesões que contêm ductos biliares, como os nódulos displásicos em pacientes cirróticos e a hiperplasia nodular focal (HNF) em não cirróticos, de lesões não hepatocelulares, como o carcinoma hepatocelular (CHC), o adenoma, a metástase e o hemangioma. A Tabela 1 lista as principais indicações para a utilização do ácido gadoxético na avaliação hepática por meio da RM e que também pudemos adotar nos casos por nós estudados.  HNF versus adenoma A HNF e o adenoma são, respectivamente, o segundo e terceiro tumores hepáticos benignos mais comuns(25) e acometem pacientes com perfil epidemiológico semelhante(26). Apesar de ambas serem lesões consideradas benignas, é importante a sua diferenciação por causa das possíveis complicações associadas ao adenoma, como o risco de sangramento e de transformação maligna para CHC, que requerem manejo clínico apropriado(25). Algumas vezes os aspectos de imagem desses tumores podem ser superponíveis, dificultando a sua diferenciação. Nestes casos, o ácido gadoxético pode ajudar para diferenciá-los(1,25). A HNF é definida como uma lesão hepática bem circunscrita, frequentemente única, caracterizada por uma cicatriz fibrosa central, circundada por aglomerados de hepatócitos hiperplásicos e pequenos ductos biliares, em um fígado com aspecto histológico normal(31). Pelo fato de esta lesão ter canalículos biliares imaturos e que não se comunicam com os ductos biliares de maior calibre, ocorre uma retenção maior do meio de contraste hepatoespecífico do que no parênquima hepático normal ao seu redor. Além disso, nas imagens obtidas com Gd-EOB-DTPA, observa-se realce da lesão homogêneo ou heterogêneo na fase hepatocelular, dependendo da quantidade de fibrose e sua distribuição na lesão (também conhecida como "cicatriz central"). Desta forma, a HNF torna-se iso ou hiperintensa em relação ao fígado normal, permitindo diferenciá-la de outras lesões, mesmo quando com aspecto heterogêneo (Figura 1)(10,24,31). 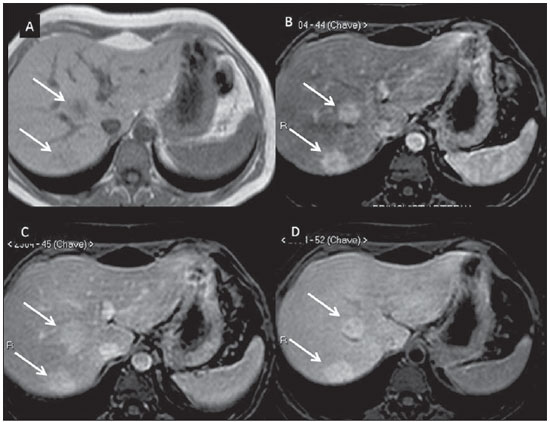 Figura 1. HNF (diagnóstico baseado em análise histológica pós-punção percutânea). Os dois nódulos no lobo hepático direito (setas) apresentam-se com hipossinal em T1 (A), realce intenso e precoce na fase arterial (B), persistente na fase portal (C) e na fase hepatobiliar realizada 10 minutos após o início da injeção intravenosa do ácido gadoxético (D). Histologicamente, os adenomas hepáticos consistem de cordões de hepatócitos bem diferenciados, com ausência de ductos biliares ou tratos portais(10,32). Nas imagens com Gd-EOB-DTPA, os adenomas tipicamente apresentam captação do meio de contraste em até 100% dos casos, porém menor do que o parênquima na fase hepatobiliar, em função da captação hepatocelular ausente ou fortemente reduzida do ácido gadoxético pela lesão (Figura 2). Por outro lado, em até 10% dos casos pode ocorrer captação semelhante ou superior ao parêquima na fase hepatobiliar(33) ou realce periférico anelar, pelo fato de alguns hepatócitos manterem a capacidade de absorção e excreção na fase hepatocelular. Este pode ser um fator de confusão no diagnóstico de adenoma ao se assemelhar à HNF(10,23,33). 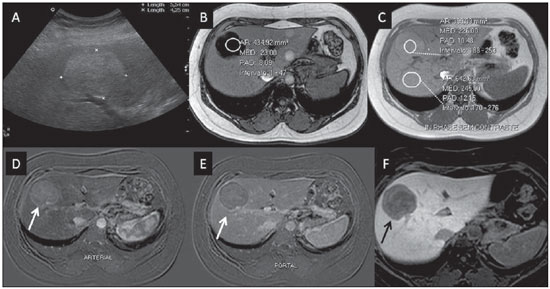 Figura 2. Adenoma hepático (diagnóstico baseado em análise histológica pós-punção percutânea). Na US observa-se massa com 5,0 cm de diâmetro, hiperecogênica e homogênea (marcada com caliper) (A). Na imagem de RM fora de fase (B) nota-se queda de sinal quando comparada com a imagem em fase (C), indicando componente adiposo intracelular. Após injeção intravenosa do ácido gadoxético, com técnica de subtração, observa-se lesão (setas) com discreto realce na fase arterial (D), imperceptível na fase portal (E) e sem captação na fase hepatobiliar (F). A presença de gordura no adenoma permite facilmente diferenciá-lo da HNF, uma vez que esta raramente a tem(34). Porém, recentemente, foram descritos três subtipos de adenomas com base em diferenças histológicas: esteatótico, inflamatório e beta-catenina ativada. Os adenomas do subtipo inflamatório correspondem a cerca de 40% destes tumores e apresentam como característica baixo teor de gordura(35). No estudo por RM com contraste inespecífico, apresentam marcado realce arterial, permanecendo com iso ou discreto hipersinal em relação ao parênquima nas fases tardias, sendo difícil sua diferenciação com a HNF. Nestes casos de dúvida diagnóstica entre HNF e adenoma, o ácido gadoxético pode ser particularmente útil(36). Por outro lado, os adenomas do subtipo beta-catenina ativada podem apresentar hiperintensidade de sinal na fase hepatobiliar, após injeção do meio de contraste hepatoespecífico, permanecendo fonte de dúvida diagnóstica diferencial com a HNF. Nódulos hepáticos em pacientes cirróticos O CHC é a neoplasia hepática primária maligna mais comum, ocorrendo geralmente como complicação da cirrose hepática, principalmente naquela causada por vírus B e C(10,32). O CHC é a principal causa de morte em pacientes cirróticos, por isso, um diagnóstico precoce e preciso é muito importante para o tratamento e manejo adequado destes pacientes(29). Lesões nodulares no fígado cirrótico podem ser separadas em dois grandes grupos: a) nódulos regenerativos e displásicos; b) nódulos neoplásicos(32). Porém, a correta caracterização por imagem destas lesões continua a ser um desafio, uma vez que as lesões pré-neoplásicas hepatocelulares, como os nódulos displásicos, muitas vezes imitam pequenos CHCs bem diferenciados(37). O diagnóstico não invasivo do CHC tem sido feito utilizando-se os Critérios de Barcelona, que adotam exames de imagem, notadamente a TC e a RM com o meio de contraste intravenoso, para caracterizar como CHC uma lesão focal no fígado cirrótico; são considerados CHCs nódulos iguais ou maiores que 2,0 cm de diâmetro, hipervasculares na fase arterial (wash-in) e com clareamento (wash-out) nas fases tardias, em um exame de imagem axial com o meio de contraste intravenoso (TC ou RM)(38). Quando a lesão hepática mede entre 1,0 e 2,0 cm de diâmetro, dois estudos dinâmicos de imagem com achados típicos são recomendados para o diagnóstico de CHC, segundo as diretrizes da Associação Americana para o Estudo do Fígado(39). No entanto, estes achados típicos de imagem frequentemente não são vistos em CHCs pequenos (menores que 2,0 cm), particularmente em CHCs iniciais bem diferenciados (early HCC), sendo necessária biópsia do fígado para o seu diagnóstico ou controles evolutivos mais frequentes(29). Em pacientes cirróticos, o ácido gadoxético pode ser útil na identificação de pequenos CHCs e na correta caracterização das lesões que apresentam comportamento atípico nas imagens ponderadas em T1, em T2 e com padrão de realce inespecífico(4,29). Na fase hepatobiliar, após administração do ácido gadoxético, os nódulos regenerativos aparecem iso ou levemente hiperintensos em relação ao parênquima hepático circundante, uma vez que são formados por hepatócitos funcionantes, sendo muitas vezes identificados pela presença de fina pseudocápsula com hipossinal decorrente da matriz fibrosa envolvente(37). Ao contrário, CHCs apresentam hipossinal em relação ao parênquima hepático adjacente na fase hepatobiliar, principalmente nas lesões moderadamente e pouco diferenciadas(29) (Figura 3). Nódulos displásicos representam achado comum no fígado cirrótico. Podem ser classificados em nódulos displásicos de baixo e de alto grau, com base na quantidade e tipo de atipia celular. Os nódulos displásicos de alto grau são considerados lesões pré-malignas. Mesmo com o uso de ácido gadoxético, a distinção entre nódulo displásico e CHC bem diferenciado permanece um desafio diagnóstico, pois em alguns casos as células neoplásicas do CHC bem diferenciado podem apresentar função hepatocelular preservada, sendo capazes de absorção e metabolização do meio de contraste e, desta maneira, o nódulo maligno pode aparecer como iso ou mesmo hiperintenso na fase hepatobiliar, simulando um nódulo regenerativo ou nódulo displásico(29,37). Por outro lado, alguns nódulos displásicos apresentam-se hipointensos na fase hepatobiliar, simulando um CHC(29) (Figura 4). 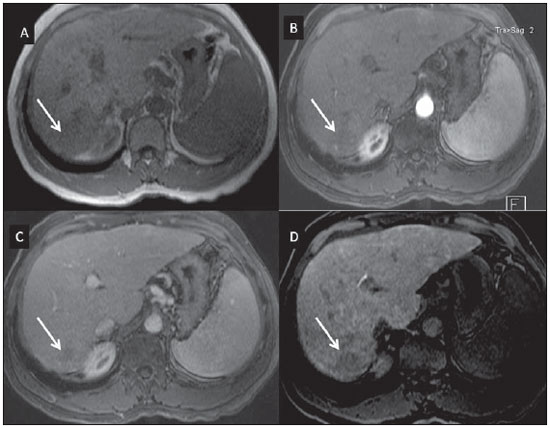 Figura 3. CHC infiltrativo e indiferenciado (confirmado por biópsia percutânea). Nas imagens ponderadas em T1 antes da injeção intravenosa do ácido gadoxético (A) e obtidas na fase arterial e portal de contrastação (B,C), a lesão é mal definida quando comparada com a imagem obtida na fase hepatobiliar (setas), realizada 20 minutos após o uso do meio de contraste (D). Notar que nesta fase a lesão é hipocaptante em relação ao parênquima hepático, indicando ausência de hepatócitos normofuncionantes. 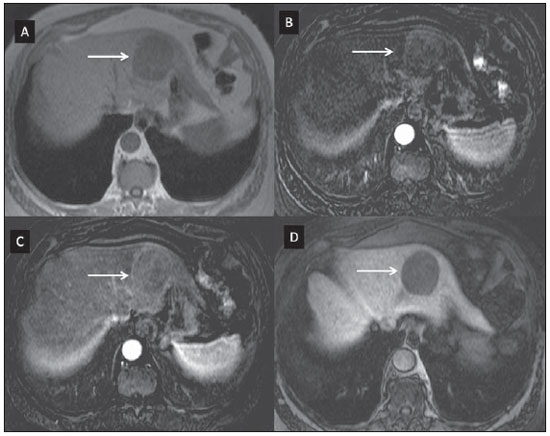 Figura 4. Nódulo displásico versus CHC bem diferenciado. Na imagem poderada em T1 (A) nota-se volumosa massa hipointensa, homogênea e bem definida no lobo esquerdo (setas). Na fases arterial (B) e portal (C) de contrastação hepática, obtidas com técnica de subtração, para potencializar a identificação do realce da lesão, observa-se tênue realce precoce, sem inequívoco wash-out. Na fase hepatobiliar (D), obtida 20 minutos após injeção intravenosa do ácido gadoxético, não houve captação da lesão. A análise histológica do material não permitiu diferenciar um nódulo displásico de alto grau de um CHC bem diferenciado. Trabalhos recentes têm demonstrado que a captação do Gd-EOB-DTPA por alguns CHCs está relacionada à expressão de proteínas transportadoras - OATP1B3 - na membrana dos hepatócitos destas lesões(40). Porém, estudos mais aprofundados são necessários para confirmar esta teoria. Embora a TC multidetectores (TCMD) tenha atingido alto padrão para a detecção de CHC, pela possibilidade de exames multifásicos e conjuntos de dados de alta resolução, a RM é considerada a melhor modalidade de imagem não invasiva para a detecção do CHC e para a caracterização de nódulos em pacientes cirróticos, em virtude dos múltiplos parâmetros avaliados e em especial pela possibilidade de utilização de agentes de contrates hepatoespecíficos(41). Vários estudos vêm demonstrando um aumento na taxa de dectecção de CHC pela RM com ácido gadoxético, em comparação com a TCMD, especialmente para lesões menores que 1,5 cm(42-44). Em 2009, Kim et al. demonstraram maior acurácia no diagnóstico de CHC pela RM com Gd-EOB-DTPA, com 91,45% de sensibilidade no grupo do ácido gadoxético versus 71,6% no grupo da TCMD, com porcentagem de 24,7% maior na detecção de CHCs pequenos (menores que 1,5 cm). Outros pesquisadores demostraram que a combinação do estudo dinâmico com a fase hepatocítica na RM com ácido gadoxético apresentou performance diagnóstica melhor do que apenas o estudo dinâmico na caracterização de lesões focais no fígado cirrótico(45,46). Metástases hepáticas Outra indicação da utilização do ácido gadoxético no estudo do fígado é a detecção de metástases hepáticas, principalmente no acompanhamento de pacientes com carcinoma colorretal(4,47). A metástase hepática é a lesão maligna mais frequente do fígado. O diagnóstico correto é fundamental para a conduta terapêutica e para estabelecer o prognóstico, sendo de extrema importância a diferenciação entre metástases e outros nódulos hepáticos benignos em pacientes oncológicos(32). Na fase hepatobiliar utilizando o ácido gadoxético, tanto as metástases hepáticas hipovasculares quanto as hipervasculares se apresentam hipointensas em relação ao parênquima adjacente, em razão da ausência de hepatócitos funcionantes nestas lesões(30). Nesta fase, o clareamento do contraste pela lesão, associado ao realce do parênquima sadio circunjacente, melhora o contraste tumor-fígado, aumentando a conspicuidade da lesão. Isto permite detecção significativamente maior de lesões, especialmente para as menores que 1,0 cm de diâmetro, o que pode ter impacto no planejamento terapêutico e na abordagem cirúrgica(15,19,30) (Figura 5). Hammerstingl et al.(13) demonstraram, em um estudo prospectivo, que a RM com ácido gadoxético foi superior à TC na avaliação de LHF, considerando a detecção, a localização, a delimitação e o manejo dos pacientes, levando a uma mudança terapêutica em 14,5% dos pacientes, permitindo um melhor planejamento pré-operatório nas ressecções hepáticas. Outro estudo, de Bluemke et al., também demostrou maior detecção de metástases hepáticas com o uso do ácido gadoxético na RM hepática, para lesões maiores e menores que 1,0 cm(19). 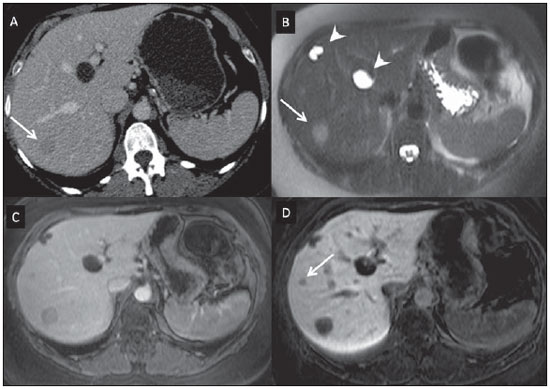 Figura 5. Metástase hepática por neoplasia de mama (diagnóstico baseado no acompanhamento evolutivo). As imagens obtidas na TC na fase de contrastação portal (A) e na RM ponderada em T2 (B) permitem identificar apenas um nódulo hepático no segmento VII/VIII (setas em A e B). As imagens de RM após injeção intravenosa do ácido gadoxético obtidas na fase portal (C) e hepatobiliar (D) possibilitam identificar um outro pequeno nódulo (seta em D), mais bem caracterizado na fase tardia. Notam-se também dois cistos no lobo esquerdo (cabeças de setas em B). Outras lesões hepáticas Para os demais nódulos hepáticos, como o hemangioma, o colangiocarcinoma e outras lesões benignas (p. ex.: abscessos e cistos hidáticos), o ácido gadoxético parece não ter indicação precisa, lembrando que nestes casos não ocorre realce das lesões na fase hepatobiliar, uma vez que estes nódulos não apresentam hepatócitos funcionates. Exceções seriam as lesões benignas das vias biliares, como a doença de Caroli, em que se observa realce das lesões císticas na fase hepatobiliar devido à sua comunicação com a árvore biliar(48). O realce do hemangioma na RM com o Gd-EOB-DTPA apresenta algumas particularidades. A lesão tende a seguir o sinal do sangue dos vasos abdominais na fase extracelular. Por outro lado, ao contrário do que ocorre quando se utiliza o meio de contraste extracelular, na fase hepatobiliar o hemangioma não apresenta realce progressivo ou persistente e maior ou igual ao parênquima hepático, mas sim, hipossinal em relação ao fígado, em função da ausência de hepatócitos, contrastando com o parênquima normal adjacente, que apresenta intensa captação do Gd-EOB-DTPA nesta fase. Este fenômeno é chamado de inversão do gradiente de realce fígado-lesão(4,10,14)(Figura 6). 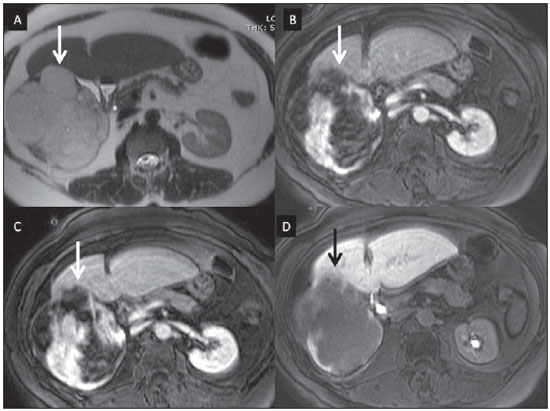 Figura 6. Hemangioma hepático (diagnóstico baseado nas características de imagem). Presença de lesão no lobo hepático direito (setas). Na imagem de RM ponderada em T2 (A) nota-se o típico hipersinal do hemangioma, assim como o realce progressivo, discontínuo e centrípeto nas fases de contrastação portal (B) e de equilíbrio (C). Na fase hepatobiliar, obtida 10 minutos após injeção intravenosa do ácido gadoxético, obserrva-se o efeito de inversão de gradiente do realce fígado-lesão, decorrente da maior captação do meio de contraste pelo parênquima, quando comparado com a hipocaptação do hemangioma, pela ausência de hepatócitos funcionantes no seu interior (D). CONCLUSÃO O propósito deste estudo foi o de fazer uma revisão sobre a avaliação por RM dos nódulos hepáticos mediante o uso do contraste hepatoespecífico, motivado pela sua recente disponibilização no nosso mercado. Na nossa experiência inicial, e substanciada pela revisão bibliográfica(1-3,11,13), foi possível identificar distintos padrões de realce das lesões estudadas com o ácido gadoxético em função da sua etiologia, sendo possível distinguir dois grupos: um grupo formado pelas lesões com hepatócitos funcionantes, como a HNF e os nódulos displásicos, e outro grupo incluindo todas as demais lesões hepáticas que não contêm hepatócitos funcionantes (p. ex.: CHC, adenomas e metástases). Neste sentido, observamos que o uso do etoxibenzil é mais útil na diferenciação entre HNF e adenoma, na diferenciação entre nódulos displásicos e CHC em fígado cirrótico, na detecção de pequenos CHCs (inferiores a 2,0 cm de diâmetro) e de diminutas metástases, em que a utilização do contraste hepatoespecífico apresenta maior sensibilidade e especificidade do que os agentes extracelulares. Por essas razões, a RM com o uso de etoxibenzil tem sido considerada, atuamente, a melhor modalidade de imagem para a investigação das LHFs(2); todavia, por causa do seu maior custo, este tipo de meio de contraste não deveria ser utilizado de forma rotineira, mas em casos selecionados, nos quais a sua utilidade tem sido comprovada, como nas indicações supramencionadas. REFERÊNCIAS 1. Ba-Ssalamah A, Uffmann M, Saini S, et al. Clinical value of MRI liver-specific contrast agents: a tailored examination for a confident non-invasive diagnosis of focal liver lesions. Eur Radiol. 2009;19:342-57. 2. Holzapfel K, Eiber MJ, Fingerle AA, et al. Detection, classification, and characterization of focal liver lesions: value of diffusion-weighted MR imaging, gadoxetic acid-enhanced MR imaging and the combination of both methods. Abdom Imaging. 2012;37:74-82. 3. Bartolozzi C. MR of the liver: from breakthrough to clinical application. Abdom Imaging. 2012;37:154. 4. Tanimoto A, Lee JM, Murakami T, et al. Consensus report of the 2nd International Forum for Liver MRI. Eur Radiol. 2009;19 Suppl 5:S975-89. 5. Bellin MF, Webb JA, Van Der Molen AJ, et al. Safety of MR liver specific contrast media. Eur Radiol. 2005;15:1607-14. 6. Bellin MF, Vasile M, Morel-Precetti S. Currently used non-specific extracellular MR contrast media. Eur Radiol. 2003;13:2688-98. 7. Reimer P, Schneider G, Schima W. Hepatobiliary contrast agents for contrast-enhanced MRI of the liver: properties, clinical development and applications. Eur Radiol. 2004;14:559-78. 8. Elias Jr J, Santos AC, Koenigkam-Santos M, et al. Complications from the use of intravenous gadolinium-based contrast agents for magnetic resonance imaging. Radiol Bras. 2008;41:263-7. 9. Semelka RC, Helmberger TK. Contrast agents for MR imaging of the liver. Radiology. 2001;218:27-38. 10. Campos JT, Sirlin CB, Choi JY. Focal hepatic lesions in Gd-EOBDTPA enhanced MRI: the atlas. Insights Imaging. 2012;3:451-74. 11. Van Beers BE, Pastor CM, Hussain HK. Primovist, Eovist: what to expect? J Hepatol. 2012;57:421-9. 12. Seale MK, Catalano OA, Saini S, et al. Hepatobiliary-specific MR contrast agents: role in imaging the liver and biliary tree. Radiographics. 2009;29:1725-48. 13. Hammerstingl R, Huppertz A, Breuer J, et al. Diagnostic efficacy of gadoxetic acid (Primovist)-enhanced MRI and spiral CT for a therapeutic strategy: comparison with intraoperative and histopathologic findings in focal liver lesions. Eur Radiol. 2008;18:457-67. 14. Reimer P, Rummeny EJ, Daldrup HE, et al. Enhancement characteristics of liver metastases, hepatocellular carcinomas, and hemangiomas with Gd-EOB-DTPA: preliminary results with dynamic MR imaging. Eur Radiol. 1997;7:275-80. 15. Huppertz A, Balzer T, Blakeborough A, et al. Improved detection of focal liver lesions at MR imaging: multicenter comparison of gadoxetic acid-enhanced MR images with intraoperative findings. Radiology. 2004;230:266-75. 16. Primovist. Bula. Berlim: Bayer Pharma AG; 2011. 17. Tanimoto A, Kadoya M, Kawamura Y, et al. Safety and efficacy of a novel hepatobiliary MR contrast agent, Gd-DTPA-DeA: results of phase I and phase II clinical trials. J Magn Reson Imaging. 2006;23:499-508. 18. Tamada T, Ito K, Sone T, et al. Dynamic contrast-enhanced magnetic resonance imaging of abdominal solid organ and major vessel: comparison of enhancement effect between Gd-EOB-DTPA and Gd-DTPA. J Magn Reson Imaging. 2009;29:636-40. 19. Bluemke DA, Sahani D, Amendola M, et al. Efficacy and safety of MR imaging with liver-specific contrast agent: U.S. multicenter phase III study. Radiology. 2005;237:89-98. 20. Zech CJ, Vos B, Nordell A, et al. Vascular enhancement in early dynamic liver MR imaging in an animal model: comparison of two injection regimen and two different doses Gd-EOB-DTPA (gadoxetic acid) with standard Gd-DTPA. Invest Radiol. 2009;44:305-10. 21. Motosugi U, Ichikawa T, Tominaga L, et al. Delay before the hepatocyte phase of Gd-EOB-DTPA-enhanced MR imaging: is it possible to shorten the examination time? Eur Radiol. 2009;19:2623-9. 22. Choi JS, Kim MJ, Choi JY, et al. Diffusion-weighted MR imaging of liver on 3.0-Tesla system: effect of intravenous administration of gadoxetic acid disodium. Eur Radiol. 2010;20:1052-60. 23. Huppertz A, Haraida S, Kraus A, et al. Enhancement of focal liver lesions at gadoxetic acid-enhanced MR imaging: correlation with histopathologic findings and spiral CT - initial observations. Radiology. 2005;234:468-78. 24. Zech CJ, Grazioli L, Breuer J, et al. Diagnostic performance and description of morphological features of focal nodular hyperplasia in Gd-EOB-DTPA-enhanced liver magnetic resonance imaging: results of a multicenter trial. Invest Radiol. 2008;43:504-11. 25. Purysko AS, Remer EM, Veniero JC. Focal liver lesion detection and characterization with GD-EOB-DTPA. Clin Radiol. 2011;66:673-84. 26. Sano K, Ichikawa T, Motosugi U, et al. Imaging study of early hepatocellular carcinoma: usefulness of gadoxetic acid-enhanced MR imaging. Radiology. 2011;261:834-44. 27. Sun HY, Lee JM, Shin CI, et al. Gadoxetic acid-enhanced magnetic resonance imaging for differentiating small hepatocellular carcinomas (< or =2 cm in diameter) from arterial enhancing pseudolesions: special emphasis on hepatobiliary phase imaging. Invest Radiol. 2010;45:96-103. 28. Lee MH, Kim SH, Park MJ, et al. Gadoxetic acid-enhanced hepatobiliary phase MRI and high-b-value diffusion-weighted imaging to distinguish well-differentiated hepatocellular carcinomas from benign nodules in patients with chronic liver disease. AJR Am J Roentgenol. 2011;197:W868-75. 29. Kogita S, Imai Y, Okada M, et al. Gd-EOB-DTPA-enhanced magnetic resonance images of hepatocellular carcinoma: correlation with histological grading and portal blood flow. Eur Radiol. 2010;20:2405-13. 30. Zech CJ, Herrmann KA, Reiser MF, et al. MR imaging in patients with suspected liver metastases: value of liver-specific contrast agent Gd-EOB-DTPA. Magn Reson Med Sci. 2007;6:43-52. 31. van Kessel CS, de Boer E, ten Kate FJ, et al. Focal nodular hyperplasia: hepatobiliary enhancement patterns on gadoxetic-acid contrast-enhanced MRI. Abdom Imaging. 2013;38:490-501. 32. Tiferes DA, D'Ippolito G. Neoplasias hepáticas: caracterização por métodos de imagem. Radiol Bras. 2008;41:119-27. 33. Denecke T, Steffen IG, Agarwal S, et al. Appearance of hepatocellular adenomas on gadoxetic acid-enhanced MRI. Eur Radiol. 2012;22:1769-75. 34. Ferlicot S, Kobeiter H, Tran Van Nhieu J, et al. MRI of atypical focal nodular hyperplasia of the liver: radiology-pathology correlation. AJR Am J Roentgenol. 2004;182:1227-31. 35. Bioulac-Sage P, Laumonier H, Couchy G, et al. Hepatocellular adenoma management and phenotypic classification: the Bordeaux experience. Hepatology. 2009;50:481-9. 36. Grazioli L, Bondioni MP, Haradome H, et al. Hepatocellular adenoma and focal nodular hyperplasia: value of gadoxetic acid-enhanced MR imaging in differential diagnosis. Radiology. 2012;262:520-9. 37. Bartolozzi C, Battaglia V, Bozzi E. Hepatocellular nodules in liver cirrhosis: contrast-enhanced MR. Abdom Imaging. 2011;36:290-9. 38. Bruix J, Sherman M, Llovet JM, et al. Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL conference. European Association for the Study of the Liver. J Hepatol. 2001;35:421-30. 39. Bruix J, Sherman M; Practice Guidelines Committee, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma. Hepatology. 2005;42:1208-36. 40. Narita M, Hatano E, Arizono S, et al. Expression of OATP1B3 determines uptake of Gd-EOB-DTPA in hepatocellular carcinoma. J Gastroenterol. 2009;44:793-8. 41. Zech CJ, Reiser MF, Herrmann KA. Imaging of hepatocellular carcinoma by computed tomography and magnetic resonance imaging: state of the art. Dig Dis. 2009;27:114-24. 42. Kim YK, Kim CS, Han YM, et al. Detection of hepatocellular carcinoma: gadoxetic acid-enhanced 3-dimensional magnetic resonance imaging versus multi-detector row computed tomography. J Comput Assist Tomogr. 2009;33:844-50. 43. Di Martino M, Marin D, Guerrisi A, et al. Intraindividual comparison of gadoxetate disodium-enhanced MR imaging and 64-section multidetector CT in the detection of hepatocellular carcinoma in patients with cirrhosis. Radiology. 2010;256:806-16. 44. Kim SH, Lee J, Kim MJ, et al. Gadoxetic acid-enhanced MRI versus triple-phase MDCT for the preoperative detection of hepatocellular carcinoma. AJR Am J Roentgenol. 2009;192:1675-81. 45. Chou CT, Chen YL, Su WW, et al. Characterization of cirrhotic nodules with gadoxetic acid-enhanced magnetic resonance imaging: the efficacy of hepatocyte-phase imaging. J Magn Reson Imaging. 2010;32:895-902. 46. Ahn SS, Kim MJ, Lim JS, et al. Added value of gadoxetic acid-enhanced hepatobiliary phase MR imaging in the diagnosis of hepatocellular carcinoma. Radiology. 2010;255:459-66. 47. Chan VO, Das JP, Gerstenmaier JF, et al. Diagnostic performance of MDCT, PET/CT and gadoxetic acid (Primovist(®))-enhanced MRI in patients with colorectal liver metastases being considered for hepatic resection: initial experience in a single centre. Ir J Med Sci. 2012;181:499-509. 48. Lee NK, Kim S, Lee JW, et al. Biliary MR imaging with Gd-EOBDTPA and its clinical applications. Radiographics. 2009;29:1707-24. 1. Médicos Radiologistas do Setor de Abdome do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil 2. Mestre, Pós-graduando do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil 3. Livre-docente, Professor do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil Endereço para correspondência: Dr. Giuseppe D'Ippolito Departamento de Diagnóstico por Imagem - EPM-Unifesp Rua Napoleão de Barros, 800, Vila Clementino São Paulo, SP, Brasil, 04024-012 E-mail: giuseppe_dr@uol.com.br Recebido para publicação em 7/5/2013. Aceito, após revisão, em 6/2/2014. Trabalho realizado no Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554