Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 47 nº 6 - Nov. / Dez. of 2014
Vol. 47 nº 6 - Nov. / Dez. of 2014
|
ENSAIO ICONOGRÁFICO
|
|
|
|
|
Autho(rs): Bruno Cheregati Pedrassa1; Eduardo Lima da Rocha1; Marcelo Longo Kierzenbaum1; Renata Lilian Bormann1; Viviane Vieira Francisco2; Giuseppe D'Ippolito3 |
|
|
Descritores: Neoplasias; Fígado; Atípicos; Tomografia computadorizada; Ressonância magnética. |
|
|
Resumo: INTRODUÇÃO
Uma grande variedade de tumores acomete o fígado, sendo que 90% das lesões hepáticas focais são benignas. Dentre os tumores hepáticos benignos, o hemangioma e a hiperplasia nodular focal (HNF) são as lesões não císticas mais comuns(1). As neoplasias malignas mais frequentes são as metástases, e o carcinoma hepatocelular (CHC) é responsável por 80–85% dos casos de tumores malignos primários, seguido pelo colangiocarcinoma intra-hepático(2). O diagnóstico das lesões hepáticas típicas pode ser feito com alguma segurança utilizando-se os diversos métodos de imagem; ao contrário, as lesões incomuns são geralmente um desafio diagnóstico para o radiologista. No grupo de tumores considerados incomuns destacamse os tumores de linhagem epitelial, como o cistoadenoma e cistoadenocarcinoma biliar, o hepatocarcinoma fibrolamelar, os tumores de linhagem não epitelial, incluindo o angiomiolipoma, o hemangioendotelioma epitelioide e o angiossarcoma, além de outros, como o linfoma, o pseudotumor inflamatório (tumor miofibroblástico) e alguns sarcomas(3). Existem poucos estudos que realizaram a análise comparativa e abrangente das características de imagem dos tumores hepáticos incomuns. O objetivo deste trabalho é, por meio de um ensaio iconográfico, descrever os principais aspectos de imagem de diversos tumores hepáticos benignos e malignos incomuns, observados na tomografia computadorizada (TC) e ressonância magnética (RM). Nesta segunda parte do estudo serão abordados o linfoma hepático primário, o tumor miofibroblástico, o tumor neuroendócrino primário hepático e o tumor desmoplásico de pequenas células. LINFOMA HEPÁTICO PRIMÁRIO O linfoma hepático primário (LHP) é uma neoplasia extremamente rara, correspondendo a menos de 1% dos linfomas extranodais. É definido como primário do fígado quando não há envolvimento do baço, linfonodos ou outros sítios a distância, no momento do seu diagnóstico. Apresenta predileção pelo sexo masculino (3 homens: 1 mulher) e usualmente ocorre na quinta década de vida(4). No momento do diagnóstico, os sintomas são inespecíficos e os pacientes podem apresentar desconforto abdominal ou febre. Há forte associação com imunossupressão, vírus da hepatite B e C, vírus da imunodeficiência humana e Epstein-Barr(5,6). Em cerca de 60% dos casos se apresentam como massas solitárias (maiores que 4 cm), com contornos bem definidos, que após injeção intravenosa do meio de contraste demonstram realce periférico com aspecto lamelar; essas massas raramente podem calcificar, simulando metástase hipovascular do tubo digestivo, com aspecto em alvo (Figuras 1 e 2). As formas multinodular e infiltrativa são menos frequentes e geralmente relacionadas a comprometimento hepático do linfoma sistêmico(5). 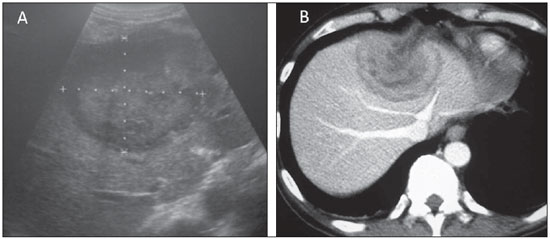 Figura 1. Linfoma hepático primário. A: Ultrassom demonstra massa hepática heterogênea, localizada na confluência dos lobos direito e esquerdo, com aspecto em alvo. B: Na correlação com a TC, evidencia-se o realce periférico de aspecto lamelar após injeção intravenosa do meio de contraste. 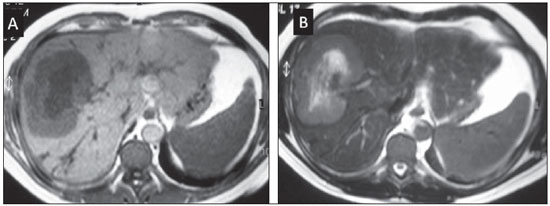 Figura 2. RM de paciente com linfoma hepático primário. Massa heterogênea no lobo hepático direito, com aspecto em alvo e hipossinal nas sequências ponderadas em T1 (A) e moderado a hipersinal em T2 (B). Alguns aspectos favorecem o diagnóstico de LHP:
PSEUDOTUMOR INFLAMATÓRIO (TUMOR MIOFIBROBLÁSTICO) É lesão hepática rara caracterizada por uma inflamação crônica, com proliferação de fibroblastos, que pode comprometer diferentes órgãos, mas é mais comumente encontrada no pulmão e no fígado(7). Possui outros sinônimos, como xantogranuloma, histiocitoma, pseudolinfoma e fibroxantoma. Atualmente, é conhecido como tumor miofibroblástico inflamatório (TMI)(8). Ocorre com maior frequência em adultos jovens do sexo masculino, e em geral tem evolução benigna. A etiologia é desconhecida, podendo estar relacionada a processos inflamatório-infecciosos (hepatite e colangite de repetição) e doenças autoimunes(8). A maioria dos pacientes apresenta sintomas não específicos, como febre, dor abdominal, perda de peso e icterícia. Geralmente, é massa solitária, podendo ser múltipla e sincrônica em 20% dos casos, localiza-se com maior frequência no lobo hepático direito e seu diâmetro pode variar de 1 cm a 20 cm no seu maior eixo(8). A análise laboratorial frequentemente demonstra leucocitose, eosinofilia e velocidade de hemossedimentação (VHS) aumentada. Casos de pacientes com elevação de marcadores tumorais como CA 19-9 já foram relatados(7,9). A TC geralmente mostra massa hipodensa, com realce periférico heterogêneo, com área central pouco vascularizada. Podem ocorrer efeitos compressivos da massa determinando dilatação das vias biliares e hipertensão portal (Figura 3). A RM é um dos métodos que pode caracterizar melhor o pseudotumor inflamatório. A lesão focal tipo massa é a mais comum e apresenta-se com baixo sinal em T1 e sinal discretamente elevado em T2, às vezes com focos de marcado hipersinal de permeio. Após injeção do contraste paramagnético, observa-se realce intenso e heterogêneo, principalmente na periferia da lesão(8). 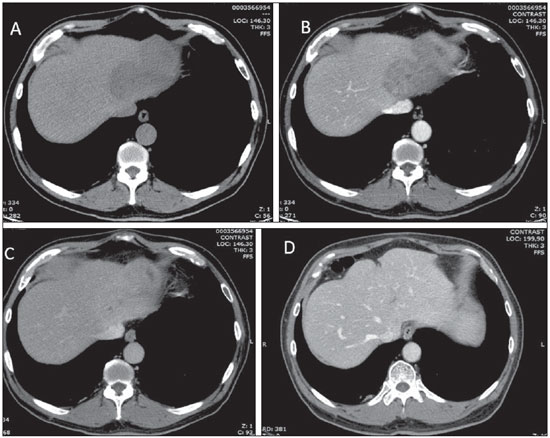 Figura 3. Pseudotumor inflamatório. Homem, 66 anos, com dor no hipocôndrio direito associada a febre e leucocitose. TC sem contraste (A) e após injeção intravenosa do meio de contraste (B,C) demonstra a presença de lesão hipodensa e hipovascularizada nos segmentos II e IV, com aspecto permeativo, simulando lesão infiltrativa. Na TC de controle, realizada após três meses de tratamento com antibióticos, observa-se regressão total da lesão (D). Geralmente, a correlação histopatológica é necessária para o diagnóstico definitivo do pseudotumor inflamatório, que inclui, entre seus diagnósticos diferenciais, o colangiocarcinoma intra-hepático, o abscesso hepático e o CHC(7). Os principais aspectos que podem sugerir o diagnóstico de TMI são:
TUMOR NEUROENDÓCRINO PRIMÁRIO DO FÍGADO O tumor neuroendócrino primário do fígado (TNPF) representa menos de 0,3% de todos os tumores neuroendócrinos. Ocorre mais comumente em mulheres, na sexta e sétima décadas de vida. Os sintomas são inespecíficos, como dor abdominal, massa abdominal palpável, fadiga e perda de peso. Mais de 10% dos casos são assintomáticos e apenas pequena porcentagem dos pacientes apresenta a síndrome carcinoide (rubor facial, dor abdominal e diarreia)(10). O diagnóstico do tumor carcinoide hepático primário é baseado no exame histológico, imuno-histoquímico e principalmente na exclusão de doença metastática. A cintilografia com análogo da somatostatina (OctreoScan) é uma técnica útil para o diagnóstico de tumores neuroendócrinos funcionantes, com sensibilidade de até 90%. A PET/CT é uma modalidade de imagem reservada para o diagnóstico dos tumores não funcionantes. A ressecção cirúrgica é o tratamento de escolha, sendo a quimioembolização arterial transcateter excelente opção paliativa para lesões recorrentes(11). Os achados de imagem à TC consistem em lesões sólidas, únicas ou múltiplas, hipervascularizadas, com áreas de necrose e calcificação de permeio (Figura 4). Na RM as lesões têm baixo sinal em T1 e alto sinal nas sequências ponderadas em T2(10) (Figuras 5 e 6). 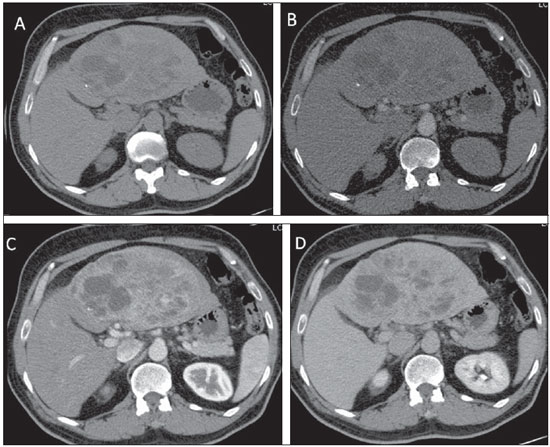 Figura 4. Carcinoma neuroendócrino primário do fígado. TC sem contraste (A) e após injeção intravenosa do meio de contraste (B,C,D) demonstra a presença de massa heterogênea, bastante vascularizada, com alguns focos de calcificação e áreas císticas de permeio, ocupando o lobo hepático esquerdo. 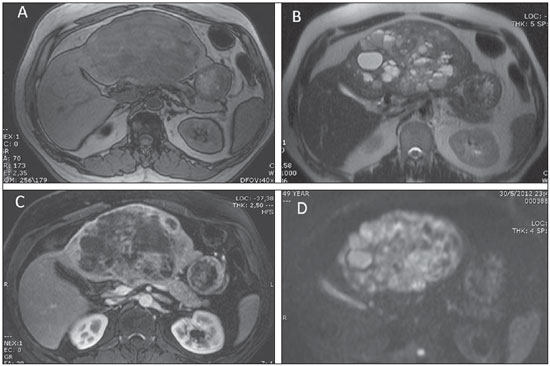 Figura 5. Carcinoma neuroendócrino primário do fígado (mesmo paciente da Figura 4). Imagens de RM ponderada em T1 (A), em T2 (B) e na sequência pós-contraste (C) demonstram massa heterogênea, com hipossinal em T1 e hipersinal em T2, com múltiplas áreas císticas de permeio (algumas das quais com nível líquido-líquido). A lesão apresentava restrição aos coeficientes de difusão da água na sequência de difusão (D). 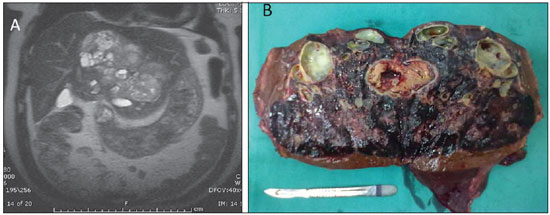 Figura 6. Carcinoma neuroendócrino primário do fígado (mesmo paciente das Figuras 4 e 5). Imagem de RM ponderada em T2 no plano coronal (A) demonstra massa heterogênea ocupando quase todo o lobo hepático esquerdo, com hipersinal e múltiplas áreas císticas de permeio, com excelente correspondência com o aspecto macroscópico observado no material da ressecção cirúrgica (B). O diagnóstico diferencial é amplo, entretanto, devemos considerar a possibilidade de metástases hipervasculares, CHC, colangiocarcinoma com diferenciação neuroendócrina e a variante epitelioide do tumor estromal gastrintestinal(10). Os seguintes aspectos podem auxiliar para considerar pertinente a hipótese de TNPF entre os diagnósticos diferenciais:
TUMOR DESMOPLÁSICO DE PEQUENAS CÉLULAS O tumor desmoplásico de pequenas células (TDPC) é um tumor mesenquimal raro e altamente agressivo, com cerca de 200 casos descritos na literatura. Apresenta maior incidência em adolescentes e adultos jovens, preferencialmente do sexo masculino, numa proporção de 4:1, com uma média de idade de 22 anos(12). A localização é quase que exclusivamente intra-abdominal, sem origem visceral claramente identificada, com acometimento do omento, implantes peritoneais envolvendo o diafragma, hilo esplênico, mesentério intestinal e peritônio pélvico(13). O envolvimento de órgãos é inconstante e secundário, com fígado e pulmão como dois locais comuns para a doença metastática além do peritônio(11). As manifestações clínicas do TDPC intra-abdominal são usualmente inespecíficas e envolvem mais frequentemente sintomas vagos pélvicos ou abdominais e massas palpáveis(13). Os achados de imagem demonstram massa tumoral, intraperitoneal, sem a identificação de um órgão sede, associada a múltiplos implantes peritoneais e ascite. À TC e à RM se apresentam como massas com densidade de partes moles, com focos centrais sugerindo necrose e hemorragia, apresentando moderado realce após injeção intravenosa de contraste, e calcificações em 22% dos casos(13)(Figura 7). 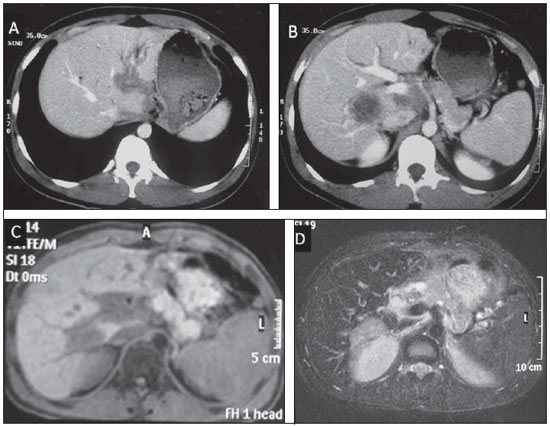 Figura 7. Tumor desmoplásico de pequenas células. TC na fase portal (A,B) demonstra formação expansiva hipodensa, hipovascularizada, infiltrando o hilo hepático, associada a discreta dilatação segmentar das vias biliares intrahepáticas à esquerda. Nota-se também um componente intraparenquimatoso. O exame de RM com imagens ponderadas em T1 e em T2 com supressão de gordura (D) mostra o hipossinal em T1 e hipersinal em T2 da lesão, insinuandose no hilo hepático. O TDPC pode ser lembrado na presença de massas intraperitoneais com extensão visceral, sem sítio primário definido e ocorrendo em pacientes jovens. CONCLUSÃO Apesar de raros, os tumores descritos nesta segunda parte do estudo devem ser conhecidos e lembrados pelos radiologistas, para que sejam incluídos nos diagnósticos diferenciais de lesões hepáticas, auxiliando não somente no planejamento e estratégia terapêutica, mas também como coadjuvante na definição do diagnóstico anatomopatológico. REFERÊNCIAS 1. Tiferes DA, D'Ippolito G. Neoplasias hepáticas: caracterização por métodos de imagem. Radiol Bras. 2008;41:119–27. 2. Walther Z, Jain D. Molecular pathology of hepatic neoplasms: classification and clinical significance. Patholog Res Int. 2011;2011:403929. 3. Hamilton SR, Aaltonen LA. World Health Organization Classification of Tumours. Pathology and genetics of tumours of the digestive system. Lyon, France: IARC Press; 2000. 4. Masood A, Kairouz S, Hudhud KH, et al. Primary non-Hodgkin lymphoma of the liver. Curr Oncol. 2009;16:74–7. 5. Coenegrachts K, Vanbeckevoort D, Deraedt K, et al. MRI findings in primary non-Hodgkin's lymphoma of the liver. JBR-BTR. 2005;88:17–9. 6. Tan Y, Xiao EH. Rare hepatic malignant tumors: dynamic CT, MRI, and clinicopathologic features: with analysis of 54 cases and review of the literature. Abdom Imaging. 2013;38:511–26. 7. Liu PS, Hussain HK. Uncommon hepatic tumors. In: Hussain HK, Francis IR, editors. Primary carcinomas of the liver. Series: Contemporary issues in cancer imaging. Cambridge: Cambridge University Press; 2010. p. 214–29. 8. Venkataraman S, Semelka RC, Braga L, et al. Inflammatory myofibroblastic tumor of the hepatobiliary system: report of MR imaging appearance in four patients. Radiology. 2003;227:758–63. 9. Fukuya T, Honda H, Matsumata T, et al. Diagnosis of inflammatory pseudotumor of the liver: value of CT. AJR Am J Roentgenol. 1994;163:1087–91. 10. Gao J, Hu Z, Wu J, et al. Primary hepatic carcinoid tumor. World J Surg Oncol. 2011;9:151. 11. Park CH, Chung JW, Jang SJ, et al. Clinical features and outcomes of primary hepatic neuroendocrine carcinomas. J Gastroenterol Hepatol. 2012;27:1306–11. 12. Dufresne A, Cassier P, Couraud L, et al. Desmoplastic small round cell tumor: current management and recent findings. Sarcoma. 2012;2012:714986. 13. Pickhardt PJ, Fisher AJ, Balfe DM, et al. Desmoplastic small round cell tumor of the abdomen: radiologic-histopathologic correlation. Radiology. 1999;210:633–8. 1. Médicos Radiologistas, Especializandos do Setor de Abdome do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil 2. Doutora, Médica Radiologista do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil 3. Livre-docente, Professor do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil Endereço para correspondência: Dr. Giuseppe D'Ippolito Departamento de Diagnóstico por Imagem – EPM-Unifesp Rua Napoleão de Barros, 800, Vila Clementino São Paulo, SP, Brazil, 04024-012 E-mail: giuseppe_dr@uol.com.br Recebido para publicação em 28/3/2013. Aceito, após revisão, em 14/10/2013. Trabalho realizado no Setor de Abdome do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554