Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 47 nº 5 - Set. / Out. of 2014
Vol. 47 nº 5 - Set. / Out. of 2014
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Flávia Angélica Ferreira Francisco1; Antonio Luis Eiras de Araújo2; Jaime Araújo Oliveira Neto3; Daniella Braz Parente4 |
|
|
Descritores: Lesões hepáticas focais; Contrastes hepatobiliares; Ressonância magnética. |
|
|
Resumo: INTRODUÇÃO
A caracterização das lesões hepáticas focais tem grande importância clínica. A ressonância magnética (RM) com administração de contraste intravenoso (gadolínio extracelular - habitual na prática radiológica) é considerada o melhor método de imagem para a avaliação destas lesões. Todavia, a RM não permite o diagnóstico de todas as lesões e algumas persistem com etiologia indeterminada. O uso dos contrastes hepatobiliares aumenta a acurácia da RM, diminuindo a necessidade de procedimentos diagnósticos invasivos com o objetivo de esclarecer lesões inespecíficas ao método(1,2). Os meios de contraste hepatócito-seletivos disponíveis são o gadobenato dimeglumina (Gd-BOPTA - MultiHance®; Bracco, Milão, Itália) e o ácido gadoxético (Gd-EOB-DTPA - Primovist®; Bayer-Schering, Berlim, Alemanha)(1,2). Estes meios de contraste são absorvidos pelos hepatócitos pelo transportador de membrana OATP1 (polipeptídio 1 transportador de ânion orgânico dependente de adenosina trifosfato), o mesmo transportador da bilirrubina. Uma fração dos contrastes hepatobiliares é excretada nos canalículos biliares pelo cMOAT (transportador de membrana ânion orgânico canalicular multiespecífico)(1). Desta forma, o realce das lesões na fase hepatobiliar depende da expressão e atividade destes transportadores, determinando padrões de realce característicos, dependentes da presença ou ausência de hepatócitos funcionantes. Na fase hepatobiliar, o fígado normal realça uniformemente tornando-se hiperintenso, as vias biliares se impregnam progressivamente pelo contraste e os vasos sanguíneos ficam hipointensos em comparação ao parênquima hepático, pois já não há contraste no compartimento vascular. Lesões hepáticas focais com hepatócitos funcionantes também se impregnam pelo contraste(1). Os contrastes hepatobiliares permitem, ainda, a avaliação das vias biliares(1-3). O estudo dinâmico habitual, com fases arterial, portal e de equilíbrio, é também adquirido com estes contrastes. Assim, os contrastes hepatobiliares combinam as características farmacodinâmicas do gadolínio extracelular (estudo dinâmico habitual) com a fase hepatobiliar tardia, adicionando informações funcionais ao estudo de RM e aumentando sua acurácia diagnóstica(1,2,4-6). A farmacocinética e as doses do gadobenato dimeglumina e do ácido gadoxético são diferentes. Enquanto a absorção do gadobenato dimeglumina pelos hepatócitos é de 3% a 5%, a do ácido gadoxético é de 50%. Consequentemente, o tempo da aquisição da fase hepatobiliar é diferente para cada contraste, devendo ser obtida 120 minutos após a administração do gadobenato dimeglumina (podendo variar de 1 a 3 horas) e 20 minutos após a administração do ácido gadoxético (podendo variar de 10 a 120 minutos)(1). A dose recomendada para uso intravenoso destes contrastes também é diferente, sendo indicada dose de 0,1 mmol/kg (0,2 ml/kg) para o gadobenato dimeglumina e de 0,025 mmol/kg (0,1 ml/kg) para o ácido gadoxético(3). Como a dose de ácido gadoxético é quatro vezes menor que a do gadolínio extracelular habitual, o tempo da fase arterial é crítico, sendo necessários métodos de precisão temporal, como a visualização da progressão do contraste no sistema arterial em tempo real, para o sucesso da aquisição desta fase. Já o realce na fase hepatobiliar é prolongado, permitindo sua aquisição com maior resolução espacial, bem como sua repetição em caso de artefatos(4). No caso do uso de gadobenato dimeglumina, recomenda-se fazer o estudo por RM da forma habitual, inclusive o estudo dinâmico até a fase de equilíbrio, retirar o paciente do magneto e retornar em 120 minutos para aquisição da fase hepatobiliar. No caso do ácido gadoxético, como a fase hepatobiliar ocorre em 20 minutos, recomenda-se a alteração da ordem de aquisição das sequências para otimização do tempo do estudo. Primeiro, são realizadas as sequências ponderadas em T1 (em fase, fora de fase e com saturação de gordura). O estudo colangiográfico fortemente ponderado em T2, quando necessário, também deve ser realizado antes do contraste, pois os contrastes hepatobiliares são excretados por via biliar e podem encurtar o tempo de relaxamento T2 da bile. Em seguida, são realizados a administração intravenosa do ácido gadoxético e o estudo dinâmico (fases arterial, portal e de equilíbrio). As sequências ponderadas em T2 e em difusão podem ser realizadas após o contraste hepatobiliar, pois não sofrem interferência significativa. Por último, adquire-se a fase hepatobiliar 20 minutos após a administração do ácido gadoxético(1,4). O uso do contraste hepatobiliar requer alguns cuidados. O realce das lesões hepáticas focais pode ser menos intenso durante o estudo dinâmico, especialmente na fase arterial, já que a dose recomendada de ácido gadoxético é menor que a do gadolínio extracelular habitual(5). Além disso, pacientes com cirrose avançada podem apresentar menor impregnação pelo contraste hepatobiliar, decorrente da disfunção hepática. Pacientes com hiperbilirrubinemia também podem ter menor impregnação pelos contrastes hepatobiliares, pois a bilirrubina e os contrastes hepatobiliares competem diretamente pelo mesmo transportador no hepatócito, o que limita seu uso em pacientes com bilirrubina total > 3 mg/dl(1,7,8). O ângulo de inclinação (flip angle) também é motivo de atenção e deve ser cerca de 25° a 40° na aquisição da fase hepatobiliar, com o objetivo de aumentar o contraste hepático(7). O gadobenato dimeglumina tem excreção biliar ao redor de 3% a 5% e renal entre 93% e 97%, e o ácido gadoxético tem excreção 50% biliar e 50% renal(8-10). Pacientes portadores de doenças hepática ou renal em estádios avançados compensam a eliminação destes contrastes por via alternativa - renal ou biliar, respectivamente. Pacientes com cirrose Child A ou B não apresentam alterações significativas no clearance total dos contrastes hepatobiliares, mas na cirrose Child C há redução do clearance total e aumento de sua meia vida, com aumento compensatório da excreção renal(8). Os efeitos adversos dos contrastes hepatobiliares são raros e muito similares aos relatados com o gadolínio extracelular. Os contrastes hepatobiliares são considerados como de risco intermediário para fibrose nefrogênica sistêmica e devem ser evitados nos pacientes com clearance de creatinina < 30 ml/min(8). As principais indicações dos contrastes hepatobiliares são a diferenciação entre hiperplasia nodular focal (HNF) e adenoma, a caracterização de carcinoma hepatocelular (CHC), a detecção de metástases hepáticas pequenas, a avaliação da anatomia biliar e a caracterização de fístulas biliares pós-operatórias. A caracterização das lesões hepáticas benignas e malignas por imagem é muito importante. Lesões hepáticas benignas são muito frequentes, mesmo em pacientes com neoplasia conhecida. Lesões hipervasculares em pacientes sem hepatopatias apresentam como diagnósticos diferenciais mais frequentes hemangioma, HNF e adenoma. Os hemangiomas geralmente têm apresentação típica por imagem e são facilmente diagnosticados por tomografia computadorizada ou RM com gadolínio extracelular. Entretanto, a diferenciação entre HNF e adenoma nem sempre é fácil pela RM convencional, pois ambas podem se apresentar como lesões hipervasculares inespecíficas, o que gera angústia para o paciente e para a equipe médica, além do custo e a ansiedade dos exames de repetição. A cicatriz central da HNF está ausente em 20% dos casos, principalmente quando pequenas. Sinais de hemorragia e gordura intratumorais não são vistas em 30% a 40% dos adenomas(11). A diferenciação entre a HNF e o adenoma é bastante importante, especialmente nas lesões maiores que 4,0 cm, pois os prognósticos e as condutas são diferentes. A HNF é uma lesão benigna que não precisa de intervenção, enquanto o adenoma apresenta risco de malignização, necrose e sangramento, podendo ser necessária cirurgia de emergência. Adenomas maiores que 4 cm e os com sintomas relacionados a hemorragia intratumoral têm indicação cirúrgica(12,13). Os contrastes hepatobiliares permitem a diferenciação entre HNF e adenoma na grande maioria dos casos, mesmo quando pequenos. HIPERPLASIA NODULAR FOCAL A HNF típica apresenta septos e bordas lobuladas ou microlobuladas, com sinal intermediário em T1 e T2, baixo contraste lesão-órgão e impregnação arterial homogênea, com decaimento nas fases subsequentes, tornando-se isointensa ao parênquima hepático circunjacente. A presença de cicatriz central, marcadamente hiperintensa em T2, hipointensa em T1, sem impregnação na fase arterial e com impregnação tardia pelo contraste é característica. Porém, em alguns casos, especialmente os pequenos (sem cicatriz central), não é possível a diferenciação entre HNF e adenoma por causa da sobreposição dos achados de imagem(1,4). A HNF contém hepatócitos funcionantes em densidade maior que o parênquima hepático normal, associados a ductos biliares anormais que não se comunicam com os ductos biliares maiores, com consequente excreção biliar lentificada quando comparada ao fígado circunjacente. Portanto, a HNF apresenta impregnação maior ou igual à do parênquima hepático adjacente na fase hepatobiliar(4) (Figuras 1 e 2). A cicatriz central é usualmente hipointensa na fase hepatobiliar em 47% dos casos, entretanto, discreto realce pode ser observado em alguns casos(1,9). 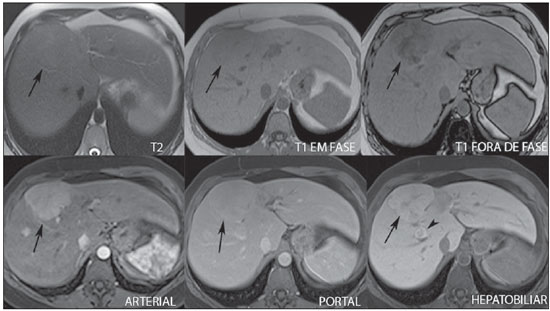 Figura 1. Paciente do sexo feminino, com 40 anos, apresentando esteatose hepática e múltiplas lesões focais hipervasculares bem definidas, com sinal intermediário em T2, com baixo contraste lesão-órgão. Entretanto, estas lesões apresentam gordura intralesional detectada na sequência T1 fora de fase. A presença de gordura intralesional não é habitual na HNF e favorece o diagnóstico de adenomas e, neste caso, adenomatose, com conduta e prognóstico muito diferentes. No entanto, as lesões apresentaram impregnação homogênea pelo contraste hepatobiliar, tornando o diagnóstico de múltiplas HNFs o mais provável. 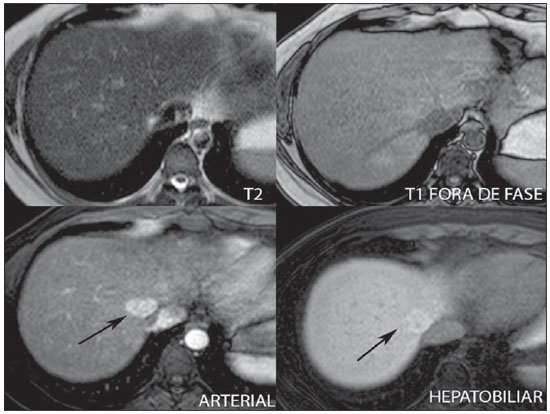 Figura 2. Paciente do sexo feminino, com 36 anos, assintomática, apresentando nódulo hepático hipervascular a esclarecer, sem gordura intralesional e sem cicatriz central. A impregnação homogênea pelo contraste hepatobiliar aponta para o diagnóstico de HNF. ADENOMA Os adenomas são lesões bem definidas, homogêneas ou heterogêneas, os maiores tendendo a heterogeneidade de sinal, com leve a moderado hipersinal em T2, hipossinal em T1, realce arterial homogêneo ou heterogêneo e lavagem tardia, podendo formar cápsula(13). Os adenomas são compostos por hepatócitos que contêm glicogênio e lipídios rodeados por uma cápsula. Embora contenham hepatócitos funcionantes, há falta de ductos biliares, o que resulta em deficiência na excreção de bilirrubina e dos contrastes hepatobiliares. Além disso, os adenomas apresentam menor expressão de transportadores de membrana como o OATP1(1,2). Desta forma, a maioria dos adenomas é hipointensa em relação ao parênquima circunjacente na fase hepatobiliar (Figura 3). Raros são os adenomas que se impregnam pelos contrastes hepatobiliares e esta impregnação tende a ser preferencialmente periférica na fase hepatobiliar(1,2,4). 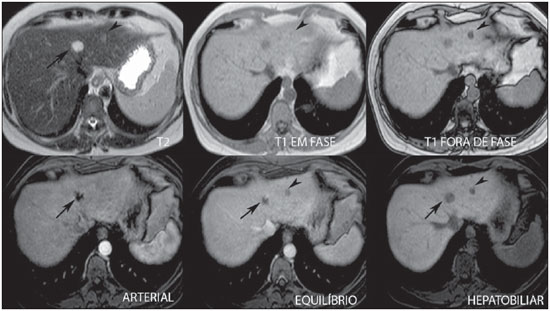 Figura 3. Paciente do sexo feminino, com 43 anos, em acompanhamento de tumor estromal gastrintestinal metastático, com nódulos hepáticos a esclarecer. A lesão menor (cabeças de setas) tem leve hipersinal em T2 e marcada queda de sinal em T1 fora de fase, por gordura intralesional, sem impregnação pelo contraste hepatobiliar. A presença de gordura intralesional e a ausência de impregnação pelo contraste hepatobiliar tornam o diagnóstico de adenoma o mais provável. A lesão maior (setas) tem alto sinal em T2, hipossinal em T1 e impregnação nodular, periférica e descontínua na fase arterial, sem impregnação pelo contraste hepatobiliar, comportamento característico do hemangioma. Os hemangiomas não contêm hepatócitos funcionantes e não se impregnam por esse contraste. Na fase de equilíbrio também não se nota o preenchimento completo desta lesão pelo contraste, o que pode ocorrer com o uso do contraste hepatobiliar. HEMANGIOMA Os hemangiomas normalmente têm aspecto típico na RM com contraste extracelular e não têm indicação de investigação com contraste hepatobiliar. Na RM convencional, os hemangiomas têm marcado hipersinal em T2, hipossinal em T1, realce nodular, periférico e descontínuo na fase arterial, tendendo ao preenchimento centrípeto pelo contraste nas fases subsequentes(13,14). No entanto, como os hemangiomas são lesões muito frequentes, nos estudos com contraste hepatobiliar realizados por motivos diversos, estas lesões estarão frequentemente presentes. Os hemangiomas apresentam as mesmas características de imagem no estudo dinâmico com contraste hepatobiliar. Porém, na fase de equilíbrio, como o contraste hepatobiliar está deixando o interstício e entrando nos hepatócitos funcionantes, o preenchimento do hemangioma pelo contraste hepatobiliar nesta fase pode ou não ocorrer, o que difere do seu comportamento habitual com o uso de gadolínio extracelular(14). Os hemangiomas são formados por lagos venosos e não contêm hepatócitos, portanto, não se impregnam pelo contraste na fase hepatobiliar e aparecem hipointensos nesta fase(1,2,9,15) (Figura 4). Um potencial fator de confusão é o fato de alguns hemangiomas poderem apresentar discreta impregnação central na fase hepatobiliar precoce devido à tendência ao realce centrípeto persistente no estudo dinâmico, da mesma forma como ocorre com o gadolínio extracelular(1). 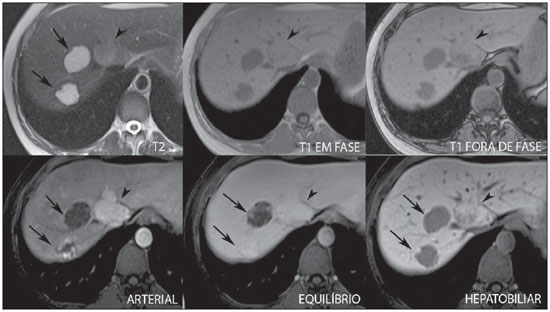 Figura 4. Paciente do sexo feminino, com 50 anos, com nódulos hepáticos a esclarecer. A lesão do lobo caudado (cabeças das setas) apresenta leve hipersinal em T2 e áreas de queda de sinal em T1 fora de fase, por gordura intralesional. Esta lesão tem intensa impregnação homogênea pelo contraste na fase arterial, com decaimento nas fases portal e de equilíbrio e apresenta impregnação pelo contraste hepatobiliar maior que a do parênquima adjacente, sugerindo HNF como primeira hipótese diagnóstica. Como é rara a presença de gordura intralesional na HNF, a paciente será mantida em controle evolutivo por imagem. As lesões dos segmentos VII e VIII (setas) são semelhantes, com marcado hipersinal em T2, hipossinal em T1 e impregnação nodular, periférica e descontínua na fase arterial, características de hemangiomas. CARCINOMA HEPATOCELULAR O contraste hepatobiliar também é útil para aumentar a sensibilidade e especificidade na detecção de CHCs em pacientes cirróticos de todos os tamanhos, incluindo os menores que 1 cm e os entre 1 e 2 cm. A sensibilidade da RM com uso do gadolínio extracelular para detecção de CHC varia de 70% a 100%, mas é muito menor para os CHCs menores(10,16). A caracterização de lesões menores que 1 cm e entre 1 e 2 cm ainda é um desafio, especialmente a diferenciação entre nódulos displásicos de alto grau e CHC precoce(4). Na cirrose, a impregnação dos nódulos pelo contraste hepatobiliar depende do seu estádio de diferenciação e da presença de hepatócitos funcionantes. Nódulos de regeneração e nódulos displásicos de baixo grau têm vascularização preferencialmente portal, contêm hepatócitos funcionantes e se impregnam pelo contraste hepatobiliar da mesma forma que o parênquima circunjacente. Nódulos displásicos de alto grau perdem a vascularização portal e começam a ganhar vascularização arterial anormal. Desta forma, os nódulos displásicos de alto grau tendem a ser hipovasculares nas fases arterial e portal, mas também podem ser hipervasculares na fase arterial se a vascularização arterial anormal estiver mais desenvolvida. Os nódulos displásicos de alto grau contêm hepatócitos funcionantes e também se impregnam pelo contraste hepatobiliar da mesma forma que o parênquima circunjacente (Figura 5). A impregnação do CHC pelo contraste hepatobiliar também depende do seu grau de diferenciação. Hepatocarcinomas bem diferenciados contêm hepatócitos funcionantes e podem se impregnar pelo contraste hepatobiliar. Por outro lado, hepatocarcinomas pouco diferenciados ou indiferenciados não contêm hepatócitos funcionantes e não se impregnam pelo contraste hepatobiliar, ficando hipointensos em relação ao parênquima circunjacente(2,10,17-19) (Figura 6). Lesões hipointensas menores que 1 cm, identificadas apenas na fase hepatobiliar, merecem seguimento de perto(10). 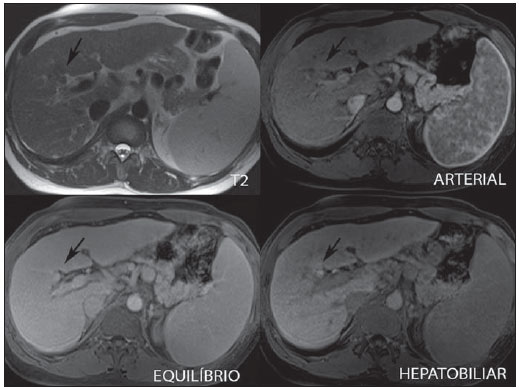 Figura 5. Paciente do sexo masculino, com 46 anos, apresentando hepatopatia crônica e nódulo hepático a esclarecer próximo à vesícula biliar, visto na ultrassonografia. Observam-se, junto à vesícula biliar, pequenos nódulos com hipossinal em T2, sem expressão nas demais sequências e no estudo dinâmico convencional, mas com retenção do contraste hepatobiliar, levando ao diagnóstico de nódulos de regeneração. CHCs bem diferenciados impregnam-se pelo contraste hepatobiliar, sendo necessário controle por imagem. 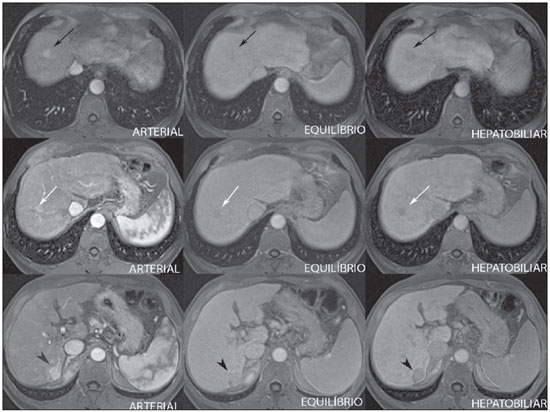 Figura 6. Paciente do sexo masculino, com 61 anos, apresentando hepatopatia crônica por vírus C. Observam-se dois nódulos hepáticos no segmento VIII (setas) e um nódulo maior no segmento VI (cabeças das setas), todos com realce na fase arterial, lavagem na fase de equilíbrio e sem impregnação na fase hepatobiliar, caracterizando CHCs. Os CHCs pouco diferenciados ou indiferenciados não contêm hepatócitos funcionantes e não se impregnam pelos contrastes hepatobiliares. Os diferentes padrões de realce dependem do grau histológico dos CHCs e podem ser explicados pela expressão dos transportadores de membrana. CHCs com realce semelhante ou maior que o do restante do parênquima hepático apresentam altos níveis de OATP1 e cMOAT quando comparados aos CHCs com hiporrealce(20). A absorção do contraste hepatobiliar pelos CHCs depende do grau de diferenciação do tumor e do número de hepatócitos funcionantes(2,4). O desempenho diagnóstico da RM para detecção de CHCs de todos os tamanhos aumenta com o uso dos contrastes hepatobiliares(1,10). Todavia, em casos de cirrose avançada, a impregnação do parênquima hepático pode ser comprometida pela redução da função de hepatócitos, o que pode resultar na diminuição da acurácia do método para detecção de CHCs(4,21). A diferenciação entre CHC e alterações perfusionais também pode ser um desafio diagnóstico. As alterações perfusionais têm sinal semelhante ao restante do fígado nas fases portal e hepatobiliar, enquanto a maioria dos CHCs tem hipossinal na fase hepatobiliar, exceto os bem diferenciados(22). A fase hepatobiliar também pode ser útil no acompanhamento de CHC pós-quimioembolização ou pós-radioablação, já que as alterações inflamatórias se impregnam pelo contraste hepatobiliar e o CHC residual tende a não se impregnar(23). METÁSTASE O contraste hepatobiliar aumenta a sensibilidade para a detecção de metástases hepáticas, principalmente as pequenas. As metástases não contêm hepatócitos funcionantes ou ductos biliares e não se impregnam pelo contraste na fase hepatobiliar. Como resultado, o tecido hepático normal fica hiperintenso e a metástase fica hipointensa, facilitando sua detecção(1,2). O uso destes contrastes aumenta a taxa de detecção das metástases hipo e hipervasculares (Figura 7). Adicionalmente, os contrastes hepatobiliares contribuem para o diagnóstico de pequenas lesões focais benignas, frequentes em pacientes com neoplasias, especialmente a HNF (Figura 8). Assim como na cirrose, as alterações perfusionais em pacientes com metástases se impregnam pelo contraste na fase hepatobiliar, de forma oposta às metástases(1). Os contrastes hepatobiliares utilizados no estadiamento de pacientes com neoplasia colorretal modificam a conduta em até 14% dos pacientes com metástases(2). 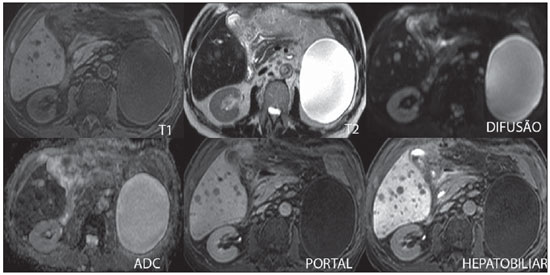 Figura 7. Paciente do sexo masculino, com 70 anos, apresentando câncer de cólon e múltiplas metástases com hipossinal em T1, leve hipersinal em T2, hipovasculares e com restrição à difusão. Na fase hepatobiliar, o parênquima hepático se impregna pelo contraste e fica hiperintenso. Os implantes, que não contêm hepatócitos funcionantes, ficam hipointensos. Destaca-se a capacidade do contrate hepatobiliar na detecção de lesões muito pequenas, não visualizadas nas demais sequências. 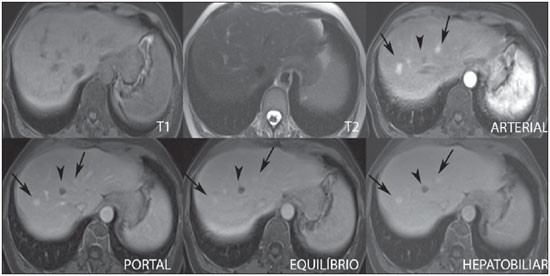 Figura 8. Paciente do sexo feminino, com 53 anos, apresentando câncer de cólon. Destacam-se duas lesões (setas) com sinal intermediário em T1 e T2, hipervasculares e com impregnação pelo contraste na fase hepatobiliar. Estas lesões apresentam hepatócitos funcionantes, sugerindo HNFs como a principal hipótese diagnóstica e descartando a possibilidade de implantes. A lesão avascular (cabeça de seta) é decorrente de alteração pós-tratamento. AVALIAÇÃO DAS VIAS BILIARES A avaliação do sistema biliar por métodos de imagem tem sido motivo de uma série de publicações recentes na literatura radiológica nacional(24-31). A excreção biliar dos contrastes hepatobiliares permite a caracterização anatômica e funcional das vias biliares intra e extra-hepáticas. Estes contrastes determinam o encurtamento do tempo de relaxamento T1 da bile e permitem a realização de uma colangiografia ponderada em T1 com alta resolução(4). O conhecimento prévio da anatomia biliar e suas variações anatômicas no planejamento pré-operatório é cada vez mais importante em razão da complexidade da anatomia hepática e das técnicas cirúrgicas mais refinadas, o que reduz as complicações pós-operatórias(4). A colangiografia com contraste hepatobiliar permite ainda a detecção acurada de complicações pós-operatórias, como as fístulas biliares e os bilomas, que são preenchidos progressivamente pelo contraste hepatobiliar. As ligaduras ductais inadvertidas também são facilmente reconhecidas na fase hepatobiliar e se apresentam como uma interrupção abrupta da via biliar no pós-operatório(4,5). Outras aplicações do contraste hepatobiliar incluem a avaliação da dinâmica do fluxo biliar, o estudo das obstruções biliares parciais ou completas e a localização do sítio de estenose. O contraste hepatobiliar pode contribuir para o diagnóstico de colecistite, pois a vesícula biliar não é preenchida pelo contraste, diferentemente do que ocorre habitualmente. A pesquisa da disfunção do esfíncter de Oddi pode ser feita pelo atraso ou ausência de passagem do contraste hepatobiliar pela ampola de Vater. O contraste hepatobiliar permite a diferenciação entre lesões biliares e cistos extrabiliares, uma vez que o contraste hepatobiliar delineia o trajeto biliar, demonstrando a comunicação de lesões císticas biliares com os ductos biliares e lesões císticas extrabiliares, que não se comunicam com os ductos biliares, como pseudocistos, divertículo duodenal e cisto de duplicação duodenal(5). AVALIAÇÃO DE FIBROSE HEPÁTICA Vários estudos estão avaliando a relação entre o grau de fibrose hepática nos pacientes cirróticos e o realce pelo contraste hepatobiliar com o objetivo de diminuir a necessidade de biópsias, consideradas hoje como padrão ouro. Os contrastes hepatobiliares são captados e excretados pelos hepatócitos, cuja integridade é necessária para o realce do parênquima hepático na fase hepatobiliar. Na cirrose, os hepatócitos são progressivamente substituídos por tecido fibroso, reduzindo o número de hepatócitos que se impregnam pelo contraste. Desta forma, quanto mais avançada a fibrose, menor a impregnação do parênquima hepático na fase hepatobiliar. Adicionalmente, os fígados cirróticos apresentam pico de realce mais tardio e lavagem mais lenta quando comparados aos saudáveis(32-37). Também são potenciais aplicações futuras do contraste hepatobiliar a avaliação da reserva funcional hepática em pacientes que serão submetidos a hepatectomia parcial, da função hepática no doador vivo, bem como da insuficiência hepática precoce pós-transplante(4). CONCLUSÃO Em resumo, o contraste hepatobiliar aumenta a acurácia diagnóstica da RM e diminui o número de lesões hepáticas indefinidas. Os achados da fase hepatobiliar devem ser sempre avaliados dentro do contexto clínico, levando-se em consideração as características de sinal da lesão nas sequências anatômicas. Suas principais indicações são a diferenciação entre HNF e adenoma, a caracterização de CHC em pacientes cirróticos, a detecção de metástases hepáticas pequenas, a avaliação da anatomia biliar e a caracterização de fístulas biliares pós-operatórias. A utilização dos contrastes hepatobiliares pode reduzir a necessidade de procedimentos diagnósticos invasivos e de avaliação complementar por outros exames de imagem, diminuir a necessidade de exames de acompanhamento, reduzindo o custo e a ansiedade do paciente e da equipe médica. Aplicações futuras deste contraste incluem a avaliação do grau de fibrose hepática, da reserva funcional hepática em pacientes que serão submetidos a hepatectomia parcial, a avaliação da função hepática no doador vivo e a avaliação da insuficiência hepática precoce pós-transplante. REFERÊNCIAS 1. Goodwin MD, Dobson JE, Sirlin CB, et al. Diagnostic challenges and pitfalls in MR imaging with hepatocyte-specific contrast agents. Radiographics. 2011;31:1547-68. 2. Ba-Ssalamah A, Uffmann M, Saini S, et al. Clinical value of MRI liver-specific contrast agents: a tailored examination for a confident non-invasive diagnosis of focal liver lesions. Eur Radiol. 2009;19:342-57. 3. Hammerstingl R, Zangos S, Schwarz W, et al. Contrast-enhanced MRI of focal liver tumors using a hepatobiliary MR contrast agent: detection and differential diagnosis using Gd-EOB-DTPA-enhanced versus Gd-DTPA-enhanced MRI in the same patient. Acad Radiol. 2002;9 Suppl 1:S119-20. 4. Seale MK, Catalano OA, Saini S, et al. Hepatobiliary-specific MR contrast agents: role in imaging the liver and biliary tree. Radiographics. 2009;29:1725-48. 5. Lee NK, Kim S, Lee JW, et al. Biliary MR imaging with Gd-EOBDTPA and its clinical applications. Radiographics. 2009;29:1707-24. 6. Reimer P, Schneider G, Schima W. Hepatobiliary contrast agents for contrast-enhanced MRI of the liver: properties, clinical development and applications. Eur Radiol. 2004;14:559-78. 7. Kim S, Mussi TC, Lee LJ, et al. Effect of flip angle for optimization of image quality of gadoxetate disodium-enhanced biliary imaging at 1.5 T. AJR Am J Roentgenol. 2013;200:90-6. 8. Gschwend S, Ebert W, Schultze-Mosgau M, et al. Pharmacokinetics and imaging properties of Gd-EOB-DTPA in patients with hepatic and renal impairment. Invest Radiol. 2011;46:556-66. 9. de Souza DA, Parente DB, de Araújo AL, et al. Modern imaging evaluation of the liver: emerging MR imaging techniques and indications. Magn Reson Imaging Clin N Am. 2013;21:337-63. 10. Parente DB, Perez RM, Eiras-Araújo A, et al MR imaging of hypervascular lesions in the cirrhotic liver: a diagnostic dilemma. Radiographics. 2012;32:767-87. 11. Bieze M, van den Esschert JW, Nio CY, et al. Diagnostic accuracy of MRI in differentiating hepatocellular adenoma from focal nodular hyperplasia: prospective study of the additional value of gadoxetate disodium. AJR Am J Roentgenol. 2012;199:26-34. 12. Bioulac-Sage P, Laumonier H, Sa Cunha A, et al. Hepatocellular adenomas. Liver Int. 2009;29:142. 13. Tiferes DA, D'Ippolito G. Liver neoplasms: imaging characterization. Radiol Bras. 2008;41:119-27. 14. Doo KW, Lee CH, Choi JW, et al. "Pseudo washout" sign in highflow hepatic hemangioma on gadoxetic acid contrast-enhanced MRI mimicking hypervascular tumor. AJR Am J Roentgenol. 2009;193:490-6. 15. Tamada T, Ito K, Yamamoto A, et al. Hepatic hemangiomas: evaluation of enhancement patterns at dynamic MRI with gadoxetate disodium. AJR Am J Roentgenol. 2011;196:824-30. 16. Colli A, Fraquelli M, Casazza G, et al. Accuracy of ultrasonography, spiral CT, magnetic resonance and alpha-fetoprotein in diagnosing hepatocellular carcinoma: a systematic review. Am J Gastroenterol. 2006;101:513-23. 17. Frericks BB, Loddenkemper C, Huppertz A, et al. Qualitative and quantitative evaluation of hepatocellular carcinoma and cirrhotic liver enhancement using Gd-EOB-DTPA. AJR Am J Roentgenol. 2009;193:1053-60. 18. Hanna RF, Aguirre DA, Kased N, et al. Cirrhosis-associated hepatocellular nodules: correlation of histopathologic and MR imaging features. Radiographics. 2008;28:747-69. 19. Willatt JM, Hussain HK, Adusumilli S, et al. MR Imaging of hepatocellular carcinoma in the cirrhotic liver: challenges and controversies. Radiology. 2008;247:311-30. 20. Kitao A, Zen Y, Matsui O, et al. Hepatocellular carcinoma: signal intensity at gadoxetic acid-enhanced MR imaging correlation with molecular transporters and histopathologic features. Radiology. 2010;256:817-26. 21. Galvão BVT, Torres LR, Cardia PP, et al. Prevalence of simple liver cysts and hemangiomas in cirrhotic and non-cirrhotic patients submitted to magnetic resonance imaging. Radiol Bras. 2013;46:203-8. 22. Burke LMB, Vachiranubhap B, Tannaphai P, et al. Contrast enhancement of liver lesions in cirrhotic patients: a single institution crossover comparative study of two MR contrast agents. Preliminary results. Radiol Bras. 2011;44:147-50. 23. Motosugi U, Ichikawa T, Sou H, et al. Distinguishing hypervascular pseudolesions of the liver from hypervascular hepatocellular carcinomas with gadoxetic acid-enhanced MR imaging. Radiology. 2010;256:151-8. 24. Souza LRMF, Rodrigues FB, Tostes LV, et al. Imaging evaluation of congenital cystic lesions of the biliary tract. Radiol Bras. 2012;45:113-7. 25. Gössling PAM, Alves GRT, Silva RVA, et al. Spontaneous biloma: a case report and literature review. Radiol Bras. 2012;45:59-60. 26. Guimarães Filho A, Carneiro Neto LA, Palheta MS, et al. Caroli's disease complicated with liver abscess: case report. Radiol Bras. 2012;45:362-4. 27. Queiroz HMC, Costa FA, Campos Junior MM, et al. Arterial embolization in the treatment of hemobilia after hepatic trauma: a case report. Radiol Bras. 2012;45:63-4. 28. Campos AG, Daneze ER, Terra Júnior JA, et al. Sonographic morphometry of the liver and biliary tract in porcine models submitted to experimental biliary obstruction. Radiol Bras. 2013;46:89-95. 29. Rocha MS. Liver abscesses secondary to acute cholangitis. Radiol Bras 2013;46(2):xi. 30. Hollanda ES, Torres US, Gual F, et al. Spontaneous perforation of gallbladder with intrahepatic biloma formation: sonographic signs and correlation with computed tomography. Radiol Bras. 2013;46:320-2. 31. Maia MCA, Amaro AP, Oliveira EC, et al. Portal cholangiopathy: case report. Radiol Bras. 2014;47:51-3. 32. Norén B, Forsgren MF, Dahlqvist Leinhard O, et al. Separation of advanced from mild hepatic fibrosis by quantification of the hepatobiliary uptake of Gd-EOB-DTPA. Eur Radiol. 2013;23:174-81. 33. Tsuda N, Okada M, Murakami T. Potential of gadolinium-ethoxybenzyl-diethylenetriamine pentaacetic acid (Gd-EOB-DTPA) for differential diagnosis of nonalcoholic steatohepatitis and fatty liver in rats using magnetic resonance imaging. Invest Radiol. 2007;42:242-7. 34. Dahlqvisq Leinhard O, Dahlström N, Kihlberg J, et al. Quantifying differences in hepatic uptake of the liver specific contrast agents Gd-EOB-DTPA and Gd-BOPTA: a pilot study. Eur Radiol. 2012;22:642-53. 35. Lee WJ, Cha SH, Kim MY, et al. Quantitative evaluation of the hepatic parenchymal change in patients with chronic liver disease using Gd-EOB-DTPA-enhanced MRI: comparison with normal liver. J Korean Soc Radiol. 2011;64:49-55. 36. Watanabe H, Kanematsu M, Goshima S, et al. Staging hepatic fibrosis: comparison of gadoxetate disodium-enhanced and diffusionweighted MR imaging - preliminary observations. Radiology. 2011;259:142-50. 37. Tsuda N, Okada M, Murakami T. New proposal for the staging of nonalcoholic steatohepatitis: evaluation of liver fibrosis on Gd-EOB-DTPA-enhanced MRI. Eur J Radiol. 2010;73:137-42. 1. Médica Residente de Radiologia e Diagnóstico por Imagem da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil 2. Médico do Serviço de Radiologia e Diagnóstico por Imagem da Rede D'Or, do Instituto D'Or de Pesquisa e Ensino (IDOR) e da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil 3. Médico do Serviço de Radiologia e Diagnóstico por Imagem da Rede D'Or e do Instituto D'Or de Pesquisa e Ensino (IDOR), Rio de Janeiro, RJ, Brasil 4. Doutora, Médica do Serviço de Radiologia e Diagnóstico por Imagem da Rede D'Or, do Instituto D'Or de Pesquisa e Ensino (IDOR) e da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil Endereço para correspondência: Dra. Flávia Angélica Ferreira Francisco Rua Cristóvão Xavier Lopes, 131, ap. 306, Coelho Neto Rio de Janeiro, RJ, Brasil, 21530-120 E-mail: flaviangel@gmail.com Recebido para publicação em 23/7/2013. Aceito, após revisão, em 22/10/2013. Trabalho realizado na Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554