Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 47 nº 5 - Set. / Out. of 2014
Vol. 47 nº 5 - Set. / Out. of 2014
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Leonardo Kayat Bittencourt1; Daniel Hausmann2; Natalia Sabaneeff3; Emerson Leandro Gasparetto4; Jelle O. Barentsz5 |
|
|
Descritores: Câncer de próstata; Ressonância magnética; Imagem por difusão; Realce dinâmico por contraste. |
|
|
Resumo: INTRODUÇÃO
O câncer de próstata (CaP) é a segunda causa de morte relacionada a câncer na população masculina. Atualmente, a principal ferramenta para screening do CaP é baseada na avaliação dos níveis de antígeno prostático específico e do exame digital retal, ambos considerados de acurácia limitada no estabelecimento de diagnóstico específico da doença(1-4). Neste contexto, as modalidades de diagnóstico por imagem têm sido crescentemente usadas como meio de refinar a detecção e estadiamento do CaP, permitindo uma seleção mais adequada para o tratamento. Consequentemente, tem havido um aumento constante no interesse da comunidade radiológica por métodos de imagem da próstata, com muitos estudos publicados recentemente, inclusive no Brasil(5-8). Dentre essas modalidades, a ressonância magnética (RM) se destaca como a mais robusta e que melhor se correlaciona com a evolução clínica dos pacientes com CaP. Esta revisão avalia o papel da RM de próstata e suas técnicas funcionais na detecção, estadiamento e avaliação de risco do CaP. RESSONÂNCIA MAGNÉTICA A RM é um método de imagem que não envolve radiação ionizante e permite a obtenção de imagens com alta resolução, com excelente contraste de partes moles. O meio de contraste utilizado é derivado de quelato de gadolínio, que tem perfil imunoalergênico inferior aos dos meios de contraste iodados. Todavia, pelo risco de fibrose sistêmica nefrogênica, é necessário tomar cuidado na utilização de agentes derivados de gadolínio em pacientes com função renal reduzida (i.e., clearance de creatinina < 30 ml/min/1,73 m2). O exame é realizado em aparelhos de alto campo (1.5 T ou 3.0 T), com bobina de superfície na pelve para maximizar o sinal na região de interesse. O uso de bobina endorretal é fonte de discussões, com a maioria das instituições relegando seu uso, atualmente, apenas para propósitos de estadiamento, de acordo com um consenso recente(9). Considerando que o sangramento é um fator de confusão potencial para o erro diagnóstico do CaP, devido a degradação das imagens por espectroscopia e degradação do sinal das imagens pesadas em difusão, é recomendado um intervalo de 6-8 semanas entre a biópsia e o exame de RM(10). Os pacientes devem abster-se de atividades sexuais por 72 horas antes do exame, de modo a distender as vesículas seminais e melhorar a sua visualização. É recomendado um mínimo de 4 horas de jejum, e os pacientes são orientados a esvaziar a bexiga 1 hora antes do exame. Além disso, é administrada escopolamina (Buscopan®) imediatamente antes do exame, para reduzir a peristalse e minimizar os artefatos de movimento. Como método de imagem, a RM permite a avaliação de doença prostática com resolução espacial e de contraste superior a qualquer outra modalidade. Consequentemente, a RM tem se tornado uma modalidade poderosa na localização e estadiamento do CaP, com performance muito superior ao exame digital retal ou à ultrassonografia transretal (USTR)(11). Avanços recentes combinam técnicas funcionais com as sequências anatômicas já estabelecidas baseadas em imagens pesadas em T1 e T2, resultando num protocolo de sequências multiparamétricas. As imagens pesadas em T2 constituem a espinha dorsal da imagem prostática, provendo detalhes anatômicos e mostrando lesões suspeitas com alta resolução espacial. Dentre as sequências funcionais, as imagens pesadas em difusão (DWI)(12), a avaliação do realce dinâmico pelo contraste (DCE - dynamic contrast enhancement, ou estudos de permeabilidade)(13) e a avaliação por espectroscopia de prótons(14) são parte dos estudos clínicos rotineiros e serão explicadas neste artigo. Achados de imagem pesada em T2 Nas imagens pesadas em T2(15) (Figura 1), a zona periférica normal tem hipersinal homogêneo, apresentando-se em formato de "crescente" ou "chifre" no plano axial. A cápsula prostática é definida por uma fina imagem linear hipointensa, que é um marco importante na avaliação do estadiamento tumoral. Na ausência de hiperplasia prostática benigna (HPB), as zonas central, transicional e periuretral não se distinguem nitidamente, sendo, portanto, avaliadas em conjunto, com a denominação genérica de glândula "interna" ou "central". A glândula interna normal exibe intensidade de sinal intermediária em T2. Delimitando a zona periférica, encontramos a "cápsula cirúrgica", uma camada hipointensa em T2 que separa a porção central da zona periférica e representa uma referência importante para cirurgia da HPB. 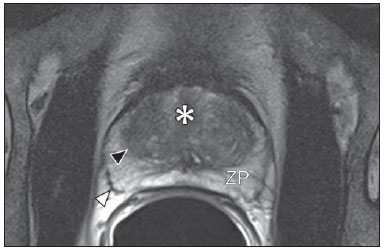 Figura 1. RM da próstata normal. T2WI no plano axial mostra a cápsula prostática (cabeça de seta branca), a zona periférica (ZP), a cápsula cirúrgica (cabeça de seta preta) e a glândula interna (asterisco). Nas imagens morfológicas pesadas em T2, o CaP é caracterizado por lesões hipointensas, geralmente com configuração nodular ou oval, que substituem o padrão usual de hiperintensidade de sinal na zona periférica, ou o padrão usualmente heterogêneo da glândula interna(16) (Figura 2). Este achado é considerado de alta sensibilidade (> 90%) na detecção de CaP com valores de Gleason de 7 ou mais, mas deve ser levado em consideração que a sensibilidade deste achado é significativamente menor com valores de Gleason de 6 ou menos. Mais importante, a especificidade das imagens em T2 isoladamente é limitada, porque hemorragia, prostatite, cicatrizes, atrofia, alterações secundárias à radioterapia, status pós-crioablação e hormonioterapia podem se apresentar como áreas de baixo sinal na zona periférica. 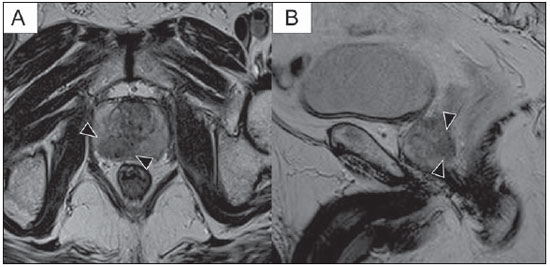 Figura 2. Aspecto típico do CaP na zona periférica em imagens pesadas em T2, mostrando uma lesão nodular hipointensa no T2 à direita, marcada com cabeças de seta nos planos axial (A) e sagital (B). O diagnóstico de CaP na zona central por meio de sequências anatômicas convencionais é um grande desafio, dada a heterogeneidade da região e o amplo espectro de alterações relacionadas a HPB. Por isso, vários critérios baseados em algoritmos de reconhecimento de padrões foram descritos(17), tais como lesão focal mal definida homogênea em T2 substituindo o padrão de fundo normal (sinal do "carvão apagado"), margens espiculadas ou mal definidas, lesão localizada anteriormente, forma lenticular ou fusiforme, perda dos contornos hipointensos em T2 dos nódulos hiperplásicos, perda da definição da cápsula cirúrgica, ou sinais de invasão uretral (Figura 3). Entretanto, áreas focais hipointensas em T2 podem ser observada normalmente na glândula interna como HPB predominantemente estromal, ou proeminência do estroma fibromuscular anterior. Os vários diferentes estudos que investigaram a acurácia da RM convencional na detecção de tumores da glândula interna quase sempre mostram baixa sensibilidade, baixa especificidade e alta variabilidade interobservador(18). 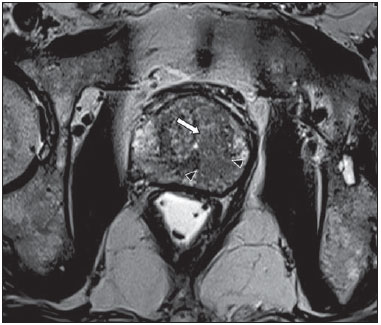 Figura 3. Aspecto do CaP na glândula interna em imagens pesadas em T2 no plano axial. Observar uma área hipointensa na glândula interna à esquerda (seta), com contornos mal definidos, e sinais e rotura da cápsula cirúrgica (cabeça de seta), estendendo-se à zona periférica adjacente. No estadiamento locorregional do CaP, o aspecto mais relevante na tomada de decisão terapêutica é a diferenciação entre tumor confinado ao órgão (estádios T1 e T2) e tumor localmente avançado, sob as formas de extensão extracapsular (T3a) ou invasão de vesículas seminais (T3b). Os critérios de imagem para extensão extracapsular incluem assimetria ou envolvimento macroscópico dos feixes vasculonervosos, abaulamento focal do contorno prostático, espiculação ou irregularidade do contorno prostático, obliteração do ângulo retoprostático, retração capsular, contato do tumor com a cápsula prostática maior que 1,0 cm, e sinais de rotura capsular com extensão direta a gordura periprostática(19,20) (Figura 4). 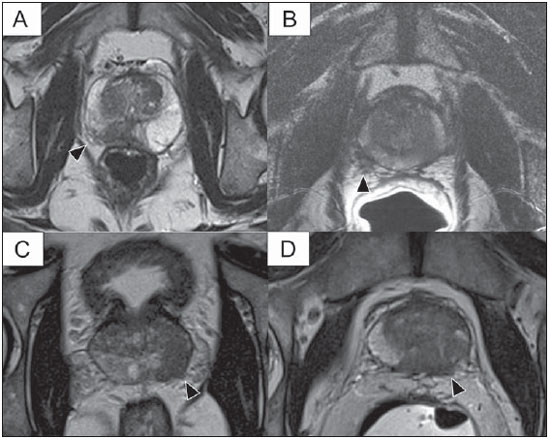 Figura 4. Glândula prostática em T2, mostrando achados típicos de extensão tumoral extracapsular, marcados por cabeças de setas nos seguintes exemplos: assimetria do feixe vasculonervoso (A), envolvimento do feixe vasculonervoso (B), espiculação do contorno da cápsula prostática (C) e abaulamento focal do contorno da cápsula prostática (D). Os achados que indicam invasão das vesículas seminais incluem: baixo sinal no interior ou de permeio a vesicular seminal, vesícula seminal aumentada e hipointensa em T2, ducto ejaculatório aumentado e hipointenso em T2, obliteração do ângulo vesicoprostático, e extensão direta da base prostática a vesícula seminal, este achado sendo o de maior valor preditivo positivo(21) (Figura 5). 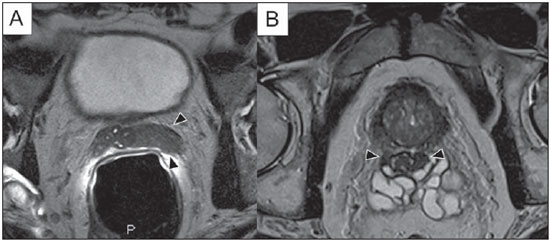 Figura 5. Sinais de extensão às vesículas seminais através de imagens pesadas em T2, identificadas por cabeças de seta. Observam-se áreas hipointensas substituindo a vesícula seminal usualmente hiperintensa, determinando espessamento das suas paredes e obliterando a sua luz, seja de forma difusa (A) ou focal (B). As técnicas anatômicas de RM da próstata exibem um amplo espectro de sensibilidades (13-95%) e especificidades (49-97%) nos diversos estudos para a detecção de extensão extracapsular. Da mesma forma, as sensibilidades (23-80%) e especificidades para a detecção de invasão de vesículas seminais variam largamente(17). Tais limitações e variações nos resultados de sequências convencionais de RM enfatizam a necessidade para uma abordagem combinada e multiparamétrica dos métodos anatômicos com os funcionais. Técnicas funcionais Espectroscopia de prótons A espectroscopia de prótons tem sido amplamente utilizada como biomarcador na detecção e caracterização de tumores, incluindo o CaP(22). Esta técnica tenta estimar a concentração de certas substâncias e metabólitos em determinado tecido biológico, pela RM. Os metabólitos são representados por picos num espectro, e a relação entre as suas concentrações é utilizada para estabelecer o diagnóstico (Figura 6). 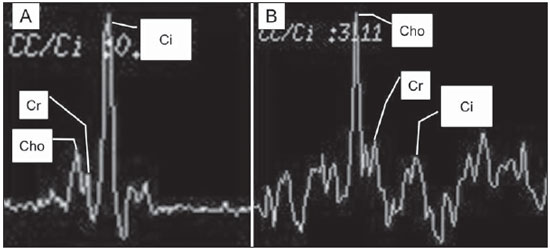 Figura 6. Exemplos de espectroscopia de prótons na próstata. A: Análise espectral típica do tecido prostático, mostrando um alto pico de citrato (Ci), com baixo pico de colina (Cho), e o pico de creatina (Cr) usado como parâmetro de comparação para outros metabólitos. Em B, observa-se o achado clássico de CaP agressivo, com alto pico de colina (Cho) e baixo nível de citrato (Ci). Dentre os metabólitos utilizados na espectroscopia da próstata, o citrato é encontrado em altas concentrações (> 60 mM) no epitélio prostático normal e líquido prostático, e em baixas concentrações em outras localizações da glândula(23). Níveis reduzidos de citrato são caracteristicamente encontrados em CaP, mas também em áreas de prostatite e sangramento. A colina representa um componente do lipídio da membrana celular. Concentrações de colina são geralmente elevadas em CaP, em função do alto turnover celular e de um aumento da razão entre a superfície da membrana celular e o volume celular. Um aumento verdadeiro no pico de colina é considerado um marcador de malignidade(24), mas também pode ser encontrado em prostatite(25) de forma menos significativa. Outros metabólitos encontrados na espectroscopia de prótons na próstata incluem a creatina, que não tem correlação direta com o CaP e é primariamente utilizada como ponto de referência, e a poliamina, que é detectada somente em aparelhos de 3 T e pode estar diminuída no CaP. Entretanto, considerando que este espectro não mostra concentrações absolutas mensuráveis dos metabólitos, razões e coeficientes são utilizados na avaliação dos picos metabólitos. Dentre estes, a razão mais importante é calculada pela fórmula (colina + creatina)/citrato. Esta razão é usada como marcadora para malignidade, especialmente na zona periférica. Apesar de a espectroscopia ser um método potencialmente de alta especificidade, apresenta ao mesmo tempo muito baixa sensibilidade. Um estudo multicêntrico recente avaliou o valor de adicionar a espectroscopia a imagens convencionais T2 na localização do CaP em estudos realizados com 1,5 T, e não mostrou benefício significativo em termos de performance e aumento da acurácia(14). O resultado deste estudo importante, combinado com a baixa concordância interobservador, o alto tempo de aquisição de imagens, e a complexidade do pós-processamento, levam a maioria dos centros a considerá-la uma técnica meramente auxiliar e opcional. Realce dinâmico pelo contraste (DCE) A avaliação do DCE é uma modalidade avançada de imagem que permite o cálculo de parâmetros intimamente relacionados às propriedades microvasculares e de angiogênese nos tecidos. No CaP, um aumento da vascularização tumoral se apresenta como um padrão de realce com intenso realce precoce pelo meio de contraste (wash-in), seguido de uma intensa e precoce lavagem (wash-out), ao contrário da zona periférica normal, que apresenta realce lento, discreto e progressivo. Doenças benignas como a prostatite e a HPB também podem levar a alterações regionais no padrão de realce, entretanto, de forma menos evidente(26) (Figura 7). 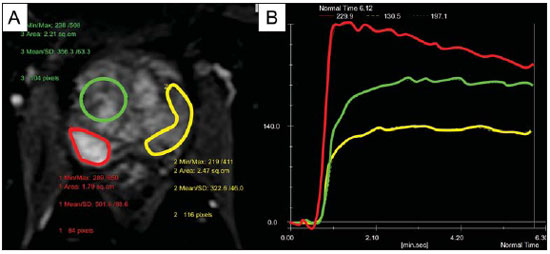 Figura 7. Curva de intensidade de sinal versus tempo numa lesão tumoral típica. A imagem A representa a fase arterial precoce na avaliação do DCE, mostrando uma área focal de realce precoce na zona periférica à direita (marcada pela linha vermelha). Áreas normais também foram demarcadas na zona periférica contralateral (amarelo) e na glândula interna (verde). As curvas resultantes (B) mostram que a lesão suspeita (curva vermelha) é caracterizada por uma subida intensa e íngreme (wash-in) seguida por uma queda significativa (wash-out), com um comportamento significativamente distinto das outras curvas. O DCE é baseado em sequências pesadas em T1 que são repetidamente obtidas antes, durante e após a administração do contraste venoso, incluindo a glândula prostática por inteiro, com alta resolução temporal. Múltiplas aquisições são obtidas, num total de 4-8 minutos. As imagens são então pós-processadas em aplicativos específicos, com avaliação semiquantitativa ou quantitativa, permitindo a produção de curvas de realce e mapas coloridos para melhor entendimento de não radiologistas e melhor comunicação dos resultados. Nestes mapas paramétricos, pixels são coloridos de acordo com o parâmetro hemodinâmico analisado (i.e., positive enhancement integral, wash-in rate, maximum intensity pixel, ktrans, kep, etc.), e as lesões suspeitas aparecem como áreas focais e assimétricas hiperintensas no espectro de cores escolhido. Além disso, é possível superpor ou fundir os mapas coloridos com as imagens originais em T2, aumentando o grau de confiança da correlação topográfica exata dos achados anatômicos e funcionais (Figura 8). 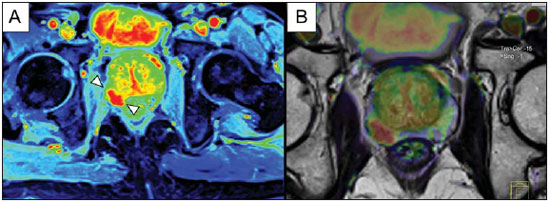 Figura 8. Pós-processamento semiquantitativo do DCE. A imagem A representa o mapa paramétrico gerado pelo DCE no mesmo paciente da Figura 7, correspondendo à área abaixo da curva durante o primeiro minuto (positive enhancement index - PEI). Observar que neste mapa a área suspeita citada na Figura 7 está codificado em vermelho (cabeças de seta), se destacando das outras porções do parênquima prostático. Em B é mostrada uma fusão entre o mapa paramétrico de DCE e as imagens pesadas em T2 no plano axial, permitindo melhor correlação entre imagens funcionais e anatômicas. Independente da escolha entre o modelo semiquantitativo e quantitativo, a avaliação do DCE tem mostrado fortes evidências de boa performance no diagnóstico de CaP. Tem sido demonstrado que o DCE é significativamente melhor que imagens convencionais em T2 na localização dos focos tumorais(27-29), e que ela aumenta a acurácia de radiologistas menos experientes na detecção de extensão extracapsular e acometimento da vesícula seminal(30). Desta forma, o uso do DCE é definitivamente bem indicado e é uma parte fundamental na RM multiparamétrica da próstata. Difusão: Diffusion weighted imaging (DWI) A DWI estuda o movimento randômico das moléculas de água em diferentes meios físicos, também conhecidos como "movimentos brownianos". Em tecidos biológicos, tal movimento é impedido por diferentes graus de interação com outras moléculas e estruturas celulares, ou mesmo pela densidade celular. Assim, métodos que avaliem estas propriedades da difusão da água têm o potencial de estimar indiretamente informações relativas à composição de um tecido, densidade celular, microperfusão tecidual, ou mesmo viabilidade das membranas celulares(31). Clinicamente, estas propriedades alçaram a DWI à categoria de biomarcador não invasivo em oncologia, com aplicações demonstradas na detecção de tumores, estadiamento e avaliação de resposta terapêutica(32). A DWI é uma sequência que não requer a administração do meio de contraste venoso e leva aproximadamente 5 minutos nos estudos de RM de próstata. A sequência gera múltiplos conjuntos de imagens, de acordo com o número de fatores de difusão ou "valores de b" escolhidos. O aparelho também gera um mapa de coeficiente de difusão aparente (ADC - apparent diffusion coefficient), que é um conjunto de imagens que permite a quantificação das propriedades de difusão. Assim, uma lesão com difusibilidade restrita aparece como uma área hipointensa no mapa ADC, mostrando um baixo coeficiente de difusão, ou baixo "valor de ADC". A próstata normal é rica em estruturas tubulares preenchidas por líquido, permitindo a difusão irrestrita de moléculas de água no seu interior, com altos valores de ADC. Na maioria dos casos, a zona periférica pode ser facilmente distinguida da glândula interna na DWI, em função dos seus valores homogeneamente altos de ADC(33-35) (Figura 9). A HPB leva à formação de nódulos adenomatosos na zona transicional, que com o passar do tempo comprimem a zona central, dificultando a definição acurada da anatomia zonal da glândula central por RM(15). Esta heterogeneidade também se manifesta nas propriedades de difusão da água na HPB, sendo classicamente representada por focos de baixos valores de ADC entremeados com áreas de altos valores(36). 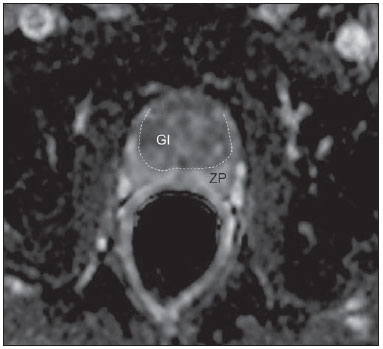 Figura 9. Mapa ADC do mesmo paciente da Figura 1, mostrando excelente distinção da anatomia zonal. A zona periférica (ZP) mostra altos valores de ADC comparativamente à glândula interna normal (GI). Este fato provavelmente explica a grande utilidade da difusão na detecção de tumores da zona periférica, que se apresentam como focos de restrição à difusão (i.e., "lesões escuras") em uma região com difusão não restrita (i.e., "claras"). O CaP é caracterizado histologicamente por uma densidade celular maior que a do tecido prostático normal, com substituição do parênquima glandular por células tumorais. Isto ocasiona restrição à difusão em relação à próstata normal(12,37,38) (Figura 10). 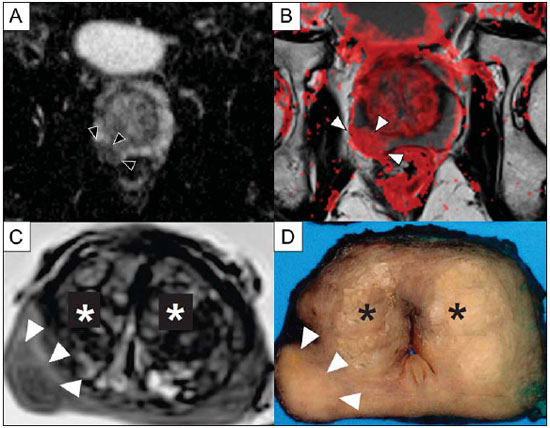 Figura 10. Detecção de CaP com DWI. Mapa ADC do mesmo paciente da Figura 7 (A) mostrando uma lesão focal hipointensa suspeita na zona periférica à direita (cabeças de seta), determinando restrição à difusibilidade da água, com valores de ADC em torno de 750 × 10-6 mm/s2, enquanto os valores de ADC da zona periférica contralateral encontram-se em torno de 1,600 × 10-6 mm/s2. A fusão dos dados da DWI com as imagens pesadas em T2 (B) mostra que a lesão detectada no mapa ADC, codificadas em vermelho (cabeça de seta) tem correspondência topográfica com a área suspeita em T2. Este paciente foi submetido a prostatectomia radical, e a amostra cirúrgica foi enviada para exame de RM ex-vivo (C), que mostrou a lesão suspeita (cabeça de seta) na mesma região da RM pré-operatória. A amostra cirúrgica no mesmo nível e a orientação das imagens da RM (D) também mostram a área tumoral (cabeça de seta) na mesma localização indicada pela RM. Asteriscos em C e D representam áreas com HPB. Adicionalmente, enquanto tumores bem diferenciados mantêm certa arquitetura tubular preservada, tumores indiferenciados ou agressivos exibem componente celular mais proeminente, com desarranjo da arquitetura tubular, consequentemente, gerando potenciais diferenças nas propriedades de difusão e mensuração de ADC entre estas duas categorias(39-44). Os principais estudos em DWI têm geralmente avaliado sua utilidade na detecção do CaP na zona periférica. A maioria destes estudos mostrou melhor performance na detecção da lesão por meio da difusão, em comparação com imagens em T2, seja pelo uso da difusão isoladamente ou a sua combinação com sequências convencionais(45). Outros estudos demonstraram que a combinação de T2 e DWI atingem níveis de sensibilidade de 45-89% e especificidade de 61-97%, em comparação com 74-85% e 57-95% para a difusão isolada, ou 25-87% e 57-92% para o T2 isoladamente(36,45-52). Para a detecção de lesões na glândula central, a difusão tem o potencial de complementar os achados do T2(53), já que é sabido que os valores de ADC no CaP são geralmente menores que aqueles encontrados na glândula central(53,54) ou nos nódulos de HPB(36), entretanto, com sensibilidade menor que na zona periférica. Em termos de estadiamento local, a identificação de mínima extensão extracapsular requer imagens anatômicas de alta resolução(17), que geralmente são superiores a resolução especial das sequências pesadas em DWI atualmente disponíveis. Por outro lado, a utilização da DWI já está bem demonstrada para a avaliação do envolvimento da vesícula seminal(55,56), com níveis mais altos de especificidade (97%) e acurácia (96%) quando combinados DWI e T2, em comparação com a especificidade (87%) e acurácia (87%) do T2 isolado. Para este mesmo fim, pode haver um papel para o uso de mapas fundidos de ADC e T2, que podem potencialmente aumentar a confiança para o diagnóstico, apesar de ainda não confirmados na literatura. Na avaliação da agressividade tumoral, o sistema de graduação histopatológico de Gleason continua sendo um dos fatores prognósticos mais importantes para a determinação do comportamento clínico do tumor e da sobrevida livre de doença(57-59). Entretanto, é bem sabido que os valores de Gleason obtidos em amostras rotineiras de biópsia guiada por USTR podem ser significativamente subestimados em relação ao escore de Gleason após a prostatectomia(60,61). Desta forma, dentre todas as outras modalidades convencionais e funcionais da RM, a difusão é provavelmente a com maior potencial para se correlacionar com o grau de agressividade tumoral, já que os mesmos fatores que levam a um aumento do escore de Gleason (por exemplo: alta celularidade, perda da arquitetura tubular) também promovem restrição na difusibilidade da água e, consequentemente, valores de ADC mais baixos(37). Estudos recentes demonstraram uma correlação negativa significativa entre os valores de ADC no CaP e os escores de Gleason em amostras de prostatectomia(62). Além disso, este mesmo estudo mostrou que a difusão teve melhor desempenho inclusive que as amostras de biópsia prostática na estimativa da agressividade do CaP. No entanto, todos os estudos até o momento demonstraram uma sobreposição significativa dos valores de ADC em diferentes valores de Gleason. Por isso, é recomendado que o papel atual da DWI na avaliação da agressividade tumoral seja principalmente a orientação da obtenção de amostras de biópsia(63) e a integração a normogramas de avaliação de risco(64). CONCLUSÃO Em resumo, a RM multiparamétrica da próstata é uma realidade na prática clínica, com dados bem estabelecidos a respeito da detecção tumoral e estadiamento. O RDC e a DWI são técnicas funcionais robustas que devem ser incluídas em todos os exames, aumentando a acurácia e confiança nos achados de imagem providos pelas imagens anatômicas em T2. Grandes estudos prospectivos estão em curso, com o intuito de correlacionar os achados da RM com a evolução clínica em longo prazo, screening de lesões, e o seguimento de pacientes em vigilância ativa. REFERÊNCIAS 1. Meeks JJ, Loeb S, Helfand BT, et al. Characteristics of prostate cancers detected at prostate specific antigen levels less than 2.5 ng/ml. J Urol. 2009;181:2515-9. 2. Okotie OT, Roehl KA, Han M, et al. Characteristics of prostate cancer detected by digital rectal examination only. Urology. 2007;70:1117-20. 3. Andriole GL, Crawford ED, Grubb RL 3rd, et al. Mortality results from a randomized prostate-cancer screening trial. N Engl J Med. 2009;360:1310-9. 4. Schröder FH, Hugosson J, Roobol MJ, et al. Screening and prostate- cancer mortality in a randomized European study. N Engl J Med. 2009;360:1320-8. 5. Franca CAS, Vieira SL, Carvalho ACP, et al. Relationship between two year PSA nadir and biochemical recurrence in prostate cancer patients treated with iodine-125 brachytherapy. Radiol Bras. 2014;47:89-93. 6. Solha RS, Ajzen S, De Nicola H, et al. Morbidade da biópsia da próstata transretal guiada por ultrassonografia. Radiol Bras. 2013;46:71-4. 7. Tyng CJ, Maciel MJS, Moreira BL, et al. Preparo e manejo de complicações em biópsias de próstata. Radiol Bras. 2013;46:367-71. 8. Milito MA. Transrectal ultrasound guided prostate biopsy: are complications and morbidity underestimated? Radiol Bras. 2013;46(2):vii. 9. Barentsz JO, Richenberg J, Clements R, et al. ESUR prostate MR guidelines 2012. Eur Radiol. 2012;22:746-57. 10. Qayyum A, Coakley FV, Lu Y, et al. Organ-confined prostate cancer: effect of prior transrectal biopsy on endorectal MRI and MR spectroscopic imaging. AJR Am J Roentgenol. 2004;183:1079-83. 11. Mullerad M, Hricak H, Kuroiwa K, et al. Comparison of endorectal magnetic resonance imaging, guided prostate biopsy and digital rectal examination in the preoperative anatomical localization of prostate cancer. J Urol. 2005;174:2158-63. 12. Tan CH, Wang J, Kundra V. Diffusion weighted imaging in prostate cancer. Eur Radiol. 2011;21:593-603. 13. Franiel T, Hamm B, Hricak H. Dynamic contrast-enhanced magnetic resonance imaging and pharmacokinetic models in prostate cancer. Eur Radiol. 2011;21:616-26. 14. Weinreb JC, Blume JD, Coakley FV, et al. Prostate cancer: sextant localization at MR imaging and MR spectroscopic imaging before prostatectomy - results of ACRIN prospective multi-institutional clinicopathologic study. Radiology. 2009;251:122-33. 15. Hricak H, Dooms GC, McNeal JE, et al. MR imaging of the prostate gland: normal anatomy. AJR Am J Roentgenol. 1987;148:51-8. 16. Bezzi M, Kressel HY, Allen KS, et al. Prostatic carcinoma: staging with MR imaging at 1.5 T. Radiology. 1988;169:339-46. 17. Hricak H, Choyke PL, Eberhardt SC, et al. Imaging prostate cancer: a multidisciplinary perspective. Radiology. 2007;243:28-53. 18. Akin O, Sala E, Moskowitz CS, et al. Transition zone prostate cancers: features, detection, localization, and staging at endorectal MR imaging. Radiology. 2006;239:784-92. 19. Outwater EK, Petersen RO, Siegelman ES, et al. Prostate carcinoma: assessment of diagnostic criteria for capsular penetration on endorectal coil MR images. Radiology. 1994;193:333-9. 20. Yu KK, Scheidler J, Hricak H, et al. Prostate cancer: prediction of extracapsular extension with endorectal MR imaging and three-dimensional proton MR spectroscopic imaging. Radiology. 1999;213:481-8. 21. Sala E, Akin O, Moskowitz CS, et al. Endorectal MR imaging in the evaluation of seminal vesicle invasion: diagnostic accuracy and multivariate feature analysis. Radiology. 2006;238:929-37. 22. Heerschap A, Jager GJ, van der Graaf M, et al. Proton MR spectroscopy of the normal human prostate with an endorectal coil and a double spin-echo pulse sequence. Magn Reson Med. 1997;37:204-13. 23. Yacoe ME, Sommer G, Peehl D. In vitro proton spectroscopy of normal and abnormal prostate. Magn Reson Med. 1991;19:429-38. 24. Podo F. Tumour phospholipid metabolism. NMR Biomed. 1999;12:413-39. 25. Shukla-Dave A, Hricak H, Eberhardt SC, et al. Chronic prostatitis: MR imaging and 1H MR spectroscopic imaging findings - initial observations. Radiology. 2004;231:717-24. 26. Padhani AR, Harvey CJ, Cosgrove DO. Angiogenesis imaging in the management of prostate cancer. Nat Clin Pract Urol. 2005;2:596-607. 27. Fütterer JJ, Heijmink SW, Scheenen TW, et al. Prostate cancer localization with dynamic contrast-enhanced MR imaging and proton MR spectroscopic imaging. Radiology. 2006;241:449-58. 28. Ocak I, Bernardo M, Metzger G, et al. Dynamic contrast-enhanced MRI of prostate cancer at 3 T: a study of pharmacokinetic parameters. AJR Am J Roentgenol. 2007;189:849. 29. Tanaka N, Samma S, Joko M, et al. Diagnostic usefulness of endorectal magnetic resonance imaging with dynamic contrast-enhancement in patients with localized prostate cancer: mapping studies with biopsy specimens. Int J Urol. 1999;6:593-9. 30. Fütterer JJ, Engelbrecht MR, Huisman HJ, et al. Staging prostate cancer with dynamic contrast-enhanced endorectal MR imaging prior to radical prostatectomy: experienced versus less experienced readers. Radiology. 2005;237:541-9. 31. Bittencourt LK, Matos C, Coutinho AC Jr. Diffusion-weighted magnetic resonance imaging in the upper abdomen: technical issues and clinical applications. Magn Reson Imaging Clin N Am. 2011;19:111-31. 32. Padhani AR, Liu G, Koh DM, et al. Diffusion-weighted magnetic resonance imaging as a cancer biomarker: consensus and recommendations. Neoplasia. 2009;11:102-25. 33. Kim CK, Park BK, Han JJ, et al. Diffusion-weighted imaging of the prostate at 3 T for differentiation of malignant and benign tissue in transition and peripheral zones: preliminary results. J Comput Assist Tomogr. 2007;31:449-54. 34. Kumar V, Jagannathan NR, Kumar R, et al. Apparent diffusion coefficient of the prostate in men prior to biopsy: determination of a cut-off value to predict malignancy of the peripheral zone. NMR Biomed. 2007;20:505-11. 35. Tamada T, Sone T, Toshimitsu S, et al. Age related and zonal anatomical changes of apparent diffusion coefficient values in normal human prostatic tissues. J Magn Reson Imaging. 2008;27:552-6. 36. Ren J, Huan Y, Wang H, et al. Diffusion-weighted imaging in normal prostate and differential diagnosis of prostate diseases. Abdom Imaging. 2008;33:724-8. 37. Anderson AW, Xie J, Pizzonia J, et al. Effects of cell volume fraction changes on apparent diffusion in human cells. Magn Reson Imaging. 2000;18:689-95. 38. Bonekamp D, Jacobs MA, El-Khouli R, et al. Advancements in MR imaging of the prostate: from diagnosis to interventions. Radiographics. 2011;31:677-703. 39. de Souza NM, Reinsberg SA, Scurr ED, et al. Magnetic resonance imaging in prostate cancer: the value of apparent diffusion coefficients for identifying malignant nodules. Br J Radiol. 2007;80:90-5. 40. Itou Y, Nakanishi K, Narumi Y, et al. Clinical utility of apparent diffusion coefficient (ADC) values in patients with prostate cancer: can ADC values contribute to assess the aggressiveness of prostate cancer? J Magn Reson Imaging. 2011;33:167-72. 41. Tamada T, Sone T, Jo Y, et al. Apparent diffusion coefficient values in peripheral and transition zones of the prostate: comparison between normal and malignant prostatic tissues and correlation with histologic grade. J Magn Reson Imaging. 2008;28:720-6. 42. Turkbey B, Shah VP, Pang Y, et al. Is apparent diffusion coefficient associated with clinical risk scores for prostate cancers that are visible on 3-T MR images? Radiology. 2011;258:488-95. 43. Verma S, Rajesh A, Morales H, et al. Assessment of aggressiveness of prostate cancer: correlation of apparent diffusion coefficient with histologic grade after radical prostatectomy. AJR Am J Roentgenol. 2011;196:374-81. 44. Woodfield CA, Tung GA, Grand DJ, et al. Diffusion-weighted MRI of peripheral zone prostate cancer: comparison of tumor apparent diffusion coefficient with Gleason score and percentage of tumor on core biopsy. AJR Am J Roentgenol. 2010;194:W316-22. 45. Mazaheri Y, Hricak H, Fine SW, et al. Prostate tumor volume measurement with combined T2-weighted imaging and diffusionweighted MR: correlation with pathologic tumor volume. Radiology. 2009;252:449-57. 46. Haider MA, van der Kwast TH, Tanguay J, et al. Combined T2-weighted and diffusion-weighted MRI for localization of prostate cancer. AJR Am J Roentgenol. 2007;189:323-8. 47. Kajihara H, Hayashida Y, Murakami R, et al. Usefulness of diffusion- weighted imaging in the localization of prostate cancer. Int J Radiat Oncol Biol Phys. 2009;74:399-403. 48. Kim CK, Park BK, Lee HM, et al. Value of diffusion-weighted imaging for the prediction of prostate cancer location at 3T using a phasedarray coil: preliminary results. Invest Radiol. 2007;42:842-7. 49. Lim HK, Kim JK, Kim KA, et al. Prostate cancer: apparent diffusion coefficient map with T2-weighted images for detection - a multireader study. Radiology. 2009;250:145-51. 50. Morgan VA, Kyriazi S, Ashley SE, et al. Evaluation of the potential of diffusion-weighted imaging in prostate cancer detection. Acta Radiol. 2007;48:695-703. 51. Shimofusa R, Fujimoto H, Akamata H, et al. Diffusion-weighted imaging of prostate cancer. J Comput Assist Tomogr. 2005;29:149-53. 52. Yoshimitsu K, Kiyoshima K, Irie H, et al. Usefulness of apparent diffusion coefficient map in diagnosing prostate carcinoma: correlation with stepwise histopathology. J Magn Reson Imaging. 2008;27:132-9. 53. Sato C, Naganawa S, Nakamura T, et al. Differentiation of noncancerous tissue and cancer lesions by apparent diffusion coefficient values in transition and peripheral zones of the prostate. J Magn Reson Imaging. 2005;21:258-62. 54. Van As N, Charles-Edwards E, Jackson A, et al. Correlation of diffusion- weighted MRI with whole mount radical prostatectomy specimens. Br J Radiol. 2008;81:456-62. 55. Ren J, Huan Y, Wang H, et al. Seminal vesicle invasion in prostate cancer: prediction with combined T2-weighted and diffusionweighted MR imaging. Eur Radiol. 2009;19:2481-6. 56. Kim CK, Choi D, Park BK, et al. Diffusion-weighted MR imaging for the evaluation of seminal vesicle invasion in prostate cancer: initial results. J Magn Reson Imaging. 2008;28:963-9. 57. Albertsen PC, Hanley JA, Gleason DF, et al. Competing risk analysis of men aged 55 to 74 years at diagnosis managed conservatively for clinically localized prostate cancer. JAMA. 1998;280:975- 80. 58. Desireddi NV, Roehl KA, Loeb S, et al. Improved stage and gradespecific progression-free survival rates after radical prostatectomy in the PSA era. Urology. 2007;70:950-5. 59. Roach M 3rd, Weinberg V, Sandler H, et al. Staging for prostate cancer: time to incorporate pretreatment prostate-specific antigen and Gleason score? Cancer. 2007;109:213-20. 60. Noguchi M, Stamey TA, McNeal J, et al. Relationship between systematic biopsies and histological features of 222 radical prostatectomy specimens: lack of prediction of tumor significance for men with nonpalpable prostate cancer. J Urol. 2001;166:104-10. 61. Ruijter ET, van de Kaa CA, Schalken JA, et al. Histological grade heterogeneity in multifocal prostate cancer. Biological and clinical implications. J Pathol. 1996;180:295-9. 62. Bittencourt LK, Barentsz JO, de Miranda LC, et al. Prostate MRI: diffusion-weighted imaging at 1.5T correlates better with prostatectomy Gleason grades than TRUS-guided biopsies in peripheral zone tumours. Eur Radiol. 2012;22:468-75. 63. Hambrock T, Somford DM, Hoeks C, et al. Magnetic resonance imaging guided prostate biopsy in men with repeat negative biopsies and increased prostate specific antigen. J Urol. 2010;183:520-7. 64. Wang L, Hricak H, Kattan MW, et al. Prediction of seminal vesicle invasion in prostate cancer: incremental value of adding endorectal MR imaging to the Kattan nomogram. Radiology. 2007;242:182-8. 1. Doutor, Professor Adjunto de Radiologia da Universidade Federal Fluminense (UFF), Niterói, RJ, Membro Titular do Colégio Brasileiro de Radiologia e Diagnóstico por Imagem (CBR), Médico Radiologista das Clínicas CDPI e Multi-Imagem, Rio de Janeiro, RJ, Brasil 2. Médico Residente do Institute of Clinical Radiology and Nuclear Medicine, Medical Faculty Mannheim, Heidelberg University, Mannheim, Alemanha 3. Membro Titular do Colégio Brasileiro de Radiologia e Diagnóstico por Imagem (CBR), Médico Radiologista da Clínica CDPI, Rio de Janeiro, RJ, Brasil 4. Doutor, Professor Adjunto do Departamento de Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Médico Radiologista das Clínicas CDPI e Multi-Imagem, Rio de Janeiro, RJ, Brasil 5. Doutor, Titular da Cadeira de Pesquisa e Professor, Departamento de Radiologia, Radboud University Medical Center, Nijmegen, Holanda Endereço para correspondência: Dr. Leonardo Kayat Bittencourt Avenida das Américas, 4666, sala 325, Centro Médico Barrashopping, Barra da Tijuca Rio de Janeiro, RJ, Brasil, 22640-102 E-mail: lkayat@gmail.com Recebido para publicação em 15 de julho de 2013. Aceito, após revisão, em 18 de novembro de 2013. Estudo realizado nas Clínicas CDPI e Multi-Imagem, Rio de Janeiro, RJ, Brasil, Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil, e no Radboud University Medical Center, Nijmegen, Holanda. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554