Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 47 nº 3 - Maio / Jun. of 2014
Vol. 47 nº 3 - Maio / Jun. of 2014
|
RELATO DE CASO
|
|
|
|
|
Autho(rs): Rafael Alfenas de Paula1; Bruno Niemeyer de Freitas Ribeiro2; Paulo Roberto Valle Bahia3; Renato Niemeyer de Freitas Ribeiro4; Laís Balbi de Carvalho5 |
|
|
Descritores: Síndrome de Parry-Romberg; Atrofia hemifacial progressiva; Atrofia hemifacial; Hemiatrofia facial de Romberg. |
|
|
Resumo: INTRODUÇÃO
A síndrome de Parry-Romberg, também conhecida como atrofia hemifacial progressiva, é uma doença neurocutânea esporádica, caracterizada por lenta e progressiva atrofia hemifacial da pele, músculos e estruturas ósseas, ocasionalmente envolvendo o sistema nervoso central (SNC)(1,2). Sua origem é desconhecida, embora alguns acreditem ser uma manifestação da esclerodermia localizada(3). Em relação à sua fisiopatologia, alguns autores propuseram uma hipótese inflamatória meningoencefálica associada a vasculite, outros, um distúrbio vasomotor crônico relacionado a hiperatividade do sistema nervoso simpático(4). Temos como objetivo descrever os achados de ressonância magnética (RM) estrutural e em sequências avançadas, buscando uma correlação fisiopatológica. RELATO DO CASO Paciente masculino, 45 anos, há 20 anos apresentando alteração da hemiface direita caracterizada por atrofia e deformidades progressivas (Figura 1A). O aspecto clínico foi compatível com síndrome de Parry-Romberg. 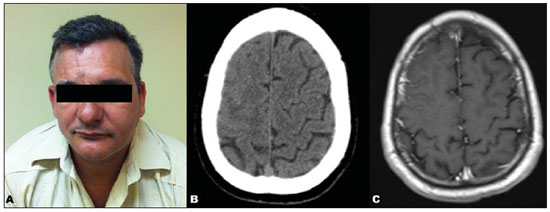 Figura 1. A: Alteração da hemiface direita, caracterizada por acentuada atrofia e deformidade. B: TC de crânio sem contraste, axial, demonstrando apagamento dos sulcos no lobo frontal direito. C: RM, sequência T1 pós-contraste, axial, demonstrando melhor o apagamento dos sulcos, assim como realce meníngeo associado. Há dois anos iniciou quadro de cefaleia e parestesia no membro superior esquerdo. A tomografia computadorizada (TC) de crânio demonstrou apagamento dos sulcos no lobo frontal direito (Figura 1B). A RM identificou espessamento cortical e focos de hipersinal em T2 e FLAIR na substância branca frontoparietal, realce leptomeníngeo (Figura 1C) e perfusão reduzida (Figura 2), todas homolaterais às alterações da hemiface. Espectroscopia de prótons mostrou um pico exuberante em 0,8 e 0,9 ppm na área acometida, caracterizado por um singleto com tempo de eco curto de 30 ms e suprimido com espectroscopia realizada com tempo de eco longo, de 270 ms, atribuível a lipídios (Figura 3). 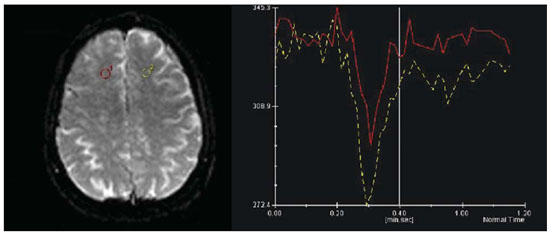 Figura 2. Análise comparativa da curva de perfusão da área da lesão com a região contralateral em correspondência demonstra uma curva de menor amplitude quando comparada com a região sem lesão, evidenciando hipoperfusão. 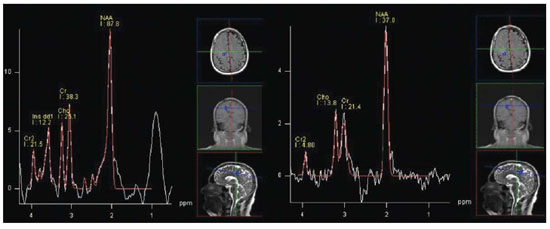 Figura 3. Análise por espectroscopia de prótons com técnica multivoxel, à esquerda com tempo de eco de 30 ms e à direita com tempo de eco de 270 ms. Observase aumento dos níveis de um singleto em torno de 0,8-0,9 ppm, com tempo de eco de 30 ms, e que é suprimido com tempo de eco longo, de 270 ms (atribuível a lipídios). Imagens em difusão não mostraram alterações significativas. Entretanto, o cálculo do coeficiente de difusão aparente (ADC) mostrou um valor maior no interior da região acometida (886,9), comparado com a mesma região contralateral (726,3). Além disso, o cálculo da anisotropia fracionada na área acometida (300,0) foi significativamente menor do que na mesma região contralateral (555,9). DISCUSSÃO A síndrome de Parry-Romberg é uma desordem infrequente, mais comum no sexo feminino, manifestada geralmente na primeira década de vida(5). Os sintomas neurológicos incluem cefaleia, neuralgia do trigêmeo e epilepsia focal(4). A TC e a RM são excelentes métodos para diagnóstico das alterações do SNC, sendo os achados característicos: hipersinal da substância branca em T2 e FLAIR, realce leptomeníngeo, calcificações intracranianas e atrofia cerebral(4). O diagnóstico diferencial inclui doenças que cursam com hemiatrofia cerebral, como a encefalite de Rasmussen e a síndrome de Sturge-Weber, porém nestas não observamos as alterações hemifaciais típicas encontradas na síndrome de Parry-Romberg (1,5). As sequências avançadas de RM são pouco exploradas atualmente na síndrome de Parry-Romberg e podem ajudar a explicar sua fisiopatologia. O caso aqui relatado apresentou alterações típicas da síndrome de Parry-Romberg: hemiatrofia da face à direita, além dos achados radiológicos descritos acima, exceto pelas calcificações intracranianas. Nas sequências avançadas observamos presença de lipídio na área acometida, além de redução da perfusão. Okumura et al.(6) demonstraram um padrão normal na espectroscopia de prótons da substância branca da área acometida. Nosso estudo demonstrou presença de lipídio na substância branca da região afetada, contrapondo-se com uma curva normal da mesma região contralateral. Alguns autores propuseram uma hipótese inflamatória meningoencefálica associada a vasculite, outros, um distúrbio vasomotor crônico relacionado a hiperatividade do sistema nervoso simpático(4), para explicar a fisiopatologia. Acreditamos que a presença de lipídio possa ser secundária a destruição da mielina por alterações metabólicas, relacionadas a um distúrbio vasomotor crônico. Alguns autores relataram alterações nos padrões de perfusão de áreas acometidas por meio de tomografia por emissão de fóton único (SPECT). Okumura et al.(6) demonstraram um padrão de fluxo reduzido na substância branca da área acometida, com fluxo relativamente aumentado no córtex do hemisfério afetado. DeFelipe et al.(7) relataram paciente com síndrome de Parry-Romberg associada a epilepsia do lobo temporal, com extensa área de hipoperfusão parieto-occipital pelo SPECT no hemisfério afetado. Nosso caso demonstrou redução da perfusão na área afetada na perfusão por RM. Como limitação, nosso paciente não realizou SPECT. Em nossa pesquisa bibliográfica não encontramos artigos relatando achados na perfusão por RM na síndrome de Parry-Romberg. Em relação à imagem por tensor de difusão, autores relatam uma redução da anisotropia fracionada(6) e uma redução das fibras de substância branca na região pela tratografia(8), podendo-se explicar por uma diminuição da mielinização. Nosso caso apresentou um valor de anisotropia fracionada reduzido em relação à mesma região contralateral, estando de acordo com os achados da literatura. Os valores de ADC foram maiores nas regiões com lesão, em comparação ao hemisfério contralateral. Imaginamos que isso também tenha ocorrido por redução da mielinização. CONCLUSÃO As sequências avançadas de RM podem ajudar a esclarecer a fisiopatologia da síndrome de Parry-Romberg, além de complementar seus achados clássicos: hipersinal da substância branca em T2 e FLAIR, realce leptomeníngeo, calcificações intracranianas e atrofia cerebral(4). REFERÊNCIAS 1. Longo D, Paonessa A, Specchio N, et al. Parry-Romberg syndrome and Rasmussen encephalitis: possible association. Clinical and neuroimaging features. J Neuroimaging. 2011;21:188-93. 2. Sharma M, Bharatha A, Antonyshyn OM, et al. Case 178: Parry-Romberg syndrome. Radiology. 2012:262:721-5. 3. Barra FR, Gonçalves FG, Matos VL, et al. Sinais em neurorradiologia - Parte 2. Radiol Bras. 2011;44:129-33. 4. Cory RC, Clayman DA, Faillace WJ, et al. Clinical and radiologic findings in progressive facial hemiatrophy (Parry-Romberg syndrome). AJNR Am J Neuroradiol. 1997;18:751-7. 5. El-Kehdy J, Abbas O, Rubeiz N. A review of Parry-Romberg syndrome. J Am Acad Dermatol. 2012;67:769-84. 6. Okumura A, Ikuta T, Tsuji T, et al. Parry-Romberg syndrome with a clinically silent white matter lesion. AJNR Am J Neuroradiol. 2006;27:1729-31. 7. DeFelipe J, Segura T, Arellano JI, et al. Neuropathological findings in a patient with epilepsy and the Parry-Romberg syndrome. Epilepsia. 2001;42:1198-203. 8. Moon WJ, Kim HJ, Roh HG, et al. Diffusion tensor imaging and fiber tractography in Parry-Romberg syndrome. AJNR Am J Neuroradiol. 2008;29:714-5. 1. Médico Residente de Radiologia e Diagnóstico por Imagem do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil 2. Médico Radiologista pelo Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (UFRJ), Especializando na Clínica de Diagnóstico por Imagem - CDPI-DASA, Rio de Janeiro, RJ, Brasil 3. Doutor, Professor Adjunto do Departamento de Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil 4. Médico rotina do Hospital de Clínicas de Jacarepaguá, Rio de Janeiro, RJ, Brasil 5. Acadêmica de Medicina da Universidade Presidente Antônio Carlos (Unipac), Juiz de Fora, MG, Brasil Endereço para correspondência: Dr. Rafael Alfenas de Paula Rua Coronel Júlio Soares, 324, ap. 603, Centro Ubá, MG, Brasil, 36500-000 E-mail: alfenas85@gmail.com Recebido para publicação em 20/2/2013. Aceito, após revisão, em 12/8/2013. Trabalho realizado no Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554