Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 47 nº 2 - Mar. / Abr. of 2014
Vol. 47 nº 2 - Mar. / Abr. of 2014
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Carlos Antônio da Silva Franca1 Sérgio Lannes Vieira2; Antonio Carlos Pires Carvalho3; Antonio Jose Serrano Bernabe4; Antonio Belmiro Rodrigues Campbell Penna5 |
|
|
Descritores: PSA nadir; Braquiterapia; Radioisótopos do iodo; Neoplasia de próstata. |
|
|
Resumo: INTRODUÇÃO
O câncer de próstata, de acordo com a Organização Mundial da Saúde, é o segundo em incidência no homem e a sexta causa de morte mais frequente na população masculina mundial(1). Para o Brasil, no ano de 2014, projetam-se 68.880 casos novos de câncer da próstata, o que equivale a um risco estimado de 70,42 casos novos a cada 100.000 homens(2). A radioterapia é utilizada no tratamento do câncer de próstata, seja em caráter exclusivo, adjuvante ou após recidiva bioquímica, por isso representa uma importante técnica de tratamento oncológico(3-5). O PSA é o principal exame de detecção da recidiva bioquímica. Encontrar um marcador de prognóstico para identificar homens com alto risco de falha de tratamento e subsequente morte poderia ajudar a selecionar aqueles que poderiam se beneficiar de terapias de resgate precoce. Diversas variáveis do PSA são testadas para predizer o controle bioquímico, incluindo o PSA inicial (PSAi) e o PSA nadir (PSAn)(6). Os níveis de PSA após tratamento radioterápico mostram um decréscimo gradual após um período de 18-24 meses. Flutuações do PSA não são infrequentes, com aumentos transitórios e quedas subsequentes, chamadas de bounce(7). Define-se como PSAn o valor mais baixo do PSA medido após qualquer método de tratamento. O tempo para se atingir o PSAn é diferente para prostatectomia radical e para radioterapia externa. Após a cirurgia, o declínio do PSA é imediato, caindo para níveis indetectáveis logo após a intervenção; já com radioterapia, a diminuição é lenta, chegando a 27 meses para atingir o nadir. Pacientes que atingem o PSAn dentro dos primeiros 12 meses após radioterapia apresentam pior prognóstico, com risco relativo de recidiva 18 vezes maior do que o observado em pacientes cujo PSAn ocorre dois anos após este tratamento(8). A braquiterapia tem sido cada vez mais utilizada, em razão dos avanços tecnológicos na ultrassonografia transretal, a disponibilidade de fontes de iodo radioativo adaptadas para implantação na glândula prostática e do desenvolvimento de programas de planejamento computadorizado para este método terapêutico(9,10). A braquiterapia é um procedimento ambulatorial, com baixa morbidade, boa conformidade na lesão alvo, ótima distribuição de dose e melhor qualidade de vida(9,10). Nos EUA, 36% dos tratamentos de radioterapia no câncer de próstata consistem de braquiterapia(11). O sucesso inicial deste tratamento conduziu a um aumento dramático na sua utilização em pacientes com câncer da próstata localizado, no mundo(12). As vantagens da braquiterapia incluem a sua propriedade conformacional, a concentração de altas doses de radiação dentro do volume alvo e o rápido declínio de dose para as estruturas adjacentes, como bexiga e reto(10,13). Vários artigos têm demonstrado relação entre o PSAn após a radioterapia definitiva e sobrevida livre de doença bioquímica (SLDB)(14-16). Embora a maioria dos pacientes experimente uma diminuição do PSA após a radioterapia definitiva, apenas alguns obtêm níveis de PSA indetectáveis(16). Vários autores propuseram um ponto de corte para vários níveis de PSAn, variando de 0,2 a 4,0 ng/ml, como um fator preditivo de recidiva bioquímica em pacientes tratados com radioterapia, braquiterapia ou sua combinação, com ou sem supressão androgênica(6,15,17,18). O objetivo deste estudo foi avaliar a relação entre os valores de PSAn dois anos após a braquiterapia com sementes de iodo-125 e as chances de recidiva bioquímica no câncer de próstata. MATERIAIS E MÉTODOS Este estudo foi aprovado pelo Comitê de Ética em Pesquisa do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro. De janeiro de 1998 a agosto de 2007, foram tratados por braquiterapia isolada 120 pacientes consecutivos com câncer de próstata (T1-T2), encaminhados por urologistas diferentes. O seguimento dos pacientes incluídos foi realizado de janeiro/2001 até dezembro/2012. Os pacientes foram classificados em três categorias de grupos de risco de recidiva, também utilizadas por D'Amico(19), com base em fatores prognósticos como PSAi, escore de Gleason e estádio clínico (EC), que avaliam o risco de recidiva bioquímica após qualquer tipo de tratamento:
PSAi é definido como o último valor de PSA total registrado antes do início de qualquer tratamento. Foram excluídos pacientes com expectativa de vida provável de menos de cinco anos, ressecção transuretral anterior causando deformidade maior da uretra prostática, alto risco cirúrgico e metástases a distância, conforme contraindicações propostas pela Sociedade Americana de Braquiterapia(20). Todos os pacientes foram tratados por braquiterapia isolada. Terapia hormonal neoadjuvante com um ou mais agonistas de liberação do hormônio luteinizante e antiandrógenos orais foi prescrita pelos urologistas assistente, durante dois a quatro meses, sempre que o volume da próstata inicial era superior a 50 g, com a finalidade de reduzir o volume da próstata, e interrompida antes do planejamento da braquiterapia. Nenhum paciente recebeu radioterapia externa. A nossa técnica de tratamento por braquiterapia está descrita em detalhes em outro artigo(21). A dosimetria pós-implante avalia a qualidade técnica do implante e as doses de radiação quantificada para a bexiga e o reto adjacente, com base na tomografia pélvica após 30 dias da braquiterapia. Critérios para a dosimetria pós-implante adequado incluíram V100 > 80%, D90 > 90% e V150 < 60% para sementes de iodo-125(22). No Brasil, apenas sementes de iodo-125 estão comercialmente disponíveis para a braquiterapia de baixa taxa de dose. Os pacientes foram acompanhados a cada quatro ou seis meses com dosagem dos níveis de PSA total, realizando exames clínicos e radiológicos, se necessário, quando da ascensão do PSA. O parâmetro utilizado para avaliar os resultados foi o PSA total. O Consenso Phoenix(23) é adotado para definir recidiva bioquímica, que estabelece recidiva bioquímica como PSAn + 2 ng/ml ou quando qualquer tratamento de resgate é iniciado. PSAn é o menor valor do PSA total registrado após qualquer tratamento. Vários autores propuseram um ponto de corte para vários níveis de PSAn, variando de 0,2 a 4,0 ng/ml, como um fator preditivo de recidiva bioquímica(6,15,17,18). No presente trabalho dividimos os grupos considerando o PSAn < 0,5 ng/ml ou > 0,5 ng/ml como ponto de corte. Os valores médios e medianos foram calculados para a análise dos resultados. Os métodos estatísticos aplicados foram o teste qui-quadrado para as variáveis categóricas e o teste t de Student para as variáveis contínuas. O nível de significância adotado foi 5% de probabilidade (p < 0,05), com intervalo de confiança de 95% (IC95%). A SLDB foi analisada pela curva de Kaplan-Meier e teste log-rank. A análise estatística foi realizada usando o programa SPSS para Windows versão 13 (SPSS Inc.; Chicago, EUA). RESULTADOS Um total de 120 pacientes foi analisado: 34 pacientes (28,3%) tiveram recidiva bioquímica e 86 (71,7%) apresentaram controle bioquímico. A média do PSAn foi 0,53 ng/ml (0,01-2,00; IC95%: 0,45-0,61) e a média de seguimento foi 98 meses (29-144; IC95%: 91-104). Nos pacientes com controle bioquímico, a média do PSAn foi 0,27 ng/ml (0,01-0,98; IC95%: 0,23-0,31), e para os pacientes com recidiva bioquímica foi 0,96 ng/ml (0,50-2,00; IC95%: 0.83-1,08), com p < 0,035. O tempo médio de recidiva bioquímica foi 36 meses (5-93; IC95%: 26-45). Os pacientes foram divididos em dois grupos: grupo 1, com 74 pacientes (61,7%) apresentando PSAn < 0,5 ng/ml dois anos após a braquiterapia, e grupo 2, com 46 pacientes (38,3%) apresentando PSAn > 0,5 ng/ml dois anos após a braquiterapia. As características clínicas dos pacientes estão descritas na Tabela 1. 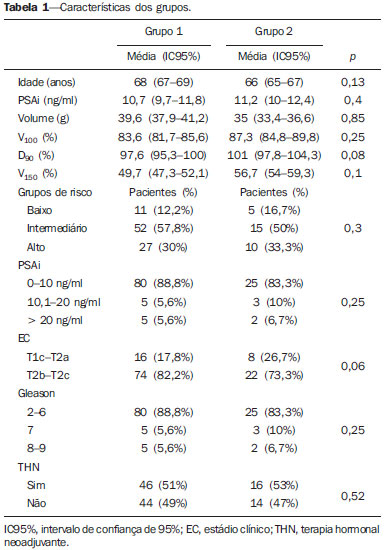 No grupo 1 houve recidiva bioquímica em 15 pacientes (20,3%) e no grupo 2, em 19 pacientes (43,2%), com p < 0,05. A análise de fatores de risco, como idade (p = 0,13), PSAi (p = 0,4), volume da próstata (p = 0,85), parâmetros dosimétricos (p > 0,08), grupos de risco (p = 0,3), EC (p = 0,06) e escore de Gleason (p = 0,25), não mostrou associação significativa entre os dois grupos. A análise da SLDB após sete anos de seguimento nos grupos 1 e 2 foi 80% e 64%, respectivamente (Figura 1), mostrando significância estatística do PSAn como um fator preditivo de recidiva bioquímica (p < 0,02). 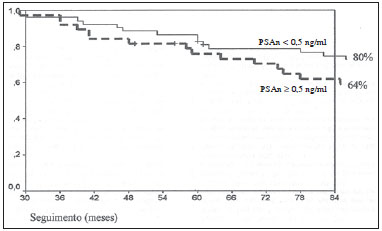 Figura 1. Sobrevida livre de doença bioquímica. DISCUSSÃO Miller et al.(24) apresentam questões acerca do valor preditivo do PSAn e se este poderia ser utilizado para prever a falha subsequentemente após a radioterapia para o câncer de próstata. Os investigadores estão procurando um preditor precoce de falhas, permitindo que o tratamento de resgate seja iniciado mais cedo. No entanto, o PSAn geralmente poderia levar vários anos para ocorrer, seu platô inferior poderia não aparecer mesmo após 8-10 anos, continuando a decrescer lentamente, em alguns casos(25). Como consequência, o PSAn teria pouco valor prático clínico. Uma abordagem muito mais razoável seria utilizar o menor PSA avaliado durante um intervalo de tempo definido, relativamente curto (por exemplo, 12 meses) após a conclusão da radioterapia. Alguns autores referem que o PSAn está significativamente relacionado com falha clínica(24,25). Nosso estudo inclui os valores de PSAn dois anos após a braquiterapia com sementes de iodo-125 e as chances de recidiva bioquímica do tratamento do câncer de próstata. Kapadia et al.(14) avaliaram vários artigos com vários níveis absolutos de PSAn pós-tratamento indicativos de recidiva bioquímica variando de 0,2-4,0 ng/ml. Nenhum consenso foi alcançado para os valores de PSAn que pudessem identificar um fator. No nosso estudo, PSAn de 0,5 ng/ml foi utilizado como ponto de corte. Optamos pelo ponto de corte de 0,5 ng/ml, pois este valor encontra-se na mediana da amostra, o que proporcionou um balanceamento dos grupos quase equitativos, para diminuir viés da amostra. O valor preditivo dos níveis de PSAn para controle bioquímico demonstrado nesta análise reforça resultados de estudos anteriores(6,7,14-17). No entanto, considerações importantes devem ser apontadas na interpretação deste tipo de análise: cuidado na avaliação do bounce, tempo excessivo para documentação da recidiva bioquímica, diferença substancial entre recidiva bioquímica para tratamento cirúrgico e tratamento radioterápico. O PSAn é um fator de pós-tratamento que é desconhecido no momento da irradiação, é determinado apenas mais tarde, após o fim do tratamento, e varia consideravelmente de paciente para paciente(6). Além disso, o bounce do PSA deverá ser levado em conta, pois ocorre em 35% após o tratamento, sendo descrito como um aumento de PSA seguido por redução subsequente, geralmente 12 a 24 meses após o implante(17). Zelefsky et al.(7), na sua análise, indicaram que o tempo de dois anos como referência foi um discriminador superior para metástases e de mortalidade em comparação com o ponto de tempo de três anos. Se houvesse um aumento no PSA visto no seguimento, testes de PSA foram realizados em intervalos menores, de 30 dias, até que a causa da falha bioquímica pudesse ser encontrada, para evitar o efeito de bounce. Kaminski et al.(16) sugerem que o PSAn após a radioterapia é mais significativo em pacientes com alto risco de recidiva bioquímica, tais como os com EC avançado, Gleason alto, ou PSAi elevado. No presente estudo foram incluídos pacientes com todas as classes de risco e nenhum deles se mostrou com diferenças estatísticas. Terapia hormonal neoadjuvante tem sido utilizada por alguns e que poderia interferir nos valores de PSAn pelas alterações nos níveis de PSA(7,16). No entanto, em nosso estudo, o PSAn não foi significativamente influenciado pelo uso de terapia hormonal neoadjuvante. Kaminski et al.(16) demonstraram que o volume da próstata é preditivo para PSAn, pois próstatas mais volumosas poderiam conduzir a valores mais elevados de PSAn. A avaliação do nosso estudo do volume prostático e PSAn não demonstrou nenhuma diferença estatística. Zelefsky et al.(12) encontraram que o nível do PSAn foi preditivo de controle bioquímico em longo prazo, pois valores relativamente baixos de PSAn parecem refletir elevadas doses intraprostáticas administradas por braquiterapia intersticial, como resultado da ablação de células malignas e normais na produção do PSA no epitélio prostático, pois as células epiteliais prostáticas são as responsáveis pelos níveis séricos de PSA(4), e maiores doses de radiação no volume prostático estão, provavelmente, diretamente relacionadas com a redução deste antígeno(4). Então, poderíamos considerar que valores maiores de D90 e V100 estariam associados com valores menores de PSAn, mostrando a importância da dose de radiação, em que doses mais elevadas estão associadas a valores inferiores de PSAn e melhor controle bioquímico(2,26-28). No entanto, nosso estudo não mostrou influência de D90 e V100 sobre os valores de PSAn. Pinkawa et al.(29) relatam o PSAn como de alta importância para o prognóstico, pois todos os pacientes com PSAn < 0,1 ng/ml permaneceram livres de recidiva (100%) e os pacientes com PSAn < 0,5 ng/ml permaneceram livres de recidiva em 87%. Nossa taxa de SLDB para o PSAn < 0,5 ng/ml foi 80%, muito próxima do referido estudo. A taxa de SLDB em cinco anos encontrada por Nickers et al.(30) e Cury et al.(31) foi 95% para PSAn < 1,0 ng/ml e 57% para PSAn > 1,0 ng/ml. Lee et al.(32) registraram 99% e 49%, respectivamente, para PSAn < 1,0 ng/ml e PSAn > 1,0 ng/ml. Estes dados são consistentes com os do presente trabalho. Critz et al.(33) relataram que todos os pacientes com PSAn > 1,0 ng/ml após cinco anos terão maior probabilidade de recidiva bioquímica, apesar do uso de braquiterapia associada a radioterapia. Outros autores(14,34) encontraram SLDB em cinco anos de 32% para os pacientes com PSAn > 1,0 ng/ml. Em nosso estudo, com sete anos de análise atuarial de SLDB, obtivemos 64% para pacientes com PsAn > 0,5 ng/ml dois anos após a braquiterapia isolada. Recentemente, Chen et al.(35) concluíram que PSAn dois anos após tratamento radioterápico com valor menor que 0,49 ng/ml significaria um melhor controle bioquímico em longo prazo, como avaliado no presente trabalho. As limitações do trabalho apresentado foram: análise retrospectiva, pacientes encaminhados de vários urologistas assistentes, estadiamentos realizados por meio de ultrassonografia transretal e dificuldade de comparação dos dados com outros autores, em razão de amostras de pacientes tão heterogêneas, tanto no Brasil quanto no exterior. CONCLUSÕES Os resultados deste estudo sugerem que o PSAn pode ser um fator preditivo para recidiva bioquímica. Níveis de PSAn > 0,5 ng/ml dois anos após a braquiterapia estão fortemente correlacionados com mau prognóstico. Este fato pode ajudar a identificar pacientes com risco de recidiva da doença. Um maior tempo de seguimento e um número maior de pacientes são necessários para confirmar os dados deste estudo. Agradecimento A Jennifer Uribe (OncuraTM), responsável pela introdução da braquiterapia com sementes de iodo-125 no Brasil. REFERÊNCIAS 1. Castro HAS, Iared W, Shigueoka DC, et al. Contribuição da densidade do PSA para predizer o câncer da próstata em pacientes com valores de PSA entre 2,6 e 10,0 ng/ml. Radiol Bras. 2011;44:205-9. 2. Brasil. Ministério da Saúde. Instituto Nacional de Câncer. Estimativa/2014 - Incidência de câncer no Brasil. Rio de Janeiro: INCA; 2014. [acessado em 17 de março de 2014]. Disponível em: http://www.inca.gov.br/estimativa/2014/estimativa-24012014.pdf. 3. Rolim AEH, Costa LJ, Ramalho LMP. Repercussões da radioterapia na região orofacial e seu tratamento. Radiol Bras. 2011;44:388-95. 4. Silva AIV, Galante C, Manzi FR. Efeito da radiação ionizante sobre o paladar em pacientes submetidos a radioterapia para a região da cabeça e pescoço. Radiol Bras. 2011;44:297-300. 5. Trindade BM, Campos TPR. Sistema computacional para dosimetria de nêutrons e fótons baseado em métodos estocásticos aplicado a radioterapia e radiologia. Radiol Bras. 2011;44:109-16. 6. Tseng YD, Chen MH, Beard CJ, et al. Posttreatment prostate specific antigen nadir predicts prostate cancer specific and all cause mortality. J Urol. 2012;187:2068-73. 7. Zelefsky MJ, Shi W, Yamada Y, et al. Postradiotherapy 2-year prostate-specific antigen nadir as a predictor of long-term prostate cancer mortality. Int J Radiat Oncol Biol Phys. 2009;75:1350-6. 8. Franca CAS, Vieira SL, Penna ABRC. Definição de recidiva bioquímica após tratamento radioterápico do câncer de próstata localizado: revisão de literatura. Rev Bras Cancerol. 2008;54:57-61. 9. Ragde H, Blasko JC, Grimm PD, et al. Interstitial iodine-125 radiation without adjuvant therapy in the treatment of clinically localized prostate carcinoma. Cancer. 1997;80:442-53. 10. Trindade BM, Christóvão MT, Trindade DFM, et al. Dosimetria comparativa de braquiterapia de próstata com sementes de I-125 e Pd-103 via SISCODES/MCNP. Radiol Bras. 2012;45:267-72. 11. Nickers P, Thissen B, Jansen N, et al. 192Ir or 125I prostate brachytherapy as a boost to external beam radiotherapy in locally advanced prostate cancer: a dosimetric point of view. Radiother Oncol. 2006;78:47-52. 12. Zelefsky MJ, Kuban DA, Levy LB, et al. Multi-institutional analysis of long-term outcome for stages T1-T2 prostate cancer treated with permanent seed implantation. Int J Radiat Oncol Biol Phys. 2007;67:327-33. 13. Franca CAS, Vieira SL, Carvalho ACP, et al. Localized prostate cancer with intermediate- or high-risk features treated with combined external beam radiotherapy and iodine-125 seed brachytherapy. Brachytherapy. 2010;9:307-12. 14. Kapadia NS, Olson K, Sandler HM, et al. Interval to biochemical failure as a biomarker for cause-specific and overall survival after dose-escalated external beam radiation therapy for prostate cancer. Cancer. 2012;118:2059-68. 15. Hanlon AL, Diratzouian H, Hanks GE. Posttreatment prostate-specific antigen nadir highly predictive of distante failure and death from prostate cancer. Int J Radiat Oncol Biol Phys. 2002;53:297-303. 16. Kaminski JM, Hanlon AL, Horwitz EM, et al. Relationship between prostate volume, prostate-specific antigen nadir, and biochemical control. Int J Radiat Oncol Biol Phys. 2002;52:888-92. 17. Bowes D, Crook JM, Wallace K, et al. Results of a surgically derived nomogram to predict Gleason score upgrading applied to a cohort of patients with "favorable-risk" prostate cancer treated with permanent seed brachytherapy. Urology. 2012;80:649-55. 18. [No authors listed]. Consensus statement: guidelines for PSA following radiation therapy. American Society for Therapeutic Radiology and Oncology Consensus Panel. Int J Radiat Oncol Biol Phys. 1997;37:1035-41. 19. Sylvester JE, Grimm PD, Blasko JC, et al. 15-Year biochemical free survival in clinical Stage T1-T3 prostate cancer following combined external beam radiotherapy and brachytherapy; Seattle experience. Int J Radiat Oncol Biol Phys. 2007;67:57-64. 20. Nag S, Beyer D, Friedland J, et al. American Brachytherapy Society (ABS) recommedations for transperineal permanent brachytherapy of prostate cancer. Int J Radiat Oncol Biol Phys. 1999;44:789-99. 21. Franca CAS, Vieira SL, Bernabe AJS, et al. The seven-year preliminary results of brachytherapy with iodine-125 seeds for localized prostate cancer treated at a Brazilian single-center. Int Braz J Urol. 2007;33:752-63. 22. Merrick GS, Grimm PD, Sylvester JE, et al. Initial analysis of Pro-Qura: a multi-institutional database of prostate brachytherapy dosimetry. Brachytherapy. 2007;6:9-15. 23. Roach M 3rd, Hanks G, Thames H Jr, et al. Defining biochemical failure following radiotherapy with or without hormonal therapy in men with clinically localized prostate cancer: recommendations of the RTOG-ASTRO Phoenix Consensus Conference. Int J Radiat Oncol Biol Phys. 2006;65:965-74. 24. Miller N, Smolkin ME, Bissonette E, et al. Undetectable prostate specific antigen at 6-12 months: a new marker for early sucess in hormonally treated patients after prostate brachytherapy. Cancer. 2005;103:2499-506. 25. Buyyounouski MK, Pickles T, Kestin LL, et al. Validating the interval to biochemical failure for the identification of potentially lethal prostate cancer. J Clin Oncol. 2012;30:1857-63. 26. Pollack A, Hanlon AL, Horwitz EM, et al. Prostate cancer radiotherapy dose response: an update of the fox chase experience. J Urol. 2004;171:1132-6. 27. Symon Z, Griffith KA, McLaughlin PW, et al. Dose escalation for localized prostate cancer: substantial benefit observed with 3D conformal therapy. Int J Radiat Oncol Biol Phys. 2003;57:384-90. 28. Abdel-Wahab M, Mahmoud O, Merrick G, et al. ACR Appropriateness Criteria® external-beam radiation therapy treatment planning for clinically localized prostate cancer. J Am Coll Radiol. 2012;9:233-8. 29. Pinkawa M, Piroth MD, Holy R, et al. Prostate-specific antigen kinetics following external-beam radiotherapy and temporary (Ir-192) or permanent (I-125) brachytherapy for prostate cancer. Radiother Oncol. 2010;96:25-9. 30. Nickers P, Albert A, Waltregny D, et al. Prognostic value of PSA nadir < or = 4 ng/mL within 4 months of high-dose radiotherapy for locally advanced prostate cancer. Int J Radiat Oncol Biol Phys. 2006;65:73-7. 31. Cury FL, Hunt D, Roach M 3rd, et al. Prostate-specific antigen response after short-term hormone therapy plus external-beam radiotherapy and outcome in patients treated on Radiation Therapy Oncology Group study 9413. Cancer. 2013;119:1999-2004. 32. Lee WR, Hanlon AL, Hanks GE. Prostate specific antigen nadir following external beam radiation therapy for clinically localized prostate cancer: the relationship between nadir level and disease-free survival. J Urol. 1996;156(2 Pt 1):450-3. 33. Critz FA, Willians WH, Holladay CT, et al. Post-treatment PSA < or = 0.2 ng/mL defines disease freedom after radiotherapy for prostate cancer using modern techniques. Urology. 1999;54:968-71. 34. DeWitt KD, Sandler HM, Weinberg V, et al. What does postradiotherapy PSA nadir tell us about freedom from PSA failure and progression-free survival in patients with low and intermediate-risk localized prostate cancer? Urology. 2003;62:492-6. 35. Chen LN, Suy S, Uhm S, et al. Stereotactic body radiation therapy (SBRT) for clinically localized prostate cancer: the Georgetown University experience. Radiat Oncol. 2013;8:58. 1. Mestre, Médico Radioterapeuta do Instituto Brasileiro de Oncologia (IBO), Radioterapia Botafogo, Universidade Federal do Rio de Janeiro (UFRJ) e Pontifícia Universidade Católica do Rio de Janeiro (PUC-Rio), Rio de Janeiro, RJ, Brasil 2. Livre-docente, Médico Radioterapeuta do Instituto Brasileiro de Oncologia (IBO), Radioterapia Botafogo e Pontifícia Universidade Católica do Rio de Janeiro (PUC-Rio), Rio de Janeiro, RJ, Brasil 3. Doutor, Professor da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil 4. Médico Urologista da Radioterapia Botafogo, Rio de Janeiro, RJ, Brasil 5. Doutor, Médico Radioterapeuta do Instituto Brasileiro de Oncologia (IBO), Radioterapia Botafogo e Pontifícia Universidade Católica do Rio de Janeiro (PUC-Rio), Rio de Janeiro, RJ, Brasil Endereço para correspondência: Dr. Carlos Antônio da Silva Franca Rua Marechal Niemeyer, 16, Botafogo Rio de Janeiro, RJ, Brasil, 22251-060 E-mail: carlosfranca@cremerj.org.br Recebido para publicação em 9/4/2013. Aceito, após revisão, em 22/10/2013. Trabalho realizado na Radioterapia Botafogo, com apoio do Instituto Brasileiro de Oncologia (IBO), Universidade Federal do Rio de Janeiro (UFRJ) e Pontifícia Universidade Católica do Rio de Janeiro (PUC-Rio), Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554