Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 47 nº 2 - Mar. / Abr. of 2014
Vol. 47 nº 2 - Mar. / Abr. of 2014
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Almir Galvão Vieira Bitencourt1; Eduardo Nóbrega Pereira Lima2; Rubens Chojniak3; Elvira Ferreira Marques4; Juliana Alves de Souza5; Luciana Graziano5; Wesley Pereira Andrade6; Cynthia Aparecida Bueno de Toledo Osório7 |
|
|
Descritores: Neoplasias da mama; PET/CT; Histologia. |
|
|
Resumo: INTRODUÇÃO
O câncer de mama é o segundo tumor maligno mais incidente e a principal causa de morte por neoplasia entre mulheres no Brasil(1). Porém, diferentes subtipos moleculares de carcinomas mamários podem apresentar diferentes prognósticos e respostas terapêuticas. Por exemplo, os tumores que expressam receptores hormonais geralmente são mais bem diferenciados e têm melhor prognóstico. Vários fatores histológicos e imuno-histoquímicos têm sido utilizados para avaliar a agressividade tumoral e classificar o tumor em um subtipo molecular específico para um adequado planejamento terapêutico(2). Os métodos de imagem desempenham papel fundamental no rastreamento, diagnóstico e manejo dos pacientes com câncer de mama. Devido às limitações dos métodos de imagem convencionais (mamografia e ultrassonografia), a ressonância magnética (RM) e novos métodos de imagem funcionais vêm sendo cada vez mais utilizados(3,4). A tomografia por emissão de pósitrons/tomografia computadorizada (PET/CT) com 18F-flúor-2-deoxi-D-glicose (18F-FDG) vem sendo amplamente utilizada para o diagnóstico, estadiamento e reestadiamento de diversos tipos de câncer(5-7). Ao contrário dos métodos de imagem convencionais capazes de detectar apenas alterações anatômicas, o PET/CT com 18F-FDG é capaz de fornecer informações relacionadas ao metabolismo da glicose nos diversos órgãos e tecidos. Todavia, a concentração de 18F-FDG nos tumores é variável a depender do órgão de origem e do tipo de tumor. Para pacientes com câncer de mama, o PET/CT com 18F-FDG tem papel comprovado na detecção de metástases a distância, recorrências e avaliação de resposta terapêutica. No entanto, para o diagnóstico de lesões mamárias primárias e estadiamento locorregional, o PET/CT com 18F-FDG tem valor diagnóstico limitado quando comparado aos outros métodos de imagem(8,9). Na literatura, o PET com 18F-FDG demonstrou sensibilidade de 64-96% e especificidade de 73-100% para o diagnóstico de lesões mamárias suspeitas(10). As principais limitações do PET/CT com 18F-FDG no diagnóstico de lesões mamárias estão relacionadas à baixa resolução espacial do PET, que dificulta a identificação de lesões inferiores a 10 mm. Para tumores menores que 10 mm, a sensibilidade do PET/CT com 18F-FDG é de 25%, comparada a 84% para tumores entre 10 e 20 mm(11). A concentração de 18F-FDG também é menor nos tumores não invasivos como o carcinoma ductal in situ (CDIS) ou de crescimento lento como o carcinoma tubular. Além disso, o PET/CT com 18F-FDG é menos sensível para o diagnóstico do carcinoma lobular invasivo (CLI) em relação ao carcinoma ductal invasivo (CDI)(9,12). O objetivo deste trabalho é correlacionar o resultado do PET/CT com 18F-FDG realizado com protocolo específico para avaliação das mamas, com achados histológicos e imuno-histoquímicos em pacientes com carcinomas mamários. MATERIAIS E MÉTODOS Estudo transversal, com coleta prospectiva dos dados, unicêntrico, em que foram estudadas pacientes com carcinomas mamários confirmados por biópsia. O trabalho foi aprovado pelo Comitê de Ética em Pesquisa da instituição antes do início da coleta dos dados. Pacientes portadoras de lesões mamárias suspeitas e indicação formal de biópsia, seja percutânea ou cirúrgica, no período de maio de 2010 a janeiro de 2012, foram contatadas para inclusão no estudo. Após concordância em participar do estudo e assinatura de termo de consentimento livre e esclarecido, as pacientes foram submetidas a exame de PET/CT com 18F-FDG, realizado com protocolo específico para este estudo, antes da coleta de material para estudo histopatológico. Foram excluídas do estudo as pacientes: com lesões mamárias menores que 5 mm; que realizaram biópsia da mama até 15 dias antes do PET/CT; que estivessem em tratamento com radioterapia ou quimioterapia ou que tivessem recebido a última dose há menos de 30 dias; grávidas ou que estivessem amamentando; e pacientes cujo resultado da biópsia foi compatível com lesão benigna. Cinquenta mulheres foram incluídas no estudo. A idade destas pacientes variou de 29 a 75 anos, com média de 47,4 anos (desvio-padrão: 11,3 anos). História familiar de câncer de mama esteve presente em 18 mulheres (35,0%) e apenas 3 pacientes (6,0%) tiveram diagnóstico prévio de câncer de mama. O PET/CT foi realizado em aparelho dedicado (PET/CT Gemini; Philips) após administração de 0,154 mCi/kg/peso de 18F-FDG, em jejum, durante repouso muscular. Antes da administração de 18F-FDG, foi colhida glicemia capilar para garantir que os níveis séricos de glicose se encontravam abaixo de 150 mg/dl. As imagens foram iniciadas no intervalo entre 60 e 120 minutos após a dose. Foi realizado o exame de PET/CT pelo protocolo padrão de avaliação oncológica, que consiste em avaliação do corpo todo com a paciente em decúbito dorsal. Em seguida, foi feita a sequência especial de imagens dedicadas à avaliação das mamas, que compreende toda a região do tórax e as axilas, sendo realizada com a paciente em decúbito ventral e as mamas pendentes, propiciando completa visualização do parênquima mamário. Para realização das imagens de PET/CT dedicadas à avaliação das mamas, foi utilizado um dispositivo especialmente confeccionado que reproduz o formato da bobina utilizada nos exames de RM das mamas (Figura 1). A aquisição cefalocaudal se inicia com cortes tomográficos contíguos de 2,5 mm de espessura sendo realizados em sistema helicoidal de dois canais sem uso de contraste intravenoso, seguidos da aquisição das imagens do 18F-FDG pelo PET acoplado. Cada bed-position de 15 cm de campo de visão foi adquirido com tempo de aquisição de 90 segundos. 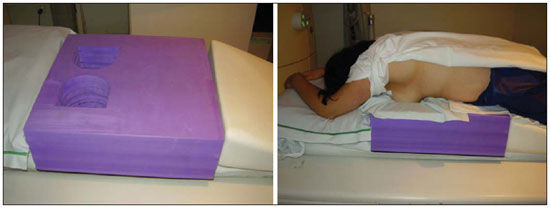 Figura 1. Dispositivo confeccionado para realização do PET/CT em decúbito ventral com as mamas pendentes. A interpretação e a avaliação do PET/CT com 18F-FDG foram realizadas por pelo menos dois médicos nucleares com experiência em PET/CT. As áreas com concentração aumentada de 18F-FDG em relação ao parênquima mamário normal foram consideradas positivas, sendo realizado cálculo do SUV máximo para cada região de interesse. Para análise dos dados, foi considerado apenas o valor de SUV máximo mensurado nas imagens de PET/CT realizadas em decúbito ventral, no exame dedicado para as mamas. Os achados do PET/CT foram comparados aos dados histológicos e imuno-histoquímicos. Os dados histológicos foram obtidos a partir dos relatórios do Departamento de Anatomia Patológica do hospital. Os seguintes parâmetros morfológicos e imuno-histoquímicos foram observados: tipo histológico, grau histológico, grau nuclear, índice mitótico, receptores hormonais para estrógeno e progesterona, e expressão de Her-2 e Ki-67. De acordo com o perfil imuno-histoquímico, os carcinomas mamários foram classificados em quatro subtipos moleculares: luminal A (receptor positivo para estrógeno e/ou progesterona, com baixa expressão dos marcadores de proliferação celular); luminal B (receptor positivo para estrógeno e/ou progesterona, com Her-2 superexpresso ou alta expressão dos marcadores de proliferação celular); Her-2 (receptores hormonais negativos e Her-2 superexpresso); e triplo-negativo (receptores hormonais e Her-2 negativos). Todos os dados obtidos foram armazenados em um banco de dados para análise estatística com o programa SPSS versão 20.0. A análise descritiva das variáveis categóricas consistiu no cálculo das frequências simples e relativas. As variáveis numéricas foram descritas como média, desvio-padrão (DP), mínimo e máximo. Na análise estatística foi utilizado o teste t de Student (ou não paramétrico de Mann-Whitney, conforme indicação) para comparação de variáveis escalares entre dois grupos. Em caso de três ou mais grupos, foi utilizado o teste de análise de variância ou o teste não paramétrico de Kruskal-Wallis. A comparação entre duas variáveis contínuas foi realizada utilizando-se correlação linear e gráficos de dispersão. Para estudo das variáveis categóricas foram utilizadas tabelas 2 × 2 e 2 × 3, com avaliação da significância estatística pelo teste do qui-quadrado de Pearson com correção de Yates ou o teste exato de Fisher, quando indicado. Foram considerados estatisticamente significantes os resultados que tiveram probabilidade de erro tipo I menor ou igual a 5% (p < 0,05). RESULTADOS Foram identificadas 59 lesões mamárias malignas nas 50 pacientes incluídas no estudo. O diâmetro máximo das lesões variou de 6 a 80 mm, com média de 32,2 mm (DP: 18,4 mm). A análise histológica foi realizada por meio de biópsia percutânea em 32 lesões (54,2%) e ressecção cirúrgica em 27 lesões (45,8%). O tipo histológico mais comum foi o CDI (n = 47; 79,7%), seguido por CLI (n = 6; 10,2%), carcinoma mucinoso (n = 2; 3,4%), CDIS (n = 2; 3,4%) e doença de Paget (n = 2; 3,4%). As características histológicas e imuno-histoquímicas dos carcinomas mamários estão descritas na Tabela 1. 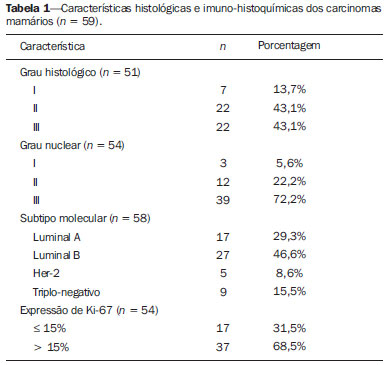 No exame por PET/CT, 53 (89,8%) destas lesões apresentaram concentração anômala de 18F-FDG, com SUV máximo variando de 0,8 a 23,1 (média: 5,5; DP: 5,0). As Figuras 2 e 3 ilustram casos de carcinomas mamários positivos no PET/CT. Seis lesões (10,2%) não apresentaram concentração anômala de 18F-FDG, sendo considerados resultados falso-negativos, dos quais três apresentavam diâmetro inferior a 10 mm e o maior tinha diâmetro máximo de 15 mm. Todos os tumores com resultado falso-negativo no PET/CT tinham receptores hormonais positivos na análise imuno-histoquímica. 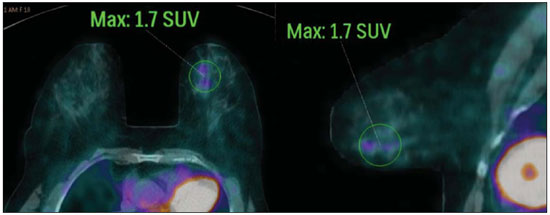 Figura 2. Mulher de 63 anos, com carcinoma ductal in situ no quadrante inferomedial da mama esquerda. Cortes axial e sagital do PET/CT dedicado às mamas demonstrando discreto aumento da concentração de FDG na localização da lesão na mama esquerda (SUV máximo: 1,7). 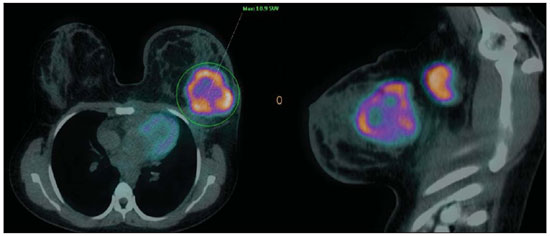 Figura 3. Mulher de 42 anos, com carcinoma ductal invasivo (subtipo triplo-negativo) no quadrante superolateral da mama esquerda associado a linfonodomegalia axilar e espessamento difuso da pele nesta mama (tumor inflamatório). Cortes axial e sagital do PET/CT dedicado às mamas demonstrando aumento heterogêneo da concentração de FDG na localização da massa na mama esquerda (SUV máximo: 10,9) e na linfonodomegalia axilar (SUV máximo: 11,2). Os fatores histológicos/imuno-histoquímicos dos carcinomas mamários que apresentaram associação estatisticamente significante com resultado positivo no PET/CT foram grau histológico, grau nuclear e expressão de Ki-67. Todos os tumores que não expressavam receptores hormonais (subtipos Her-2 e triplo-negativo) foram positivos no PET/CT. Os fatores histológicos/imuno-histoquímicos que foram associados a valores mais altos de SUV máximo nas lesões malignas foram tipo histológico, grau histológico, subtipo molecular, diâmetro do tumor, índice mitótico e expressão de Ki-67 (Tabela 2, Figuras 4 a 6). 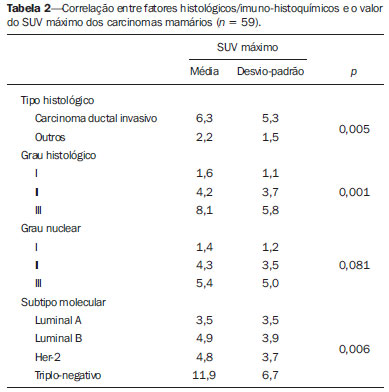 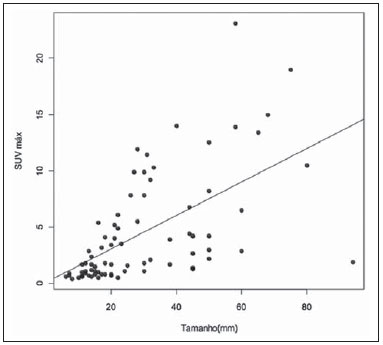 Figura 4. Gráfico de dispersão demonstrando correlação entre o valor do SUV máximo e o maior diâmetro dos carcinomas mamários (n = 59). Espera-se que o SUV máximo aumente em 0,14 para cada aumento de 1 mm no diâmetro (p < 0,0001). 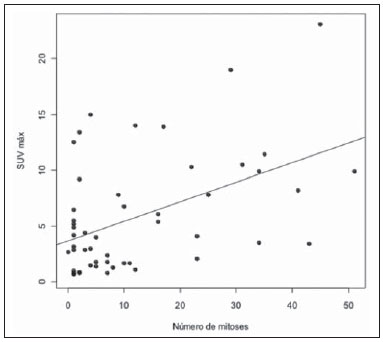 Figura 5. Gráfico de dispersão demonstrando correlação entre o valor do SUV máximo e o índice mitótico nos carcinomas mamários (n = 59). Espera-se que o SUV máximo aumente em 0,17 para cada aumento de uma unidade no número de mitoses (p = 0,0005). 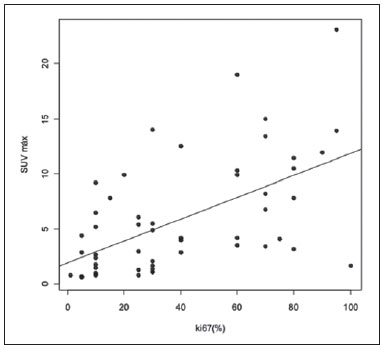 Figura 6. Gráfico de dispersão demonstrando a correlação entre o valor do SUV máximo e a expressão de Ki-67 nos carcinomas mamários (n = 59). Espera-se que o SUV máximo aumente em 0,09 para um aumento de 1% na expressão do Ki-67 (p < 0,0001). DISCUSSÃO Os resultados deste trabalho demonstram que o PET/CT realizado em decúbito ventral, com protocolo específico para avaliação das mamas, possui elevada sensibilidade para o diagnóstico de carcinomas mamários, sendo positivo em cerca de 90% dos tumores malignos na nossa casuística. Desde 1999, quando Yutani et al. descreveram pela primeira vez a utilização do PET em decúbito ventral, vários autores demonstraram as vantagens deste posicionamento na avaliação de lesões mamárias(13). O PET/CT na posição prona aumenta a detecção do câncer de mama em razão do maior contraste entre os tecidos tumoral e não tumoral e maiores valores de SUV apresentados pelos tumores mamários nesta forma de aquisição, em comparação ao PET realizado na posição supina, aumentando a confiança dos observadores na avaliação das áreas de metabolismo anormal(13–15). A principal limitação do PET encontrada no nosso trabalho foi a resolução espacial do método com os equipamentos disponíveis atualmente no mercado. Nesta casuística, houve seis resultados falso-negativos, dos quais três tinham diâmetro inferior a 10 mm e o maior tinha diâmetro de 15 mm. Todas as lesões falso-negativas no PET/CT na nossa casuística foram identificadas na RM. Diversos autores já haviam demonstrado a menor sensibilidade do PET para lesões menores que 10 mm(16,17). Kumar et al., por exemplo, correlacionaram fatores clínicos e patológicos associados aos resultados do PET nas lesões mamárias e encontraram que tumores pequenos (< 10 mm) e de baixo grau são fortes preditores de resultados falso-negativos(16). Alguns autores tentaram definir um ponto de corte do valor de SUV máximo para diferenciar lesões benignas e malignas na mama(18). No entanto, a maioria dos trabalhos comprovou que considerando qualquer ponto de corte, muitos diagnósticos seriam perdidos devido aos baixos valores de SUV apresentados por alguns tipos de carcinomas mamários, principalmente aqueles de baixo grau(15,19). Deste modo, a maioria dos trabalhos atuais considera que todas as lesões com concentração de 18F-FDG superior ao parênquima normal devem ser consideradas suspeitas. Nestes casos, é fundamental a correlação com exames de imagem convencionais, dados clínicos e, se necessário, estudo histológico para afastar possíveis resultados falso-positivos, que podem estar relacionados a processos inflamatórios agudos ou crônicos, lactação, lesões benignas (alterações fibrocísticas, fibroadenomas, etc.), granulomas de silicone, necrose gordurosa e alterações pós-operatórias/actínicas(20). Assim como demonstrado por outros autores, foi confirmado neste estudo que o PET tem o potencial de identificar tumores de mama mais agressivos e suas implicações prognósticas, podendo ser ferramenta útil para prever as características biológicas do tumor antes do tratamento. Os fatores histológicos que foram associados a valores mais altos de SUV máximo nas lesões malignas foram tipo histológico, grau histológico, subtipo molecular, diâmetro do tumor, índice mitótico e expressão de Ki-67. Em relação ao tipo histológico, os CDIs apresentaram valores de SUV superiores à combinação dos outros carcinomas encontrados na nossa amostra (carcinoma mucinoso, CLI, CDIS e doença de Paget). Em relação ao subtipo molecular, é importante ressaltar que todos os tumores com receptores hormonais negativos (subtipos Her-2 e triplo-negativo) apresentaram concentração anômala de 18F-FDG no PET/CT. Estes resultados estão de acordo com outros trabalhos presentes na literatura(21-23). Os tumores menos diferenciados, sem receptores hormonais, são mais agressivos e têm um metabolismo da glicose mais acelerado para suprir a demanda de crescimento rápido. Basu et al. observaram sensibilidade de 100% do PET nos cânceres de mama do subtipo triplo-negativo e maior concentração de 18F-FDG neste subtipo quando comparado aos subtipos com receptores hormonais positivos. Esses autores sugeriram que o PET/CT pode ser um importante marcador da atividade tumoral e reposta ao tratamento nestes tumores(21). Ueda et al. examinaram 152 pacientes com câncer de mama e, em análise multivariada, encontraram que o tamanho do tumor invasivo, grau nuclear e negatividade para receptor de estrógeno estavam associados a maiores valores de SUV(22). Mavi et al. também demonstraram que os tumores de mama com receptores negativos para estrógeno têm valores de SUV máximo significativamente superiores aos tumores com receptores positivos. Neste mesmo trabalho, os autores encontraram 25 tumores maiores que 5 mm na peça cirúrgica que não apresentaram concentração aumentada de 18F-FDG e todos tinham receptores hormonais positivos(23). Na nossa casuística também observamos que todos os resultados falso-negativos no PET/CT eram tumores que expressavam receptores hormonais (subtipos luminal A e luminal B). Vários métodos vêm sendo desenvolvidos no sentido de melhorar os resultados atuais do PET/CT com 18F-FDG no diagnóstico das lesões mamárias. Por exemplo, nos últimos anos foi desenvolvido um aparelho específico para a obtenção de imagens PET com 18F-FDG dedicado apenas para as mamas, em que são adquiridas imagens tridimensionais sob leve compressão, nas mesmas incidências realizadas no exame de mamografia. Este novo exame, denominado mamografia por emissão de pósitrons (PEM), tem como principais vantagens em relação ao PET/CT: elevada resolução espacial, sendo capaz de identificar lesões de até 2 mm; correlação com as imagens da mamografia; e possibilidade de guiar biópsias percutâneas(24). Este método tem demonstrado elevada acurácia diagnóstica para lesões mamárias primárias, incluindo os carcinomas in situ, com sensibilidade e especificidade de até 91% e 93%, respectivamente(25,26). A PEM também tem demonstrado ser útil na avaliação pré-cirúrgica de tumores mamários, com resultados semelhantes à RM(27). Além do aumento da resolução espacial, novos marcadores mais específicos para o câncer de mama vêm sendo desenvolvidos para superar os resultados do PET com 18F-FDG, que é um marcador pouco específico. Dentre estes novos marcadores destacam-se o 18F-16-alfa-17-beta-fluoroestradiol e o 68Ga-trastuzumab, que podem retratar de forma não invasiva a expressão tumoral de receptores para estrógeno e Her-2, respectivamente, com potencial para auxiliar no planejamento terapêutico e avaliação de resposta(28). Vale destacar que, com a tecnologia atual, o PET/CT ainda não deve ser usado como primeiro exame de imagem para o diagnóstico do câncer de mama, e a conduta terapêutica sempre dependerá dos estudos histológicos e de imunohistoquímica. CONCLUSÃO O PET/CT com 18F-FDG realizado com protocolo específico para avaliação das mamas tem boa sensibilidade no diagnóstico dos carcinomas mamários e permite a identificação dos tumores mais agressivos na histologia. Houve associação estatisticamente significante entre os valores de SUV máximo e importantes fatores histológicos e imuno-histoquímicos relacionados à agressividade e prognóstico dos carcinomas mamários. Acreditamos que este método tem potencial para auxiliar de forma mais efetiva no manejo das lesões mamárias num futuro próximo, com a melhora da resolução espacial dos aparelhos de PET e introdução de novos radiofármacos. REFERÊNCIAS 1. Brasil. Ministério da Saúde. Instituto Nacional de Câncer. Câncer: incidência de câncer no Brasil. Rio de Janeiro: INCA; 2012. 2. Cirqueira MB, Moreira MAR, Soares LR, et al. Subtipos moleculares do câncer de mama. Femina. 2011;39:499–503. 3. Marques EF, Medeiros MLL, Souza JA, et al. Indicações de ressonância magnética das mamas em um centro de referência em oncologia. Radiol Bras. 2011;44:363–6. 4. Barra FR, Barra RR, Barra Sobrinho A. Novos métodos funcionais na avaliação de lesões mamárias. Radiol Bras. 2012;45:340–4. 5. Soares Junior J, Fonseca RP, Cerci JJ, et al. Lista de recomendações do exame PET/CT com 18F-FDG em oncologia. Consenso entre a Sociedade Brasileira de Cancerologia e a Sociedade Brasileira de Biologia, Medicina Nuclear e Imagem Molecular. Radiol Bras. 2010;43:255–9. 6. Curioni OA, Souza RP, Amar A, et al. Valor da PET/CT na abordagem do câncer de cabeça e pescoço. Radiol Bras. 2012;45:315–8. 7. Mohan K, McShane J, Page R, et al. Impact of 18F-FDG PET scan on the prevalence of benign thoracic lesions at surgical resection. Radiol Bras. 2011;44:279–82. 8. Groheux D, Espié M, Giacchetti S, et al. Performance of FDG PET/CT in the clinical management of breast cancer. Radiology. 2013;266:388–405. 9. Lim HS, Yoon W, Chung TW, et al. FDG PET/CT for the detection and evaluation of breast diseases: usefulness and limitations. Radiographics. 2007;27 Suppl 1:S197–213. 10. Scheidhauer K, Walter C, Seemann MD. FDG PET and other modalities in the primary diagnosis of suspicious breast lesions. Eur J Nucl Med Mol Imaging. 2004;31 Suppl 1:S70–9. 11. Avril N, Rosé CA, Schelling M, et al. Breast imaging with positron emission tomography and fluorine-18 fluorodeoxyglucose: use and limitations. J Clin Oncol. 2000;18:3495–502. 12. Crippa F, Seregni E, Agresti R, et al. Association between [18F]fluorodeoxyglucose uptake and postoperative histopathology, hormone receptor status, thymidine labelling index and p53 in primary breast cancer: a preliminary observation. Eur J Nucl Med. 1998;25:1429–34. 13. Yutani K, Tatsumi M, Uehara T, et al. Effect of patients' being prone during FDG PET for the diagnosis of breast cancer. AJR Am J Roentgenol. 1999;173:1337–9. 14. Moy L, Noz ME, Maguire GQ Jr, et al. Prone mammoPET acquisition improves the ability to fuse MRI and PET breast scans. Clin Nucl Med. 2007;32:194–8. 15. Kaida H, Ishibashi M, Fujii T, et al. Improved detection of breast cancer on FDG-PET cancer screening using breast positioning device. Ann Nucl Med. 2008;22:95–101. 16. Kumar R, Chauhan A, Zhuang H, et al. Clinicopathologic factors associated with false negative FDG-PET in primary breast cancer. Breast Cancer Res Treat. 2006;98:267–74. 17. Moy L, Noz ME, Maguire GQ Jr, et al. Role of fusion of prone FDG-PET and magnetic resonance imaging of the breasts in the evaluation of breast cancer. Breast J. 2010;16:369–76. 18. Chae EY, Cha JH, Kim HH, et al. Analysis of incidental focal hypermetabolic uptake in the breast as detected by 18F-FDG PET/CT: clinical significance and differential diagnosis. Acta Radiol. 2012;53:530–5. 19. Mavi A, Urhan M, Yu JQ, et al. Dual time point 18F-FDG PET imaging detects breast cancer with high sensitivity and correlates well with histologic subtypes. J Nucl Med. 2006;47:1440–6. 20. Adejolu M, Huo L, Rohren E, et al. False-positive lesions mimicking breast cancer on FDG PET and PET/CT. AJR Am J Roentgenol. 2012;198:W304–14. 21. Basu S, Chen W, Tchou J, et al. Comparison of triple-negative and estrogen receptor-positive/progesterone receptor-positive/HER2-negative breast carcinoma using quantitative fluorine-18 fluorodeoxyglucose/positron emission tomography imaging parameters: a potentially useful method for disease characterization. Cancer. 2008;112:995–1000. 22. Ueda S, Tsuda H, Asakawa H, et al. Clinicopathological and prognostic relevance of uptake level using 18F-fluorodeoxyglucose positron emission tomography/computed tomography fusion imaging (18F-FDG PET/CT) in primary breast cancer. Jpn J Clin Oncol. 2008;38:250–8. 23. Mavi A, Cermik TF, Urhan M, et al. The effects of estrogen, progesterone, and C-erbB-2 receptor states on 18F-FDG uptake of primary breast cancer lesions. J Nucl Med. 2007;48:1266–72. 24. Zaidi H, Thompson C. Evolution and developments in instrumentation for positron emission mammography. PET Clin. 2009;4:317– 27. 25. Berg WA, Weinberg IN, Narayanan D, et al. High-resolution fluorodeoxyglucose positron emission tomography with compression ("positron emission mammography") is highly accurate in depicting primary breast cancer. Breast J. 2006;12:309–23. 26. Narayanan D, Madsen K, Kalinyak JE, et al. Interpretation of positron emission mammography: feature analysis and rates of malignancy. AJR Am J Roentgenol. 2011;196:956–70. 27. Schilling K, Narayanan D, Kalinyak JE, et al. Positron emission mammography in breast cancer presurgical planning: comparisons with magnetic resonance imaging. Eur J Nucl Med Mol Imaging. 2011;38:23–36. 28. Pinker K, Bogner W, Gruber S, et al. Molecular imaging in breast cancer – potential future aspects. Breast Care (Basel). 2011;6:110– 9. 1. Doutor, Médico Titular do Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 2. Doutor, Médico Responsável pelo Setor de Medicina Nuclear do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 3. Doutor, Médico Diretor do Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 4. Médica Responsável pelo Setor de Imagem da Mama do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 5. Médicas Titulares do Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 6. Mestre, Médico Titular do Departamento de Mastologia do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 7. Mestre, Médica Titular do Departamento de Patologia do A.C.Camargo Cancer Center, São Paulo, SP, Brasil Endereço para correspondência: Dr. Almir Bitencourt Rua Professor Antônio Prudente, 211, Liberdade São Paulo, SP, Brasil, 09015-010 E-mail: almirgvb@yahoo.com.br Recebido para publicação em 11/3/2013. Aceito, após revisão, em 12/12/2013. Trabalho realizado no A.C.Camargo Cancer Center, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554