Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 46 nº 6 - Nov. / Dez. of 2013
Vol. 46 nº 6 - Nov. / Dez. of 2013
|
ARTIGOS DE REVISÃO
|
|
|
|
|
Autho(rs): Chiang Jeng Tyng1; Macello José Sampaio Maciel2; Bruno Lima Moreira2; João Paulo Kawaoka Matushita Jr.2; Almir Galvão Vieira Bitencourt3; Miriam Rosalina Brites Poli4 |
|
|
Descritores: Próstata; Biópsia por agulha; Ultrassonografia de intervenção; Complicações. |
|
|
Resumo: INTRODUÇÃO
Uma série de trabalhos recentes publicados no Brasil tem ressaltado a importância da radiologia intervencionista para coleta de material adequado para o diagnóstico de diversas enfermidades em diferentes órgãos(1-3). As biópsias transretais da próstata guiadas por ultrassonografia (US) são um dos procedimentos mais comumente realizados neste contexto, com alta sensibilidade para o diagnóstico de câncer de próstata. A técnica para biópsia de próstata já foi amplamente estudada, assim como suas indicações e resultados(4,5). Este procedimento é relativamente simples, rápido e seguro, com baixa morbimortalidade. As complicações geralmente são leves, no entanto, alguns cuidados devem ser tomados no preparo dos pacientes para evitar complicações mais graves. Apesar das diretrizes já publicadas(6,7), ainda não há uma padronização dessas condutas em nosso meio, de modo que diferentes tipos de preparo são indicados para realização deste procedimento em diferentes instituições. O objetivo deste trabalho é fazer uma revisão da literatura sobre as complicações relacionadas à biópsia transretal de próstata guiada por US, discutir seu manejo e orientações para reduzir sua incidência. ORIENTAÇÕES PARA PREPARO ANTES DO PROCEDIMENTO Todo paciente que será submetido a este procedimento deve ser previamente orientado e estar ciente de seus riscos e complicações. O preparo dos pacientes para a biópsia prostática transretal guiada por US é um assunto controverso. Antibioticoprofilaxia A antibioticoprofilaxia é recomendada para todos os pacientes antes da biópsia. Este conceito baseia-se no fato de 16% a 100% dos casos de biópsia sem profilaxia apresentarem bacteriúria assintomática ou bacteremia transitória, aumentando o risco de complicações infecciosas como infecção do trato urinário, sepse e síndrome de Fournier(8). O antibiótico utilizado deve ter espectro para bactérias da flora cutânea, do reto e do trato geniturinário. Estudos apontam a Escherichia coli como o principal agente etiológico das infecções após biópsia, sendo também comuns Streptococcus faecalis e bacterioides. O uso de antibióticos de largo espectro é prática comum, porém guidelines devem ser feitos localmente de acordo com o perfil microbiológico, levando em consideração a resistência antibiótica regional. Zani et al. demonstraram, em uma metanálise, que a antibioticoprofilaxia antes da biópsia prostática transretal reduz significativamente o risco de bacteriúria, bacteremia, febre, infecção do trato urinário e hospitalização(9). Não houve diferença significativa entre as vias de administração, seja oral ou sistêmica. Atualmente, as quinolonas (por exemplo: ciprofloxacino) são os antibióticos de escolha, por serem bem absorvidas por via oral e atingirem bons níveis no tecido prostático(10-12). Quanto à duração do regime, não existe consenso. Vários estudos compararam o regime de dose única com o regime de três doses (uma dose 30 a 60 minutos antes do procedimento e continuado por mais 2 dias). Evidências sugerem que dose única é tão efetiva quanto a profilaxia com múltiplas doses(13-15). Considerando todas as evidências descritas na literatura, disponibilidade, conveniência e custo, recomendamos a antibioticoprofilaxia com ciprofloxacino por via oral na dose de 500 mg uma hora antes da biópsia. Nos pacientes com fatores de risco maiores, como diabetes, imunodepressão, uso recente de corticoide, disfunção urinária grave ou volume prostático superior a 75 g, pode-se manter a antibioticoterapia por três dias, apesar de não haver evidências na literatura que justifiquem esta conduta. Em pacientes com histórico de alergia às quinolonas, pode-se utilizar sulfametoxazol-trimetoprim, piperacilina-tazobactam, cefalosporinas ou aminoglicosídeos. A Tabela 1 descreve as doses de antibioticoterapia recomendadas. 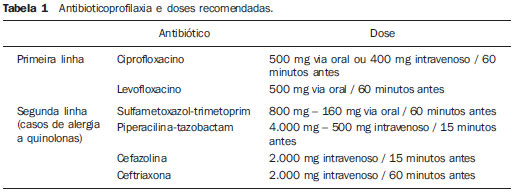 O amplo uso de quinolonas aumentou a taxa de infecções por E. coli resistentes. O uso adicional de aminoglicosídeo intravenoso reduz o risco desta infecção em instituições onde este problema foi documentado(16,17). Pacientes com risco de desenvolver endocardite ou infecção de próteses cardíacas (por exemplo: marcapasso, cardiodesfibriladores implantados) beneficiam-se com o uso associado de ampicilina e gentamicina intravenoso antes do procedimento, seguido de quinolona oral por 2 a 3 dias. Preparo intestinal O preparo intestinal antes da biópsia prostática transretal, seja por enemas, supositórios ou lavagem com polvidine, baseia-se na suposição de que reduziria as complicações infecciosas por bactérias provenientes da ampola retal. Considerando o fato de o reto normalmente conter fezes somente durante o ato defecatório, o uso rotineiro do preparo intestinal pré-biópsia é questionável. Alguns autores acreditam que seu uso pode até aumentar o nível de bactérias no reto por liquefazer as fezes no cólon sigmoide e ainda prejudicar a qualidade das imagens ultrassonográficas pela introdução de ar durante o preparo(18). Evidências demonstram que não houve diferença significativa nas taxas de complicação infecciosa entre pacientes submetidos ou não ao preparo intestinal, desde que realizem antibioticoprofilaxia(18,19). Deste modo, alguns autores defendem que o preparo intestinal aumenta os custos do procedimento e desconforto do paciente, sem benefício adicional. Por este motivo, pacientes submetidos a antibioticoprofilaxia apropriada não necessitam de preparo intestinal pré-biópsia. Anticoagulantes e antiagregantes plaquetários Muitos dos pacientes submetidos a biópsia de próstata apresentam risco cardiovascular aumentado e fazem uso continuado de anticoagulantes ou terapia antiagregante plaquetária. A decisão de suspender ou manter estas terapias deve ser tomada em conjunto com os médicos assistentes, levando-se em consideração os riscos de sangramento e de um evento cardiovascular. Embora estudos prospectivos com pacientes em uso contínuo de ácido acetilsalicílico (AAS) em baixas doses submetidos a biópsia transretal da próstata não demonstrarem aumento das complicações hemorrágicas graves(20,21), a maioria dos urologistas recomenda suspender a terapia. AAS e outros anti-inflamatórios não esteroides devem ser suspensos 3 a 5 dias antes da biópsia, enquanto o clopidogrel precisa ser suspenso 7 dias antes e a ticlopidina, 14 dias antes do procedimento(22,23). Quanto ao uso de terapia anticoagulante com cumarínicos, a falta de evidências sobre as complicações hemorrágicas pós-biópsia nestes pacientes sugere suspender tal terapia 4 a 5 dias antes do procedimento(24,25). Estudos futuros são necessários para mudar esta prática. Conforme o risco de trombose e indicação para anticoagulação, algumas recomendações são necessárias(26). Pacientes com história de tromboembolismo venoso ou arterial agudo no último mês antes da biópsia devem realizar o procedimento em regime de internação e ter substituída a terapia anticoagulante por heparina intravenosa. Pacientes com outras indicações para terapia anticoagulante (por exemplo: válvulas cardíacas metálicas, tromboembolismo venoso recorrente ou fibrilação atrial) e risco menor de eventos embólicos podem ser mudados para heparina subcutânea ou de baixo peso molecular. Anestesia Embora a biópsia transretal da próstata seja geralmente bem tolerada sem o uso de anestesia(27), a dor e ansiedade relacionadas ao procedimento podem causar resultados desfavoráveis e influenciar a decisão do paciente de se submeter a uma nova biópsia. Estudos randomizados demonstraram que o uso somente de anestésicos tópicos não é suficiente(28-30). Deste modo, anestesia local ou sedação devem ser rotineiramente realizados para reduzir o desconforto durante o procedimento, especialmente em pacientes mais jovens e nos procedimentos que requerem um maior número de amostras colhidas. A sedação com um agente hipnótico (por exemplo: midazolam ou propofol) geralmente é realizada e acompanhada pelo anestesista. Esta técnica promove grande satisfação, com aceitação pela maioria dos pacientes, por reduzir o desconforto secundário ao posicionamento do transdutor, reduzir o medo do paciente relacionado ao procedimento e promover ambiente tranquilo para a sua realização(31,32). Todavia, deve-se associar um agente analgésico para prevenir dor pós-operatória, dos quais o fentanil é o mais utilizado. Porém, essa associação não está isenta de riscos, podendo ocorrer casos de depressão respiratória decorrente da interação do fentanil com o propofol(31). É importante que os pacientes candidatos à realização de biópsia com sedação sejam submetidos a uma avaliação pré-anestésica para adequada avaliação do risco cirúrgico e melhor planejamento anestésico. O paciente deve ser adequadamente monitorado durante o procedimento e este deve ser preferencialmente realizado em ambiente hospitalar. Nos casos em que não for realizada sedação, a anestesia local com bloqueio neural periprostático é altamente recomendada. Diversas técnicas foram descritas para realização deste bloqueio, das quais a mais aceita consiste na injeção de cerca de 5 ml de lidocaína 2% com agulha tipo spinal (7 polegadas, 22-gauge), na junção entre as vesículas seminais e a base da próstata, bilateralmente, no trajeto dos nervos periprostáticos (Figura 1). Evidências demonstram que esta técnica permite controle satisfatório da dor, sem aumento da incidência de complicações(32-35). 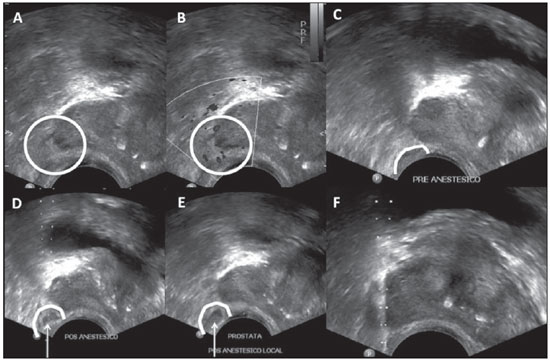 Figura 1. Ultrassonografia demonstrando passo-a-passo da anestesia local para biópsia de próstata pela técnica de bloqueio periprostático. Injeção de lidocaína 2% com agulha tipo spinal na junção entre as vesículas seminais e a base da próstata. A,B: Identificação do ângulo entre a vesícula seminal e a base prostática – modo B (A), estudo Doppler (B). C: Pré-anestesia. D: Durante a injeção do anestésico. E: Pós-anestesia: observa-se conteúdo anecoico no ângulo entre a vesícula seminal e a base brostática. F: Biópsia. Hipertensão arterial sistêmica Não há evidências na literatura demonstrando aumento no risco de complicações após biópsias transretais de próstata em pacientes com níveis pressóricos elevados durante o procedimento. No entanto, existe um aumento teórico no risco de sangramento nestes casos. Além disso, a presença de hipertensão arterial aumenta o risco de eventos cardiovasculares durante procedimentos cirúrgicos. Deve-se ter especial cuidado nos pacientes que realizarão o procedimento sob sedação, já que os anestésicos utilizados podem aumentar a pressão arterial sistêmica e a frequência cardíaca(36,37). Em geral, deve-se evitar a realização do procedimento em pacientes com pressão sistólica superior a 170 mmHg ou pressão diastólica superior a 110 mmHg. Os pacientes que fazem uso crônico de anti-hipertensivos devem manter suas medicações regulares, inclusive no dia do procedimento. A redução dos níveis pressóricos antes do procedimento pode ser realizada com uso de anti-hipertensivos orais ou parenterais. ORIENTAÇÕES APÓS O PROCEDIMENTO Os pacientes devem ser aconselhados sobre repouso, ingesta hídrica, profilaxia antibiótica e acompanhamento após a biópsia. Sempre ao liberar um paciente submetido a biópsia prostática transretal guiada por US, deve-se estar seguro que ele entendeu as potenciais complicações do procedimento, necessitando de reavaliação médica em caso de febre ou outros sinais de infecção, obstrução/retenção urinária ou sangramento persistente. Deve-se lembrar que pacientes com cateter uretral ou diabetes mellitus necessitam de monitoração mais rigorosa em relação a sinais de sepse. COMPLICAÇÕES A biópsia prostática transretal guiada por US é geralmente um procedimento sem complicações e bem tolerado. A taxa de desconforto e complicações maiores não depende do número e local dos disparos feitos com a agulha de biópsia e não tem incidência maior em pacientes submetidos a biópsia inicial ou rebiópsia após algumas semanas(38,39). Complicações menores Pequeno sangramento urinário e/ou retal é esperado após biópsia prostática, sendo geralmente autolimitado, sem necessidade de intervenção. Hematospermia é a queixa mais frequente do paciente (6,5% a 74,4% dos casos), seguida por hematúria (até 14,5% dos casos) e sangramento retal (2,2% dos casos). Estas complicações podem persistir por até duas semanas, com redução progressiva da sua intensidade(40,41). Complicações maiores A taxa de complicações severas relacionadas à biópsia prostática guiada por US é baixa. As complicações graves mais comuns são infecção, hemorragia e obstrução urinária. Hospitalização é necessária em até 1,6% dos pacientes(42). Infecções relacionadas ao procedimento ou episódios febris são relatados em até 6,6% dos casos, com urossepse causada por bactérias aeróbicas em 0,3% dos casos(42). Septicemia por anaeróbios é relatada com pouco frequência. Profilaxia antibiótica antes da biópsia reduz a taxa de infecção do trato urinário, porém alguns pacientes estão sob risco para complicações infecciosas sérias, independente da profilaxia. Os principais fatores de risco preditivos para sepse incluem presença de cateter uretral e diabetes mellitus(43,44). O tratamento da infecção urinária decorrente da biópsia prostática com antibióticos orais (como as quinolonas e o sulfametoxazol-trimetoprim) é geralmente suficiente, embora hospitalização e antibioticoterapia intravenosa podem ser necessárias(42,45). O tratamento antimicrobiano pode ser alterado com base na resposta clínica e o resultado da urocultura e antibiograma. A prostatite bacteriana aguda é relativamente incomum e caracteriza-se por dor perineal, febre, calafrios, sintomas miccionais irritativos (urgência miccional, polaciúria e disúria) e até retenção urinária aguda. Esta complicação deve ser prontamente avaliada e tratada, pelo risco de evoluir para sepse, formação de abscesso prostático e disseminação para órgãos adjacentes como epidídimo e testículo(46). Obstrução/retenção urinária (incluindo obstrução pelo coágulo ou secundária às próprias alterações inflamatórias locais pós-biópsia) é descrita em 0% a 4,6% dos casos(42). A avaliação do resíduo vesical pós-miccional deve ser feita em pacientes sintomáticos. Terapia com bloqueadores alfa-adrenérgicos pode ser iniciada em pacientes com volumes urinários residuais menores que 100 ml, ao passo que a inserção de cateter uretral de pequeno calibre ou cistostomia pode ser necessária em pacientes com maiores volumes residuais. Sangramento retal severo que requer intervenção é complicação rara, ocorrendo em até 1% dos casos(47). O manejo de pacientes com hemorragia importante no momento da biópsia está descrito no algoritmo abaixo. Em pacientes hemodinamicamente estáveis com sangramento retal ativo, compressão digital manual da próstata (ou com o transdutor ultrassonográfico) é a primeira linha de estratégia. Um conjunto de gazes aplicadas no reto pode ser usado(48). À medida que pressão direta é aplicada sobre a próstata, os sinais vitais do paciente são monitorados e os parâmetros da coagulação são conferidos e corrigidos se necessário. A inserção retal de cateter de Foley com balão insuflado (50 ml) mostrou reduzir hemorragia(49); contudo, o uso rotineiro desta técnica para prevenção do sangramento não é defendido, pois causa desconforto indevido em comparação com o benefício limítrofe. De qualquer modo, pode ser usada para controle temporário do sangramento até que seja feita intervenção resolutiva. No caso de o sangramento continuar ativo ou o paciente estiver hemodinamicamente instável, intervenção endoscópica (para injeção de epinefrina ou clipagem) ou cirúrgica (por exemplo: ligadura) deve ser feita(47,50). Qualquer paciente com complicação maior relacionada ao procedimento da biópsia prostática deve ser avaliado e acompanhado por um urologista experiente. 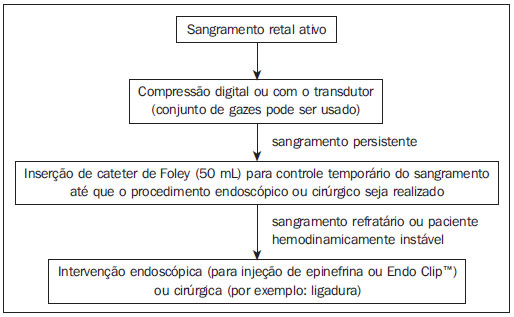 Algoritmo para manejo de sangramento retal ativo pós-biópsia de próstata. CONCLUSÕES Os médicos radiologistas que realizam a biópsia transretal da próstata guiada por US devem conhecer as complicações relacionadas ao procedimento e seu manejo. As orientações para o preparo antes do procedimento são fundamentais para reduzir a incidência de complicações graves. Neste contexto, a antibioticoprofilaxia deve ser realizada rotineiramente. REFERÊNCIAS 1. Chojniak R, Pinto PNV, Tyng CJ, et al. Computed tomography-guided transthoracic needle biopsy of pulmonary nodules. Radiol Bras. 2011;44:315-20. 2. Chojniak R, Grigio HR, Bitencourt AGV, et al. Percutaneous computed tomography-guided core needle biopsy of soft tissue tumors: results and correlation with surgical specimen analysis. Radiol Bras. 2012;45:259-62. 3. Ceratti S, Giannini P, Souza RAS, et al. Ultrasound-guided fine-needle aspiration of thyroid nodules: assessment of the ideal number of punctures. Radiol Bras. 2012;45:145-8. 4. Scherr DS, Eastham J, Ohori M, et al. Prostate biopsy techniques and indications: when, where, and how? Semin Urol Oncol. 2002;20:18-31. 5. Smeenge M, de la Rosette JJ, Wijkstra H. Current status of transrectal ultrasound techniques in prostate cancer. Curr Opin Urol. 2012;22:297-302. 6. Dall'Oglio MF, Crippa A, Faria EF, et al. Diretrizes de câncer de próstata. Rio de Janeiro: Sociedade Brasileira de Urologia; 2011. 7. Rocha LCA, Silva EA, Costa RP, et al. Biópsia de próstata - projeto diretrizes. Sociedade Brasileira de Urologia. Rio de Janeiro: Associação Médica Brasileira e Conselho Federal de Medicina; 2006. 8. Puig J, Darnell A, Bermúdez P, et al. Transrectal ultrasound-guided prostate biopsy: is antibiotic prophylaxis necessary? Eur Radiol. 2006;16:939-43. 9. Zani EL, Clark OA, Rodrigues Netto N Jr. Antibiotic prophylaxis for transrectal prostate biopsy. Cochrane Database Syst Rev. 2011;(5):CD006576. 10. Aron M, Rajeev TP, Gupta NP. Antibiotic prophylaxis for transrectal needle biopsy of the prostate: a randomized controlled study. BJU Int. 2000;85:682-5. 11. Muñoz Vélez D, Vicens Vicens A, Ozonas Moragues M. Antibiotic prophylaxis in transrectal prostate biopsy. Actas Urol Esp. 2009;33:853-9. 12. Bootsma AM, Laguna Pes MP, Geerlings SE, et al. Antibiotic prophylaxis in urologic procedures: a systematic review. Eur Urol. 2008;54:1270-86. 13. Lindstedt S, Lindström U, Ljunggren E, et al. Single-dose antibiotic prophylaxis in core prostate biopsy: impact of timing and identification of risk factors. Eur Urol. 2006;50:832-7. 14. Shigemura K, Tanaka K, Yasuda M, et al. Efficacy of 1-day prophylaxis medication with fluoroquinolone for prostate biopsy. World J Urol. 2005; 23:356-60. 15. Shandera KC, Thibault GP, Deshon GE Jr. Efficacy of one dose fluoroquinolone before prostate biopsy. Urology. 1998;52:641-3. 16. Hori S, Sengupta A, Joannides A, et al. Changing antibiotic prophylaxis for transrectal ultrasound-guided prostate biopsies: are we putting our patients at risk? BJU Int. 2010;106:1298-302. 17. Steensels D, Slabbaert K, De Wever L, et al. Fluoroquinolone-resistant E. coli in intestinal flora of patients undergoing transrectal ultrasound-guided prostate biopsy - should we reassess our practices for antibiotic prophylaxis? Clin Microbiol Infect. 2012;18:575-81. 18. Zaytoun OM, Anil T, Moussa AS, et al. Morbidity of prostate biopsy after simplified versus complex preparation protocols: assessment of risk factors. Urology. 2011;77:910-4. 19. Carey JM, Korman HJ. Transrectal ultrasound guided biopsy of the prostate. Do enemas decrease clinically significant complications? J Urol. 2001;166:82-5. 20. Giannarini G, Mogorovich A, Valent F, et al. Continuing or discontinuing low-dose aspirin before transrectal prostate biopsy: results of a prospective randomized trial. Urology. 2007;70:501-5. 21. Maan Z, Cutting CW, Patel U, et al. Morbidity of transrectal ultrasonography-guided prostate biopsies in patients after the continued use of low-dose aspirin. BJU Int. 2003;91:798-800. 22. Mukerji G, Munasinghe I, Raza A. A survey of the peri-operative management of urological patients on clopidogrel. Ann R Coll Surg Engl. 2009;91:313-20. 23. El-Hakim A, Moussa S. CUA guidelines on prostate biopsy methodology. Can Urol Assoc J. 2010;4:89-94. 24. Ihezue CU, Smart J, Dewbury KC, et al. Biopsy of the prostate guided by transrectal ultrasound: relation between warfarin use and incidence of bleeding complications. Clin Radiol. 2005;60:459-63. 25. Ghani KR, Rockall AG, Nargund VH, et al. Prostate biopsy: to stop anticoagulation or not? BJU Int. 2006;97:224-5. 26. Kearon C, Hirsh J. Management of anticoagulation before and after elective surgery. N Engl J Med. 1997;336:1506-11. 27. Irani J, Fournier F, Bon D, et al. Patient tolerance of transrectal ultrasound-guided biopsy of the prostate. Br J Urol. 1997;79:608-10. 28. Yurdakul T, Taspinar B, Kilic O, et al. Topical and long-acting local anesthetic for prostate biopsy: a prospective randomized placebo-controlled study. Urol Int. 2009;83:151-4. 29. Szlauer R, Gotschl R, Gnad A, et al. Comparison of lidocaine suppositories and periprostatic nerve block during transrectal prostate biopsy. Urol Int. 2008;80:253-6. 30. Song SH, Kim JK, Song K, et al. Effectiveness of local anaesthesia techniques in patients undergoing transrectal ultrasound-guided prostate biopsy: a prospective randomized study. Int J Urol. 2006;13:707-10. 31. Barbosa RAG, Silva CD, Torniziello MYT, et al. Estudo comparativo entre três técnicas de anestesia geral para biópsia de próstata dirigida por ultrassonografia transretal. Rev Bras Anestesiol. 2010;60:457-65. 32. Song JH, Doo SW, Yang WJ, et al. Value and safety of midazolam anesthesia during transrectal ultrasound-guided prostate biopsy. Korean J Urol. 2011;52:216-20. 33. Bingqian L, Peihuan L, Yudong W, et al. Intraprostatic local anesthesia with periprostatic nerve block for transrectal ultrasound guided prostate biopsy. J Urol. 2009;182:479-83. 34. Ashley RA, Inman BA, Routh JC, et al. Preventing pain during office biopsy of the prostate: a single center, prospective, double-blind, 3-arm, parallel group, randomized clinical trial. Cancer. 2007;110:1708-14. 35. Kuppusamy S, Faizal N, Quek KF, et al. The efficacy of periprostatic local anaesthetic infiltration in transrectal ultrasound biopsy of prostate: a prospective randomised control study. World J Urol. 2010;28:673-6. 36. Wolfsthal SD. Is blood pressure control necessary before surgery? Med Clin North Am. 1993;77:349-63. 37. Eagle KA, Berger PB, Calkins H, et al. ACC/AHA guideline update for perioperative cardiovascular evaluation for noncardiac surgery - executive summary a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Update the 1996 Guidelines on Perioperative Cardiovascular Evaluation for Noncardiac Surgery). Circulation. 2002;105:1257-67. 38. Rodríguez LV, Terris MK. Risks and complications of transrectal ultrasound guided prostate needle biopsy: a prospective study and review of the literature. J Urol. 1998;160:2115-20. 39. Djavan B, Waldert M, Zlotta A, et al. Safety and morbidity of first and repeat transrectal ultrasound guided prostate needle biopsies: results of a prospective European prostate cancer detection study. J Urol. 2001;166:856-60. 40. Ecke TH, Gunia S, Bartel P, et al. Complications and risk factors of transrectal ultrasound guided needle biopsies of the prostate evaluated by questionnaire. Urol Oncol. 2008;26:474-8. 41. Loeb S, Carter HB, Berndt SI, et al. Complications after prostate biopsy: data from SEER-Medicare. J Urol. 2011;186:1830-4. 42. Chiang IN, Chang SJ, Pu YS, et al. Major complications and associated risk factors of transrectal ultrasound guided prostate needle biopsy: a retrospective study of 1875 cases in Taiwan. J Formos Med Assoc. 2007;106:929-34. 43. Simsir A, Kismali E, Mammadov R, et al. Is it possible to predict sepsis, the most serious complication in prostate biopsy? Urol Int. 2010;84:395-9. 44. Lange D, Zappavigna C, Hamidizadeh R, et al. Bacterial sepsis after prostate biopsy - a new perspective. Urology. 2009;74:1200-5. 45. Lindert KA, Kabalin JN, Terris MK. Bacteremia and bacteriuria after transrectal ultrasound guided prostate biopsy. J Urol. 2000;164:76-80. 46. Sharp VJ, Takacs EB, Powell CR. Prostatitis: diagnosis and treatment. Am Fam Physician. 2010;82:397-406. 47. Brullet E, Guevara MC, Campo R, et al. Massive rectal bleeding following transrectal ultrasound-guided prostate biopsy. Endoscopy. 2000;32:792-5. 48. Maatman TJ, Bigham D, Stirling B. Simplified management of post-prostate biopsy rectal bleeding. Urology. 2002;60:508. 49. Kilciler M, Erdemir F, Demir E, et al. The effect of rectal Foley catheterization on rectal bleeding rates after transrectal ultrasound-guided prostate biopsy. J Vasc Interv Radiol. 2008;19:1344-6. 50. Braun KP, May M, Helke C, et al. Endoscopic therapy of a massive rectal bleeding after prostate biopsy. Int Urol Nephrol. 2007;39:1125-9. 1. Mestre, Titular Responsável pelo Setor de Intervenção do Departamento de Imagem do A. C. Camargo Cancer Center, São Paulo, SP, Brasil 2. Médicos Residentes do Departamento de Imagem do A. C. Camargo Cancer Center, São Paulo, SP, Brasil 3. Doutor, Titular do Departamento de Imagem do A. C. Camargo Cancer Center, São Paulo, SP, Brasil 4. Médica, Titular Responsável pelo Setor de Ultrassonografia do Departamento de Imagem do A. C. Camargo Cancer Center, São Paulo, SP, Brasil Endereço para correspondência: Dr. Chiang Jeng Tyng A. C. Camargo Cancer Center Rua Professor Antônio Prudente, 211, Liberdade São Paulo, SP, Brasil, 01509-010 E-mail: chiangjengtyng@gmail.com Recebido para publicação em 13/4/2013. Aceito, após revisão, em 7/6/2013. Trabalho realizado no A. C. Camargo Cancer Center, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554