Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 46 nº 5 - Set. / Out. of 2013
Vol. 46 nº 5 - Set. / Out. of 2013
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Patrick Bastos Metzger1; Eduardo Rafael Novero2; Fabio Henrique Rossi3; Samuel Martins Moreira4; Frederico Augusto Linhares5; Bruno Lorenção de Almeida6; Heraldo Antônio Barbato7; Nilo Mitsuru Izukawa8; Antonio Massamitsu Kambara9 |
|
|
Descritores: Aneurisma; Prótese vascular; Angiografia. |
|
|
Resumo: INTRODUÇÃO
O método de imagem ideal para a preparação de uma correção endovascular aórtica deve permitir a avaliação do diâmetro do vaso, das características da parede aórtica e das artérias ilíacas, assim como avaliar os colos proximais e distais das regiões próximas da doença a ser tratada. Desde o desenvolvimento da técnica por Seldinger et al. em 1953, a angiografia (AG) foi considerada, até recentemente, o método padrão para o diagnóstico de enfermidades aórticas. O estudo angiográfico corresponde à injeção de meio de contraste no sistema vascular, para sua visualização com o uso de raios-x(1), sendo capaz de mapear toda a aorta, fornecendo informações precisas sobre seus ramos, orifícios de entrada, reentrada, zonas de ruptura e ulcerações. O maior benefício da aortografia é determinar a relação do aneurisma ou do flap aórtico com os vasos do arco, além de permitir o diagnóstico de insuficiência aórtica e a presença de alteração cefálica do óstio coronário. Está indicada para pacientes com idade maior que 40 anos, com a finalidade de diagnosticar doenças coronarianas concomitantes. Proporciona a avaliação do lúmen do vaso, não avaliando sua parede, bem como a presença de trombos murais, sendo este um diagnóstico sugestivo(2). A AG apenas não é suficiente para dar todos os subsídios necessários para uma correção endovascular de doença aórtica(3-6). Atualmente, a angiotomografia (ATG) multislice é o exame de eleição para o diagnóstico e avaliação topográfica da aorta, pois está disponível em muitos centros e apresenta altas sensibilidade e especificidade, além de ser realizada de forma rápida e pouco invasiva(7-9). A ATG pode fornecer informações sobre: estruturas adjacentes à aorta, espessura da parede ventricular, presença de calcificação das coronárias, derrame pericárdico, dimensões da aorta e extensão comprometida, presença de trombos, características da parede aórtica, suas delaminações, hematomas, ulcerações, principais ramificações e oclusões(2). Em nossa instituição, todos os pacientes candidatos a correção endovascular são avaliados com ATG pré-operatória, sendo a AG complementar e opcional. O objetivo deste trabalho foi avaliar a utilização da AG associada à ATG pré-intervenção, comparada com apenas à ATG nas seguintes variáveis: sucesso técnico, sucesso terapêutico, complicações, cálculo correto das endopróteses e mortalidade. MATERIAIS E MÉTODOS Tipo de estudo Delineou-se um estudo retrospectivo, longitudinal, observacional e comparativo, realizado em um centro de referência para doenças cardiovasculares em São Paulo, SP, no período de janeiro de 2009 a julho de 2010. Foram avaliados 156 pacientes submetidos a reparo endovascular de doenças da aorta abdominal e torácica. Esta população foi dividida em dois grupos: grupo 1 (G1) - intervenções na aorta torácica; grupo 2 (G2) - intervenções na aorta abdominal. O G1 foi subdividido em 1A (pacientes que realizaram aortografia e ATG pré-operatórias) e 1B (pacientes que foram submetidos apenas à ATG). O G2 foi subdividido em 2C e 2D, correspondendo aos pacientes submetidos no pré-operatório a ATG + AG e apenas à ATG, respectivamente (Figura 1). 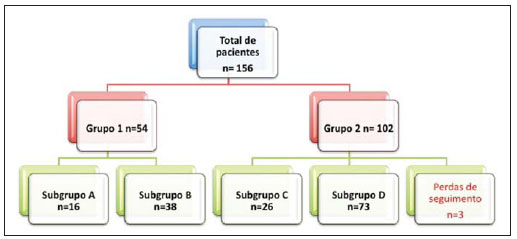 Figura 1. Organograma da distribuição populacional. Critérios de inclusão e exclusão Foram incluídos neste estudo pacientes de ambos os sexos, assintomáticos ou sintomáticos, com indicação de correção das seguintes enfermidades aórticas(4,10-12): 1 - Aneurisma de aorta abdominal com diâmetro maior que 55 mm no sexo masculino, ou 50 mm no sexo feminino. 2 - Vazamento tipo I ou tipo III em pacientes tratados previamente. 3 - Aneurisma de aorta torácica com diâmetro maior que 55 mm. 4 - Dissecção tipo B de Stanford crônica com dilatação aneurismática maior que 55mm, ou correção de vazamentos tipo I ou III. 5 - Pseudoaneurisma de aorta torácica. 6 - Úlcera penetrante de aorta torácica, com mais de 2 cm de diâmetro e 1 cm de profundidade. Foram excluídos do estudo pacientes com extensão do colo proximal menor que 15 mm, presença de trombo ou calcificação superior a 50% do diâmetro do colo, angulação do colo proximal superior a 65º, angulação da bifurcação aortoilíaca maior que 90º, diâmetro das artérias ilíacas externas menor que 7 mm, creatinina sérica maior que 2,0 mg/dl ou clearance de creatinina menor que 30 ml/min. Os pacientes que se adequaram aos critérios de inclusão e exclusão foram encaminhados para tratamento endovascular consecutivamente. A avaliação do risco cardiológico e/ou anestésico não foi considerada na inclusão ou exclusão dos pacientes. O diagnóstico e a programação terapêutica foram baseados em ATG em todos os casos, sendo a arteriografia pré-operatória um método diagnóstico opcional. Todas as tomografias foram reconstruídas no software Osirix® em modo tridimensional e em modo reconstrução multiplanar, sendo então obtidos os diâmetros, angulações e extensões do colo aórtico proximal, do aneurisma e da bifurcação aortoilíaca (Figuras 2, 3, 4 e 5). 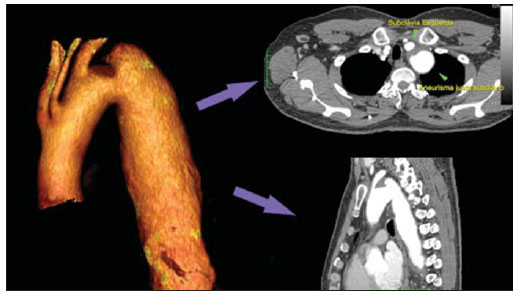 Figura 2. Angiotomografia com reformatação tridimensional e cortes axial e sagital da angiotomografia. Aneurisma torácico justa-subclávia em arco aórtico tipo 3. 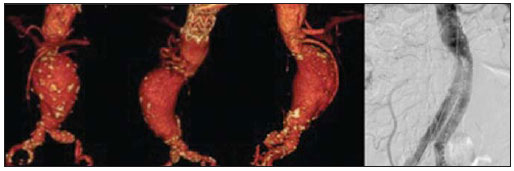 Figura 3. A: Angiotomografia de aneurisma aórtico abdominal com angulação de colo aneurismatico proximal maior que 65° e bifurcação aortoilíaca maior que 90°. B: Correção endovascular com a endoprótese aórtica. 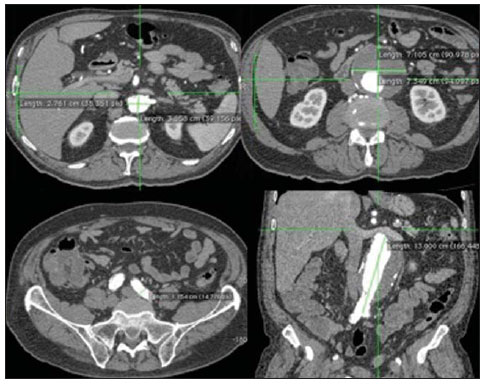 Figura 4. Angiotomografia de aorta abdominal com reconstrução multiplanar. A: Medida do colo aórtico proximal. B: Medida da perna ilíaca esquerda. C: Medida do maior diâmetro aórtico. D: Medida da extensão do aneurisma aórtico abdominal. 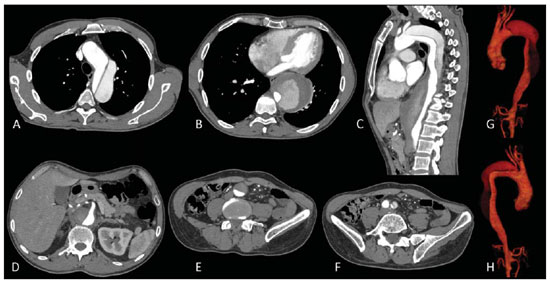 Figura 5. Angiotomografia com reconstrução multiplanar e tridimensional. A: Corte axial demonstrando a porta de entrada da dissecção ao nível de origem de artéria subclávia esquerda. B: Maior diâmetro da aorta. C: Corte sagital. D: Artéria mesentérica superior com origem na luz verdadeira. E: Acometimento da aorta abdominal. F: Dissecção ao nível de artéria ilíaca esquerda. G: Reconstrução tridimensional em oblíqua anterior esquerda. H: Reconstrução tridimensional em oblíqua anterior direita. Técnica cirúrgica Todos os procedimentos foram realizados em um centro de referência para doenças cardiovasculares - Instituto Dante Pazzanese de Cardiologia - São Paulo, SP. Os pacientes foram tratados sob anestesia geral inalatória. A profilaxia antimicrobiana foi realizada com 1,5 g de cefuroxima, no momento da indução anestésica. A abordagem preferencial foi a artéria femoral comum, uni ou bilateral, assim como pela artéria braquial esquerda, conforme o tipo de intervenção ou endoprótese escolhida. Na impossibilidade desta, foi realizada abordagem da artéria ilíaca externa ou comum por acesso retroperitoneal. O controle radiográfico foi realizado com aparelho Artis flat panel (Siemens; Munique, Alemanha). A arteriografia intraoperatória foi realizada em todos os pacientes (Figura 6). O pós-operatório imediato foi realizado em unidade de terapia intensiva em todos os casos. 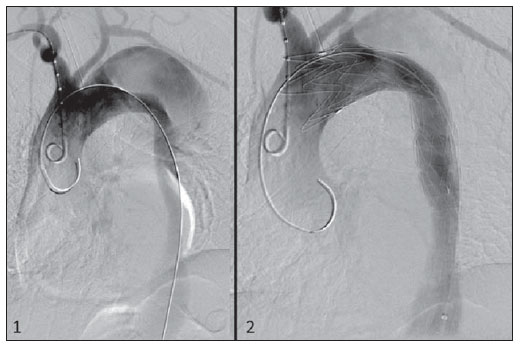 Figura 6. 1: Aortografia intraoperatória demonstrando dissecção aórtica tipo B de Stanford em um arco aórtico tipo II, bovino. 2: Correção endovascular de dissecção tipo B de Stanford com presença de vazamento tipo Ia. Acompanhamento pós-operatório Os pacientes foram acompanhados com avaliação ambulatorial com 15, 30, 180 e 360 dias do procedimento. Após o primeiro ano, as consultas passaram a ser realizadas anualmente. ATG foi realizada no primeiro mês e no décimo segundo mês de seguimento ambulatorial. A ultrassonografia color Doppler foi realizado quando houve contraindicação à realização da ATG. Desfechos primários e secundários 1 - Sucesso técnico: quando o objetivo de liberar a endoprótese na área acometida foi cumprido, com ou sem vazamentos ou outras intercorrências que influenciassem na evolução favorável da doença aórtica. 2 - Sucesso terapêutico: quando a liberação da endoprótese ocorreu sem vazamentos ou outras intercorrências que repercutissem na evolução favorável da doença aórtica. 3 - Mortalidade perioperatória: quantidade de óbitos registrados dentro dos primeiros 30 dias pós-procedimento. 4 - Mortalidade anual: quantidade de óbitos ocorridos dentro dos 12 meses de acompanhamento. 5 - Complicações periprocedimento: a) intraoperatórias - as complicações ocorridas na sala de hemodinâmica, durante a intervenção; b) perioperatórias - as complicações ocorridas durante a internação, fora da sala de hemodinâmica e dentro dos 30 dias após intervenção. Definições 1 - Vazamento inicial ou primário: originado durante o procedimento inicial ou diagnosticado dentro dos primeiros 30 dias. 2 - Precisão do cálculo das endopróteses: comparação da prótese programada, de acordo com a medição pré-operatória, com a prótese utilizada. Quando a prótese programada foi igual à utilizada, considerouse um cálculo coincidente. Quando houve diferença de mais de 2 mm no diâmetro e 20 mm no comprimento entre a prótese programada e a utilizada, foi considerado um cálculo aproximado. Nos casos em que houve uma maior diferença no diâmetro e comprimento citados previamente, o cálculo foi considerado como diferente. Este critério utilizado, apesar de ainda não ter sido validado na literatura, corresponde aos critérios empregados universalmente na prática diária dos médicos intervencionistas que tratam das intervenções endovasculares das doenças aórticas. Análise estatística Para verificar a associação entre as variáveis qualitativas, foi usado o teste exato de Fisher ou o teste qui-quadrado. Foi utilizado o gráfico de Kaplan-Meier para análise de sobrevivência. Para verificar se houve diferença entre as curvas de sobrevida, foi utilizado o teste de log-rank. O nível de significância adotado foi 5% (p < 0,05). RESULTADOS Foram incluídos no estudo 156 pacientes submetidos a correção de doenças aórticas. O G1 foi composto por 54 pacientes, dos quais 16 realizaram ATG e AG (subgrupo A) e 38 realizaram apenas ATG (subgrupo B). A idade média dos pacientes foi 62,4 ± 8 anos, sendo 61% do sexo masculino. Os pacientes apresentavam-se assintomáticos em 24 casos (44%). O fator de risco predominante foi a hipertensão arterial sistêmica (100%), 10 pacientes (5,4%) eram diabéticos, 28 (15,1%) eram tabagistas e 21 (11,3%) eram portadores dislipidemia. A obesidade (índice de massa corpó-Tabela 1 Dados clínicos da população estudada (n = 156). rea maior que 40) estava presente em 4 pacientes (2,1%) da população estudada (Tabela 1) 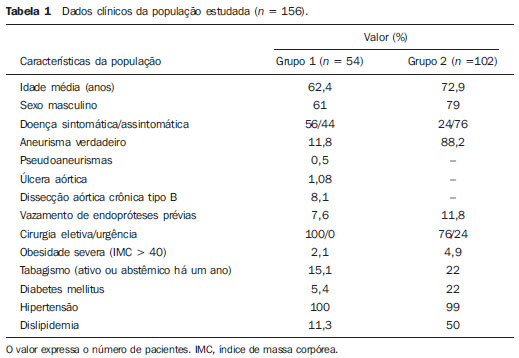 Entre as comorbidades, notamos alta incidência de cardiopatia isquêmica (10,8%). Em menor grau, insuficiência renal crônica (6,4%) e acidente vascular encefálico (3,7%) também estiveram presentes. Observamos uma porcentagem significativa de pacientes com procedimentos cirúrgicos aórticos prévios (9,7%) (Tabelas 1 e 2). 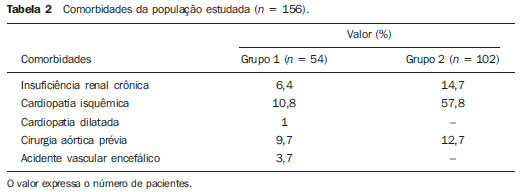 As indicações de tratamento endovascular nesta população foram distribuídas da seguinte forma: AAT verdadeiros em 22 casos (11,8%), vazamentos de endopróteses prévias em 14 casos (7,6%), úlcera penetrante de aorta em 2 casos (1,08%), pseudoaneurisma em 1 caso (0,5%) e dissecção crônica tipo B em 15 casos (8,1%). Todos os pacientes foram tratados de forma eletiva, sob anestesia geral inalatória, com drenagem liquórica seletiva. Todos os pacientes do subgrupo A tiveram sucesso técnico, enquanto no subgrupo B houve sucesso técnico em 36 pacientes (94,7%), de modo que, em 2 pacientes, não foi possível avançar e posicionar a endoprótese no local desejado (p = 1). O sucesso terapêutico no subgrupo submetido a ATG + AG foi 81% (13 pacientes). Neste, 3 pacientes apresentaram vazamentos ou intercorrências que repercutissem na evolução favorável da doença aórtica (19%). No subgrupo B, 22 casos tiveram sucesso terapêutico (58%) (p = 0,13). A taxa de complicações do subgrupo A foi 12% (2 pacientes) e no subgrupo B foi 42% (16 pacientes) (p = 0,057). As complicações foram assim divididas: subgrupo 1A - a) intraoperatória: 1 caso de lesão da artéria femoral; b) periprocedimento: 1 caso de insuficiência renal aguda; subgrupo 1B - a) intraoperatória: 1 caso de embolia periférica, 6 casos de lesão femoral, 1 caso de oclusão de artéria subclávia esquerda; b) periprocedimento: 2 casos de hematoma retroperitoneal, 2 casos de insuficiência renal aguda, 2 casos de paraplegia e 1 óbito. A precisão do cálculo da prótese foi maior no grupo que possuía ATG + AG (p = 0,065). Nesse grupo, 87,5% dos pacientes apresentaram coincidência entre a prótese calculada e a utilizada, e apenas 1 paciente obteve um cálculo aproximado. Não houve casos de cálculos diferentes. No grupo que realizou apenas ATG, houve coincidência entre a prótese solicitada e a utilizada em 18 casos (47%), e em 10 casos (26%) o cálculo foi aproximado (Tabela 3). 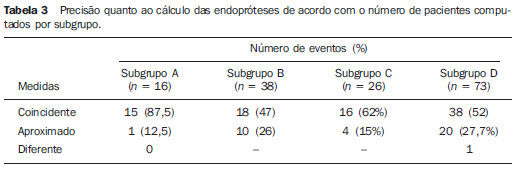 Não houve óbitos no subgrupo 1A, enquanto no subgrupo 1B houve 4 óbitos durante o acompanhamento anual (10,5%) (p = 0,936) (Figura 7). 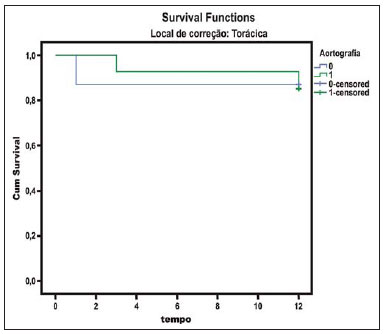 Figura 7. Curva de sobrevida anual Kaplan-Meier do grupo 1. Grupo 1A em azul, grupo 1B em verde. No G2 foram incluídos 102 pacientes, dos quais 3 perderam o acompanhamento. Destes, 26 (25,4%) foram avaliados no período pré-operatório com ATG + AG (subgrupo 2C) e 73 realizam apenas ATG (subgrupo 2D). A idade média foi 72,9 anos, sendo 79% do sexo masculino. Apresentaram-se assintomáticos 76% dos casos. O fator de risco predominante foi a hipertensão arterial sistêmica em 100 pacientes (99%), 23 pacientes (22%) eram tabagistas e 51 pacientes (50%) apresentavam dislipidemia. A diabetes mellitus esteve presente em 23 casos (22%) e a obesidade (índice de massa corpórea maior que 40), em 5 pacientes (4,9%) (Tabela 1). Entre as comorbidades presentes, encontramos alta incidência de cardiopatia isquêmica (57,8%) e, em menor grau, insuficiência renal crônica (14,7%). Treze pacientes (12,7%) possuíam cirurgias aórticas prévias. As indicações de tratamento endovascular nesta população foram distribuídas da seguinte forma: aneurisma de aorta abdominal em 88,2% e vazamentos em 11,8%. Aproximadamente um quarto dos pacientes (24%) foi tratado em caráter de urgência, devido a sintomas de alarme. Houve sucesso técnico em 92,3% no subgrupo 2C e em 98,6% no subgrupo 2D (p = 0,17), ao passo que o sucesso terapêutico esteve presente em 73% e 98,6%, respectivamente (p = 0,79). A taxa de complicações do subgrupo 2C foi 23% (6 pacientes) e no subgrupo 2D foi 77% (56 pacientes) (p = 1,0). As complicações foram assim divididas: subgrupo 2C - a) intraoperatória: 3 casos de sangramentos de ferida operatória, 1 caso de lesão de artéria femoral e 1 caso de embolia periférica; subgrupo 2D - a) intraoperatória: 3 casos de sangramentos de ferida operatória, 1 caso de oclusão de artéria renal, 1 caso de lesão de artéria femoral e 1 caso de embolia periférica; b) periprocedimento: 2 casos de insuficiência renal aguda. A precisão do cálculo da endoprótese no subgrupo 2C foi coincidente entre a endoprótese programada e a utilizada em 16 pacientes (62%), aproximada em 4 pacientes (15%), e em 6 pacientes não foi possível realizar esta avaliação (23%). Por sua vez, no subgrupo 2D, a precisão foi coincidente em 38 pacientes (52%), aproximada em 20 pacientes (27,7%) e diferente em 1 paciente. Em 14 pacientes não foi possível realizar esta avaliação (p = 0,46) (Tabela 3). A mortalidade anual do subgrupo 2C foi 14,3% e no subgrupo 2D, 11,3% (Figura 8). A sobrevida global anual do G1 foi 86,7% e no G2 foi 87,8%. 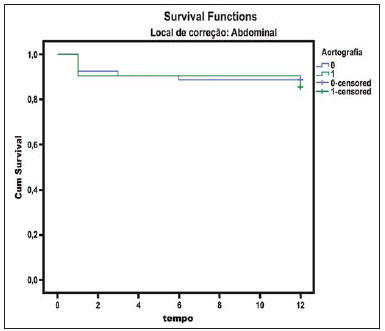 Figura 8. Curva de Kaplan-Meier de sobrevida do grupo 2. Subgrupo 2C em verde, subgrupo 2D em azul. DISCUSSÃO A ATG pré-operatória, associada ou não a arteriografia, é o método padrão para o estudo das doenças aórticas(4,11). Este estudo avaliou o uso da aortografia pré-operatória como ferramenta útil para obtenção do tratamento adequado. Na amostra analisada, o número de AGs pré-intervenção foi maior no G1 em relação ao G2 (29,6% versus 25,4%). Observamos que a porcentagem de medições coincidentes nos casos em quem foi realizada a aortografia torácica foi 87,5%, contra 47% nos quais esta não foi realizada. O número de cálculos aproximados foi menor na população torácica com AG (6,3% versus 26%, com p = 0,065). Uma mostra populacional maior talvez aumentasse o nível de significância estatística aqui encontrada. O estudo angiográfico do arco aórtico, aorta torácica descendente e aorta abdominal evidencia alterações como estenoses, dilatações, ulcerações e variações anatômicas, porém está associado a maior morbidade e menor definição de imagem para determinação da presença de calcificações, tortuosidades e estenoses ostiais, quando comparada com a ATG. Isso se deve ao fato que a AG é um estudo biplanar da luz arterial, enquanto a ATG é realizada em três dimensões(13,14). O êxito da correção endovascular depende da avaliação anatômica e morfológica da parede (calcificações e trombos), assim como da correta obtenção das medidas de diâmetro e comprimento dos colos de aterrissagem proximais e distais. A porcentagem de coincidência no cálculo da endoprótese foi maior no G1 que no G2. Este último possui maior taxa de cálculos aproximados. Isto demonstra que, no estudo das afecções da aorta torácica, a arteriografia pré ou intraoperatória pode ser um recurso útil para uma melhor programação da intervenção. Portanto, quando avaliamos os colos proximal e distal de um aneurisma, observamos que na medição do diâmetro a tomografia é o melhor método, uma vez que tanto na AG digital por subtração como na angiorressonância magnética o diâmetro é identificado através da coluna de contraste, subestimando seu verdadeiro valor. Por sua vez, a AG com cateter centimetrado é mais precisa na medição do comprimento do colo, na extensão do aneurisma e no melhor ponto de liberação da endoprótese, seja com o objetivo de oclusão do orifício de entrada nas dissecções, bem como nas liberações próximas a ramos do tronco supra-aórtico. Nas doenças da aorta abdominal, os cortes axiais da ATG não são adequados para avaliação de segmentos ilíacos, uma vez que estes vasos apresentam inclinações tanto no plano coronal quanto no sagital. A reformatação e a apresentação de imagens nos planos coronais, sagitais e tridimensionais permitem uma melhor avaliação. A qualidade destas reconstruções de imagens dependem do cuidado oneroso de pós-processamento(15,16), por isso a arteriografia tem maior valor no cálculo e no planejamento das extensões das pernas contra ou ipsilaterais, em razão das tortuosidades frequentemente encontradas nestes casos. Variáveis como sucesso técnico, sucesso terapêutico e mortalidade não mostraram, no G1 e no G2, marcadores estatísticos de relevância que possam sugerir que a combinação de ATG + AG apresenta alguma vantagem em relação à realização de apenas a ATG. Quanto às complicações, no G2 observamos 2 pacientes com obstruções iliacofemorais, sendo que apenas um possuía AG pré-intervenção. Por sua vez, no G1, 7 pacientes apresentaram lesões iliacofemorais, dos quais 6 não haviam sido avaliados com AG pré-operatória. Observamos também que, em ambos grupos, os pacientes preparados de forma pré-operatória com dois exames de imagem apresentaram menor incidência de complicações. No G1, o número populacional limita a significância estatística (p = 0,057). Deve-se destacar que quanto maior a distância percorrida pelo sistema de liberação da endoprótese, maiores serão os obstáculos anatômicos a serem vencidos e, portanto, maiores as possibilidades de complicações. As distâncias percorridas pelos sistemas de liberação foram maiores no G1 quando comparado ao G2, devendo superar as frequentes distorções anatômicas torácicas e ilíacas, assim como a maior tortuosidade do arco aórtico. A AG digital continua sendo o método padrão para o estudo dos ramos parietais como, por exemplo, as artérias brônquicas, as intercostais e as nutrientes da medula espinhal(17-20). Isto tem implicação na taxa de complicações. No G1 observamos 2 casos de paraplegia permanente, sendo que estes pacientes foram avaliados pré-operatoriamente apenas com ATG. Com o advento de novas tecnologias de imagem empenhadas em oferecer melhor precisão nos planejamentos terapêuticos endovasculares, o ultrassom intravascular tem sido realizado em conjunto com a AG. O ultrassom intravascular é um excelente método para a avaliação da parede do vaso. A parede intensamente calcificada é preditora de vazamentos, enquanto a aderência da prótese a trombos parietais pode dar a falsa ideia de fixação, predispondo assim a migrações com consequente vazamento tardio. Apesar de o ultrassom intravascular não demonstrar diminuição de vazamentos nas correções das endopróteses aórticas, ele pode ser um instrumento útil na avaliação de zonas de aterrissagem mais complexas, seja pela anatomia tortuosa ou pela necessidade de precisão de liberação dos dispositivos devido à preservação de ramos viscerais(21). Finalmente, a avaliação dos vazamentos em tempo real com a AG permite observar o volume de perda ou vazamento, inclusive em vazamentos tipo IV, os quais são sugeridos de forma indireta pela tomografia, pelo aumento do saco aneurismático sem a presença dos demais tipos de vazamentos, levando à tomada de condutas no momento da aquisição de imagens. Limitações do estudo Este estudo apresenta limitações decorrentes do pequeno número de pacientes analisados, de seu caráter retrospectivo, da realização de uma comparação não randomizada entre os grupos, assim como a utilização de critérios de avaliação da mensuração da endoprótese ainda não validados na literatura. Isso limita a sua conclusão e a comparação com estudos maiores. CONCLUSÕES Em nosso estudo, a aortografia pré-operatória na avaliação de doenças aórticas abdominais não influenciou na escolha entre a prótese calculada no pré-operatório e a utilizada, assim como não modificou os desfechos analisados. No grupo de pacientes com doenças da aorta torácica, a arteriografia pré-operatória conduziu a uma maior coincidência entre a prótese calculada no pré-operatório e a utilizada, porém os desfechos analisados, também, não foram alterados. Portanto, em nosso estudo, concluímos que o estudo angiográfico diagnóstico deve ser reservado aos casos em que a ATG não é capaz de dar todas as informações com segurança para o planejamento de uma intervenção terapêutica, ou quando existam adversidades anatômicas para se conseguir o objetivo do tratamento desejado. REFERÊNCIAS 1. Met R, Bipat S, Legemate DA, et al. Diagnostic performance of computed tomography angiography in peripheral arterial disease: a systematic review and meta-analysis. JAMA. 2009;301:415-24. 2. Albuquerque LC, Palma JH, Braile DM, et al. Diretrizes para a cirurgia das doenças da aorta. Arq Bras Cardiol. 2004;82(Supl V):35-50. 3. Nyman R, Eriksson MO. The future of imaging in the management of abdominal aortic aneurysm. Scand J Surg. 2008;97:110-5. 4. Turina MI, Shennib H, Dunning J, et al; EACTS/ESCVS Committee. EACTS/ESCVS best practice guidelines for reporting treatment results in the thoracic aorta. Eur J Cardiothorac Surg. 2009;35:927-30. 5. Svensson LG, Kouchoukos NT, Miller DC, et al; Society of Thoracic Surgeons Endovascular Surgery Task Force. Expert consensus document on the treatment of descending thoracic aortic disease using endovascular stent grafts. Ann Thorac Surg. 2008;85(1 Supp):S1-41. 6. Albrecht T, Foert E, Holtkamp R, et al. 16-MDCT angiography of aortoiliac and lower extremity arteries: comparison with digital subtraction angiography. AJR Am J Roentgenol. 2007;189:702-11. 7. Juvonen T, Ergin MA, Galla JD, et al. Risk factors for rupture of chronic type B dissections. J Thorac Cardiovasc Surg. 1999;117:776-86. 8. Akutsu K, Nejima J, Kiuchi K, et al. Effects of the patent phase lumen on the long-term outcome of type B acute aortic dissection. Eur J Cardiothorac Surg. 2004;26:359-66. 9. Nienaber CA, von Kodolitsch Y, Petersen B, et al. Intramural hemorrhage of the thoracic aorta: diagnostic and therapeutic implications. Circulation. 1995;92:1465-72. 10. Nienaber CA, Rousseau H, Eggebrecht H, et al. Randomized comparison of strategies for type B aortic dissection: INvestigation of STEnt Grafts in Aortic Dissection (INSTEAD) trial. Circulation. 2009;120;2519-28. 11. Chaikof EL, Brewster DC, Dalman RL, et al. The care of patients with an abdominal aortic aneurysm: the Society for Vascular Surgery practice guidelines. J Vasc Surg. 2009;50(4 Suppl):S2-49. 12. Leurs LJ, Bell R, Degrieck Y, et al.; EUROSTAR; UK Thoracic Endograft Registry collaborators. Endovascular treatment of thoracic aortic diseases: combined experience from the EUROSTAR and United Kingdom Thoracic Endograft registries. J Vasc Surg. 2004;40:670-80. 13. Almeida MO, Baroni RH, Aun R, et al. Próteses endovasculares em aneurisma da aorta: avaliação pela angiotomografia. Rev Imagem. 2004;26:133-9. 14. Rodrigues S, Abrantes AF, Ribeiro LP, et al. Estudo da dose nos exames de tomografia computadorizada abdominal em um equipamento de 6 cortes. Radiol Bras. 2012;45:326-33. 15. Carroccio A, Faries PL, Morrissey NJ, et al. Predicting iliac limb occlusions after bifurcated aortic stent grafting: anatomic and device-related causes. J Vasc Surg. 2002;36:679-84. 16. Novero ER, Metzger PB, Angelieri FMR, et al. Correção endovascular do aneurisma da aorta abdominal: análise dos resultados de único centro. Radiol Bras. 2012;45:1-6. 17. Cinà CS, Abouzahr L, Arena GO, et al. Cerebrospinal fluid drainage to prevent paraplegia during thoracic and thoracoabominal aortic aneurysm surgery: a systemic review and meta-analysis. J Vasc Surg. 2004;40:36-44. 18. Biglioli P, Roberto M, Cannata A, et al. Upper and lower spinal cord blood supply: the continuity of the anterior spinal artery and the relevance of the lumbar arteries. J Thorac Cardiovasc Surg. 2004;127:1188-92. 19. Novero ER, Metzger PB, Obregon J, et al. Tratamento endovascular das doenças da aorta torácica: análise dos resultados de um centro. Radiol Bras. 2012;45:251-8. 20. Metzger PB, Fontes DCC, Novero ER, et al. Tratamento endovascular da dissecção crônica de aorta tipo B complicada. Rev Bras Cardiol Invasiva. 2012;20:184-90. 21. Arko FR, Murphy EH, Davis CM 3rd, et al. Dynamic geometry and wall thickness of the aortic neck of abdominal aortic aneurysms with intravasculat ultrasonography. J Vasc Surg. 2007;46:891-7. 1. Cirurgião Vascular e Endovascular, Doutorando, Médico Assistente no Setor de Radiologia Intervencionista do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil 2. Médico Cardiologista Intervencionista, Aprimorando Estrangeiro do Centro de Intervenções Endovasculares (CIEV) do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil, Hemodinamicista na Cidade de Santa Fé, Argentina 3. Doutor, Médico Assistente da Seção Médica de Cirurgia Vascular do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil 4. Cirurgião Vascular e Endovascular, Médico Assistente do Setor de Radiologia Intervencionista do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil 5. Médico Cirurgião Vascular, Aprimorando do Centro de Intervenções Endovasculares (CIEV) do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil 6. Cirurgião Vascular e Endovascular, Doutorando, Médico Assistente do Setor de Radiologia Intervencionista do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil 7. Cirurgião Vascular, Endovascular e Angiorradiologista, Médico Assistente da Sessão Médica de Cirurgia Vascular do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil 8. Doutor, Chefe da Seção Médica de Cirurgia Vascular do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil 9. Doutor, Membro Titular do Colégio Brasileiro de Radiologia e Diagnóstico por Imagem (CBR), Chefe da Seção Médica de Radiologia do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil Endereço para correspondência: Dr. Patrick Bastos Metzger Centro de Intervenções Endovasculares (CIEV) Avenida Doutor Dante Pazzanese, 500, Vila Mariana São Paulo, SP, Brasil, 04012-909 E-mail: patrickvascular@gmail.com Recebido para publicação em 11/3/2013. Aceito, após revisão, em 5/6/2013. Trabalho realizado no Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554