Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 46 nº 4 - Jul. / Ago. of 2013
Vol. 46 nº 4 - Jul. / Ago. of 2013
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Rafael Dahmer Rocha1; Renata Reis Pinto2; Diogo Paes Barreto Aquino Tavares3; Cláudia Sofia Aires Gonçalves4 |
|
|
Descritores: Core biópsia guiada por ultrassonografia; Mama. |
|
|
Resumo: INTRODUÇÃO
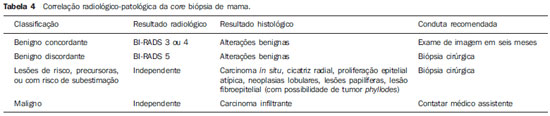
A literatura radiológica brasileira vem, recentemente, publicando artigos enfatizando a importância dos exames de imagem no aprimoramento do diagnóstico mamário(1–10). Nas últimas décadas, os procedimentos percutâneos guiados por imagem tornaram-se opções muito confiáveis para os diagnósticos histológicos. No tecido mamário, a punção aspirativa por agulha fina (PAAF) foi utilizada por muitos anos na tentativa de se evitar a biópsia cirúrgica (padrão ouro). Com o advento das biópsias por agulha grossa (core) conseguiu-se melhorar a qualidade das amostras e tornar possível diferenciar carcinomas in situ de carcinomas invasivos. Nas lesões mamárias, a core biópsia (CB) é realizada, preferencialmente, utilizando um método de imagem como guia – por exemplo: a ultrassonografia (US) ou a estereotaxia –, embora ainda seja realizada, com menor sensibilidade, somente por meio da palpação(11). Primeiramente descrita por Parker et al.(12), no início da década de 90, a CB de mama guiada por US constitui, atualmente, um dos principais métodos diagnósticos das doenças neoplásicas mamárias, sendo considerada por muitos como a técnica de biópsia de escolha nas alterações mamárias sólidas visíveis ao método(12–23). O presente estudo tem por objetivo detalhar as principais etapas da CB de mama guiada por US, incluindo indicações, vantagens, limitações, seguimento e técnica, e elaborar um checklist, o qual resume de maneira didática os passos indispensáveis para uma boa prática deste procedimento. REVISÃO As indicações mais consistentes à realização da CB de mama guiada por US estão relacionadas na Tabela 1. Lesões que exames de imagem revelam achados com categoria BI-RADS® 4 (cerca de 20% a 40% são malignos)(14,19,24) ou BI-RADS 5 (± 95% são malignos)(25,26) devem ser biopsiadas. Achados categorizados como BIRADS 3 têm menor risco de malignidade (< 2,0%), entretanto, necessitam de acompanhamento em curto prazo(25,26). Nesta categoria são indicativas de biópsia as seguintes situações: dificuldade em realizar o intervalo curto de seguimento (fatores geográficos, gravidez, cirurgia plástica mamária) ou que possa causar constrangimentos psicológicos à paciente(14,19,24); vontade explícita da paciente e/ou do médico assistente; situações clínicas em que há necessidade de antecipação diagnóstica, pois podem acarretar mudança terapêutica (por exemplo: transplantes, malignidade sincrônica)(14,27); pacientes com múltiplos fatores de risco para câncer de mama.  A sensibilidade da CB de mama guiada por US foi revisada por Youk et al.(15) em oito estudos, totalizando 1.518 pacientes, e registraram taxa média de 96%, similar à da biópsia cirúrgica. Schueller et al.(28) obtiveram sensibilidade semelhante (95,8%) em 1.352 casos. Entre os fatores que aumentam a sensibilidade da amostra, incluem-se que os fragmentos devem ser: em número mínimo de cinco(12,17,23,29); idealmente intactos, homogêneos, esbranquiçados e que afundem rapidamente na solução com formaldeído(15,24,29); e obtidos por pistola de longo alcance (> 15 mm), de maneira que a sensibilidade encontra-se diretamente proporcional ao volume dos fragmentos(12,13,24,29,30). Vários estudos(13,15,20) sugerem que a visualização em tempo real da agulha dentro da lesão possa ajudar a diminuir os falso-negativos. A CB de mama guiada por US é mais bem tolerada que a biópsia cirúrgica, podendo ser feita rapidamente e com custo extremamente inferior, como exposto na Tabela 2. Nos últimos 20 anos, esta técnica tem demonstrado ser muito segura, sendo raras as complicações graves(11,12,19,31–33). Parker et al.(21) relataram apenas seis casos (0,2%) no seguimento de 3.765 CBs, em que ocorreu a formação de três hematomas volumosos e três abscessos que necessitaram drenagem cirúrgica. Não se constatou nenhum caso de pneumotórax nesse estudo, apesar de haver remoto risco, o qual é maior em mamas pequenas com lesões axilares ou mediais(39). Durante a gravidez ou lactação podem ocorrer fístulas, especialmente nas regiões centrais e profundas(19,31). Complicações menores são frequentes, tais como dor, edema, trauma psicológico, pequenas hemorragias e reações vaso-vagais(12,27,31). Hemorragias são mais comuns em pacientes hipertensas e em mamas submetidas a radioterapia, nas quais os vasos estão mais friáveis(40). Se possível, deve-se evitar a biópsia no período perimenstrual, em que as mamas geralmente encontram-se mais sensíveis.  No que se refere ao uso de medicamentos anticoagulantes, apesar de o ácido acetilsalicílico não representar contraindicação(19,27,30), LaTrenta recomenda a suspensão por sete dias anteriores à biópsia, bem como a suspensão de anti-inflamatório não esteroidal por dois a cinco dias(31). Em relação à suspensão de anticolagulante oral, esta deve ser submetida a análise e decisão multidisciplinar(19), estimando-se o risco de eventos trombóticos versus o risco de hematoma importante. Se considerado necessário, o uso é suspenso nos quatro a sete dias prévios e pode ser reiniciado logo após o procedimento(31). A possibilidade de ser necessária uma nova biópsia é de até 18% dos casos(11,18,40,41). De acordo com Liberman et al.(13), nódulos < 5 mm podem ocasionalmente ser retirados por completo durante a biópsia em 4% a 9% dos casos, dificultando a marcação cirúrgica. Nesses casos sugere-se a colocação de um clipe metálico que servirá como marcador para cirurgias posteriores. Memarsadeghi et al.(42) relataram taxa geral de falso-negativos de 0,4%, com base em 3.380 biópsias. Entre os fatores que aumentaram o índice de falso-negativos foram associados os seguintes: baixa visualização da agulha, mobilidade da lesão, lesões profundas, lesões centrais em mamas grandes, mamas densas com fibrose, nódulos > 5 mm, e lesões obscurecidas por acúmulo de sangue. Em outro estudo, a taxa de falso-negativos foi 1,1%, sendo que mais de 20% das lesões biopsiadas mediam até 10 mm(21). Fornage et al.(43) relataram que qualquer lesão vista claramente na US pode ser submetida a CB. Apesar das inúmeras vantagens de se utilizar a US como guia, algumas lesões são inaparentes ao método, sendo preferível o uso da estereotaxia(14,17,31,44). Pacientes com microcalcificações suspeitas ou com prótese de silicone podem ser beneficiados com a biópsia vácuo-assistida, consistindo em maior número de calcificações nos fragmentos e menor risco de ruptura do implante(14,20,30,34,45–47). Em relação às lesões císticas simples, a PAAF, além de ser um meio diagnóstico, pode tornar-se terapêutica quando o aspirado citológico apresenta-se tipicamente benigno. PRÉ-BIÓPSIA (PACIENTE, SALA E MATERIAL) Em razão da baixa incidência de complicações e de contraindicações, geralmente nenhum exame laboratorial é necessário, exceto em pacientes com história de coagulopatia ou em uso de anticoagulantes(2,19,23,31). Da mesma forma, a profilaxia antibiótica não está indicada, entretanto, a técnica estéril ajuda a diminuir os riscos de infecção(31). Bugbee et al.(48) avaliaram os efeitos de medicação ansiolítica oral pré-biópsia e encontraram redução significativa nos níveis de ansiedade nas pacientes que fizeram uso de alprazolan 0,25–0,5 mg cerca de 15 minutos prévios ao procedimento. A sala deve ser adequada à realização do procedimento, dispondo de iluminação ajustável e espaço dos dois lados da maca, facilitando a movimentação da auxiliar e o acesso a todas as regiões das mamas e axilas. O transdutor deve ser linear de alta frequência, idealmente maior que 10 MHz(15), o qual deve ser limpo com antisséptico ou ser envolvido por uma capa ou luva estéril(12). Gel estéril ou o próprio antisséptico servirá como agente condutor. A pistola automática com agulha de longo alcance (2,3 cm) é preferível à de curto alcance (1,5 cm). O calibre de agulha recomendado para a CB é de 14-gauge, que demonstrou sensibilidade superior às de 16-gauge e 18-gauge, sem gerar maior complicação ou custo(27,34,35,49–51). O profissional deve estar acostumado em como manusear a pistola, ciente de quantos milímetros a gaveta da agulha avançará quando disparada, a fim de evitar que a agulha transfixe a parede torácica. Antes de se iniciar o procedimento propriamente dito, alguns itens devem ser conferidos. Explica-se à paciente o motivo da biópsia, qual técnica será utilizada, os riscos e benefícios, a existência de técnicas alternativas, e então obtém-se o consentimento informado. Inicialmente devem ser revisados os exames de imagem da paciente. A US é refeita para documentar a lesão, estabelecer a técnica a ser utilizada, confirmar se há uma adequada indicação de biópsia e avaliar as limitações que possam dificultar o procedimento. A documentação da lesão, obtendo-se medidas ortogonais e sua localização (recomenda-se o sistema de horas de relógio e mensurar a distância da lesão ao mamilo), é útil para o seguimento e comparação. Nesse momento, o médico já deve estabelecer o melhor acesso à lesão e decidir com qual mão irá segurar o transdutor. A escolha deve ser a mais confortável e eficaz para o procedimento, podendo variar conforme a localização da lesão e a mão dominante do profissional. A paciente geralmente é posicionada em decúbito dorsal, estando o membro superior ipsilateral à lesão repousado atrás da cabeça(12,19,31). A posição oblíqua anterior pode ser benéfica em casos de mamas grandes ou de lesões localizadas muito lateralmente(19,31). Lesão no quadrante externo comumente é mais bem acessada estando o profissional ao lado da mama ipsilateral, enquanto na lesão em quadrante interno é preferível estar ao lado da mama contralateral(31). Sobre uma mesa portátil deve ser aberto um campo estéril e sobre ele dispostos os materiais representados na Figura 1. O médico veste as luvas estéreis e acopla a agulha de biópsia na pistola. Realiza-se um teste de disparo, informando à paciente o som (estalo) que ela irá ouvir toda vez que for obter o fragmento. Em especial, nas mamas muito densas deve-se ficar atento ao barulho, pois este, quando for diferente do esperado, pode sugerir que a amostra está inadequada. A seguir, aspira-se o anestésico com cerca de 5–10 ml de lidocaína 1% (sem vasoconstritor) ou 3–5 ml de lidocaína 2% diluídos em 5 ml de água destilada. 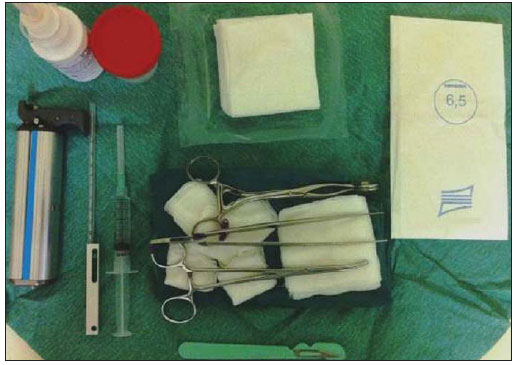 Figura 1. Disposição dos materiais necessários para a realização da core biópsia de mama. Campo fenestrado, lâmina de bisturi, agulhas de 18-gauge a 22-gauge, seringa de 5–10 ml, recipiente com 5–10 ml de formalina a 10%, luvas e gazes estéreis, pistola automática e agulha de core biópsia 14-gauge. BIÓPSIA A técnica de biópsia preferida é a "mão-livre" (freehand), baseada na descrição de Parker et al.(12) e outros pesquisadores(19,31,34,52), em que o radiologista manuseia o transdutor com uma mão e a pistola com a outra. Quanto às normativas técnicas, essas apresentam pequenas variações regionais. Na Tabela 3 é sugerido um checklist adaptado das literaturas estudadas e da experiência profissional dos autores. A Figura 2 mostra as principais etapas da CB de mama guiada por US. Primeiramente efetua-se a antissepsia da área exposta com gazes estéreis e solução antisséptica (clorexidina, povidine ou álcool). Com o transdutor identifica-se a lesão a ser biopsiada e com a mão que o segura recomenda-se apoiar a palma e os 4º e 5º dedos sobre o campo, sem exercer pressão sobre a mama, somente evitando a movimentação desta. Mantendo-se a área de interesse o mais distante do local de introdução da agulha, possibilita-se observar todo o seu trajeto, da pele à lesão. 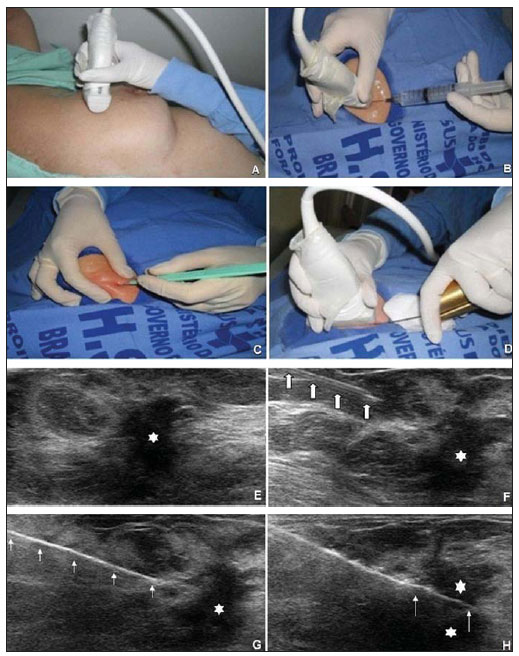 Figura 2. Principais etapas da core biópsia de mama guiada por ultrassonografia. A e E: Identificação da lesão suspeita (asterisco). B e F: Infiltração do anestésico no trajeto até a lesão. A agulha de anestesia aparece como uma fina linha hiperecogênica (setas largas). C: Incisão de 2–3 mm sobre a área anestesiada. D e G: Através da incisão, segue-se o trajeto no qual foi realizada a anestesia, insinuando-se a agulha de core (setas finas) até a margem da lesão. H: Após efetuar o disparo, deve-se verificar que a agulha transfixou a lesão (asteriscos). Pode-se notar a parte da agulha que avançou (espaço entre setas) no nódulo. O acesso recomendado faz-se pela periferia da mama, em sua curvatura, posicionando a agulha distante pelo menos 2–3 cm da borda do transdutor, orientada em eixo paralelo à parede torácica e perpendicular ao transdutor, permitindo a melhor visualização ultrassonográfica da agulha e diminuindo o risco de pneumotórax (Figura 3A). Deve-se evitar o acesso no complexo areolomamilar. Para lesões muito profundas ou superficiais centrais, pode ser necessário o acesso oblíquo da agulha, o que pode dificultar a visualização ultrassonográfica dela. Nesses casos pode-se angular o transdutor, tentando manter um ângulo próximo a 90° (Figura 3B). 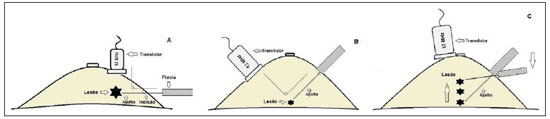 Figura 3. Acessos comumente utilizados na core biópsia de mama guiada por ultrassonografia. A: Agulha paralela à parede torácica e perpendicular ao transdutor. Melhor visualização ultrassonográfica da agulha e menor risco de pneumotórax. B: Agulha angulada em relação à parede torácica. Orienta-se o transdutor na tentativa de manter o ângulo perpendicular. Útil em lesões muito profundas ou superficiais centrais. C: A movimentação inferior da pistola pode auxiliar a afastar lesões próximas à parede torácica. Orientando-se pela US, infiltra-se o anestésico por todo o trajeto da agulha até a lesão. Em casos de lesões móveis, pode-se realizar a infiltração no seu entorno, o que diminuirá sua mobilidade. Lesões profundas podem beneficiar-se de infiltração posterior, na tentativa de deslocar o nódulo anteriormente. Com a lâmina de bisturi, uma incisão de 2–3 mm é feita na pele anestesiada. Gazes são deixadas em sua proximidade, para facilitar a compressão da mama e limpeza do sangue. Pelo local da incisão, a agulha de biópsia é avançada ao encontro da margem da lesão, seguindo-se o trajeto já realizado na anestesia. Nesse momento posiciona-se a agulha paralelamente ao nódulo, avisa-se à paciente que irá se obter a amostra e realiza-se o disparo. Nos casos de lesões móveis, com a mão que segura o transdutor, pode-se realizar uma compressão contrária ao nódulo, diminuindo a chance de a agulha empurrá-lo no disparo e não se obter uma amostra adequada. Pode-se ainda, antes do disparo, introduzir um pouco da agulha dentro do nódulo. Lesões profundas podem ser mais bem acessadas com maior angulação da agulha, com o objetivo de se alcançar a borda posterior da lesão. Pode-se orientar a agulha superiormente, a fim de levantar e afastar a lesão o máximo possível da parede torácica (Figura 3C). Outra grande dificuldade pode ocorrer em mamas muito densas. Nessas, a fibrose mamária pode tornar difícil a progressão da agulha e o ato de refazer o trajeto a cada disparo é uma importante limitação. Nesses casos pode-se utilizar a técnica com agulha coaxial, em que áreas diferentes podem ser biopsiadas apenas mudando-se a angulação do trocarte. Efetivado o disparo, deve-se confirmar ecograficamente se a agulha está dentro do nódulo, procurando-se analisar a agulha nos dois planos (transversal e longitudinal). Frequentemente, durante a biópsia, há entrada de ar pela agulha, a qual será vista como uma linha hiperecoica no trajeto do disparo (Figura 4). Este artefato pode auxiliar na determinação de locais da lesão que ainda não foram biopsiados. 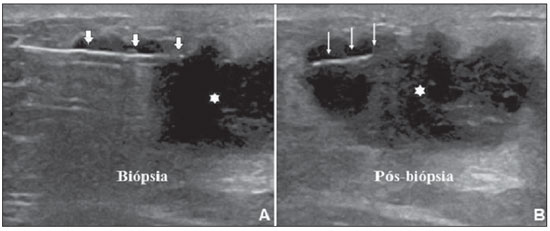 Figura 4. Artefato de gás pós-disparo. A: Excursão da agulha (setas largas) dentro do nódulo (asterisco) durante a biópsia. B: Após a biópsia, pode-se verificar uma pequena quantidade de gás, representado por uma linha hiperecogênica (setas finas). Este artefato pode auxiliar na determinação de locais da lesão que ainda não foram biopsiados. O fragmento deve ser retirado da agulha de core e brevemente analisado quanto às características que o qualifiquem como adequado (Figura 5). A agulha de anestesia ou a lâmina do bisturi podem ser utilizadas para retirá-lo, colocando-o no frasco com formalina a 10%. Deve-se tentar retirar fragmentos de diferentes áreas da lesão, geralmente do centro e próximo às margens das 3, 6, 9 e 12 horas. Entre uma amostra e outra, o médico ou a auxiliar deve realizar compressão da mama com gazes, no intuito de diminuir o risco de hematomas. Para as biópsias que incluam microcalcificações, Parker et al.(12) recomendam retirar, no mínimo, 10 fragmentos, os quais devem ser radiografados para confirmar a presença ou ausência de cálcio(53). Ao enviar o material ao patologista, recomenda-se separar os fragmentos que mostram calcificação daqueles que não mostram. 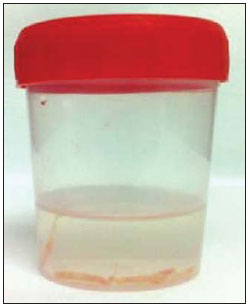 Figura 5. Fragmentos adequados de uma core biópsia de mama: brancos, íntegros e que afundam na solução. PÓS-BIÓPSIA Retirados os fragmentos, comprimem-se as áreas da incisão e do nódulo por pelo menos cinco minutos e então se aplica um curativo. O uso de gelo local também auxilia na hemostasia. Recomenda-se à paciente evitar exercícios físicos mais intensos por pelo menos dois dias. Prescrevem-se analgésicos e anti-inflamatórios, se necessário, evitando-se o uso de ácido acetilsalicílico nos sete dias seguintes. O profissional emite um laudo do procedimento e preenche a requisição do histopatológico, o qual deve incluir um relato detalhado da lesão, especificando categoria radiológica, localização, número de fragmentos obtidos, presença de linfonodomegalias e intercorrências. Deve-se esclarecer qualquer dúvida da paciente e agendar retorno quando obtiver o resultado do histopatológico. O seguimento recomendado por Youk et al.(15) e pelo Instituto Nacional de Câncer(54) está exposto na Tabela 4. É de extrema importância estar ciente do resultado histológico e manter o acompanhamento próximo da paciente, a fim de que, em resultados discordantes, principalmente aqueles em que se possa estar subestimando uma neoplasia maligna, sejam corretamente diagnosticadas o mais breve possível. Uma boa relação médico-paciente e com o médico patologista deve ser enfatizada. Em dois estudos(18,22), grande parte dos falso-negativos pôde ser reavaliada precocemente sem alterar a evolução da paciente. Liberman(55) revisou alguns estudos e encontrou taxas de 20% a 56% de carcinoma subestimado na hiperplasia ductal atípica e de 16% a 35% nos carcinomas ductais in situ. Lesões subestimadas são aquelas em que a biópsia cirúrgica indicou carcinoma ductal in situ ou invasor, ao passo que na CB o resultado foi lesão de alto risco ou um carcinoma, porém, com caracterização patológica incompleta(16,36,45). Alguns estudos demonstraram que o uso da biópsia vácuo-assistida reduziu o risco de subestimação na hiperplasia ductal atípica e no carcinoma ductal in situ em 20% e 10%, respectivamente(30,37). Quanto à incidência de rebiópsias, Youk et al.(15) encontraram taxa de 10% (338 pacientes) em 3.299 lesões biopsiadas de oito estudos, e dessas, 17% eram malignas. Os principais motivos de repetição deveram-se a resultados histológicos demonstrando lesões benignas e/ou de alto risco que exigiram intervenção cirúrgica (3% a 5%)(13,15,18,30,32,40), seguidos de discordância com o achado clinicorradiológico (2% a 7,7% do total)(15,19,45) e amostra inadequada (0,4% a 2% do total de biópsias)(13,20,45). CONCLUSÃO O número de pacientes que necessitam de biópsia mamária tem crescido nos últimos anos, principalmente em decorrência do maior acesso da população aos exames de triagem, os quais proporcionam diagnósticos mais precoces. Assim, é necessário haver um crescimento proporcional ou maior de profissionais que realizem os procedimentos diagnósticos histológicos, no intuito de diminuir o tempo de espera pelo diagnóstico definitivo e aumentar a sobrevida das pacientes. A CB de mama guiada por US tornou-se o método de escolha para todas as alterações que por ela são visualizadas, apresentando taxas de sensibilidade muito próximas às das biópsias cirúrgicas. A abordagem multidisciplinar envolvendo o triângulo clínica-radiologia-patologia é responsável pelo mais alto índice de acurácia da técnica, devendo sempre ser utilizada. Por fim, o médico radiologista também possui papel importante no seguimento dessas pacientes, devendo manter uma boa relação com elas, garantindo o retorno e bom acompanhamento do caso. REFERÊNCIAS 1. Miranda CM, Santos CJ, Maranhão CP, et al. A tomografia computadorizada multislice é ferramenta importante para o estadiamento e seguimento do câncer de mama? Radiol Bras. 2012;45:105–12. 2. Calas MJ, Gutfilen B, Pereira W. CAD e mamografia: por que usar esta ferramenta? Radiol Bras. 2012;45:46–52. 3. Azevedo A, Canella E, Djahjah MC, et al. Conduta das funcionárias de um hospital na adesão ao programa de prevenção do câncer de mama. Radiol Bras. 2012;45:215–8. 4. Alvares B, Freitas C, Jales R, et al. Mammographic density in asymptomatic menopausal women: correlation with clinical and sonographic findings. Radiol Bras. 2012;45:149–54. 5. Barra FR, Barra RR, Barra Sobrinho A. Novos métodos funcionais na avaliação de lesões mamárias. Radiol Bras. 2012;45:340–4. 6. Criado DA, Braojos F, Torres U, et al. Aesthetic breast augmentation with hyaluronic acid: imaging findings and implications for radiological assessment. Radiol Bras. 2012;45:181–3. 7. Urban L, Schaefer M, Duarte D, et al. Recomendações do Colégio Brasileiro de Radiologia e Diagnóstico por Imagem, da Sociedade Brasileira de Mastologia e da Federação Brasileira das Associações de Ginecologia e Obstetrícia para rastreamento do câncer de mama por métodos de imagem. Radiol Bras. 2012;45:334–9. 8. Calas MJG, Alvarenga AV, Gutfilen B, et al. Avaliação de parâmetros morfométricos calculados a partir do contorno de lesões de mama em ultrassonografias na distinção das categorias do sistema BI-RADS®. Radiol Bras. 2011;44:289–96. 9. Marques E, Medeiros ML, Souza J, et al. Indicações de ressonância magnética das mamas em um centro de referência em oncologia. Radiol Bras. 2012;44:363–6. 10. Lykawka R, Biasi P, Guerini C, et al. Avaliação dos diferentes métodos de medida de força de compressão em três equipamentos mamográficos diferentes. Radiol Bras. 2012;44:172–6. 11. Liberman L, Ernberg LA, Heerdt A, et al. Palpable breast masses: is there a role for percutaneous imaging-guided core biopsy? AJR Am J Roentgenol. 2000;175:779–87. 12. Parker SH, Jobe WE, Dennis MA, et al. US-guided automated large-core breast biopsy. Radiology. 1993;187:507–11. 13. Liberman L, Feng TL, Dershaw DD, et al. US-guided core breast biopsy: use and cost-effectiveness. Radiology. 1998;208:717–23. 14. Liberman L. Centennial dissertation. Percutaneous imaging-guided core breast biopsy: state of the art at the millennium. AJR Am J Roentgenol. 2000;174:1191–9. 15. Youk JH, Kim EK, Kim MJ, et al. Missed breast cancers at US-guided core needle biopsy: how to reduce them. Radiographics. 2007;27:79–94. 16. Youk JH, Kim EK, Kim MJ, et al. Sonographically guided 14-gauge core needle biopsy of breast masses: a review of 2,420 cases with long-term follow-up. AJR Am J Roentgenol. 2008;190:202–7. 17. Dillon MF, Hill AD, Quinn CM, et al. The accuracy of ultrasound, stereotactic, and clinical core biopsies in the diagnosis of breast cancer, with an analysis of false-negative cases. Ann Surg. 2005;242:701–7. 18. Schoonjans JM, Brem RF. Fourteen-gauge ultrasonographically guided large-core needle biopsy of breast masses. J Ultrasound Med. 2001;20:967–72. 19. Harvey JA, Moran RE. US-guided core needle biopsy of the breast: technique and pitfalls. Radiographics. 1998;18:867–77. 20. Philpotts LE, Hooley RJ, Lee CH. Comparison of automated versus vacuum-assisted biopsy methods for sonographically guided core biopsy of the breast. AJR Am J Roentgenol. 2003;180:347–51. 21. Parker SH, Burbank F, Jackman RJ, et al. Percutaneous large-core breast biopsy: a multi-institutional study. Radiology. 1994;193:359–64. 22. Crystal P, Koretz M, Shcharynsky S, et al. Accuracy of sonographically guided 14-gauge core-needle biopsy: results of 715 consecutive breast biopsies with at least two-year follow-up of benign lesions. J Clin Ultrasound. 2005;33:47–52. 23. Liberman L, Dershaw DD, Rosen PP, et al. Stereotaxic 14-gauge breast biopsy: how many core biopsy specimens are needed? Radiology. 1994;192:793–5. 24. Dershaw DD. Needles and biopsy probes. In: Dershaw DD, editor. Imaging-guided interventional breast techniques. New York: Springer-Verlag; 2003. p. 69–86. 25. American College of Radiology. BI-RADS® – Ultrasound, 1st ed. Breast Imaging Reporting and Data System Atlas (BI-RADS® Atlas). 4th ed. Reston: American College of Radiology; 2003. 26. American College of Radiology. BI-RADS® – Mammography, 4th ed. Breast Imaging Reporting and Data System Atlas (BI-RADS® Atlas). 4th ed. Reston: American College of Radiology; 2003. 27. Sweeney KJ, Kerin MJ. Preoperative diagnosis and biopsy guns. In: Drew P, Cawthorn S, Michell M, editors. Interventional ultrasound of the breast. London: Informa Healthcare; 2007. p. 63–78. 28. Schueller G, Jaromi S, Ponhold L, et al. US-guided 14-gauge core-needle breast biopsy: results of a validation study in 1352 cases. Radiology. 2008;248:406–13. 29. Fishman JE, Milikowski C, Ramsinghani R, et al. US-guided core-needle biopsy of the breast: how many specimens are necessary? Radiology. 2003;226:779–82. 30. Mainiero MB, Koelliker SL, Lazarus E, et al. Ultrasound-guided large-core needle biopsy of the breast: frequency and results of repeat biopsy. J Women Imaging. 2002;4:52–7. 31. LaTrenta L. Ultrasound-guided core breast biopsy. In: Dershaw DD, editor. Imaging-guided interventional breast techniques. New York: Springer-Verlag; 2003. p. 119–29. 32. Sauer G, Deissler H, Strunz K, et al. Ultrasound-guided large-core needle biopsies of breast lesions: analysis of 962 cases to determine the number of samples for reliable tumour classification. Br J Cancer. 2005;92:231–5. 33. Buchberger W, Niehoff A, Obrist P, et al. Sonographically guided core needle biopsy of the breast: technique, accuracy and indications. Radiologe. 2002;42:25–32. 34. Non-operative Diagnosis Subgroup of the National Coordination Group for Breast Screening Pathology. Guidelines for non-operative diagnostic procedures and reporting in breast cancer screening. NHSBSP Publication No. 50. Sheffield: NHS Cancer Screening Programmes; 2001. 35. Wallis M, Tarvidon A, Helbich T, et al. Guidelines from the European Society of Breast Imaging for diagnostic interventional breast procedures. Eur Radiol. 2007;17:581–8. 36. Verkooijen HM, Peeters PH, Buskens E, et al. Diagnostic accuracy of large-core needle biopsy for nonpalpable breast disease: a meta-analysis. Br J Cancer. 2000;82:1017–21. 37. Helbich TH, Matzek W, Fuchsjäger MH. Stereo-tactic and ultrasound-guided breast biopsy. Eur Radiol. 2004;14:383–93. 38. Burkhardt JH, Sunshine JH. Core-needle and surgical breast biopsy: comparison of three methods of assessing cost. Radiology. 1999;212:181–8. 39. Michell M. Tecnhiques of ultrasound biopsy. In: Drew P, Cawthorn S, Michell M, editors. Interventional ultrasound of the breast. London: Informa Healthcare; 2007. p. 79–88. 40. Berg WA. Image-guided breast biopsy and management of high-risk lesions. Radiol Clin North Am. 2004;42:935–46. 41. Gur D, Wallace LP, Klym AH, et al. Trends in recall, biopsy, and positive biopsy rates for screening mammography in an academic practice. Radiology. 2005;235:396–401. 42. Memarsadeghi M, Pfarl G, Riedl C, et al. Value of 14-gauge ultrasound-guided large-core needle biopsy of breast lesions: own results in comparison with the literature. Rofo. 2003;175:374–80. 43. Fornage BD, Sneige N, Edeiken BS. Interventional breast sonography. Eur J Radiol. 2002;42:17–31. 44. Liberman L. Stereotatic core biopsy. In: Dershaw DD, editor. Imaging-guided interventional breast techniques. New York: Springer-Verlag; 2003. p. 87–118. 45. Liberman L, Drotman M, Morris EA, et al. Imaging-histologic discordance at percutaneous breast biopsy. Cancer. 2000;89:2538–46. 46. Brennan ME, Turner RM, Ciatto S, et al. Ductal carcinoma in situ at core-needle biopsy: metaanalysis of underestimation and predictors of invasive breast cancer. Radiology. 2011;260:119–28. 47. Jackman RJ, Lamm RL. Stereotactic histologic biopsy in breasts with implants. Radiology. 2002;222:157–64. 48. Bugbee ME, Wellisch DK, Arnott IM, et al. Breast core-needle biopsy: clinical trial of relaxation technique versus medication versus no intervention for anxiety reduction. Radiology. 2005;234:73–8. 49. Nath ME, Robinson TM, Tobon H, et al. Automated large-core needle biopsy of surgically removed breast lesions: comparison of samples obtained with 14-, 16-, and 18-gauge needles. Radiology. 1995;197:739–42. 50. Pijnappel RM, van den Donk M, Holland R, et al. Diagnostic accuracy for different strategies of image-guided breast intervention in cases of nonpalpable breast lesions. Br J Cancer. 2004;90:595–600. 51. Helbich TH, Rudas M, Haitel A, et al. Evaluation of needle size for breast biopsy: comparison of 14-, 16-, and 18-gauge biopsy needles. AJR Am J Roentgenol. 1998;171:59–63. 52. Georgian-Smith D, Shiels WE 2nd. From the RSNA refresher courses. Freehand interventional sonography in the breast: basic principles and clinical applications. Radiographics. 1996;16:149–61. 53. Liberman L, Kaplan JB, Morris EA, et al. To excise or to sample the mammographic target: what is the goal of stereotactic 11-gauge vacuum-assisted breast biopsy? AJR Am J Roentgenol. 2002;179:679–83. 54. Ministério da Saúde. Instituto Nacional de Câncer. Controle do câncer de mama: documento de consenso. Rio de Janeiro: Instituto Nacional de Câncer; 2004. 55. Liberman L. Percutaneous image-guided core breast biopsy. Radiol Clin North Am. 2002;40:483–500. 1. Médico Residente em Radiologia e Diagnóstico por Imagem no Hospital Federal dos Servidores do Estado do Rio de Janeiro, Rio de Janeiro, RJ, Brasil 2. Médica Mastologista do Hospital do Instituto Nacional de Câncer (INCA), Rio de Janeiro, RJ, Brasil 3. Chefe do Departamento de Radiologia Intervencionista do Hospital Federal dos Servidores do Estado do Rio de Janeiro, Rio de Janeiro, RJ, Brasil 4. Médica Radiologista do Hospital Federal dos Servidores do Estado do Rio de Janeiro, Rio de Janeiro, RJ, Brasil Endereço para correspondência: Dr. Rafael Dahmer Rocha Avenida XV de novembro, 70, ap. 801, Centro Joaçaba, SC, Brasil, 89600-000 E-mail: rafaeldrocha@gmail.com Recebido para publicação em 2/9/2012. Aceito, após revisão, em 19/2/2013. * Trabalho realizado no Hospital Federal dos Servidores do Estado do Rio de Janeiro e no Hospital do Instituto Nacional de Câncer (INCA), Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554