Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 46 nº 4 - Jul. / Ago. of 2013
Vol. 46 nº 4 - Jul. / Ago. of 2013
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Sâmia de Freitas Brandão1; Tarcísio Passos Ribeiro de Campos2 |
|
|
Descritores: Braquiterapia; Glioblastoma multiforme; Dosimetria; BNCT; MCNP. |
|
|
Resumo: INTRODUÇÃO
O glioblastoma multiforme (GBM) é um tumor primário maligno, comum entre os tumores do sistema nervoso central, e um dos tipos de câncer mais letais, devido à sua agressividade e à ineficácia dos tratamentos(1,2). Geralmente, acomete os hemisférios cerebrais e, em alguns casos, pode ter mais de uma região de concentração(3). A localização anatômica do GBM é fator determinante na escolha do tratamento a ser empregado, sendo a ressecção tumoral a primeira opção. Entretanto, nem sempre o tumor pode ser removido, pelo risco de causar dano ainda maior às funções cerebrais. Além disso, como o GBM é altamente infiltrativo, mesmo que seja realizada a ressecção total do tumor, ainda permanecem extensões microscópicas no tecido adjacente que não podem ser removidas(4). A finalidade do tratamento cirúrgico é, então, reduzir a população de células tumorais, sendo necessário que o paciente receba radioterapia e quimioterapia. Ainda assim, a maioria dos casos apresenta recorrência e a sobrevida do paciente, em geral, é menor que dois anos(2). A braquiterapia vem sendo utilizada no tratamento dos tumores cerebrais primários, principalmente em casos de recidiva. Nos últimos anos foi desenvolvida uma modalidade de braquiterapia que consiste de um dispositivo composto por um balão e um cateter para infusão de líquido radioativo. Durante o período de irradiação, o balão é preenchido por uma solução radioativa de 125I, que emite fótons com energia média de 28 keV, resultando em uma atenuação com rápida queda de dose(2,5). O dispositivo é inserido no paciente por um procedimento cirúrgico, no qual primeiramente é feita a ressecção do tumor e, em seguida, o espaço deixado por ele é preenchido pelo balão(5,6). Uma outra técnica, ainda considerada experimental, mas que vem sendo continuamente desenvolvida nas últimas décadas é a terapia por captura de nêutrons pelo boro (BNCT – do inglês boron neutron capture therapy). Esta técnica consiste da administração intravenosa de um composto borado no paciente, seguida de irradiação por um feixe de nêutrons epitérmicos(7). O boro contido no composto captura nêutrons em reações 10B(n,α)7Li, produzindo partículas com alta transferência linear de energia e alcance médio em torno de 10 µm (aproximadamente o diâmetro da célula). Dessa maneira, a deposição de dose proveniente da reação nuclear com o boro é mantida no tumor. Além disso, como o metabolismo das células cancerosas é mais alto que o das células normais, o tumor absorve uma maior concentração do composto borado do que o tecido normal adjacente, promovendo uma irradiação seletiva(8). A braquiterapia com agulha de califórnio (Cf) pode ser empregada como fonte de nêutrons para BNCT. O 252Cf é um isótopo que sofre fissão espontânea, emitindo nêutrons rápidos com uma energia média de 2,1 MeV, seguidos de radiação gama. Sua meia-vida é de 2,7 anos e é considerado satisfatório para o uso em braquiterapia de tumores cerebrais(9). Este trabalho apresenta uma análise dosimétrica comparativa entre braquiterapia por balão de 125I e braquiterapia por 252Cf associada à BNCT, através de simulação computacional, considerando localizações disseminadas do GBM. MATERIAIS E MÉTODOS As simulações computacionais foram realizadas no código MCNP5, usando um modelo de cabeça humana em voxels(10), construído no programa SISCODES(11,12). Neste modelo foi inserido o tumor GBM hipotético, disseminado em três regiões, que neste trabalho serão referidas como tumor alvo, infiltração 1 (I1) e infiltração 2 (I2). O tumor alvo e I1 estão localizados no lobo temporal esquerdo e possuem volume de 13,7 cm3 e 0,43 cm3, respectivamente, enquanto I2 está localizado no lobo temporal direito e possui 0,27 cm3 de volume. Primeiramente, foi realizada a simulação da braquiterapia com o balão contendo a solução de 125I. O programa SISCODES foi usado para gerar um arquivo com todas as informações do modelo computacional em voxel, em um formato compreendido pelo MCNP5. A fonte, então, foi definida como uma esfera de 2 cm de diâmetro, com centro coincidente com o centro do tumor alvo, localizado a 4,3 cm da pele. Assim, há a representação da ressecção parcial do tumor e ocupação do espaço pelo balão. Os fótons, com energia média de 28 keV, foram emitidos uniformemente por todo o volume da esfera que representa a fonte e foi solicitado ao código a deposição de energia nos voxels do modelo, em MeV.g–1. Também foi solicitado que o código transformasse a deposição de energia (MeV.g–1) em taxa de dose absorvida (Gy.h–1.p–1.s), por meio de um fator de conversão, para que a dose absorvida pudesse ser melhor avaliada em termos do tempo de irradiação. Essa unidade de taxa de dose significa que uma dose de um gray (Gy) por hora é depositada no tecido quando submetido a uma fluência de uma partícula (p) emitida por segundo (s) pela fonte. Neste artigo, o "p" significa "partícula", representando tanto fótons quanto nêutrons. Para a simulação da braquiterapia por 252Cf associada à BNCT, primeiramente foi incorporada ao modelo computacional uma concentração de boro de 52,5 µg.g–1 no tumor e suas infiltrações, e 15 µg.g–1 no tecido normal adjacente (substância branca, substância cinzenta e sistema límbico). Estas concentrações representam a captação observada, em ensaios clínicos, quando o composto borado utilizado é a borofenilalanina (BPA)-frutose(13,14). Para que a dose absorvida nesta técnica pudesse ser obtida com precisão, foi necessário considerar o espectro de nêutrons e gamas emitidos pela fonte de califórnio, assim como a composição química do tecido humano e as reações ocorridas decorrentes da presença de boro no tumor e suas infiltrações, e no tecido normal. Assim, pôde-se concluir que as principais componentes que contribuem para a taxa de dose absorvida total, na combinação BNCT + 252Cf, são:
Foram executados, então, quatro casos separados no código MCNP5, sendo obtidas a deposição de energia devido aos nêutrons da fonte (DH), a deposição de energia devido a gamas da fonte (DS), a deposição de energia devido à captura radioativa (Dγ) e a fluência dos nêutrons nos voxels do modelo. O objetivo da execução deste último caso foi obter dados para o cálculo das componentes de dose por nêutrons térmicos (DN) e boro (DB), pois a versão do código usada nas simulações não avalia o transporte das partículas secundárias emitidas, tais como prótons, partículas alfa e núcleos de recuo. Com a fluência de nêutrons e as concentrações de nitrogênio e boro nos tecidos foi possível determinar as taxas das reações 14N(n,p)14C e 10B(n,α)7Li e, considerando as energias liberadas nessas reações e a massa do voxel, foi encontrada a energia depositada nos voxels do modelo. Essa energia foi convertida em taxa de dose absorvida (Gy.h–1.p–1.s) através do mesmo fator de conversão citado anteriormente. Nas simulações para obter as componentes DH, Dγ e a fluência de nêutrons, a fonte de 252Cf foi definida como um cilindro de 7,6 mm de comprimento e 0,7 mm de diâmetro, encapsulada por 0,2 mm de espessura de aço inox. O posicionamento adotado foi no centro do tumor alvo, a 4,3 cm da pele. Os nêutrons foram emitidos uniformemente por todo o volume do cilindro que representa o núcleo ativo da fonte. O espectro de energia dos nêutrons emitidos foi representado pela função de Watt, com energia média de 2,1 MeV. O uso do espectro de Watt é recomendado pelo código MCNP5 para representar os nêutrons de fissão espontânea do 252Cf(15). Na simulação para obter a componente DS, foi considerada a emissão de fótons pela fonte de califórnio, para obter a dose absorvida devido a gamas da fonte. Nos três casos executados para obter a deposição de energia nos voxels do modelo, também foi solicitado ao código a conversão dessa deposição de energia em taxa de dose absorvida (Gy.h–1.p–1.s), através do mesmo fator de conversão. Assim, todas as componentes de taxa de dose absorvida foram determinadas. Para considerar os efeitos biológicos provocados pela radiação, a taxa de dose absorvida (Gy.h–1) para cada componente foi multiplicada por um fator de ponderação e, então, foi obtida a taxa de dose ponderada (RBE.Gy.h–1). Esse fator de ponderação leva em consideração o efeito biológico nos tecidos devido a um feixe misto de radiação de alta e baixa transferência linear de energia (LET), representado por nêutrons, partículas α e raios gama, nesse estudo. Os fatores de ponderação adotados para nêutrons e fótons foram 3,2 e 1, respectivamente, enquanto no tecido borado foi adotado um fator de 1,3 no tecido normal e 3,8 no tumor e suas infiltrações. No caso da braquiterapia por balão de 125I, o fator de ponderação foi igual a 1(13,14). A taxa de dose ponderada total (Dw) foi obtida pela soma das componentes de taxas de dose absorvida, multiplicadas por seus respectivos fatores de ponderação. RESULTADOS A análise dosimétrica foi realizada considerando a deposição de dose média nos voxels do tumor, da periferia do balão, do tecido normal adjacente a cada uma das regiões tumorais e do tecido normal, como um todo, representado por todos os voxels preenchidos pelo tecido normal no modelo computacional. Os voxels avaliados neste trabalho estão sob um eixo paralelo ao plano axial, como mostra a Figura 1. 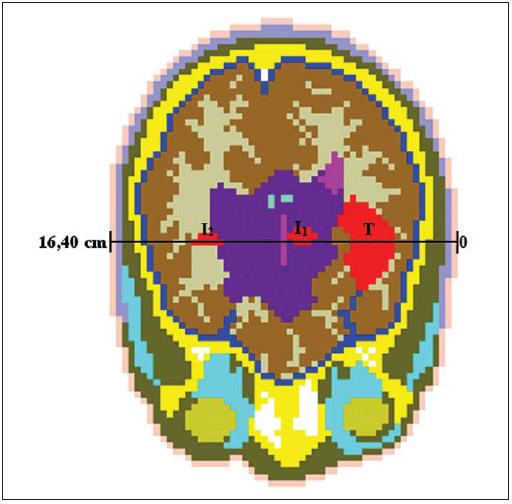 Figura 1. Plano axial do modelo computacional. O eixo sobre os voxels avaliados passa pelo centro do tumor alvo (T) e também pelas infiltrações (I1 e I2). A Figura 2 apresenta a taxa de dose ponderada produzida na braquiterapia por 125I e a produzida na braquiterapia por 252Cf associada à BNCT.  Figura 2. Taxas de dose ponderada produzidas na braquiterapia por 125I e na braquiterapia por 252Cf associada à BNCT. As colunas, em tom de cinza, destacam a região do tumor alvo (T) e das infiltrações (I1 e I2). O perfil da taxa de dose ponderada produzida na braquiterapia por balão preenchido por 125I, mostrado na Figura 2, não apresenta deposição de dose na região do tumor alvo devido à sua hipotética ressecção, na qual o espaço deixado foi preenchido pelo balão com a solução radioativa. A taxa de dose ponderada média no tecido normal (DTN) foi 3,2E-11 RBE.Gy.h–1.p–1.s, enquanto nas infiltrações I1 e I2 a taxa de dose média foi apenas 1,9E-11 (59% DTN) e 6,9E-13 RBE.Gy.h–1.p–1.s (2% DTN), respectivamente. Estes resultados mostram que não houve nenhuma especificidade de dose depositada no tumor ou nas infiltrações. Além disso, a infiltração I2 recebeu uma dose média muito menor que a média de dose no tecido normal adjacente, provavelmente não promovendo um resultado clínico favorável. Já o perfil de taxa de dose ponderada produzida na braquiterapia por 252Cf associada à BNCT, também mostrada na Figura 2, apresenta uma seletividade na deposição de dose nas regiões tumorais. A taxa de dose ponderada média em todo o tecido normal foi 5,2E-09 RBE.Gy.h–1.p–1.s, enquanto nas regiões tumorais, ou seja, tumor, I1 e I2, foi 9,0E-08 RBE.Gy.h–1.p–1.s. A braquiterapia por 252Cf apresentou uma diferença de duas ordens de grandeza, em relação à braquiterapia por balão, na deposição de dose, por partícula emitida pela fonte na unidade de tempo. A Figura 3 apresenta, detalhadamente, a distribuição da taxa de dose ponderada produzida pelas diversas componentes que contribuem com a deposição de dose na braquiterapia por 252Cf associada à BNCT. 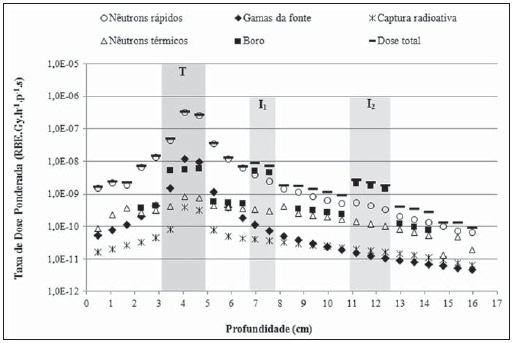 Figura 3. Taxa de dose ponderada total (Dw) e componentes de taxa de dose ponderada (DH, DS, Dγ, DN e DB) produzidas na braquiterapia por 252Cf associada à BNCT. As colunas, em tom de cinza, destacam a região do tumor alvo (T) e das infiltrações (I1 e I2). Analisando a Figura 3, é possível observar que a maior deposição de dose ocorreu no tumor, que recebeu uma dose média 21 vezes maior do que a do tecido normal adjacente. Como esperado, em função do posicionamento da fonte de califórnio, a principal contribuição de dose foi da componente referente à interação dos nêutrons com o hidrogênio presente no cérebro (DH) – 91% da taxa de dose ponderada total. A componente de dose por boro (DB) foi a responsável pela seletividade na deposição de dose ocorrida nas infiltrações, apresentando uma contribuição de 56% e 75% da dose total, sendo a deposição de dose 13,4 e 9,5 vezes maior que no tecido borado adjacente, nas infiltrações I1 e I2, respectivamente. Nos primeiros 2 cm de profundidade (voxels que representam tecido conectivo, músculo esquelético e osso do crânio), assim como em uma profundidade de 8 cm (ventrículo) e após 14,5 cm (meninge, músculo esquelético e tecido conectivo), a componente DB é nula pois não foi definida concentração de boro nestes tecidos. Como mencionado anteriormente, a concentração de boro no tecido normal só foi considerada na substância branca, substância cinzenta e sistema límbico. DISCUSSÃO O GBM apresenta alto grau de malignidade, tendendo a se espalhar rapidamente, invadindo o tecido normal do cérebro. Estudos e novas tecnologias vêm sendo continuamente apresentados com o intuito de maximizar o controle tumoral e, ao mesmo tempo, minimizar seus efeitos colaterais(6,7,16–19). Entretanto, a cura do glioblastoma ainda é um desafio, sendo este entendido como encontrar uma forma de equacionar a eliminação de resíduos celulares e infiltrações na periferia da região ressectada. Atualmente, o protocolo padrão para o glioblastoma recém-diagnosticado compreende a ressecção do tumor, seguida de radioterapia com quimioterapia concomitante ou adjuvante, principalmente com o agente quimioterápico temozolomida (TMZ). Ainda assim, a maioria dos casos apresenta recorrência(2,3). A braquiterapia tem sido proposta para ser administrada em casos de recorrência, mas Schwarz et al. citam em seu estudo vários casos em que a braquiterapia por 125I foi empregada no tratamento de tumores primários(20). A braquiterapia por balão preenchido por 125I também tem apresentado resultados encorajadores, de acordo com Liu et al.(21), Niyazi et al.(22) e Amelio et al.(2). Estudos relatados por Wernicke et al.(23) e, mais recentemente, realizados por Gobitti et al.(5), mostraram que a sobrevida média de pacientes tratados com esta técnica foi 4,6–14 meses e 13,7 meses, respectivamente. Quanto à BNCT, o carreamento do boro até o tumor ainda é um dos desafios para o sucesso da técnica. Atualmente, os únicos compostos em uso clínico são a BPA e o BSH (borocaptato de sódio), mas nenhum deles é considerado ideal em relação à sua captação pelo tumor e razão de concentração tumor:tecido normal(8,24,25). Em consequência disto, recentemente, vários estudos estiveram voltados para a incorporação de boro em moléculas do tumor alvo através de peptídeos, proteínas, anticorpos, nucleosídeos, açúcares, porfirinas, lipossomas e nanopartículas, apresentando resultados promissores em modelos animais e in vitro(8). Além do carreamento do boro, outra dificuldade na aplicação da BNCT está relacionada aos nêutrons, necessários na irradiação do tumor. Geralmente esses nêutrons são produzidos por reatores nucleares, que requerem instalações complexas, tornando o tratamento muito caro. Contudo, relatos de casos tratados vêm sendo continuamente publicados nas duas últimas décadas, com resultados satisfatórios(7,26–28). Resultados clínicos apresentados por Barth et al. mostraram sobrevida média de 7 a 21,9 meses para um total de 190 pacientes com GBM, tratados com BNCT, entre os anos de 1994 e 2008. Dentre 53 desses pacientes, apenas 9,4% alcançaram sobrevida de dois anos(8). Recentemente, o tratamento de 23 pacientes com BNCT foi relatado por Kageji et al., que registraram sobrevida média de 19,5 meses, e 26,1%, 17,4% e 5,8% dos pacientes tiveram sobrevida de dois anos, três anos e cinco anos, respectivamente. Esses autores sugerem, ainda, que a combinação da técnica com TMZ produziria melhores resultados(29). A associação da BNCT com outras técnicas radioterápicas também vem sendo avaliada. Estudos em que esta técnica foi combinada à irradiação por raios X e quimioterapia adjuvante com TMZ apresentaram resultados promissores e continuarão em estudo, segundo Yamamoto et al.(27) e Nakai et al.(28). Outro ensaio clínico que terá continuidade compreende o tratamento de glioblastoma recorrente com BNCT, pois esta técnica revelou-se segura e eficaz no controle tumoral, segundo Aiyama et al.(26). Os vários protocolos de BNCT que vêm sendo desenvolvidos (combinação de compostos borados e associação com outras técnicas), assim como outras técnicas radioterápicas, visam benefícios para o paciente, como aumento da sobrevida, ou mesmo controle tumoral e melhora da qualidade de vida durante e após o tratamento. Os resultados apresentados neste trabalho, por exemplo, mostram que há uma diferença significativa entre as técnicas apresentadas, quanto à duração do tratamento. Para atingir um boost de 20 Gy na periferia do tumor, a braquiterapia por 125I, com uma atividade de 0,5 Ci (1,85 × 1010 Bq), deve ser empregada por 7,77 horas, ao passo que a mesma dose poderia ser obtida por 50 µg de 252Cf, com surgência de 1,15 × 108 n.s–1, em um tempo de 4,54 horas. Portanto, a braquiterapia pode ser uma opção para o tratamento de pacientes com tumores cerebrais recorrentes ou inoperáveis. A escolha entre as técnicas apresentadas neste trabalho depende, entre outros fatores, da localização do tumor e da taxa de dose desejada, que está diretamente relacionada à atividade da fonte. Na Figura 2 pode-se observar que a braquiterapia por 125I apresentou um aumento na deposição de dose no osso, no intervalo entre as profundidades de 1 a 2 cm. Este aumento da dose se deve ao efeito fotoelétrico, produzido pelas interações dos fótons de 28 keV com os elementos constituintes do osso (cálcio e fósforo, principalmente), que são superiores às interações no cérebro em geral. Comparando as duas dosimetrias, a braquiterapia por 252Cf associada à BNCT apresentou uma maior deposição de dose em relação à braquiterapia por balão, que se deve ao fato de as interações na braquiterapia por 252Cf serem de ordem nuclear (reações nucleares), enquanto na braquiterapia por 125I as interações são eletrônicas. Além disso, o composto borado utilizado na braquiterapia por 252Cf foi o responsável pela seletividade na deposição de dose ocorrida nas infiltrações. Este fato é explicado pela alta seção de choque do boro (3840 b) para nêutrons com energia térmica, bem como do comportamento 1/√E da seção de choque, onde E é a energia cinética do nêutron. À medida que se aprofundam no tecido, os nêutrons são moderados pelo hidrogênio presente no tecido humano, fazendo com que tais partículas atinjam as infiltrações com energias mais baixas, termalizadas para a faixa energética onde a seção de choque é mais elevada. Ao serem capturados pelo boro, promovem maior deposição de dose in situ, através de reações 10B(n,α)7Li. Considerando o caráter altamente infiltrativo do GBM, a braquiterapia por 252Cf associada à BNCT apresenta a vantagem de proporcionar uma irradiação seletiva das células tumorais. Ainda que, em exames diagnósticos, não seja possível visualizar pequenas infiltrações, ou nos casos em que o tumor se concentra em mais de uma região no cérebro, ou até mesmo nos casos em que houver infiltrações remanescentes após ressecção do tumor, estas são capazes de captar o composto borado em maior concentração. Além disso, a fonte de 252Cf possui baixo custo e sua associação com BNCT pode ser uma alternativa para a viabilização desta técnica nos centros radioterápicos. CONCLUSÃO A braquiterapia por 252Cf associada à BNCT apresentou-se superior à braquiterapia com balão preenchido com solução de 125I, pois foi capaz de produzir irradiação diferenciada nas infiltrações. Apesar de o composto borado não contribuir significativamente com a deposição de dose no tumor alvo, comparada com as reações de espalhamento com hidrogênio, sua captação nas infiltrações proporcionou uma contribuição de dose maior do que a dos nêutrons emitidos pela fonte, poupando também o tecido normal adjacente. REFERÊNCIAS 1. Haar CP, Hebbar P, Wallace GC 4th, et al. Drug resistance in glioblastoma: a mini review. Neurochem Res. 2012;37:1192–200. 2. Amelio D, Amichetti M. Radiation therapy for the treatment of recurrent glioblastoma: an overview. Cancers. 2012;4:257–80. 3. Ferreira NF, Barbosa M, Amaral LLF, et al. Estudo através da ressonância magnética de 67 casos de glioblastoma multiforme e a ocorrência de metástases. Arq Neuropsiquiatr. 2004;62:695–700. 4. Thumma SR, Elaimy AL, Daines N, et al. Long-term survival after gamma knife radiosurgery in a case of recurrent glioblastoma multiforme: a case report and review of the literature. Case Reports in Medicine [internet]. 2012 [cited 2012 Jun 21]. Available from: http://www.hindawi.com/crim/medicine/2012/545492/. 5. Gobitti C, Borsatti E, Arcicasa M, et al. Treatment of recurrent high-grade gliomas with GliaSite brachytherapy: a prospective mono-institutional Italian experience. Tumori. 2011;97:614–9. 6. Noda SE, Lautenschlaeger T, Siedow MR, et al. Technological advances in radiation oncology for central nervous system tumors. Semin Radiat Oncol. 2009;19:179–86. 7. Savolainen S, Kortesniemi M, Timonen M, et al. Boron neutron capture therapy (BNCT) in Finland: technological and physical prospects after 20 years of experiences. Phys Med. 2013;29:233–48. 8. Barth RF, Vicente MG, Harling OK, et al. Current status of boron neutron capture therapy of high grade gliomas and recurrent head and neck cancer. Radiat Oncol. 2012;7:146. 9. Al-Saihati I, Naqvi AA. Neutron and gamma ray doses from a 252Cf brachytherapy source in a water phantom. J Radioanal Nucl Chem [internet]. 2012 Set [cited 2012 Nov 28]. Available from: http://link.springer.com/article/10.1007%2Fs10967-012-2172-5#page-1. 10. Brandão SF, Campos TPR. Análise comparativa da taxa de dose em tumor cerebral através de radioterapia megavoltagem 10 MV e BNCT – Boron Neutron Capture Therapy. [Dissertação]. Belo Horizonte: Universidade Federal de Minas Gerais; 2008. 11. Trindade BM, Campos TPR. Sistema computacional para dosimetria de nêutrons e fótons baseado em métodos estocásticos aplicado a radioterapia e radiologia. Radiol Bras. 2011;44:109–16. 12. Trindade BM, Christóvão MT, Trindade DFM, et al. Dosimetria comparativa de braquiterapia de próstata com sementes de I-125 e Pd-103 via SISCODES/MCNP. Radiol Bras. 2012;45:267–72. 13. Binns PJ, Riley KJ, Harling OK, et al. An international dosimetry exchange for boron neutron capture therapy. Part I: absorbed dose measurements. Med Phys. 2005;32:3729–36. 14. Riley KJ, Binns PJ, Harling OK, et al. An international dosimetry exchange for BNCT. Part II: computational dosimetry normalizations. Med Phys. 2008;35:5419–25. 15. X-5 Monte Carlo Team. MCNP – A General Monte Carlo N-Particle Transport Code, Version 5 – Volume I: Overview and theory. Los Alamos: Los Alamos National Laboratory; 2003. 16. Sadeghi M, Enferadi M, Shirazi A. External and internal radiation therapy: past and future directions. J Cancer Res Ther. 2010;6:239–48. 17. Amelio D, Lorentini S, Schwarz M, et al. Intensity-modulated radiation therapy in newly diagnosed glioblastoma: a systematic review on clinical and technical issues. Radiother Oncol. 2010;97:361–9. 18. Cuneo KC, Vredenburgh JJ, Sampson JH, et al. Safety and efficacy of stereotactic radiosurgery and adjuvant bevacizumab in patients with recurrent malignant gliomas. Int J Radiat Oncol Biol Phys. 2012;82:2018–24. 19. Brandão SF, Campos TPR. Brain tumour and infiltrations dosimetry of boron neutron capture therapy combined with 252Cf brachytherapy. Radiat Prot Dosimetry. 2012;149:289–96. 20. Schwarz SB, Thon N, Nikolajek K, et al. Iodine125 brachytherapy for brain tumours – a review. Radiat Oncol. 2012;7:30. 21. Liu BL, Cheng JX, Zhang X, et al. Controversies concerning the application of brachytherapy in central nervous system tumors. J Cancer Res Clin Oncol. 2010;136:173–85. 22. Niyazi M, Siefert A, Schwarz SB, et al. Therapeutic options for recurrent malignant gliomas. Radiother Oncol. 2011;98:1–14. 23. Wernicke AG, Sherr DL, Schwartz TH, et al. The role of dose escalation with intracavitary brachytherapy in the treatment of localized CNS malignancies: outcomes and toxicities of a prospective study. Brachytherapy. 2010;9:91–9. 24. Cruickshank GS, Ngoga D, Detta A, et al. A cancer research UK pharmacokinetic study of BPAmannitol in patients with high grade glioma to optimise uptake parameters for clinical trials of BNCT. Appl Radiat Isot. 2009;67(7-8 Suppl):S31–3. 25. tig A, Stecher-Rasmussen F, Hilger RA, et al. Sodium mercaptoundecahydro-closo-dodecaborate (BSH), a boron carrier that merits more attention. Appl Radiat Isot. 2011;69:1760–4. 26. Aiyama H, Nakai K, Yamamoto T, et al. A clinical trial protocol for second line treatment of malignant brain tumors with BNCT at University of Tsukuba. Appl Radiat Isot. 2011;69:1819–22. 27. Yamamoto T, Nakai K, Nariai T, et al. The status of Tsukuba BNCT trial: BPA-based boron neutron capture therapy combined with X-ray irradiation. Appl Radiat Isot. 2011;69:1817–8. 28. Nakai K, Yamamoto T, Aiyama H, et al. Boron neutron capture therapy combined with fractionated photon irradiation for glioblastoma: a recursive partitioning analysis of BNCT patients. Appl Radiat Isot. 2011;69:1790–2. 29. Kageji T, Mizobuchi Y, Nagahiro S, et al. Clinical results of boron neutron capture therapy (BNCT) for glioblastoma. Appl Radiat Isot. 2011;69:1823–5. 1. Doutoranda no Programa de Pós-Graduação em Ciências e Técnicas Nucleares do Departamento de Engenharia Nuclear da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil 2. Pós-doutor, Professor Associado da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil Endereço para correspondência: Sâmia de Freitas Brandão Departamento de Engenharia Nuclear, Universidade Federal de Minas Gerais Avenida Antônio Carlos, 6627, Campus UFMG, Escola de Engenharia, Bloco 4, Pampulha Belo Horizonte, MG, Brasil, 31270-010 E-mail: samiabrandao@gmail.com Recebido para publicação em 6/12/2012. Aceito, após revisão, em 1/4/2013. Apoio financeiro: Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes). * Trabalho realizado no Departamento de Engenharia Nuclear da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554