Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 45 nº 5 - Set. / Out. of 2012
Vol. 45 nº 5 - Set. / Out. of 2012
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Bruno Machado Trindade1; Marília Tavares Christóvão2; Daniela de Fátima Maia Trindade3; Patrícia Lima Falcão4; Tarcisio Passos Ribeiro de Campos5 |
|
|
Descritores: Radioterapia; Dosimetria; Câncer de próstata; Braquiterapia; SISCODES; MCNP. |
|
|
Resumo: INTRODUÇÃO
A braquiterapia representa um tratamento seguro e efetivo para câncer prostático localizado(1). Esta técnica emprega fontes radioativas seladas posicionadas próximas ou no interstício do tecido canceroso. Como a dose absorvida é inversamente proporcional ao quadrado da distância da fonte emissora, a braquiterapia permite a aplicação segura de altas doses absorvidas em um alvo determinado em curto período de tempo(2). A braquiterapia pode ser classificada, de acordo com a região de aplicação, como: intracavitária, quando as fontes são inseridas nas cavidades naturais do corpo; intersticial, quando as fontes radioativas são inseridas no tecido alvo; intraluminal ou intravascular, quando na luz do esôfago, brônquios ou dos vasos sanguíneos; ou superficial, quando a fonte é posicionada diretamente sobre a pele ou mucosa da área a ser tratada(2). Pode também ser identificada como temporária ou permanente. No relatório nº 38 da International Commission on Radiation Units (ICRU)(3) a braquiterapia foi classifica, de acordo com a taxa de dose, como baixa taxa de dose (low dose rate - LDR), média taxa de dose (medium dose rate - MDR) e alta taxa de dose (high dose rate - HDR), para taxas de dose de 0,4 a 2 Gy.h-1, de 2 a 12 Gy.h-1 e maior que 12 Gy.h-1, respectivamente. Braquiterapia intersticial por implantes permanentes de sementes radioativas é uma das modalidades utilizadas para tratamento de tumores de próstata, em geral aplicada para neoplasias em estadiamento T1 ou T2, com escores Gleason entre 2 e 6 e PSA sérico < 10 ng. As indicações dos implantes são na sua maioria para volumes pequenos, em especial na doença ainda em fase inicial, localizada dentro da cápsula prostática (estágios T1B-T1C, T2A-T2B-T2C, ausência de metástases e comprometimento linfático). Esta técnica pode ser associada a teleterapia, principalmente para pacientes considerados de alto risco(4). Para a braquiterapia de próstata são usadas, principalmente, sementes metálicas de iodo-125 (I- 125) ou, mais recentemente, de paládio- 103 (Pd-103)(5). As sementes de I-125 e Pd- 103 são constituídas de material dopado com o isótopo radiativo encapsulado em um invólucro de titânio. As dimensões externas das sementes são 4,5 a 5 mm de comprimento por 0,8 mm de diâmetro(6,7). Tais sementes são representadas na Figura 1. 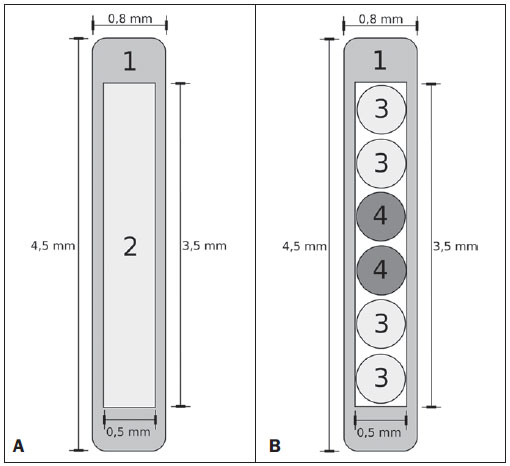 Figura 1. Diagrama das sementes de I-125 (A) e Pd-103 (B). Essas sementes são compostas de: 1 - cápsula de titânio; 2 - óxido de iodo; 3 - poliestireno dopado com Pd-103; 4 - marcadores metálicos para visualização das sementes por imagens de raios X. O I-125 é um isótopo radioativo com meia vida de 60,1 dias e emissão de fótons de raios X. As principais energias de emissão de fótons são 27,20 keV, 27,47 keV e 30,97 keV, com respectivas probabilidades de 39,80%, 74,20% e 25,70%. O Pd-103 tem meia vida de 17 dias e emissão de fótons de raios X nas energias principais de 20,07 keV, 20,22 keV e 22,71 keV, com probabilidades de 19,83%, 37,55% e 11,88%, respectivamente(8). Em razão das menores energias, os fótons do Pd-103 possuem um alcance no tecido menor que os emitidos pelo I-125. Assim, para uma igual distribuição de sementes com mesma atividade, a distribuição espacial de dose obtida pelo Pd-103 tende a ser, teoricamente, menos homogênea que a obtida com o I-125. Por outro lado, mas pelo mesmo motivo, sementes de Pd-103 produzirão menor dose absorvida a distâncias maiores, principalmente nos tecidos sadios no entorno. A taxa de dose do Pd-103 é maior que a do I-125, assim como a efetividade biológica relativa (RBE)(9). Dessa forma, a dose de prescrição para os implantes com sementes de Pd- 103 é menor que a preconizada para implantes com sementes de I-125: 125 Gy e 144 Gy, respectivamente(10,11). O valor de 80% da dose depositada pelas sementes de I-125 é liberado em 140 dias, enquanto as sementes de Pd-103 liberam este valor em 39 dias. Isto se deve ao fato que sementes de Pd-103 geram maior taxa de dose, e consequentemente produzem um maior efeito biológico, principalmente em linhagens cancerosas com alto índice de proliferação. O número de sementes implantadas na próstata depende dos seguintes parâmetros: volume de referência irradiado, atividade individual das sementes, dose de prescrição adotada, assim como o modelo de distribuição espacial de sementes escolhido(12). As sementes são aplicadas alinhadas, mediante introdução, guiada por ultrassonografia, de agulhas contendo um conjunto de sementes. Estas são depositadas no tecido uma a uma espaçadas entre si. A quantidade e a disposição espacial das sementes são escolhidas de modo a se atender à dose de prescrição na próstata, ao mesmo tempo em que se minimiza a dose nos tecidos e estruturas adjacentes. Obviamente, há uma forte dependência do controle da doença com as doses aplicadas, e por sua vez, do arranjo das sementes no implante. Para mensurar a efetividade do tratamento aplicado, assim como a possibilidade de efeitos adversos, são definidos parâmetros de referência ou de mérito, relativos à dose absorvida, para fins comparativos. Por exemplo, o parâmetro Dx corresponde ao valor da dose mínima em x% de um volume irradiado. Esse volume pode ser de um órgão ou de um volume de interesse pré-definido no planejamento radioterápico. Por sua vez, o parâmetro Dycc corresponde à dose mínima no volume de y cm3 que contém a maior dose absorvida em um órgão ou volume de interesse definido no planejamento(13). O método de Monte Carlo é uma técnica matemática aplicada para reproduzir um processo estatístico. Esta técnica é particularmente interessante na resolução de problemas complexos que não podem ser modelados por métodos computacionais determinísticos. O Monte Carlo N-Particle (MCNP) aplica essa técnica no transporte de partículas nucleares, acompanhando cada uma das muitas partículas primárias ou secundárias, geradas por uma fonte radioativa, entre sua emissão até algum evento terminal, como absorção, aniquilamento, fuga do sistema, entre outros(14). A simulação tridimensional do transporte de partículas nucleares visa eliminar as deficiências do planejamento bidimensional por método analítico em meio homogêneo, sendo uma importante ferramenta para a melhoria da qualidade dos procedimentos radioterápicos em oncologia(15,16). Métodos computacionais têm sido de elevada relevância para avaliação dosimétrica usando modelos heterogêneos(17-20). O SISCODES (Sistema Computacional para Dosimetria por Nêutrons e Fótons por Métodos Estocásticos) é uma ferramenta para construção de objetos simuladores computacionais e simulação de tratamentos radioterápicos via códigos estocásticos, como o MCNP(21,22). Esse sistema permite a conversão de imagens tomográficas em modelo de voxels. Tendo à sua disposição um banco de dados de composição química de tecidos e de dados nucleares, o SISCODES permite a associação de dados nucleares e químicos aos voxels do modelo, pela seleção do tecido de cada voxel, bem como o posicionamento de fontes de braquiterapia e teleterapia. O sistema usa o MCNP para a simulação do transporte de partículas nucleares no modelo, com consequente obtenção da dose absorvida. Dos resultados, os dados relevantes de dosimetria são extraídos e apresentados por distribuições espaciais de doses e histogramas dose versus volume (DVH - dose-volume histograms)(21,22). O presente artigo tem como objetivo investigar a dosimetria de implantes permanentes de próstata por meio de sementes de I-125 e Pd-103, empregando DVHs, isodoses e parâmetros de referência, como Dx e Dycc, no intuito de elaborar comparações entre os dois protocolos. MATERIAIS E MÉTODOS Foi arbitrariamente adotado um protocolo de implante permanente em próstata com sementes de I-125. O mesmo protocolo de implante foi reproduzido com sementes de Pd-103. A disposição e o número de sementes não foram alterados entre os protocolos, apenas as sementes de I-125 foram substituídas pelas de Pd-103. Para a simulação do transporte de partículas nucleares foi utilizado um modelo de voxels de pelve masculina(23) com voxels de 5 × 5 × 5 mm. Neste modelo, a próstata apresenta volume de aproximadamente 40 cm3. A Figura 2 mostra dois cortes deste modelo. As sementes foram posicionadas de acordo com a distribuição uniforme modificada, proposta por Butler et al.(12), como ilustrado na Figura 3. No total foram posicionadas 148 sementes em 24 aplicações, formando segmentos alinhados paralelos em direção tangencial aos ossos do púbis, em grade de espaçamento entre segmentos de 1 cm mantendo espaçamento das sementes em um mesmo segmento em 6 mm centro a centro. 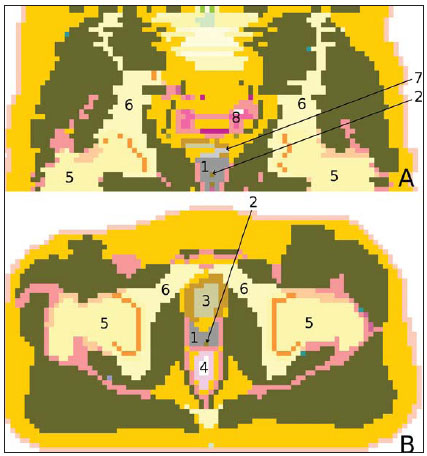 Figura 2. Cortes frontal (A) e radial (B) do modelo de voxels utilizado, em que podem ser observadas as seguintes estruturas anatômicas: 1 - próstata; 2 - uretra; 3 - bexiga; 4 - reto; 5 - fêmur; 6 - ossos ilíacos; 7 - vesícula seminal; 8 - cólon. 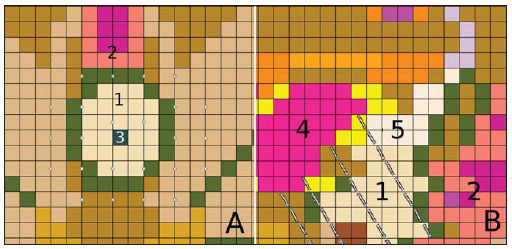 Figura 3. Corte do modelo com as sementes nos eixos Z (A) (vista central) e X (B) (vista sagital). Os órgãos marcados são: 1 - próstata; 2 - reto; 3 - uretra; 4 - bexiga; 5 - vesícula seminal. Ambas as sementes foram representadas tendo um cilindro de material radioativo com 3,5 mm de comprimento e 0,5 mm de diâmetro contido por outro cilindro de titânio com 5 mm de comprimento e 0,8 mm de diâmetro, como mostra a Figura 4. A matriz radioativa adotada para a semente de I-125 foi óxido de iodo, e a da semente de paládio, poliestireno dopado com Pd-103. 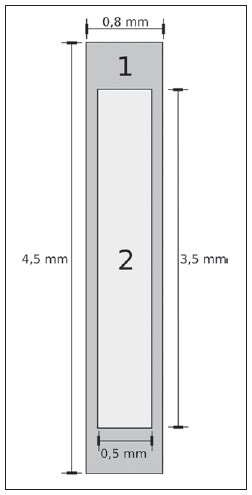 Figura 4. Modelo da semente usado no MCNP. O volume marcado com 1 corresponde à cápsula de titânio. O volume marcado com 2 corresponde ao composto radioativo: óxido de iodo ou poliestireno dopado com Pd-103. Após a simulação no MCNP (versão 5.2) de cada protocolo, os resultados foram importados pelo código SISCODES. Foram, então, geradas as distribuições espaciais de dose e os DVHs de cada procedimento. A atividade inicial das sementes foi calculada para que fosse obtida a dose de prescrição na próstata preconizada para cada implante. O código SISCODES funciona como uma interface para o código MCNP. Toda avaliação e simulação do transporte de partículas nucleares é feita pelo código MCNP. Consequentemente, a dosimetria é avaliada pelo MCNP. O SISCODES permite a definição do modelo e do protocolo a ser simulado, e auxilia na manipulação e apresentação dos resultados em forma gráfica e de histogramas. O programa de transporte de partícula calcula a energia depositada por unidade de massa em cada voxel, em unidades de MeV.g-1 por partícula emitida pela fonte. Este valor é convertido em Gy (J.kg-1) por unidade de partícula emitida pela fonte. As emissões das fontes são avaliadas em função da atividade (Bq = transformações.s-1) multiplicada pela taxa de produção de fótons por unidade de transição. O resultado destes cálculos gera a dose em Gy em cada voxel. No caso, adotaram-se todas as sementes com a mesma atividade. A atividade da semente foi calculada para que a dose prescrita (D90) seja igual a 144 Gy e 125 Gy, respectivamente, para I-125 e Pd-103. Assim, as atividades foram encontradas de modo a ajustar a D90 para valor equivalente à dose prescrita em um protocolo clínico. Com esta atividade foram avaliadas as doses absorvidas na região alvo e nos tecidos adjacentes, utilizando representações de regiões de isodoses e DVHs. RESULTADOS Para que o valor D90 seja igual à dose preconizada, a atividade inicial de cada semente foi calculada em 0,42 mCi e 0,94 mCi, para I-125 e Pd-103, respectivamente. O DVH obtido para a próstata é mostrado na Figura 5A. Considerando estas atividades e a distribuição espacial das sementes adotadas, a dose absorvida máxima na uretra foi por volta de 90% da dose prescrita para I-125 e 108% da dose prescrita para Pd-103. A dose D2cc no reto para I-125 foi 30 Gy e para Pd-103 foi 29 Gy, como mostrado no DVH representado na Figura 5B. A mesma dose (D2cc) para a bexiga foi 127 Gy para I-125 e 189 Gy para Pd-103 (Figura 5C). Os ossos da pelve apresentaram doses elevadas na interface tecido moleosso, principalmente para sementes de I-125. Com as sementes de I-125, o valor deD10 obtido para os ossos do púbis foi 144 Gy e para os ossos ilíacos foi 2,7 Gy. As sementes de Pd-103 apresentaram um valorD10 para os ossos do púbis de 66 Gy e para os ossos ilíacos de 165 mGy. As diferenças na distribuição espacial das doses podem ser observadas nas representações de distribuição espacial de doses mostradas na Figura 6. 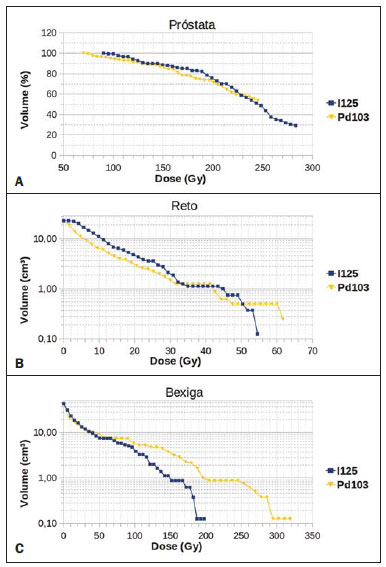 Figura 5. Histogramas dose-volume para próstata, reto e bexiga. 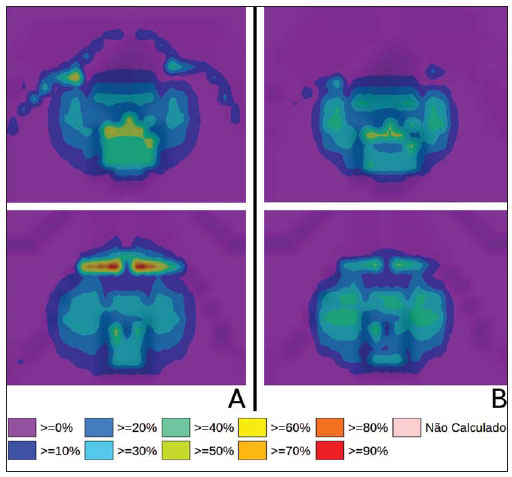 Figura 6. Distribuição espacial de dose na próstata e nos tecidos adjacentes em dois cortes axiais arbitrários, para I-125 (A) e Pd-103 (B). O percentual da legenda é relativo à dose máxima de cada simulação. Observar as doses elevadas na interface tecido mole-osso, para as sementes de I-125, mostradas na metade superior de cada imagem. Observam-se, na Figura 6A, doses absorvidas elevadas na interface tecido moleosso, para o implante com sementes de I-125. Todavia, o mesmo não foi observado para Pd-103 (Figura 6B). As relações de dose no volume alvo (D90) com a dose em reto (D2cc) e bexiga (D2cc) para o implante com sementes de I-125 foram 0,208 e 0,882, respectivamente, e para Pd-103 atingiram 0,232 e 1,512, respectivamente. A relação de dose D90/D2cc na bexiga e reto para sementes de Pd-103 foi superior à obtida com sementes de I-125. DISCUSSÃO Nestas simulações foram considerados os seguintes efeitos: de autoabsorção na matriz e no encapsulamento metálico das sementes; de sombreamento entre sementes; da heterogeneidade dos tecidos, inclusive altas densidades das regiões ósseas e vazios presentes; dos limites do contorno do corpo e proximidade com ar externo. Este fato distingue o presente método aplicado dos cálculos analíticos utilizados na dosimetria em braquiterapia, preconizados pelo AAPP Task Group No. 43, que considera o meio homogêneo infinito equivalente à água(10). A dose absorvida máxima na uretra ficou abaixo das doses limites do valorD10 < 150% e D30 < 130% da dose de prescrição com ambas as sementes. As doses D2cc no reto foram significativamente menores que a dose limite de 145 Gy(24). As doses nos volumes mais irradiados do reto, a partir da D0.5cc, assim como na bexiga a partir da D7cc, decorrentes das se-mentes de Pd-103 são maiores que as doses decorrentes das sementes de I-125. Isso pode ser explicado pelo menor alcance dos fótons do Pd-103, o que faz com que a energia seja depositada em um volume menor, aumentando a dose absorvida no entorno da semente. Se uma semente de PD103 estiver próxima a um dos órgãos vitais, a dose neste órgão será elevada. Já com a semente de I-125, a distribuição espacial de dose é mais ampla, mas tendendo a ter valores de doses por volume menores. De modo surpreendente, doses elevadas na ordem de 100% da dose de prescrição foram encontradas na interface entre os ossos da pelve e o tecido mole. Nesta região, as doses decorrentes das sementes de I-125 são significativamente maiores que as doses decorrentes das sementes de PD103, com D10 = 144 Gy e D10 = 66 Gy para I-125 e Pd-103, respectivamente. Esse fato também pode ser explicado pelo maior alcance dos fótons emitidos pelo I-125, o que faz com que alcancem os ossos da bacia com maior intensidade que os emitidos pelo Pd-103. Os efeitos nesses órgãos referentes ao implante de I-125 devem ser considerados em situações clínicas e mais bem investigados. Observa-se que tal efeito não está presente quando avaliada a dosimetria por modelos analíticos e adotado meio homogêneo. CONCLUSÕES Os implantes de sementes de Pd-103 e I-125 puderam depositar a dose prescrita no volume alvo. O implante com Pd-103 está associado a uma menor dose nos ossos da pelve, desde que o posicionamento das sementes seja cuidadosamente estudado e estas sejam corretamente posicionadas durante protocolo clínico. A relação de dose no reto D2cc/D90 foi 11,5% superior para Pd-103. No caso estudado, os implantes de Pd-103 depositaram maior dose no reto e bexiga do que o I-125. O principal achado neste trabalho consistiu na constatação de doses absorvidas elevadas fora da região alvo em tecidos ósseos adjacentes à próstata, principalmente com os implantes de I-125. Os métodos computacionais aqui empregados podem auxiliar em futuras avaliações clínicas comparativas da braquiterapia por implantes de sementes de I-125 e Pd-103, entre outras sementes radioativas, podendo ser validados, posteriormente, por meio de estudos experimentais com simulação de protocolos clínicos e dosimetria em objetos simuladores reais. Agradecimentos Os autores agradecem à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pelo suporte e apoio a pesquisa no grupo de pesquisa Núcleo de Radiações Ionizantes da Universidade Federal de Minas Gerais (NRI/UFMG). REFERÊNCIAS 1. Emami B. Oral cavity. In: Perez CA, Brady LW, editors. Principles and practice of radiation oncology. 3rd ed. Philadelphia, PA: Lippincott- Raven; 1998. p. 981-1002. 2. Williamson JF, Brenner DJ. Physics and biology of brachytherapy. In: Halperin EC, Perez CA, Brady LW, et al., editors. Perez and Brady's Principles and practice of radiation oncology. 5th ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2008. p. 424-76. 3. International Commission on Radiation Units. Dose and volume specifications for reporting intracavitary therapy in gynecology. ICRU Report No. 38. Bethesda, MD: International Commission on Radiation Units; 1985. p. 1-16. 4. Chung HT, Speight JL, Roach M III. Intermediate and high-risk prostate cancer. In: Halperin EC, Perez CA, Brady LW, et al., editors. Perez and Brady's Principles and practice of radiation oncology. 5th ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2008. p. 1484-503. 5. Zelefsky MJ, Valicenti RK, Hunt M, et al. Lowrisk prostate cancer. In: Halperin EC, Perez CA, Brady LW, et al., editors. Perez and Brady's Principles and practice of radiation oncology. 5th ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2008. p. 1440-83. 6. Sowards K, Meigooni AS. A Monte Carlo evaluation of the dosimetric characteristics of the Best Model 2301 125I brachytherapy source. Appl Radiat Isot. 2002;57:327-33. 7. Li Z, Palta JR, Fan JJ. Monte Carlo calculations and experimental measurements of dosimetry parameters of a new 103Pd source. Med Phys. 2000;27:1108-12. 8. ENDF/B-VI Decay data. [acessado em 11 de novembro de 2011]. Disponível em: http://t2.lanl.gov/data/endf/decayVI.html 9. Ling CC, Li WX, Anderson LL. The relative biological effectiveness of I-125 and Pd-103. Int J Radiat Oncol Biol Phys. 1995;32:373-8. 10. Nath R, Anderson LL, Luxton G, et al. Dosimetry of interstitial brachytherapy sources: recommendations of the AAPM Radiation Therapy Committee Task Group No. 43. American Association of Physicists in Medicine. Med Phys. 1995;22:209- 34. 11. Beyer D, Nath R, Butler W, et al. American brachytherapy society recommendations for clinical implementation of NIST-1999 standards for (103)palladium brachytherapy. The clinical research committee of the American Brachytherapy Society. Int J Radiat Oncol Biol Phys. 2000;47:273-5. 12. Butler WM, Merrick GS, Lief JH, et al. Comparison of seed loading approaches in prostate brachytherapy. Med Phys. 2000;27:381-92. 13. Pötter R, Haie-Meder C, Van Limbergen E, et al. Recommendations from gynaecological (GYN) GEC ESTRO working group (II): concepts and terms in 3D image-based treatment planning in cervix cancer brachytherapy-3D dose volume parameters and aspects of 3D image-based anatomy, radiation physics, radiobiology. Radiother Oncol. 2006;78:67-77. 14. X-5 Monte Carlo Team. MCNP - A general Monte Carlo N-Particle transport code, version 5. Los Alamos, NM: Los Alamos National Laboratory; 2003. 15. Purdy JA. Three-dimensional physics and treatment planning. In: Perez CA, Brady LW, editors. Principles and practice of radiation oncology. 3rd ed. Philadelphia, PA: Lippincott-Raven; 1998. p. 343-70. 16. Emami B, Graham MV, Michalski JM, et al. Three-dimensional conformal radiation therapy: clinical aspects. In: Perez CA, Brady LW, editors. Principles and practice of radiation oncology. 3rd ed. Philadelphia, PA: Lippincott-Raven; 1998. p. 371-86. 17. Fonseca KR, Trindade BM, Campos TPR. Development of a voxel model of the heart for dosimetry. Artif Organs. 2011;35:459-64. 18. Brandão SF, Campos TPR. Brain tumour and infiltrations dosimetry of boron neutron capture therapy combined with 252Cf brachytherapy. Radiat Prot Dosimetry. 2012;149:289-96. 19. Christóvão MT, Campos TPR, Trindade BM. Simulation and dosimetric analysis of proton and carbon ion therapy in the treatment of uveal melanoma. Radiol Bras. 2011;44:367-73. 20. Campos TPR. Computational simulations in medical radiation. A new approach to improve therapy. [acessado em 11 de novembro de 2011]. Disponível em: http://www.sbmac.org.br/bol/boletim_2002/campos-4emc.pdf 21. Trindade BM, Campos TPR. Sistema computacional para dosimetria de nêutrons e fótons baseado em métodos estocásticos aplicado a radioterapia e radiologia. Radiol Bras. 2011;44:109- 16. 22. Trindade BM. Remodelagem do sistema computacional para dosimetria em radioterapia por nêutrons e fótons baseado em métodos estocásticos - SISCODES. [tese de doutorado]. Belo Horizonte, MG: Universidade Federal de Minas Gerais; 2011. 23. Silva CHT. Desenvolvimento de fantomas: computacional de voxels e antropomórfico-antropométrico de pelve masculina para dosimetria em braquiterapia de próstata. [dissertação de mestrado]. Belo Horizonte, MG: Universidade Federal de Minas Gerais; 2004. 24. Salembier C, Lavagnini P, Nickers P, et al. Tumour and target volumes in permanent prostate brachytherapy: a supplement to the ESTRO/ EAU/EORTC recommendations on prostate brachytherapy. Radiother Oncol. 2007;83:3-10. 1. Doutor, Pós-doutorando e Pesquisador do Núcleo de Radiações Ionizantes da Universidade Federal de Minas Gerais (NRIUFMG), Belo Horizonte, MG, Brasil. 2. Doutora, Tecnologista da Comissão Nacional de Energia Nuclear (CNEN), Belo Horizonte, MG, Brasil. 3. Mestre, Professora do Centro Universitário Una, Belo Horizonte, MG, Brasil. 4. Pós-doutora, Pesquisadora do Núcleo de Radiações Ionizantes da Universidade Federal de Minas Gerais (NRI/UFMG), Belo Horizonte, MG, Brasil. 5. Pós-doutor, Professor Associado da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil. Endereço para correspondência: Dr. Bruno Machado Trindade. Rua Guilherme de Almeida, 255, ap.302, Santo Antônio. Belo Horizonte, MG, Brasil, 30350-230 E-mail: bmtrindade@yahoo.com Recebido para publicação em 7/12/2011. Aceito, após revisão, em 27/8/2012. * Trabalho realizado na Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554