Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 45 nº 5 - Set. / Out. of 2012
Vol. 45 nº 5 - Set. / Out. of 2012
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Eduardo Rafael Novero1; Patrick Bastos Metzger2; Javier Obregon1; Vanessa Luciene Abreu de Marco3; Fabio Henrique Rossi4; Samuel Martins Moreira5; Nilo Mitsuru Izukawa6; Antonio Massamitsu Kambara7 |
|
|
Descritores: Aneurisma; Prótese vascular; Aterosclerose. |
|
|
Resumo: INTRODUÇÃO
O aneurisma de aorta torácica (AAT) está entre as 15 principais causas de morte nos Estados Unidos. Apenas 39% dos pacientes portadores de AAT não tratados sobrevivem em cinco anos. Os portadores de AAT com diâmetro maior que 8 cm possuem 80% de risco de ruptura e morte em um ano de acompanhamento. O diâmetro do aneurisma é o fator mais importante na determinação desse risco(1,2). A dissecção aórtica é a afecção mais temida da aorta, sendo duas vezes mais frequente que a ruptura da aorta. A mortalidade associada à dissecção varia de 1% a 2%, por hora, nas primeiras 48 horas. Os fatores de risco frequentemente associados a ela são: hipertensão, doença cardiovascular e respiratória. A dissecção é três vezes mais frequente no sexo masculino. Os sítios mais comuns de lesão de entrada são: na aorta ascendente, alguns centímetros distais à válvula aórtica, e na aorta descendente, abaixo da origem da artéria subclávia. A dissecção aguda é diferenciada da crônica quando o diagnóstico é feito dentro dos 14 dias do início dos sintomas. Quando uma dissecção tipo B desenvolve complicações isquêmicas, a intervenção cirúrgica ou endovascular se faz mandatória. Cerca de 30% dos pacientes com dissecção tipo B desenvolvem complicações. A mortalidade associada à correção cirúrgica na dissecção aguda tipo B varia de 30% a 80%, quando há isquemia renal ou mesentérica. A terapia endovascular pode oferecer técnicas de reperfusão de leitos vasculares isquêmicos em dissecções complicadas, com riscos inferiores à cirurgia aberta(3). As dissecções e os AATs constituem enfermidades de consequências às vezes catastróficas. Apesar dos avanços obtidos nos métodos diagnósticos, técnicas operatórias e controles intra e pós-operatórios, estas afecções ainda são importantes desafios para os cirurgiões endovasculares(4). Nos últimos anos, surgiu o conceito de que as doenças da aorta poderiam ser corrigidas por próteses endoluminais, posicionadas no interior da aorta por intermédio de cateteres introduzidos pela artéria femoral. Considerando a alta taxa de morbimortalidade relacionada às intervenções cirúrgicas em dissecções de aneurismas torácicos, a técnica endovascular torna-se uma opção muito atrativa. Os dispositivos endovasculares permitem um acesso minimamente invasivo, sendo o fluxo mantido sem clampeamento(5). Outras vantagens são: menor taxa de transfusão sanguínea, menor tempo de internação, menor tempo de unidade de terapia intensiva (UTI) e menores custos. A principal desvantagem é que esta técnica predispõe a maior número de reintervenções em médio e longo prazos(4). A intervenção endovascular da aorta torácica foi pouco comparada à cirurgia aberta em estudos clínicos controlados e randomizados, porém os resultados pós-implantes obtidos em curto e médio prazos são estimulantes, com morbimortalidade precoce menor, quando comparados à cirurgia aberta(6). Segundo alguns autores, o tratamento endovascular nos AATs verdadeiros representa um desafio maior do que o realizado em pacientes com dissecção tipo B crônica, com menor êxito terapêutico e maior mortalidade(6,7). O objetivo deste trabalho consiste em avaliar os resultados clínicos obtidos em uma série consecutiva de pacientes submetidos a correção endovascular de AATs e dissecções aórticas tipo B crônicas, analisando sucesso técnico, sucesso terapêutico, morbimortalidade, complicações e taxa de reintervenções realizadas. MATERIAIS E MÉTODOS Trata-se de um estudo retrospectivo, longitudinal, observacional, realizado em um centro de referência para doenças cardiovasculares, no período de janeiro de 2010 a julho de 2011. Foram avaliados 55 pacientes submetidos a reparo endovascular de aorta torácica. Esta população foi dividida em dois grupos: grupo 1 (G1) - pacientes portadores de AATs verdadeiros, úlcera penetrante de aorta torácica e pseudoaneurismas; grupo 2 (G2) - dissecção aórtica tipo B e hematoma intramural. Ambos os grupos comportavam pacientes cuja indicação do procedimento endovascular foi tratar o vazamento da endoprótese prévia, independentemente de sua doença de base. Foram incluídos no estudo pacientes de ambos os sexos, com ou sem sintomas torácicos, com indicação de correção aórtica por: a) AAT com diâmetro maior que 55 mm, correção de vazamentos tipo I ou tipo III; b) dissecção tipo B crônica com dilatação aneurismática maior que 55 mm ou correção de vazamentos tipo I ou tipo III; c) pseudoaneurisma de aorta torácica; d) úlcera penetrante de aorta torácica com mais de 2 cm de diâmetro e 1 cm de profundidade. Foram excluídos do estudo pacientes com colo aórtico de fixação proximal com extensão menor que 15 mm, colo aórtico de fixação distal menor que 15 mm de extensão a partir do tronco celíaco, presença de trombo ou calcificação superior a 50% do diâmetro do colo, diâmetro das artérias ilíacas externas menor que 7 mm, creatinina sérica maior que 2,0 mg/dl ou clearance de creatinina menor que 30 ml/min. Os pacientes que permaneceram no estudo foram considerados como tendo anatomia favorável e encaminhados ao tratamento endovascular. A avaliação do risco cardiológico e/ou anestésico não foi considerada na inclusão ou exclusão dos pacientes. O diagnóstico e a programação terapêutica foram realizados a partir da angiotomografia em todos os casos, sendo que o papel da arteriografia pré-operatória permaneceu como método diagnóstico opcional. Todas as tomografias foram reconstruídas no software Osirix® em modo tridimensional (3D) e em modo reconstrução multiplanar (MPR), a partir do qual foram obtidos os diâmetros, angulações e extensões do colo aórtico proximal e distal do aneurisma (Figura 1). 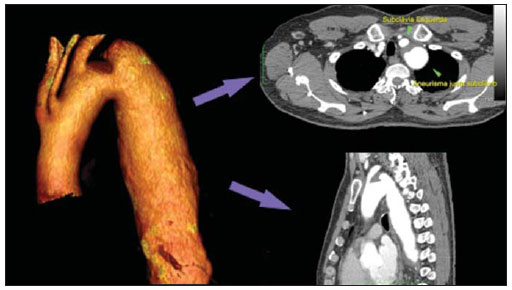 Figura 1. Angiotomografia com reformatação em 3D e cortes axial e sagital da angiotomografia. Aneurisma torácico justassubclávia em arco aórtico tipo 3. Técnica cirúrgica Todos os procedimentos foram realizados no laboratório de hemodinâmica do Centro de Intervenções Endovasculares (CIEV) do Instituto Dante Pazzanese de Cardiologia. Os pacientes foram tratados sob anestesia geral inalatória. Profilaxia antimicrobiana foi realizada com 1,5 g de cefuroxima no momento da indução anestésica. A abordagem foi preferencialmente realizada pela artéria femoral comum por dissecção cirúrgica aberta, uni ou bilateral, conforme o tipo de intervenção ou endoprótese escolhida. Na impossibilidade dessa via de acesso, foi realizada abordagem da artéria ilíaca externa por acesso retroperitoneal. O controle radiográfico foi realizado com aparelho Siemens Artis Flat Panel. Foram utilizados os dispositivos: Valiant® (Medtronic; Minneapolis, MN, EUA), Zenith® TX2® (Cook Medical; Bloomington, IN, EUA), TAG® (Gore Medical; Flagstaff, AZ, EUA), HerculesTM (MicroPort; Shangai, China), Relay® (Bolton Medical; Sunrise, FL, EUA), e E®-vita (Jotec GmbH; Hechingen, Alemanha). Foi realizada arteriografia intraoperatória em todos os pacientes. O pós-operatório imediato foi realizado em UTI em todos os casos (Figura 2). 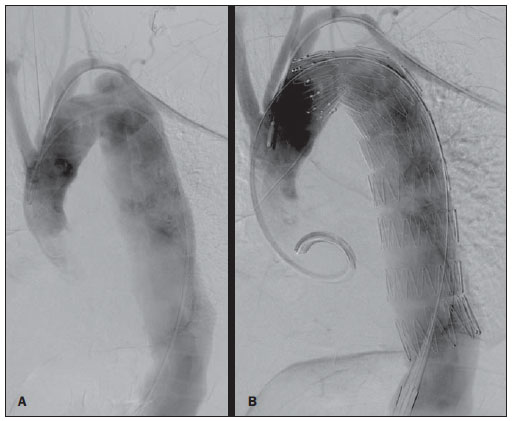 Figura 2. Aortografia intraprocedimento via acesso braquial esquerdo (A) e resultado final de correção endovascular do aneurisma de aorta torácico (B). Ausência de vazamento intraoperatório e preservação da artéria subclávia esquerda. Os pacientes foram avaliados ambulatorialmente aos 15, 30, 180 e 360 dias após a correção. Após o primeiro ano, as consultas foram realizadas anualmente. Angiotomografia foi realizada no 30º e no 360º dias de seguimento ambulatorial. Os desfechos analisados foram definidos conforme descrição a seguir. Desfechos primários 1. Sucesso técnico - quando o objetivo de liberar a endoprótese na área acometida foi alcançado, com ou sem a presença de vazamentos ou outras intercorrências que pudessem influenciar desfavoravelmente na evolução da doença aórtica. 2. Sucesso terapêutico - quando a liberação da endoprótese ocorreu sem vazamentos ou outras intercorrências que repercutissem na evolução favorável da doença aórtica. 3. Mortalidade perioperatória - quantidade de óbitos registrados dentro dos primeiros 30 dias após o procedimento. 4. Complicações - a) intraoperatórias: complicações ocorridas na sala de hemodinâmica durante a intervenção; b) intra-hospitalares: complicações ocorridas durante a internação, fora da sala de hemodinâmica e dentro dos 30 dias após intervenção. Foram considerados como complicações: sangramento local; presença de hematoma inguinal ou retroperitoneal; oclusão de artéria subclávia de forma inadvertida durante a liberação do dispositivo; presença de embolização periférica para membros inferiores como causa de oclusão arterial aguda; ocorrência de paraplegia ou paraparesia; infecções, sejam do sítio cirúrgico, do trato respiratório inferior ou da endoprótese utilizada; desenvolvimento de insuficiência renal aguda, definida como um aumento da creatinina maior que duas vezes o valor prévio ao procedimento; óbito. 5. Taxa de reintervenção - intervenções realizadas para manutenção do funcionamento adequado da endoprótese ou para resolução de complicações associadas à intervenção. Desfechos secundários 1. Tempo de internação - período de tempo entre a admissão hospitalar e a alta hospitalar. 2. Tempo do procedimento - período de tempo do início da indução anestésica ao fechamento do sítio operatório. Vazamentos 1. Vazamento inicial ou primário - os originados durante o procedimento inicial ou diagnosticados nos primeiros 30 dias. 2. Vazamento secundário - os diagnosticados após 30 dias do procedimento inicial. Definições Derivação carotídeo-subclávia e/ou carotídeo- carotídea a enxerto extra-anatômico realizado para ancoragem da endoprótese em zonas 1 e 2, quando há comprometimento da artéria carótida esquerda ou da artéria subclávia esquerda. RESULTADOS Este seguimento foi composto por 55 pacientes submetidos a correção de doenças aórticas torácicas. O G1 foi composto de 29 pacientes. A enfermidade primária desta população foi: AATs verdadeiros em 26 casos (89,6%), úlcera penetrante em 2 casos (6,8%), pseudoaneurisma em 1 caso (3,4%). A idade média foi 66,8 ± 10 anos, sendo que 18 (69%) eram do sexo masculino. Os pacientes eram assintomáticos em 20 casos (68,9%), tendo sido realizado o diagnóstico por achados circunstanciais ao exame de rotina. O fator de risco predominante foi a hipertensão em 28 pacientes (96,8%), 19 (65,5%) eram tabagistas e 12 (41,3%) apresentavam dislipidemia. O diabetes esteve presente em 4 casos (13,7%). A obesidade, com índice de massa corpórea maior que 40, estava presente em 2 pacientes (6,8%) da população (Tabela 1). Entre as comorbidades presentes, encontramos alta incidência de cardiopatia isquêmica (58,6%), insuficiência renal aguda (17,2%), e em menor grau cardiopatia dilatada, em um caso (3,4%). Observamos também uma porcentagem significativa de pacientes com correção prévia endovascular de aneurismas aórticos (20,6%). Doença pulmonar obstrutiva crônica esteve presente em 2 casos (6,8%) (Tabela 2). 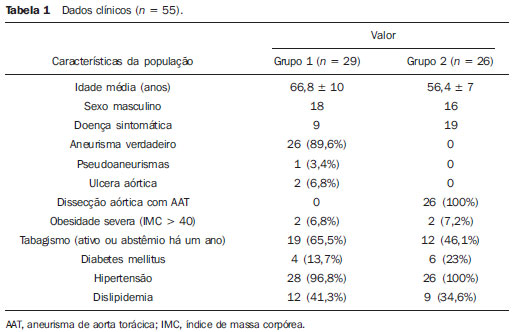 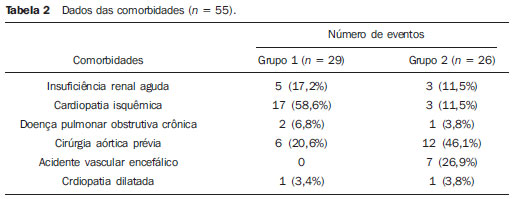 As indicações de tratamento endovascular nesta população foram: AATs verdadeiros em 23 casos (79,3%), vazamentos de endopróteses prévias em 3 casos (10,3%), úlcera penetrante em 2 casos (6,8%) e pseudoaneurisma em 1 caso (3,4%). Dentre os aneurismas tratados, 17 eram torácicos, sendo 10 saculares e 7 fusiformes, e 9 eram toracoabdominais, sendo 3 casos do tipo I, 3 casos do tipo II, 2 casos do tipo III e 1 caso do tipo V, de acordo com a classificação de Saffi. Todos os pacientes foram tratados de forma eletiva. Anestesia geral inalatória foi utilizada em todos os casos, com drenagem liquórica nos pacientes com indicação de reintervenção aórtica, nos que possuíam cirurgias aórticas abdominais ou torácicas prévias e nos pacientes que eram portadores de oclusões de troncos viscerais ou supra-aórticos documentados no pré-operatório. O sucesso técnico foi obtido em 86,2%, ou seja, em 25 pacientes foi possível liberar a endoprótese no local desejado. Em quatro casos não foi possível o avanço da endoprótese para local desejado, por dificuldades técnicas ou anatômicas (calcificações ou tortuosidades). O sucesso terapêutico foi 58,6%, ou seja, em 17 pacientes a prótese foi liberada sem vazamentos ou outras intercorrências que repercutissem na evolução favorável da intervenção. A única causa de insucesso terapêutico foi o vazamento ou a persistência deste, segundo a indicação da intervenção. A taxa de complicação foi 48,2%, e as complicações intra-operatórias mais frequentes foram lesão femoral em 7 casos (24,5%) e embolia periférica em 1 caso (3,4%). As complicações pós-operatórias intra-hospitalares foram: infecções em 2 casos (6,8%), sendo as 2 de ferida operatória, insuficiência renal aguda em 2 pacientes (6,8%), paraplegia em 1 caso (3,4%) e hematoma retroperitoneal em 1 caso (3,4%) (Tabela 3). 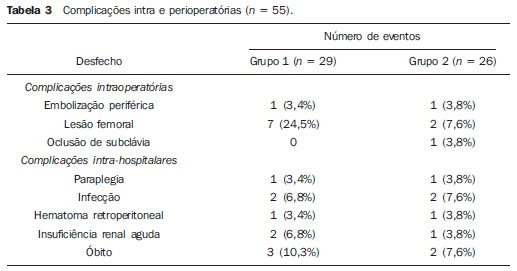 A mortalidade perioperatória foi 10,3%. Ocorreu um óbito, por rotura aneurismática durante o posicionamento da endoprótese; outros dois óbitos ocorreram em consequência de sepse por infecção do trato respiratório (Tabela 3). Após os 30 dias de pós-operatório, não se observaram óbitos. A taxa total de vazamentos primários foi 27,5%, sendo o vazamento tipo Ia observado em 4 casos e o tipo Ib em 3 casos. O vazamento tipo IV esteve presente em 1 caso (3,4%). Não houve casos de vazamentos tipo III e de migração de endoprótese durante o seguimento dos pacientes. A taxa de reintervenção em um ano foi 10,3%, em razão do tratamento do vazamento do tipo I (Tabela 4). A sobrevida anual, durante nosso acompanhamento, foi 89,7%. Um óbito teve causa vascular. 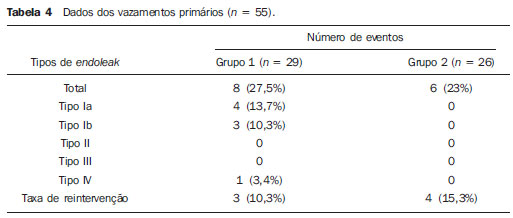 O tempo médio de procedimento foi 78 minutos (variação de 54 a 115 minutos), e o tempo de internação médio foi 4,2 dias, com variação de 7 dias. Os dispositivos das endopróteses mais usados foram: Valiant® em 13 casos (45%), Zenith® TX2® em 3 casos (10,4%), TAG® em 3 casos (10,4%), HerculesTM em 3 casos (10,4%) e E®-vita em 3 casos (10,4%). A taxa de derivação carotídeo-carotídea e/ou carotídeo-subclávia foi 6,8%, ou seja, em 2 casos foi necessária esta derivação. As zonas de ancoragem da endoprótese se distribuíram da seguinte forma: 25 casos (86,2%) na zona 3, 2 casos na zona 4 (6,9%), 1 caso na zona 2 e 1 caso na zona 1 (Figura 3). 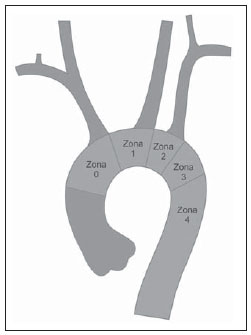 Figura 3. Zonas de ancoragem dos aneurismas torácicos. No G2 foram incluídos 26 pacientes tratados em razão de dissecção aórtica tipo B crônica. A afecção primária desta população foi dissecção aórtica tipo B em 100% dos casos. A idade média foi 56,4 ± 7 anos, sendo que 16 (61,5%) eram do sexo masculino. Os pacientes foram sintomáticos em 19 casos (73%), 2 casos (7,2%) apresentaram sintomas inespecíficos e 5 casos não apresentaram sintomas (19,2%). O fator de risco predominante foi a hipertensão em 26 pacientes (100%), 12 pacientes (46,1%) eram tabagistas e 9 pacientes (34,6%) apresentavam dislipidemia. O diabetes esteve presente em 6 casos (23%). A obesidade com índice de massa corpórea maior que 40 estava presente em 2 pacientes (7,2%) da população (Tabela 1). Entre as comorbidades presentes, encontramos alta incidência de cirurgias aórticas prévias, em 12 casos (46,1%), acidente vascular encefálico em 7 casos (26,9%), insuficiência renal crônica em 3 casos (11,5%), cardiopatia isquêmica em 3 casos (11,5%), e em menor grau cardiopatia dilatada em 1 caso (3,8%). Doença pulmonar obstrutiva crônica esteve presente em 1 caso (3,8%) (Tabela 2). As indicações de tratamento endovascular nesta população se distribuíram da seguinte forma: dissecção tipo B em 15 casos (57,6%), vazamentos de endopróteses prévias em 11 casos (42,3%). Nesse grupo todos foram tratados de forma eletiva. Anestesia geral inalatória foi utilizada em todos os casos, com drenagem liquórica nos pacientes com indicação de reintervenção aórtica, nos que possuíam cirurgias aórticas abdominais ou torácicas prévias, e nos pacientes que eram portadores de oclusões de troncos viscerais ou supra-aórticos documentados no pré-operatório. O sucesso técnico foi 100%. Em todos os casos foi possível liberar a endoprótese no local desejado. O sucesso terapêutico foi 74%, ou seja, em 20 pacientes a prótese foi liberada sem vazamentos ou outras intercorrências que repercutissem na evolução favorável da intervenção. A única causa de insucesso terapêutico foi o vazamento ou a persistência deste, segundo a indicação da intervenção. A taxa de complicação foi 30,7%, sendo as complicações intraoperatórias mais frequentes: lesão femoral em 2 casos (7,6%) e oclusão involuntária da artéria subclávia em 1 caso (3,8%). As complicações pósoperatórias intra-hospitalares foram: infecções em 2 casos (7,6%), hematoma retroperitoneal em 1 caso (3,8%), insuficiência renal aguda em 1 paciente (3,8%) e paraplegia em 1 caso (3,8%) (Tabela 3). A mortalidade perioperatória foi 7,6%. Ocorreram dois óbitos: um decorrente de sepse por infecção do trato respiratório inferior e outro por parada cardiorrespiratória secundária a miocardiopatia dilatada chagásica (Tabela 3). Após 30 dias de pósoperatório ocorreram três óbitos: dois por redissecção e outro por edema agudo pulmonar. A taxa total de vazamentos primários foi 23%, sendo o vazamento tipo Ia observado em todos os casos. Não houve casos de vazamentos tipos II e III e de migração de endoprótese durante o seguimento dos pacientes. A taxa de reintervenção em um ano foi 15,3%, em razão do tratamento de vazamento tipo I (Tabela 4). A sobrevida anual, durante nosso acompanhamento, foi 80,7%. O tempo médio de procedimento foi 67 minutos (variação de 49 a 104 minutos) e o tempo de internação médio foi 9,9 dias, com variação de 8 dias. Os dispositivos mais utilizados foram: Valiant® em 10 casos (38,5%), Zenith® TX2® em 7 casos (27%), TAG® em 6 casos (23%), Relay® em 2 casos (7,7%) e HerculesTM em 1 caso (3,8%). A taxa de derivação carotídeo-subclávia e/ou carotídeo-carotídea foi 23%, ou seja, em 6 casos foi necessária esta derivação. As zonas de ancoragem da endoprótese se distribuíram da seguinte forma: 6 casos na zona 2 (23%), 14 casos (53,8%) na zona III e 6 casos na zona 4 (23%) (Figura 3). DISCUSSÃO Apesar de ter sua indicação reconhecida, o tratamento endovascular da doença aórtica crônica apresenta resultados variáveis e dependentes da população analisada(7). As diferenças fisiopatológicas e anatômicas entre aneurismas e dissecções aórticas condicionam técnicas operatórias que se traduzem em resultados diferentes. Em razão da instabilidade clínica e fragilidade da parede aórtica nas dissecções da aorta torácica, a utilização do balão complacente proximal após implante da endoprótese não é recomendada. Já nos aneurismas, a distorção anatômica, traduzida numa maior tortuosidade do arco aórtico, e a maior incidência de estenose por placas ateroscleróticas periféricas limitam com frequência o avanço harmônico do sistema de liberação nessa população. Autores brasileiros demonstraram taxas de sucesso técnico de 97% em 92 pacientes tratados por AATs verdadeiros e de 98% em 130 pacientes tratados por dissecção tipo B torácica(7). O estudo EUROSTAR demonstrou 89% de sucesso técnico primário em pacientes com dissecção aórtica(8). Em nosso levantamento, a taxa de sucesso técnico atingiu 86,2% no G1 e 100% no G2. Quatro dispositivos da população com aneurismas verdadeiros não avançaram à aorta torácica descendente por limitações da anatomia aórtica e do eixo ilíacofemoral. A taxa de sucesso terapêutico, em nossa casuística, foi 58,6% no G1 e 73% no G2. Autores brasileiros apresentam 71% de sucesso clínico em aneurismas e 84% em dissecções(7). O vazamento tipo I foi a intercorrência mais frequente associada à correção endovascular do aneurisma ou dissecção aórtica e pode resultar eventualmente em falência clínica. O percentual relatado na literatura varia de 0% a 44%(9,10). Em nossa população, a única causa de insucesso terapêutico foi o vazamento. A taxa de vazamentos primários no G1 foi 27,5%, e no G2, 23%. Sabemos que um colo proximal menor que 2 cm da artéria subclávia esquerda e a presença do orifício de entrada localizado na pequena curvatura do arco aórtico são fatores predisponentes a vazamentos e a acotovelamento da endoprótese na angiografia de controle. A evolução do vazamento tipo I é controversa. Alguns autores acreditam que existe a necessidade de uso de uma endoprótese adicional, eventual embolização ou conversão cirúrgica. Porém, há relatos de trombose espontânea sem nenhum outro tipo de tratamento, apesar da presença inicial de vazamento durante o procedimento. O período de resolução espontânea varia de uma semana a oito meses. Caso este vazamento persista, deve-se proceder com intervenções terapêuticas corretivas(11). Na população que teve vazamento tipo I, encontramos cinco pacientes do G1 e dois do G2 com vazamento de pequeno volume pela arteriografia, que se resolveu de forma espontânea, entre o terceiro e sexto mês de acompanhamento. Dois pacientes do G1 tinham colo menor que 2 cm de extensão. Estes dados se traduzem em melhores taxas de sucesso terapêutico, sem intervenções precipitadas e também em menores reintervenções futuras. Em nenhum dos grupos se constataram vazamentos secundários. Tendo em conta os casos de resolução espontânea, as taxas anuais de reintervenções foram 10,3% para o G1 e 15,3% para o G2. O estudo VALOR apresentou taxas anuais de vazamentos de 17%, sendo que os vazamentos do tipo I ocorreram em 6,3%, do tipo 2 em 9,5% e do tipo III em 1,9%(12). No G1, três pacientes (10,3%) tiveram como indicação de procedimento endovascular o vazamento. Desses, um paciente possuía antecedente de cirurgia aórtica prévia e dois pacientes, tratamento endovascular prévio. Ao analisar o tipo de vazamento tratado, vimos que dois eram tipo Ia, com persistência do vazamento após a intervenção, e um paciente possuía vazamento tipo Ib, apresentando sucesso terapêutico após a intervenção. No G2, 11 pacientes (42,3%) tiveram como indicação do procedimento endovascular o vazamento; destes casos, 4 possuíam tratamento cirúrgico aórtico prévio e 7, tratamento endovascular prévio. Os tipos de vazamentos foram: 7 casos do tipo Ia, dos quais 3 tiveram sucesso terapêutico e 4 persistiram com vazamentos; 4 casos apresentaram vazamentos tipo Ib, sendo que todos foram corrigidos. Observamos que a taxa de sucesso terapêutico quando o vazamento a ser tratado foi tipo Ia é mais baixa quando comparado com o do tipo Ib, fenômeno mais notável no G1. Assim, no G1 não foi possível corrigir os vazamentos tipo Ia, enquanto no G2 apenas 43% dos vazamentos puderam ser corrigidos. Para explicar estes dados, observamos que no G1 a porcentagem de ancoragem nas zonas 1 e 2 foi 6,8%. Em 6,8% dos pacientes foi realizada a derivação carotídeo-subclávia e/ou carotídeo-carotídea, o que permitiu o ancoramento da endoprótese em zona 1 ou 2 com maior segurança, ocluindo, dessa forma, a artéria subclávia e/ou a artéria carótida comum esquerda. No G2, vimos que 23% das endopróteses se ancoraram na zona 2. Todos esses pacientes foram submetidos a derivações carotídeo-subclávias. Provavelmente, a zona 2 de ancoragem foi subutilizada na correção de vazamentos Ia do G1. A cobertura da artéria subclávia é geralmente bem tolerada e são poucos os pacientes que desenvolvem tonturas ou claudicação do membro superior esquerdo. O estudo VA-LOR demonstrou 5% de derivação carotídeo-subclávia. Muitos grupos realizam esta derivação de forma eletiva, tardiamente, caso haja o aparecimento de sintomas(12). Evitar o clampeamento aórtico com a técnica endovascular reduz as complicações por isquemia do órgão alvo, assim como as complicações cardíacas (1% versus 10%), respiratórias (8% versus 28%) e renais, em comparação com a cirurgia aberta(13). A lesão da via de acesso arterial, provocada pela combinação de sistema de liberação de alto perfil (20-24 French) e a ar-terioesclerose íliaco-femoral, é em contrapartida muito frequente na técnica endovascular. No estudo VALOR, os pacientes com AATs verdadeiros apresentaram taxa de complicações de 41%(12). Na série publicada pelo Arizona Heart Institute ocorreram apenas 38% de complicações leves, em pacientes com dissecção(14). Nosso levantamento mostrou taxa de complicação de 48,2% no G1 e 30,7% no G2. A população tratada devido a AATs verdadeiros mostra taxa de lesão femoral de 24,1%, muito superior ao G2, com 7,6%. A aterosclerose periférica desta população incide não só neste tipo de lesão, como também na incidência de embolização periférica causada pela manipulação prolongada de guias ou do próprio dispositivo no arco aórtico. A correção endovascular do AAT está associada a risco de isquemia medular e paraplegia permanente. O fator preditivo principal é a extensão da aorta recoberta pela endoprótese(15). De acordo com o protocolo TAG Gore, que comparou cirurgia aberta versus o tratamento endovascular em AATs, a incidência de paraplegia é menor no segundo (14% versus 3%)(16). A dissecção tratada cirurgicamente tem incidência de paraplegia de 19%, no entanto, quando tratada de forma endovascular, sua incidência está em torno de 0-10%, com média de 1,8%(17-19). O estudo EUROSTAR registra incidência de 4% de paraplegia nos pacientes tratados por aneurismas e de 0,8% para dissecções aórticas tratadas por via endovascular(8). Na população analisada houve dois casos de paraplegia permanente: uma no G1 (3,4%) e outra no G2 (3,8%). Não se observaram casos de acidentes vasculares encefálicos em nenhum dos dois grupos. A cirurgia prévia ou simultânea, a cobertura de segmento aórtico longo e a hipotensão perioperatória são fatores de risco para paraplegia após a correção dos AATs. A drenagem profilática do líquido cerebrospinal pode ser útil em pacientes de alto risco, ou seja, pacientes com AATs e aneurismas da aorta abdominal associados, história prévia de correção aberta ou endovascular de aneurisma da aorta abdominal, necessidade de conduto ilíaco para avanço da endoprótese, em pacientes com antecedentes de paralisia de membros inferiores transitória e na incapacidade de colocação da drenagem liquórica em menos de uma hora após implante da endoprótese, se a paraparesia ou paraplegia forem esperadas. A principal desvantagem da drenagem préoperatória é a potencial formação de hematoma espinhal quando se administra heparina durante a intervenção. Nessa eventualidade, a drenagem liquórica deve ser suspensa(20,21). No presente estudo, 17% da população do G1 receberam cateter de raquianestesia contínua, e no G2, 10%. Os resultados pós-implante de endoprótese em doenças da aorta torácica, tanto em curto quanto em médio prazo, são favoráveis, com taxas de mortalidade precoce significativamente menores quando comparados com a cirurgia aberta. O estudo VALOR(12) apresentou mortalidade intraoperatória de 2,1%, enquanto Stone et al. registraram taxa de 10,4% em pacientes tratados devido a AAT(22). O estudo EUROSTAR apresentou 10% de mortalidade hospitalar, elevando-se a 28% em pacientes com aneurismas quando tratados em regime de urgência(8). Um protocolo de endoprótese Talent torácica, para correção de aneurismas, apresentou 5% de mortalidade intra-hospitalar(23). De acordo com Stone et al., a mortalidade cirúrgica hospitalar chega a 15,1% nesta população(22). Nossa população no G1 apresentou um óbito atribuído à intervenção terapêutica endovascular e dois casos por sepse decorrente de infecção de trato respiratório inferior no pós-operatório. A taxa de mortalidade perioperatória desta população chega a 10,3%, estando dentro da variação de valores encontrada na literatura. O protocolo Talent torácico mostrou sobrevida anual de 91%. Em nosso estudo, o G1 apresentou 89,6% de sobrevida, já que não se registraram óbitos durante o período de 30 dias a um ano de seguimento. De outra forma, o estudo EUROSTAR constatou mortalidade intra-hospitalar de 8,4% em pacientes tratados por dissecção(8). A mortalidade geral de correção cirúrgica da dissecção tipo B está em torno de 30%, chegando a 50% quando esses pacientes são operados em situações de urgência(3). O estudo EUROSTAR apresentou 90% de sobrevida anual em pacientes com dissecção, enquanto na série do Arizona Heart Institute a sobrevida anual foi 85%(8,14). A população do G2 apresentou mortalidade perioperatória de 7,6%, com sobrevida anual de 80,7%. Após os 30 dias de intervenção, ocorreram três óbitos: dois casos por redissecção e um caso por edema agudo pulmonar. Nosso levantamento demonstrou que a taxa de sobrevida no G2 é próxima à de outras publicações, e menor que no G1. Não está claro se a terapia endovascular tem algum impacto na sobrevida de pacientes que evoluem para dissecção crônica tipo B de Stanford comparada com tratamento clínico. O estudo INSTEAD comparou o tratamento clínico e endovascular inicial em 140 pacientes portadores de dissecções, não encontrando diferença na taxa de mortalidade por qualquer causa. A sobrevida foi 95,6% no grupo de tratamento clínico versus 88,9% no grupo de tratamento endovascular, no seguimento de dois anos. A progressão e morte por rotura foi igual em ambos os grupos, enquanto a remodelação aórtica foi 91,3% nos pacientes tratados por via endovascular versus 19,4% no grupo de tratamento clínico, o que sugere o tratamento endovascular em pacientes com complicações aórticas emergentes. Entretanto, no acompanhamento clínico, houve um número razoável de pacientes que tiveram que migrar para o tratamento endovascular(24). CONCLUSÕES A experiência com os procedimentos endovasculares na aorta torácica causou um impacto na prática clínica e atualmente está se tornando o tratamento padrão para afecções da aorta torácica, simples ou complexas. As intervenções são tecnicamente mais difíceis na população com AATs verdadeiros. Em nosso estudo, o tratamento endovascular das doenças da aorta torácica demonstrou ser um método viável e associado a aceitáveis taxas de complicações perioperatórias. As taxas de sucesso terapêutico e de reintervenções obtidas demonstram a necessidade de um seguimento clínico rigoroso e atento desses pacientes. Novos estudos devem confirmar o benefício da terapia endovascular na dissecção tipo B crônica. REFERÊNCIAS 1. Bickerstaff LK, Pairolero PC, Hollier LH, et al. Thoracic aortic aneurysms: a population-based study. Surgery. 1982;92:1103-8. 2. Dapunt OE, Galla JD, Sadeghi AM, et al. The natural history of thoracic aortic aneurysms. J Thorac Cadiovasc Surg. 1994;107:1323-33. 3. Trimarchi S, Nienaber CA, Rampoldi V, et al. Role and results of surgery in acute type B aortic dissection: insights from the International Registry of Acute Aortic Dissection (IRAD). Circulation. 2006;114(1 Suppl):I357-64. 4. Palma JH, Buffolo E, Gaia D. Tratamento endovascular das doenças da aorta: visão geral. Rev Bras Cir Cardiovasc. 2009;24(2 Supl 1):40s-44s. 5. Dake MD, Kato N, Mitchell RS, et al. Endovascular stent-graft placement for the treatment of acute aortic dissection. N Engl J Med. 1999;340:1546-52. 6. Matalanis G, Durairaj M, Brooks M. A hybrid technique of aortic arch transposition and antegrade stent graft deployment for complete arch repair without cardiopulmonary bypass. Eur J Cardiothorac Surg. 2006;29:611-2. 7. Alves CMR, Fonseca JHP, Souza JAM, et al. Tratamento endovascular nos aneurismas verdadeiros e na dissecção aórtica do tipo B: fase intrahospitalar, seguimento de médio prazo e uma reflexão sobre seleção de pacientes. Rev Bras Cardiol Invas. 2009;17:46-51. 8. Leurs LJ, Bell R, Degrieck Y, et al. Endovascular treatment of thoracic aortic diseases: combined experience from the EUROSTAR and United Kingdom Thoracic Endograft registries. J Vasc Surg. 2004;40:670-80. 9. Chagas Neto FA, Barreto ARF, Reis HF, et al. A importância do diagnóstico por imagem na classificação dos endoleaks como complicação do tratamento endovascular de aneurismas aórticos. Radiol Bras. 2010;43:289-94. 10. Criado FJ, Clark NS, Barnatan MF. Stent-graft repair in the aortic arch and descending thoracic aorta: a 4-year experience. J Vasc Surg. 2002;36:1121-8. 11. Lepore V, Lönn L, Delle M, et al. Endograft therapy for diseases of the descending thoracic aorta: results in 43 high-risk patients. J Endovasc Ther. 2002;9:829-37. 12. Fairman RM, Criado F, Farber M, et al. Pivotal results of the Medtronic Vascular Talent Thoracic Stent Graft System: the VALOR trial. J Vasc Surg. 2008;48:546-54. 13. Svensson LG, Crawford ES, Hess KR, et al. Variables predictive of outcome in 832 patients undergoing repairs of the descending thoracic aorta. Chest. 1993;104:1248-53. 14. Nathanson DR, Rodriguez-Lopez JA, Ramaiah VG, et al. Endoluminal stent-graft stabilization for thoracic aortic dissection. J Endovasc Ther. 2005;12:354-9. 15. Amabile P, Grisoli D, Giorgi R, et al. Incidence and determinants of spinal cord ischaemia in stent-graft repair of the thoracic aorta. Eur J Vasc Endovasc Surg. 2008;35:455-61. 16. Makaroun MS, Dillavou ED, Kee ST, et al. Endovascular treatment of thoracic aortic aneurysms: results of the phase II muiticenter trial of the GORE TAG thoracic endoprosthesis. J Vasc Surg. 2005;41:1-9. 17. Coselli JS, Conklin LD, LeMaire SA. Thoracoabdominal dominal aortic aneurysm repair: review and update of current strategies. Ann Thorac Surg. 2002;74:S1881-4. 18. Palma JH, Souza JAM, Alves CMR, et al. Selfexpandable aortic stent-grafts for treatment of descending aortic dissections. Ann Thorac Surg. 2002;73:1138-42. 19. Elefteriades JA, Hartleroad J, Gusberg RJ, et al. Long-term experience with descending aortic dissection: the complication-specific approach. Ann Thorac Surg. 1992;53:11-21. 20. Cinà CS, Abouzahr L, Arena GO, et al. Cerebrospinal fluid drainage to prevent paraplegia during thoracic and thoracoabominal aortic aneurysm surgery: a systemic review and meta-analysis. J Vasc Surg. 2004;40:36-44. 21. Novero ER, Metzger PB, Angelieri FMR, et al. Correção endovascular do aneurisma da aorta abdominal: análise dos resultados de único centro. Radiol Bras. 2012;45:1-6. 22. Stone DH, Brewster DC, Kwolek CJ, et al. Stentgraft versus open-surgical repair of the thoracic aorta: mid-term results. J Vasc Surg. 2006;44:1188-97. 23. Fattori R, Nienaber CA, Rousseau H, et al. Results of endovascular repair of the thoracic aorta with the Talent Thoracic stent graft: the Talent Thoracic Retrospective Registry. J Thorac Cardiovasc Surg. 2006;132:332-9. 24. Nienaber CA, Rousseau H, Eggebrecht H, et al. Randomized comparison of strategies for type B aortic dissection: the INvestigation of STEnt Grafts in Aortic Dissection (INSTEAD) trial. Circulation. 2009;120:2519-28. 1. Cardiologistas Intervencionistas, Médicos Aprimorandos estrangeiros do Centro de Intervenções Endovasculares (CIEV) do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil. 2. Cirurgião Vascular, Médico Aprimorando do Centro de Intervenções Endovasculares (CIEV) do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil. 3. Cardiologista, Médica Residente de Ecografia Vascular do Hospital do Servidor Público Estadual "Francisco Morato de Oliveira" (HSPE), São Paulo, SP, Brasil. 4. Doutor, Médico Assistente da Seção Médica de Cirurgia Vascular, Membro do Centro de Intervenções Endovasculares (CIEV) do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil. 5. Cirurgião Vascular, Médico Assistente da Seção Médica de Radiologia, Membro do Centro de Intervenções Endovasculares (CIEV) do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil. 6. Doutor, Chefe da Seção Médica de Cirurgia Vascular e do Centro de Intervenções Endovasculares (CIEV) do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil. 7. Doutor, Chefe da Seção Médica de Radiologia e do Centro de Intervenções Endovasculares (CIEV) do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil. Endereço para correspondência: Dr. Patrick Bastos Metzger Instituto Dante Pazzanese de Cardiologia Rua Doutor Dante Pazzanese, 500, Vila Mariana São Paulo, SP, Brasil, 04012-180 E-mail: patrickvascular@gmail.com Recebido para publicação em 6/4/2012. Aceito, após revisão, em 9/8/2012. * Trabalho realizado no Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554