Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 45 nº 1 - Jan. / Fev. of 2012
Vol. 45 nº 1 - Jan. / Fev. of 2012
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Eduardo Rafael Novero1; Patrick Bastos Metzger2; Fernanda Maria Resegue Angelieri2; Marcelo Bueno de Oliveira Colli2; Samuel Martins Moreira3; Nilo Mitsuru Izukawa4; Fabio Henrique Rossi5; Antonio Massamitsu Kambara6 |
|
|
Descritores: Aneurisma; Prótese vascular; Arterioesclerose. |
|
|
Resumo: INTRODUÇÃO
Os aneurismas da aorta abdominal (AAA) infrarrenal ocorrem em 1% das mulheres e em 6% dos homens acima dos 64 anos de idade. Sua ruptura é fatal em 80% a 90% dos casos quando as mortes pré-hospitalares são incluídas(1). O tratamento desta doença tem apresentado muitos progressos. Sem dúvida, a técnica endovascular, inicialmente apresentado por Parodi e posteriormente desenvolvida por muitos pesquisadores, possibilitou a oferta de tratamento a pacientes de alto risco para o tratamento cirúrgico aberto convencional. Atualmente, com a experiência acumulada e o desenvolvimento de endopróteses mais seguras e flexíveis, o tratamento endovascular pode ser considerado uma alternativa mesmo em pacientes de risco cirúrgico e com características anatômicas favoráveis ao tratamento cirúrgico aberto convencional(2). O reparo endovascular tem indicação precisa em pacientes com alto risco cirúrgico, em idosos e em casos que existe dificuldade anatômica à abordagem cirúrgica aberta (abdome hostil). O reparo cirúrgico aberto é considerado efetivo e definitivo, com taxas de falência do enxerto de apenas 0,3% ao ano. No entanto, esta técnica possui taxas de morbimortalidade não desprezíveis, com período de recuperação muitas vezes prolongado, que pode chegar a vários meses, caso haja complicações. Em contrapartida, sabemos que a taxa de reintervenções no tratamento endovascular não é desprezível, e maior quando comparada ao tratamento por cirurgia aberta(3—6). O objetivo deste estudo é avaliar os resultados clínicos imediatos e em médio prazo do tratamento endovascular em pacientes portadores de AAA infrarrenal em um centro de referência para doenças cardiovasculares. MATERIAIS E MÉTODOS Tipo de estudo Trata-se de um estudo retrospectivo, longitudinal, observacional, realizado no Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, no período de janeiro de 2009 a julho de 2010, em que foram avaliados os resultados de 102 pacientes submetidos a reparo endovascular de AAA. Critérios de inclusão e exclusão Foram incluídos pacientes de ambos os sexos, assintomáticos ou sintomáticos, com indicação de correção de AAA, com diâmetro > 55 mm no sexo masculino ou 50 mm no sexo feminino, e correção de vazamento tipo I ou tipo III em pacientes tratados previamente. Foram excluídos do estudo pacientes com colo proximal de extensão < 15 mm, presença de trombo ou calcificação superior a 50% do diâmetro do colo, angulação do colo superior a 65º, bifurcação aortoilíaca > 90º, diâmetro das artérias ilíacas externas < 7 mm, creatinina sérica > 2,0 mg/dl ou clearance de creatinina < 30 ml/min (Figura 1). 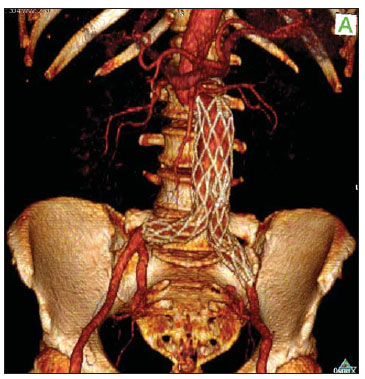 Figura 1. Controle tomográfico de um mês da correção endovascular de AAA. Colo aneurismático de 60° e bifurcação aortoilíaca de 65°. Os pacientes que apresentaram estes pré-requisitos foram considerados como tendo anatomia favorável e encaminhados para tratamento endovascular de forma consecutiva. A avaliação do risco cardiológico e/ou anestésico não foi considerada na inclusão ou exclusão dos pacientes. O diagnóstico e a programação terapêutica foram baseados em angiotomografia em todos os casos, sendo a arteriografia pré-operatória o método diagnóstico opcional. Técnica cirúrgica Todos os procedimentos foram realizados no Laboratório de Hemodinâmica do Instituto Dante Pazzanese de Cardiologia. Os pacientes foram tratados sob anestesia geral inalatória. A profilaxia antimicrobiana foi realizada com 1,5 g de cefuroxima, no momento da indução anestésica. A abordagem preferencial foi pela artéria femoral comum, uni ou bilateral, conforme o tipo de intervenção ou endoprótese escolhida. Na impossibilidade desta, foi realizada abordagem da artéria ilíaca externa por acesso retroperitoneal. O controle radiográfico foi realizado com aparelho Artis flat panel (Siemens; Munique, Alemanha). Foram utilizados os seguintes dispositivos: AnacondaTM (Vascutek, Terumo; Inchinnan, Escócia), AorfixTM (Lombard Medical Technologies PLC; Oxfordshire, UK), Apolo® (Nano; Florianópolis, SC, Brasil), EndurantTM (Medtronic; Minneapolis, MN, EUA), Excluder® (Gore Medical; Flagstaff, AZ, EUA), PowerLink System® (Endologix; Irvine, CA, EUA), Talent® (Medtronic; Minneapolis, MN, EUA), Zenith Flex® (Cook Medical; Bloomington, IN, EUA). Foi realizada arteriografia intraoperatória em todos os pacientes. O pós-operatório imediato foi realizado em unidade de terapia intensiva em todos os casos. Acompanhamento pós-operatório Os pacientes foram acompanhados com avaliação ambulatorial após 15, 30, 180 e 360 dias após a correção. Após o primeiro ano, as consultas foram realizadas anualmente. Angiotomografia foi realizada no 1º mês e no 12º mês de seguimento ambulatorial. O ultrassom color Doppler foi realizado quando houve contraindicação à realização da angiotomografia. Desfechos e definições Os desfechos primários e secundários avaliados foram assim definidos: 1 — Sucesso técnico: quando o objetivo de liberar a endoprótese na área acometida foi cumprido, com ou sem vazamentos ou outras intercorrências que influenciassem na evolução favorável do aneurisma. 2 — Sucesso terapêutico: quando a liberação da endoprótese ocorreu sem vazamentos ou outras intercorrências que repercutissem na evolução favorável do aneurisma. 3 — Mortalidade perioperatória: quantidade de óbitos registrados dentro dos primeiros 30 dias pós-procedimento. 4 — Mortalidade anual: quantidade de óbitos ocorridos dentro dos 12 meses de acompanhamento. 5 — Complicações periprocedimento: a) intraoperatórias — as complicações ocorridas na sala de hemodinâmica durante a intervenção; b) intra-hospitalares — as complicações ocorridas durante a internação, fora da sala de hemodinâmica e dentro dos 30 dias após intervenção. 6 — Taxa de reintervenção: intervenções realizadas para manutenção do funcionamento adequado da endoprótese e exclusão do saco aneurismático, ou para resolução de complicações associadas à intervenção. Desfechos secundários 1 — Tempo de internação: período de tempo entre a admissão hospitalar e a alta hospitalar. 2 — Tempo do procedimento: período de tempo do início da indução anestésica ao fechamento do sítio cirúrgico operatório. Vazamentos 1 — Vazamento inicial ou primário: os originados durante o procedimento inicial ou diagnosticados dentro dos primeiros 30 dias. 2 — Vazamento secundário: os diagnosticados após 30 dias do procedimento inicial. RESULTADOS Este seguimento foi composto por 102 pacientes submetidos a correção de AAA infrarrenal. A idade média dos pacientes foi de 72 ± 9 anos, sendo que 79% eram do sexo masculino. O fator de risco predominante foi a hipertensão em 100 pacientes (99%), 23 (22%) eram diabéticos, 23 (22%) eram tabagistas, 47 (46%) eram ex-tabagistas e 51 (50%) pacientes tinham dislipidemia. A obesidade com índice de massa corpórea > 40 estava presente em 5 pacientes (4,9%) da população estudada. Entre as comorbidades presentes, encontramos alta incidência de cardiopatia isquêmica (57,8%), e em menor grau, insuficiência renal crônica (14,7%). Observamos também uma porcentagem significativa de pacientes com correção prévia endovascular de aneurismas aórticos (12,7%) (Tabela 1). 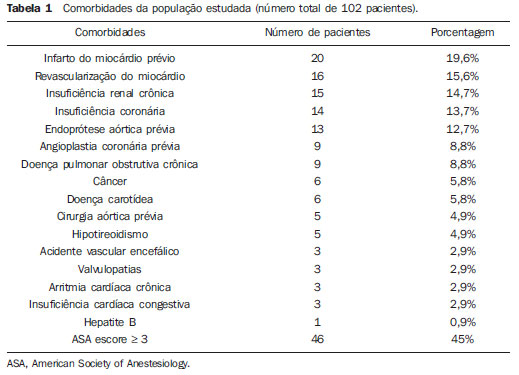 A maioria dos pacientes (76%) foi tratada de forma eletiva (assintomáticos abdominais) e 24% foram tratados de urgência devido a sintomas de alarme (dor abdominal ou sinais tomográficos de iminência de ruptura aneurismática). O aneurisma foi a indicação de tratamento em 88,2% dos casos e a correção de endoleak em AAA em 11,8%. A morfologia dos aneurismas foi predominantemente fusiforme, encontrada em 98 pacientes (96,1%), sendo saculares apenas em 4 casos (3,9%). Os tipos de aneurismas tratados, de acordo com a classificação usada no estudo EUROSTAR, foram: tipo A em 28 pacientes (27,4%); tipo B em 48 pacientes (47,0%); tipo C em 10 pacientes (9,8%); tipo D em 13 pacientes (12,7%); tipo E em 1 paciente (1%). Em 2 casos (2%) a indicação foi a correção de pseudoaneurisma de aorta abdominal (Figura 2). O diâmetro médio dos aneurismas foi de 61 ± 1,0 mm. 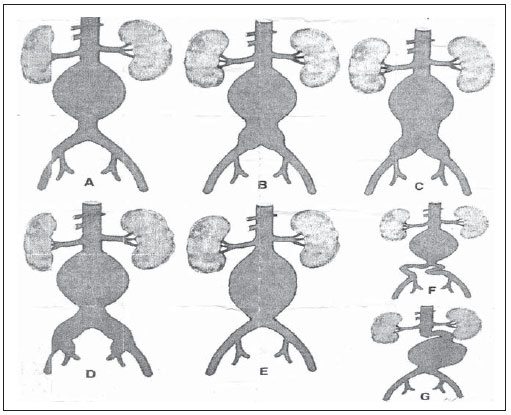 Figura 2. Classificação de AAA – estudo EUROSTAR. O principal modelo de endoprótese foi a bifurcada, utilizada em 98% dos casos, sendo usado o padrão monoilíaco em apenas 2 pacientes (2%). Os dispositivos mais utilizados foram: 23 (22,5%) Talent, 19 (18,6%) PowerLink System, 19 (18,6%) Zenith Flex, 17 (16,7%) Excluder, 9 (8,8%) Endurant, 8 (7,8%) Anaconda, 5 (4,9%) Aorfix, 2 (2%) Apolo. Anestesia geral inalatória foi utilizada em todos os casos. O sucesso técnico foi de 97,1%, em 99 pacientes foi possível liberar a endoprótese no local desejado. Em três casos não foi possível o avanço da endoprótese para o local desejado, em razão de dificuldades técnicas ou anatômicas (calcificações ou tortuosidades). O sucesso terapêutico foi de 81%, ou seja, em 83 pacientes a prótese foi liberada sem vazamentos ou outras intercorrências que repercutissem na evolução favorável da intervenção. Em 16 casos (15,7%) houve a necessidade de realizar embolização de uma artéria hipogástrica. Em nenhum caso foi observada isquemia pélvica, intestinal ou disfunção erétil relatada durante o acompanhamento. A taxa de complicação foi de 19%, registrando-se como complicações intraoperatórias mais frequentes: sangramento ativo no sítio operatório em 6 casos (5,8%), lesão femoral em 3 casos (2,9%), embolia periférica em 3 casos (2,9%) e oclusão de uma artéria renal em 2 casos (1,9%), sem desfecho para insuficiência renal crônica nestes pacientes. As complicações pós-operatórias intra-hospitalares foram: infecções em 4 casos (3,9%), sendo 2 infecções de ferida operatória (50%) e 2 do trato respiratório (50%), e insuficiência renal aguda em 2 pacientes (1,9%). A mortalidade perioperatória foi de 0,9%. Ocorreu um óbito em paciente submetido a correção aórtica de urgência, por ruptura aneurismática. A taxa total de vazamento foi de 19,6%, sendo os vazamentos tipos I e III presentes em 16,6%. Não houve casos de migração de endoprótese durante o seguimento dos pacientes. A taxa de reintervenção em um ano foi de 18,8%, decorrente de tratamento de vazamentos tipo I ou tipo III (Tabelas 2 e 3). A mortalidade anual, durante nosso acompanhamento, foi de 7,8%. Um óbito foi de causa vascular (Figura 3). 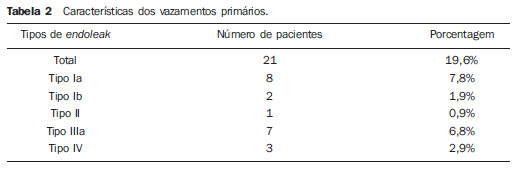 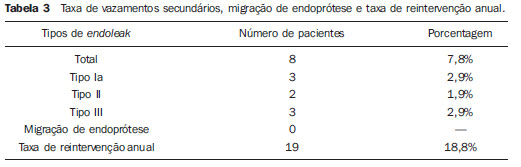 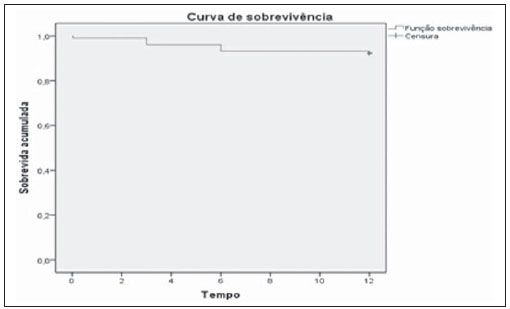 Figura 3. Sobrevida em médio prazo. Estimativa de probabilidade de sobrevivência (método de Kaplan- Meier). Tempo expresso em meses. O tempo médio de procedimento foi de 93 minutos (variando de 65 a 130 minutos), e o tempo de internação médio foi de 5,2 dias, com variação de 9 dias. DISCUSSÃO A correção endovascular do AAA evoluiu na última década como alternativa à cirurgia aberta. O impacto dos novos dispositivos e a experiência de duas década de aprendizado têm tradução na taxa de mortalidade operatória, que se reduz significativamente de acordo com as diversas publicações(7,8). O estudo EVAR-I(9) demonstrou diminuição da mortalidade perioperatória de 4,7% para o reparo aberto contra 1,7% no tratamento endovascular, significando uma redução relativa de risco de 65%. O estudo EUROSTAR(10) apresentou mortalidade de 30 dias de 1,7% para o tratamento minimamente invasivo, ao passo que o estudo DREAM(11) apresentou 4,6% de mortalidade perioperatória para cirurgia aberta versus 1,2% para o tratamento endovascular. Autores brasileiros relatam uma diminuição menos significativa, de 6,5% versus 5,5%, com o tratamento convencional e endovascular, respectivamente(12,13). Em nossa experiência, a taxa de mortalidade de 30 dias foi de 0,9%. Um paciente faleceu durante intervenção de um AAA roto. A mortalidade operatória para cirurgia de AAA roto é de mais de 40% para cirurgia aberta(14). Grandes estudos randomizados que comparam a cirurgia aberta versus o tratamento endovascular neste tipo de urgência médica estão sendo aguardados, como o estudo IMPROVE(15). A mortalidade anual no presente estudo foi de 7,8% (Figura 3). Houve um óbito de causa vascular, relacionado a ruptura aneurismática. A comorbidade mais frequente foi a cardiopatia isquêmica, com grande número de pacientes com infarto miocárdico prévio, revascularização miocárdica e angioplastia coronária (Tabela 1). A morte de causa cardíaca foi predominante, sendo o choque cardiogênico e a parada cardíaca os mais prevalentes. O êxito da técnica endovascular depende da exclusão continuada do saco aneurismático(7). O posicionamento e a liberação da endoprótese para tal fim nem sempre são possíveis, destacando-se a importância dos exames complementares prévios à intervenção que avaliam tal factibilidade, como a angiotomografia e a arteriografia. Por meio destes exames, a análise do diâmetro do aneurisma, a avaliação anatômica do colo proximal e distal e os acessos ilíacos e femorais são realizados, prática indispensável neste tipo de intervenção. O êxito técnico foi de 97,1%, pois em três pacientes não foi possível posicionar e liberar as endopróteses. Nestes casos, o grau de tortuosidade e calcificação dos acessos foi subestimado. No trabalho EUROSTAR(10) a impossibilidade de avançar o sistema de liberação da endoprótese ocorreu em 0,8% dos casos. O objetivo primário de todo tratamento endovascular do aneurisma de aorta é a prevenção da ruptura aneurismática e da morte potencialmente associada. Outros objetivos incluem a diminuição do tamanho aneurismático e a ausência de vazamentos como marcadores de risco continuado de ruptura. A taxa de êxito terapêutico inicial foi de 81%, medida em função da incidência de vazamento nos procedimentos primários. No estudo EUROSTAR(10), a incidência de vazamentos iniciais foi de: vazamento tipo I, 4,4%; tipo II, 9%; tipo III, 2,4%. Em nossa população houve 19,6% de vazamento inicial. Desta porcentagem, foram constatados: tipo Ia, 7,8% (8 casos); tipo Ib, 1,9% (2 casos); tipo II, 0,9% (1 caso); tipo III, 6,8% (7 casos); tipo IV, 2,9% (3 casos). Essa alta taxa de vazamentos iniciais foi analisada detalhadamente. A porcentagem de vazamentos tipos I e III foi de 16%. Na população que apresentou vazamento tipo I, encontramos 6 pacientes com grau de vazamento mínimo, que cedeu espontaneamente no seguimento tomográfico de um mês. Em 3 casos de vazamentos tipo III foi achado o mesmo fenômeno. Isto reduz sensivelmente a porcentagem de reintervenções por vazamento para 11%, taxa similar a de outros registros. Ao analisar os colos aneurismáticos nos pacientes com vazamento tipo I, observamos que 4 pacientes tinham colos com comprimento entre 15 e 17 mm, 2 pacientes tinham formatos cônicos e em 4 casos o ângulo era próximo a 65º. Stanley et al., em um dos seus mais importantes estudos, analisaram a morfologia dos aneurismas como preditora de vazamentos e complicações, demonstrando que a presença de morfologia diferentes das recomendadas aumentava em quatro vezes a presença de vazamento tipo I, e a desobediência a mais de uma recomendação multiplicava este risco(16). Sem dúvida, em alguns casos exploramos o limite da intervenção terapêutica endovascular. Segundo May et al., cerca de 20% dos pacientes tratados por via endovascular apresentam complicações intraoperatórias. Algumas complicações estão relacionadas em uma proporção inversa ao comprimento do colo aneurismático, ou seja, quanto menor a extensão do colo do aneurisma, mais difícil é a acomodação do dispositivo endovascular(17). Assim, também, quanto maior o número de comorbidades, mais prováveis serão as intercorrências intra e pós-operatórias. O estudo DREAM, que comparou a mortalidade operatória e complicações em tratamento cirúrgico com o tratamento endovascular em 30 dias, concluiu que o tratamento endovascular é preferível em razão das baixas taxas de mortalidade, complicações e também pela significativa redução de complicações sistêmicas(11). No estudo EVAR-I a taxa de complicações foi de 35%, enquanto no estudo EVAR-II foi de 33%(9,18). Em nossa casuística, a taxa de complicação total foi de 19% dentro de 30 dias periprocedimento. O sangramento intraoperatório do sítio cirúrgico esteve presente em 6 casos (5 casos em nível de região inguinal e 1 caso de hematoma retroperitoneal) e as lesões femorais em 3, sendo estas as mais frequentes complicações. Sem dúvida, o perfil dos materiais utilizados, aliado às práticas cirúrgicas desfavoráveis, têm influência nesta taxa. As reintervenções são realizadas para manter a função da endoprótese e em alguns casos para resolução de complicações remotas. Segundo Sampram et al.(19), as principais indicações são: a) vazamentos; b) migração da endoprótese; c) oclusão de ramos ilíacos; d) hemorragias pós-operatórias; e) oclusão renal. Menos frequentes são as embolizações distais, infecções e rupturas aneurismáticas. No presente estudo, a maior parte das reintervenções foi por vazamentos referentes ao procedimento inicial (11%) e em menor grau por endoleaks secundários (7,8%), surgidos após 30 dias. Nossa taxa anual de reintervenção foi de 18,8%. O estudo EVAR-I apresentou taxa de reintervenção em quatro anos de 20%, e o EVAR-II, de 26%. Já os estudos DREAM e EUROSTAR apresentaram taxas de 14,3% e 13,5% em três anos de seguimento, respectivamente(9—11,18). O estudo DREAM mostrou que a taxa de reintervenção foi três vezes maior nos primeiros nove meses para o tratamento endovascular, em comparação com a cirurgia aberta, igualando-se este índice aos dois anos de seguimento(11). Nesse estudo, o principal motivo para reintervenção foram os vazamentos tipos I e II. Drury et al. apresentam taxa de reintervenção por vazamento inicial de 17,5%, sendo 3,5% de vazamentos tipo I e 14% de vazamentos tipo II. Aos 12 meses, a taxa de vazamento foi de 21%, com os aumentos dos vazamentos tipo I (6,8%) e tipo III e diminuição dos vazamentos tipo II. A taxa global de intervenções secundárias anual foi de 16,2%(20). Em nossa casuística, as porcentagens de vazamentos secundários foram: tipo I, 2,9%; tipo II, 1,9%; tipo III, 2,9%; mantendo altos os índices de endoleak tipos I e III como causas de reintervenções durante o seguimento de um ano. No estudo EUROSTAR, com seguimento de cinco anos, a indicação de reintervenção principal foi o endoleak tipo II, seguido do tipo III(10). Destacamos que em nossa casuística o paciente que apresentou vazamento tipo II não foi reabordado, por não se constatar aumento tomográfico do saco aneurismático, assim como nos vazamentos tipo IV não foram observados vazamentos tomográficos adicionais durante o seguimento, interpretando-se como de resolução espontânea. CONCLUSÃO Estes resultados obtidos através do tratamento endovascular do AAA são associados a baixos índices de complicações em curto e médio prazos. Esses índices de complicações e de reintervenção são semelhantes aos obtidos em outros centros de referência nacionais e internacionais. Estes resultados justificam a realização desse procedimento nos pacientes com anatomia adequada. REFERÊNCIAS 1. Mastracci TM, Cinà CS; Canadian Society for Vascular Surgery. Screening for abdominal aortic aneurysm in Canada: review and position statement of the Canadian Society for Vascular Surgery. J Vasc Surg. 2007;45:1268—76. 2. Parodi JC, Palmaz JC, Barone HD. Transfemoral intraluminal graft implantation for abdominal aortic aneurysms. Ann Vasc Surg. 1991;5:491—9. 3. Lederle FA, Wilson SE, Johnson GR, et al. Immediate repair compared with surveillance of small abdominal aortic aneurysms. N Engl J Med. 2002;346:1437—44. 4. Hallett JW Jr, Marshall DM, Petterson TM, et al. Graft-related complications after abdominal aortic aneurysm repair: reassurance from a 36-year population-based experience. J Vasc Surg. 1997;25:277—84. 5. Johnston KW. Nonruptured abdominal aortic aneurysm: six-year follow-up results from the multicenter prospective Canadian aneurysm study. Canadian Society for Vascular Surgery Aneurysm Study Group. J Vasc Surg. 1994;20:163—70. 6. Silvestre JMS, Motta F, Sardinha WE, et al. Endovascular treatment of infrarenal abdominal aortic aneurysm in patients with favorable anatomy for the repair — initial experience in a university hospital. J Vasc Bras. 2011;10:31—9. 7. Matsumura JS, Brewster DC, Makaroun MS, et al. A multicenter controlled clinical trial of open versus endovascular treatment of abdominal aortic aneurysm. J Vasc Surg. 2003;37:262—71. 8. Blankensteijn JD, de Jong SE, Prinssen M, et al. Two-year outcomes after conventional or endovascular repair of abdominal aortic aneurysms. N Engl J Med. 2005;352:2398—405. 9. Greenhalgh RM, Brown LC, Kwong GP, et al. Comparison of endovascular aneurysm repair with open repair in patients with abdominal aortic aneurysm (EVAR trial 1), 30-day operative mortality results: randomised controlled trial. Lancet. 2004;364:843—8. 10. Harris PL, Vallabhaneni SR, Desgranges P, et al. Incidence and risk factors of late rupture, conversion, and death after endovascular repair of infrarenal aortic aneurysms: the EUROSTAR experience. European Collaborators on Stent/graft techniques for aortic aneurysm repair. J Vasc Surg. 2000;32:739—49. 11. Prinssen M, Verhoeven EL, Buth J, et al. A randomized trial comparing conventional and endovascular repair of abdominal aortic aneurysms. N Engl J Med. 2004;351:1607—18. 12. Mendonça CT, Moreira RCR, Timi JRR, et al. Comparação entre os tratamentos aberto e endovascular dos aneurismas da aorta abdominal em pacientes de alto risco cirúrgico. J Vasc Bras. 2005;4:232—42. 13. Mendonça CT, Moreira RCR, Carvalho CA, et al. Tratamento endovascular de aneurismas da aorta abdominal em pacientes de alto risco cirúrgico. J Vasc Bras. 2009;8:56—64. 14. Pae SJ, Carr JA. Ruptured abdominal aortic aneurysm in community practice: age and operative variables predict survival. Am Surg. 2007;73:912—6. 15. IMPROVE Trial, Powell JT, Thompson SG, Thompson MM, et al. The immediate management of the patient with rupture: open versus endovascular repair (IMPROVE) aneurysm trial — ISRCTN 48334791 IMPROVE trialists. Acta Chir Belg. 2009;109:678—80. 16. Stanley BM, Semmens JB, Mai Q, et al. Evaluation of patient selection guidelines for endoluminal AAA repair with the Zenith Stent-Graft: the Australasian experience. J Endovasc Ther. 2001;8:457—64. 17. May J, White GH. Endovascular treatment of aortic aneurysm. In: Rutherford RB, editor. Vascular surgery. 5th ed. Philadelphia, PA: WB Saunders; 2000. p. 1281—95. 18. EVAR trial participants. Endovascular aneurysm repair and outcome in patients unfit for open repair of abdominal aortic aneurysm (EVAR trial 2): randomised controlled trial. Lancet. 2005;365:2187—92. 19. Sampram ES, Karafa MT, Mascha EJ, et al. Nature, frequency, and predictors of secondary procedures after endovascular repair of abdominal aortic aneurysm. J Vasc Surg. 2003;37:930—7. 20. Drury D, Michaels JA, Jones L, et al. Systematic review of recent evidence for the safety and efficacy of elective endovascular repair in the management of infrarenal abdominal aortic aneurysm. Br J Surg. 2005;92:937—46. 1. Médico Cardiologista Intervencionista, Aprimorando estrangeiro do Centro de Intervenções Endovasculares (CIEV) do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil. 2. Médicos Cirurgiões Vasculares, Aprimorandos do Centro de Intervenções Endovasculares (CIEV) do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil. 3. Médico Cirurgião Vascular e Endovascular, Assistente da Seção Médica de Radiologia do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil. 4. Doutor, Chefe da Seção Médica de Cirurgia Vascular do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil. 5. Doutor, Médico Assistente da Seção Médica de Cirurgia Vascular do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil. 6. Doutor, Membro Titular do Colégio Brasileiro de Radiologia e Diagnóstico por Imagem (CBR), Chefe da Seção Médica de Radiologia do Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil. Endereço para correspondência: Dr. Patrick Bastos Metzger Centro de Intervenções Endovasculares (CIEV) Avenida Doutor Dante Pazzanese, 500, Vila Mariana São Paulo, SP, Brasil, 04012-909 E-mail: patrickvascular@gmail.com Recebido para publicação em 12/9/2011. Aceito, após revisão, em 8/11/2011. Trabalho realizado no Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554