Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 44 nº 6 - Nov. / Dez. of 2011
Vol. 44 nº 6 - Nov. / Dez. of 2011
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Marília Tavares Christóvão1;Tarcisio Passos Ribeiro de Campos2;Bruno Machado Trindade3 |
|
|
Descritores: Radioterapia por íons de carbono; Protonterapia; Geant4; Siscodes. |
|
|
Resumo: INTRODUÇÃO
O melanoma uveal, tumor ocular primário de maior incidência, vem apresentando importante modificação em seu tratamento ao longo do tempo, com a crescente introdução de modalidades que propiciam a conservação do globo ocular, como a ressecção local, a braquiterapia e a radioterapia externa. A utilização de próton e íon de carbono na radioterapia externa apresenta-se vantajosa na medida em que proporciona uma forma espacial de deposição de energia ionizante predominante no final do percurso das partículas incidentes, representada por uma curva cuja maior amplitude é conhecida como pico de Bragg(1). A profundidade de ocorrência do pico de Bragg é dependente da energia inicial da partícula incidente, e dessa forma, a posição de deposição máxima de energia ionizante é controlada pela velocidade inicial da partícula incidente. Como consequência, pode-se preservar os tecidos sadios em região prévia e posterior ao pico de Bragg, ampliar a dose no tecido alvo e obter maior taxa de controle tumoral, através da variação de parâmetros físicos aplicados na terapia. Na terapia de íons de carbono, feixes são em geral aplicados no formato estreito denominado pencil beam. A energia absorvida é depositada sobre todo o alvo através de múltiplos pencil beams de partículas com energias incidentes cobrindo um espectro amplo, com menor radiação lateral e espalhada, se comparado com feixes de prótons. Entretanto, íons de carbono apresentam ionização após o pico de Bragg, expondo regiões imediatamente posteriores ao pico, com doses que correspondem a 10% a 20% do valor presente no pico de Bragg(1). A terapia por íons de carbono é indicada nas lesões T2 e T3(2) localizadas a uma distância menor ou igual a 3 mm do disco óptico e para tumores resistentes a prótons e fótons(3), conforme descrito na Tabela 1. 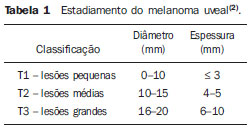 A alta dose de radiação aplicada com precisão, aliada à alta LET do feixe de íons de carbono, aumenta o controle tumoral, fator essencial para obter resultados satisfatórios no tratamento(4,5). O objetivo do presente artigo é a avaliação dosimétrica da radioterapia por feixes pencil beams de íons de carbono e de prótons em tumores oculares. Serão expostos resultados de simulações computacionais baseadas no código Geant4 (GEometry ANd Tracking), utilizado para simulação de transporte de partículas na matéria. MATERIAIS E MÉTODOS Ambiente computacional e ferramentas de software utilizadas A partir do modelo de uma típica instalação de tratamento de hadronterapia, definido no Geant4, módulos foram desenvolvidos e integrados com a finalidade de simular o ambiente de radioterapia, utilizando feixe de íons de carbono. Foi definido como alvo um modelo de olho discretizado em voxels originado do projeto denominado Visible Man Project (VMP)(6), adaptado e importado para o sistema Siscodes (sistema computacional para dosimetria em radioterapia)(7), por Mourão e Campos(8), e implementado no código Monte Carlo N-particle transport code system (MCNP) versão 5. O Siscodes é um sistema para elaboração e simulação computacional de planejamentos radioterápicos, operando como interface para o MCNP, que emprega métodos estocásticos para avaliação da dose depositada(7). O modelo tridimensional da região ocular foi utilizado para gerar os perfis de dose em profundidade e as curvas de isodose. No modelo de voxel da região ocular foram representadas as principais estruturas da região ocular, como bulbo ocular, músculos e nervo óptico. Este é um modelo não isotrópico composto por 82 × 100 × 43 voxels, que corresponde a um volume de 41 × 50 × 38,7 mm3, representando uma matriz cujo elemento de volume tem dimensões de 0,5 × 0,5 × 0,9 mm3(8). O material adotado para cada voxel onde ocorreu o transporte de íons de carbono e prótons foi a água; entretanto, as isodoses foram plotadas em superposição ao material presente no fantoma ocular. Em consideração ao detalhamento do estudo da protonterapia com base neste ambiente computacional, foram publicadas avaliações dosimétricas dedicadas à protonterapia(9). Neste estudo, para fins de comparação entre diferentes modalidades terapêuticas, as simulações utilizando feixes de íons de carbono e de prótons foram produzidas a partir das mesmas ferramentas, modelo e ambiente computacional. Parâmetros de simulação aplicados O sistema de liberação das partículas do feixe utilizado nas simulações foi do tipo passivo, conforme parâmetros definidos na aplicação de hadronterapia do Geant4. O sistema passivo emprega dispositivos ao longo da linha de irradiação para produzir um campo de dose homogêneo e para degradar e modular a energia do feixe(10). Desta forma, para as simulações com feixe de prótons foi utilizado o sistema passivo, em que a posição de entrada do feixe está no início da linha de irradiação e abrange todos os elementos da linha de irradiação, porém, o sistema de modulação não foi ativado. O alcance do feixe e a dose aplicada são definidos pelos parâmetros físicos dos componentes utilizados, como o material absorvedor e colimadores, sendo que a energia cinética dos prótons do feixe é definida em 62 MeV. Os parâmetros referentes à espessura do material absorvedor, constituído de polimetilmetacrilato (PMMA), aplicados na degradação dos feixes de prótons foram de 6,0 e 8,0 mm. O feixe pode ser deslocado nas coordenadas X e Y, alterando a posição do pico de Bragg no interior do bulbo ocular, simulando a irradiação em diferentes regiões do alvo. Em aplicações clínicas, para configurar o colimador, as dimensões do volume alvo devem ser consideradas. Para as simulações aplicando feixe de íons de carbono, a posição da fonte de íons está a 30 cm em relação ao alvo, utilizando apenas o colimador final, com diâmetro de 5,0 mm, como parte do sistema passivo. O alcance do feixe é definido pela energia empregada e o feixe foi deslocado, alterando o local da deposição da dose para simular a irradiação em diferentes regiões do alvo. Para íons, a energia específica das partículas incidentes é definida como a razão da energia total sobre o número de massa atômica (MeV.amu—1 ou MeV.u—1)(11). O número de partículas incidentes utilizado para as simulações com feixe de prótons é 100 vezes maior do que para o feixe de íons de carbono, de acordo com valores apresentados em instalação de hadronterapia(12,13). Um síncrotron acelera prótons até 250 MeV e íons de carbono até 430 MeV/u, com extração de até 1011 prótons por segundo e de 109 íons por segundo(12, 13). Para calcular a corrente de íons de carbono aplicada, deve-se considerar a carga de íons de carbono. Por sua vez, a energia cinética total dos íons foi obtida multiplicando-se a energia por unidade de massa pela massa do carbono-12. No planejamento radioterápico por íons pesados é definido um feixe pencil beam, cujo deslocamento é definido de acordo com o posicionamento e dimensão do alvo, considerando a preservação de estruturas sensíveis, como o nervo óptico, a glândula lacrimal e o cristalino. As simulações para dosimetria de feixes de prótons e íons de carbono seguiram um protocolo de pencil beam sem modulação. Dose absorvida em profundidade e perfis espaciais de taxa de dose Para os tratamentos radioterápicos, é essencial a avaliação da distribuição da dose no volume alvo, assegurando que a deposição de dose se limite ao alvo, preservando os tecidos sadios adjacentes. Para gerar os perfis de dose em profundidade e as curvas de isodose, foi empregado o modelo de olho implementado no sistema Siscodes(7). Os resultados das simulações no Geant4 foram traduzidos no Siscodes como superfícies de distribuição de dose em profundidade, superpostas ao modelo ocular de voxel. Os arquivos de saída da simulação registram informações da energia depositada nas coordenadas X, Y e Z do voxel nos formatos AIDA para geração de gráficos e histogramas de distribuição e em ASCII. O arquivo de saída da simulação no formato ASCII do Geant4 é tratado por meio de um programa específico desenvolvido in house, que converte o arquivo de saída do código para o formato do sistema Siscodes, em MCNP, e calcula a taxa de dose depositada em cada voxel através da razão entre a energia depositada em MeV pela massa especifica de cada voxel convertida em unidades de Gy/p. Este valor é ajustado pelo fator RBE, produzindo GyE/p (grays equivalente por partícula incidente). A unidade de dose recomendada para radioterapia de íons de carbono e de prótons é GyE, calculada pelo produto da dose física expressa em Gy pelo RBE, considerado como valor 3 para radioterapia por íons de carbono e 1,1 para protonterapia, seguindo recomendações de estudos clínicos(1,3,4,14). Da mesma forma, a taxa de dose total absorvida é multiplicada pelo RBE de íons de carbono ou prótons, cujo resultado é unidade de partícula incidente(4,15). A dose liberada pelo feixe de íons de carbono é depositada em uma geometria em voxel de material e formato definidos, e então convertida para o sistema Siscodes. A dose clínica, adotada para íons de carbono, é a dose aplicada em melanoma uveal, de 70 GyE em cinco sessões(3,4). Para o tratamento de melanoma uveal com prótons, a dose total aplicada é de 60 GyE, liberada em quatro frações de 15 GyE(14). RESULTADOS Simulações com feixe de íons de carbono Nas simulações produzidas sem modulação, com o processamento de 1,0 × 104 íons de carbono, foram evidenciados o alcance e a corrente aplicada. As energias do feixe de íons de carbono variaram de 62 a 90 MeV/u. Os alcances no volume alvo foram de 11,0 a 21,5 mm, respectivamente. Para cada energia cinética de partícula aplicada foram realizadas simulações com deslocamentos do feixe, atendendo posições radiais em 5,0 mm à direita e 7,0 mm à esquerda do centro da lente do olho do modelo de voxel. Os principais resultados apurados das simulações com feixe de íons de carbono, de acordo com a Tabela 2, foram: a dose máxima produzida por unidade de partícula incidente (DM) e a quantidade de íons de carbono incidentes e de corrente aplicada (nA) necessária para alcançar a dose de 14 GyE, correspondente a uma sessão no tratamento de melanoma ocular. Pode-se observar que a corrente do feixe necessária para atingir 14 GyE varia não linearmente com a energia total do próton incidente, no range de 1,14 a 1,53 nA. A menor corrente, de 1,14 nA × 10—4, ocorre para 840 MeV de carbono-12. 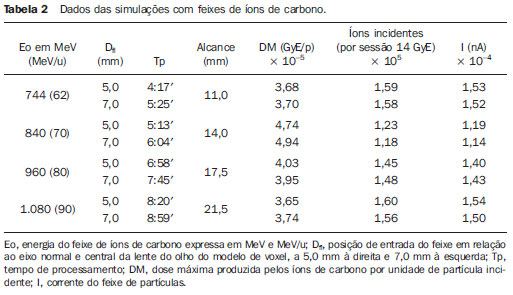 O pico de Bragg para feixes de carbono-12 mostrou-se bastante definido. Um típico pico de Bragg está reproduzido na Figura 1. Este pico foi gerado sem modulação do feixe, gerado pelo pencil beam de diâmetro do colimador final de 5,0 mm e deslocamento de 7,0 mm à esquerda do centro da lente do olho do modelo de voxel, com incidências de 1,0 × 104 íons de carbono e energia de 1.080 MeV ou 90 MeV/u. Neste caso, a dose máxima depositada resultante foi de 3,74 GyE/p, em tempo de processamento de 8 horas e 59 minutos. O alcance do pico de Bragg foi de 21,5 mm, conforme indicado no eixo X, que foi grafado em voxels de volume de 0,5 mm3. 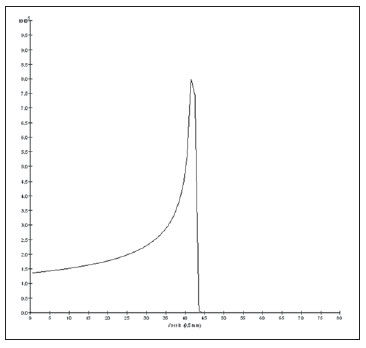 Figura 1. Perfil do pico de Bragg referente à energia 1.080 MeV (90 MeV/u) do feixe de íons de carbono, representada pela energia depositada em eV (× 105) versus múltiplos da profundidade do número de voxels em 0,5 mm. Da mesma forma que os picos de Bragg, as distribuições espaciais de dose das simulações no modelo ocular são bem definidas, com baixo espalhamento lateral. As Figuras 2 e 3 apresentam tais distribuições espaciais de dose geradas no Siscodes, com incidências de 1,0 × 104 íons de carbono, energias de 840 MeV (70 MeV/u) e 960 MeV (80 MeV/u), respectivamente. 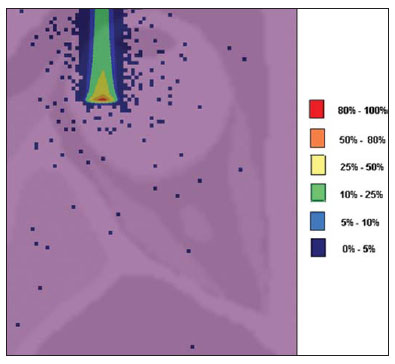 Figura 2. Distribuição espacial de isodoses superposta ao modelo de olho, gerada no Siscodes, referente à simulação executada com energia do feixe de íons de carbono de 840 MeV (70 MeV/u) e deslocamento do feixe de 7,0 mm à esquerda do centro da lente do olho do modelo de voxel. 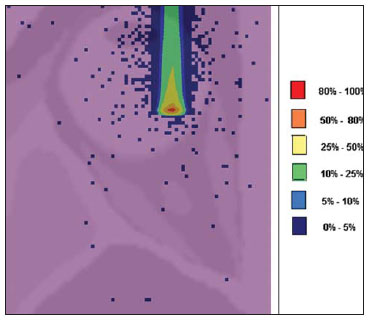 Figura 3. Distribuição espacial de isodoses superposta ao modelo de olho, gerada no Siscodes, referente à simulação executada com energia do feixe de íons de carbono de 960 MeV (80 MeV/u) e deslocamento do feixe de 5,0 mm à direita do centro da lente do olho do modelo de voxel. Nos casos representados pelas Figuras 2 e 3, as doses máximas depositadas foram de 4,94 e 4,03 GyE/p. Os percentuais de dose foram normalizados em função da dose máxima para uma entrada do feixe em posição, energia da partícula incidente e número de íons de carbono incidente. Os tempos de processamento foram de 6 horas e 4 minutos e 6 horas e 58 minutos, respectivamente. Simulações com feixe de prótons As simulações produzidas sem modulação, processando 1,0 × 106 prótons, foram elaboradas de forma comparativa às simulações com carbono. Para estas simulações, foram incluídos todos os dispositivos da linha de irradiação(10,14), sendo que a distância percorrida pelo feixe de prótons até o alvo equivale a 2,70 m. O diâmetro do colimador de 5,0 mm e a energia de 62 MeV foram mantidos para todas as simulações. O alcance do feixe atingiu 23,0 e 20,5 mm para aplicação de 6,0 e 8,0 mm de material absorvedor, respectivamente. Os principais resultados apurados são apresentados na Tabela 3. Estes foram a dose máxima produzida por unidade de partícula incidente (DM), a quantidade de prótons incidentes e a corrente aplicada (nA) necessárias para alcançar a dose de 15 GyE, correspondente a uma sessão no tratamento por protonterapia de melanoma ocular. Pode-se observar, neste caso, uma corrente de 3,91 a 5,54 nA. O número de prótons incidentes necessitou ser de 3,05 a 4,12 × 1010 para atingir a dose de 15 GyE nas posições de alcance máximo. 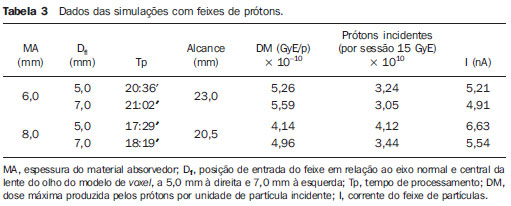 As distribuições espaciais de dose no modelo de olho foram também reproduzidas. As simulações foram executadas com feixe de prótons de energia de 62 MeV, com incidências de 1,00 × 106 prótons. Nos casos reproduzidos houve deslocamento do posicionamento de entrada do feixe de prótons. O material absorvedor aplicado foi o PMMA. As doses máximas depositadas foram de 4,14 e 5,59 GyE/p nos seus pontos máximos, reproduzidas nas Figuras 4 e 5, respectivamente. Os percentuais de dose foram normalizados em função da dose máxima para uma entrada do feixe em posição, energia da partícula incidente e número de prótons incidente. Os tempos de processamento foram de 17 horas e 29 minutos e 21 horas e 2 minutos. 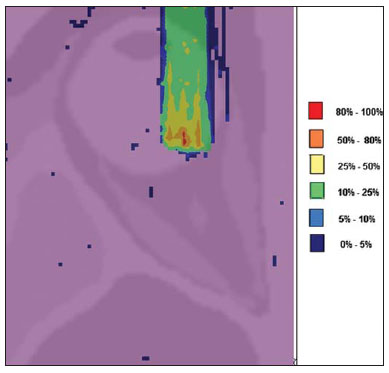 Figura 4. Distribuição espacial de isodoses superposta ao modelo de olho, gerada no Siscodes, referente à simulação executada sem modulação do feixe de prótons de 62 MeV e diâmetro colimador final de 5,0 mm. Deslocamento do feixe de 5,0 mm à direita e 8,0 mm de material absorvedor. 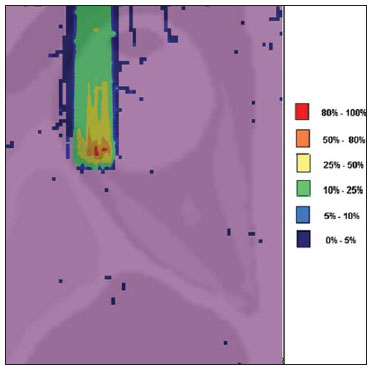 Figura 5. Distribuição espacial de isodoses superposta ao modelo de olho, gerada no Siscodes, referente à simulação executada sem modulação do feixe de prótons de 62 MeV e diâmetro colimador final de 5,0 mm. Deslocamento do feixe de 7,0 mm à esquerda e 6,0 mm de material absorvedor. O pico de Bragg da simulação de feixe de prótons de 62 MeV, com incidência de 1,00 × 106 prótons sem modulação, foi reproduzido. Neste caso, foi aplicado um colimador com diâmetro final de 5,0 mm, 6,0 mm de material absorvedor e deslocamento de 7,0 mm à esquerda do centro da lente do olho do modelo de voxel. A Figura 6 ilustra este pico. Esta simulação resultou em dose máxima depositada de 5,59 GyE/p. O alcance do pico de Bragg foi de 23,0 mm, presente em voxels de volume de 0,5 mm3. Nota-se um pico mais alargado que o pico de Bragg para carbono mostrado na Figura 1. 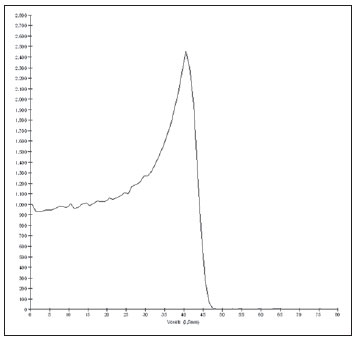 Figura 6. Perfil do pico de Bragg referente à energia 62 MeV do feixe de prótons sem modulação, representado pela energia depositada em eV versus múltiplos da profundidade do número de voxel em 0,5 mm. DISCUSSÃO Os parâmetros de processo de irradiação e dosimétricos aplicados nas simulações de terapia por íons de carbono ou prótons são compatíveis aos encontrados na literatura(1—4,14). As intensidades dos feixes incidentes e correntes de íons de carbono produzidas foram definidas de modo a possibilitar atingir a dose clínica para tratamento de melanoma uveal (70 GyE — cinco sessões de 14 GyE). Nos estudos de Koyama-Ho et al.(3) e Tsuji et al.(4), do Research Center Hospital for Charged Particle Therapy, National Institute of Radiological Sciences (NIRS), Chiba, Japão, pacientes com melanoma uveal foram submetidos a tratamentos com íons de carbono, com doses aplicadas de 60, 70, 77 e 85 GyE em cinco frações, conforme o tamanho do tumor, acuidade visual e distância do disco óptico(3,4). Esses autores investigaram a terapia de íons de carbono e empregaram uma energia cinética incidente de 140 MeV/u, considerando a configuração completa de sistema de liberação de feixe passivo, que inclui, dentre outros componentes, sistema de modulação e materiais absorvedores para a modulação e degradação da energia do feixe. No presente estudo, as energias empregadas foram de 744 MeV (62 MeV/u) a 1.080 MeV (90 MeV/u), inferiores à energia de 140 MeV/u, pelas características das configurações computacionais do modelo de olho aplicado(8) e da linha de irradiação(10), onde não foram ativados os dispositivos para modulação e degradação do feixe de íons, devido a limitações de distância entre a fonte de íons de carbono e o alvo. A intensidade de feixe e a corrente de carbono aplicadas na presente simulação foram comparáveis às aplicadas no NIRS, para atingir uma equivalente dose clínica para tratamento de melanoma uveal (60 GyE — quatro sessões de 15 GyE)(14). Cirrone et al.(14), do Centro di AdroTerapia e Applicazioni Nucleari Avanzate, na Itália, reportam tratamentos oculares com prótons. Um total de 47 pacientes com melanoma uveal foi submetido a tratamento com prótons, com dose aplicada de 60 GyE em quatro frações. De acordo com Cirrone et al.(10), do total de pacientes tratados, 60% foram casos de lesões T3(2). Os níveis de dose definem a corrente e a intensidade do feixe de irradiação. Da mesma forma, ambos os parâmetros foram equivalentes aos investigados nas simulações de prótons. Nas simulações com íons de carbono, de acordo com a Tabela 2, observa-se que mesmo mantendo uma incidência de feixe constante, a dose máxima absorvida não é diretamente proporcional à energia cinética da partícula incidente. Esta varia com a energia cinética incidente da partícula e com o número de partículas de entrada. Nas simulações, feixe de carbono de energia cinética de 840 MeV (70 MeV/u) produziu maior dose depositada por voxel, considerando a incidência de 1,0 × 104 íons de carbono. Assim, será necessário menor número de íons de carbono incidentes e de corrente para reproduzir uma fração terapêutica de 14 GyE, otimizando a utilização dos recursos da instalação. Por sua vez, os valores referentes às doses máximas depositadas, o número de íons de carbono incidentes e o valor da corrente aplicada variaram cerca de 24%, entre os valores máximos e mínimos de cada parâmetro, enquanto a diferença entre o maior valor de energia cinética do feixe incidente variou de 31%. O alcance em profundidade do pico de Bragg produzido por feixes de íons de carbono, bem como o de prótons, é dependente da energia inicial da partícula no feixe. Para íons de carbono, o alcance variou de 11 a 21,5 mm. Este fato é importante em ambas as situações, visto que a posição da dose absorvida máxima pode ser regulada por um parâmetro físico externo, que independe da anatomia e biologia do tumor, mas sim da energia cinética da partícula incidente. Pode-se dizer que os parâmetros físicos apresentados neste trabalho definem a faixa de operação da terapia por carbono nos protocolos terapêuticos. Nas simulações com feixe de carbono, a variação da energia cinética das partículas incidentes foi utilizada para atender profundidades distintas, ao passo que para as simulações com feixe de prótons foi utilizado um material absorvente para degradar a energia do feixe. O tempo de processamento nas simulações variou de 4 horas e 17 minutos a 8 horas, dependendo da energia empregada. Observa-se que o planejamento por radioterapia por íons pesados necessita de alto custo computacional. De acordo com a Tabela 3, o alcance do feixe de prótons varia conforme a espessura do material absorvedor, atingindo variação de 20,5 a 23,0 mm. Para a execução das simulações com feixe de prótons, as espessuras do material absorvedor utilizadas foram de 6 e 8 mm, porém em aplicações clínicas(14) a localização e as dimensões do volume alvo devem ser consideradas para configurar este parâmetro. Assim, para cada caso clínico deve-se definir a variação de espessura do material absorvedor, em cada posição de entrada do feixe de partículas. As doses máximas depositadas, mantendo-se o mesmo número de prótons incidentes e a corrente aplicada, variaram de acordo com a espessura do material absorvedor. Quanto mais espesso o material absorvedor, menor a dose absorvida; assim, para manter a dose preconizada constante independente da profundidade, o tempo de exposição deve aumentar com a espessura de material absorvedor. Nas simulações apresentadas, o número de partículas processadas para íons de carbono foi 100 vezes menor do que para prótons(12). Os valores médios das doses máximas foram 1,23 × 10—5 menor para prótons em relação ao feixe de íons de carbono, devido ao maior valor da carga e massa dos íons de carbono, que, consequentemente, causa maior ionização em sua interação. Dessa forma, são necessárias cerca de 3 × 105 partículas incidentes e 4 × 104 nA de corrente a mais para prótons em aplicações clínicas, em relação ao feixe de íons de carbono. Para as simulações executadas com a energia do feixe incidente de 62 MeV/u, o alcance para íons de carbono foi de 11 mm e para prótons foi de 23 mm e 20,5 mm, para 6 mm e 8 mm de material absorvedor, respectivamente. Considera-se que deve ser aplicada energia incidente igual ou maior a 90 MeV/u para íons de carbono, para alcançar a mesma profundidade que 62 MeV/u para prótons. CONCLUSÃO Os parâmetros empregados nas simulações, como energia cinética incidente das partículas, corrente, material absorvedor, modulador e colimador, auxiliaram na caracterização do perfil de dose absorvida em profundidade no globo ocular para feixes de prótons e íons de carbono. A caracterização destes parâmetros físicos é essencial no planejamento radioterápico, seguindo a distribuição geométrica do volume alvo. A integração das ferramentas de software nos diferentes ambientes computacionais, envolvendo o código Geant4 e suas bibliotecas aplicativas, juntamente com o código Siscodes, podem proporcionar uma avaliação de planejamentos em teleterapia por íons e contribuir para futuros estudos de dosimetria em radioterapia por íons de carbono e prótons. Os achados apresentados contribuem para o desenvolvimento de aplicações clínicas e pesquisa em radioterapia por íons de carbono e prótons. REFERÊNCIAS 1. Amaldi U, Kraft G. Radiotherapy with beams of carbon ions. Rep Prog Phys. 2005;68:1861—82. 2. Sobin LH, Wittekind Ch. TNM classification of malignant tumours. 6th ed. New York, NY: Wiley-Liss; 2002. 3. Koyama-Ito H, Kanai T, Minohara S, et al. Carbon ion therapy for ocular melanoma: planning orthogonal two-port treatment. Phys Med Biol. 2007;52:5341—52. 4. Tsuji H, Ishikawa H, Yanagi T, et al. Carbon-ion radiotherapy for locally advanced on unfavorably located choroidal melanoma: a phase I/II dose-escalation study. Int J Radiat Oncol Biol Phys. 2007;67:857—62. 5. Tsujii H, Kamada T, Baba M, et al. Clinical advantages of carbon-ion radiotherapy. New J Phys. 2008;10. 6. U.S. National Library of Medicine. The visible human project. [cited 2008 Nov 17]. Available from: http://www.nlm.nih.gov/research/visible 7. Trindade BM, Campos TPR. Sistema computacional para dosimetria de nêutrons e fótons baseado em métodos estocásticos aplicado a radioterapia e radiologia. Radiol Bras. 2011;44:109—16. 8. Mourão AP, Campos TPR. Considerações radiodosimétricas da braquiterapia ocular com iodo-125 e rutênio/ródio-106. Radiol Bras. 2009;42:43—8. 9. Christóvão MT, Campos TPR. Análise da distribuição espacial de dose absorvida em próton terapia ocular. Radiol Bras. 2010;43:249—54. 10. Cirrone P, Cuttone G, Di Rosa F, et al. The hadrontherapy Geant4 advanced example. In: 4th Workshop on Geant4 Bio-medical Developments, Geant4 Physics Validation. 2005 July 13—20; Genova, Italy. 11. National Council on Radiation Protection and Measurements. Report No. 144 — Radiation Protection for Particle Accelerator Facilities. Bethesda, MD: National Council on Radiation Protection and Measurements; 2003. 12. Ondreka D, Weinrich U. The Heidelberg ion therapy (HIT) accelerator coming into operation. Proceedings of EPAC08:979—81; Genoa, Italy. 13. Endo K, Fang Z, Fukumoto S, et al. Compact proton and carbon ion synchrotrons for radiation therapy. Proceedings of EPAC 2002:2733—5; Paris, France. 14. Cirrone GAP, Cuttone G, Lojacono RA, et al. A 62-MeV proton beam for the treatment of ocular melanoma at Laboratori Nazionali del Sud-INFN. IEEE Transactions on Nuclear Science. 2004;51:860—5. 15. Greco C, Wolden S. Current status of radiotherapy with proton and light ion beams. Cancer. 2007;109:1227—38. 1. Doutora, Tecnologista do Centro de Desenvolvimento da Tecnologia Nuclear (CDTN), Belo Horizonte, MG, Brasil. 2. Doutor, Professor do Departamento de Engenharia Nuclear da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil. 3. Pós-Doc, Departamento de Engenharia Nuclear da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil. Endereço para correspondência: Dra. Marília Tavares Christóvão Avenida Presidente Antônio Carlos, 6627, Campus da UFMG, Pampulha, Caixa Postal 941 Belo Horizonte, MG, Brasil, 31270-901 E-mail: marilia@cdtn.br Recebido para publicação em 16/11/2010. Aceito, após revisão, em 25/10/2011. * Trabalho realizado no Departamento de Engenharia Nuclear da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554