INTRODUÇÃO
A mamografia é, ainda hoje, o melhor método de detecção precoce do câncer de mama, com sensibilidade variando entre 89% e 95% e, comprovadamente, contribui para a redução da mortalidade por câncer de mama em 24% nas mulheres entre 40 e 49 anos e em 30% em pacientes acima de 50 anos(1,2). Porém, a interpretação mamográfica representa um desafio para o especialista, particularmente nos casos de mama densa(1,2). Uma das maneiras de aumentar a acurácia diagnóstica, em particular a especificidade, é a partir da comparação da imagem atual com mamografias prévias, assim como a realização da dupla leitura (
double reading), em que deve haver concordância de interpretação entre dois médicos. Esta prática se baseia em trabalhos científicos, que demonstraram um aumento de 7% a 15% no número de lesões detectadas(1,2).
A ultrassonografia (US) mamária tem grande participação como exame complementar à mamografia e à clínica, consolidando- se como importante exame de imagem das doenças mamárias. A US mamária, além de poder detectar algumas lesões suspeitas iniciais, não vistas à mamografia, ajuda na diferenciação entre nódulos císticos e sólidos e entre nódulos sólidos benignos e malignos(3–5). Algumas características observadas nas lesões são exclusivas da US, como orientação e ecogenicidade, e outras são fundamentais na interpretação da imagem, como contorno e forma, apresentando, o primeiro, maior sensibilidade, e o segundo, alta especificidade(6–9). Apesar dos vários aspectos relevantes do exame por US, por exemplo, não utilizar radiação ionizante, a portabilidade do equipamento, a facilidade de repetição do exame e a capacidade de gerar imagens em tempo real, este depende da qualidade da imagem gerada, podendo resultar em elevada variabilidade na interpretação diagnóstica pelos radiologistas(10–13). A literatura descreve, ainda, que o sucesso na detecção de uma lesão na US mamária é influenciada pela fadiga do operador, pelo tamanho da mama e pela profundidade da lesão(10–13).
A utilização de uma padronização na descrição das lesões mamárias, como o léxico BI-RADS
®, é importante para uniformizar a nomenclatura, auxiliar na indicação do grau de suspeição de malignidade, de acordo com a morfologia dos achados ecográficos e, por conseguinte, permitir orientar, de forma mais precisa, a conduta a ser seguida(3–5).
Estudos inter e intraobservadores são motivo de interesse para os profissionais que se dedicam à radiologia mamária. Porém, a maioria dos estudos de concordância em imagem mamária é de mamografia, provavelmente porque o léxico BI-RADS para esta é utilizado desde 1993, enquanto para a US seu uso tem aproximadamente oito anos(14). Recentemente, estudos de concordância interobservador na US apresentaram índices de kappa variando entre 0,28 (razoável) e 0,83 (quase perfeito), em um diagnóstico essencialmente baseado na avaliação subjetiva dos achados morfológicos de uma lesão(14–17). Todavia, apesar da padronização permitida pelo BI-RADS, o exame ultrassonográfico, assim como a elaboração do laudo, ainda é uma tarefa operador-dependente.
O estudo de métodos que se baseiem em avaliações quantitativas pode auxiliar na redução da subjetividade e da dependência do operador, uma vez que a quantificação é independente da sua experiência(18). Assim, com o objetivo de reduzir o número de biópsias realizadas em lesões sólidas benignas e aumentar a consistência da interpretação diagnóstica da US, diversos trabalhos têm proposto métodos para auxiliar no diagnóstico do câncer de mama em imagens por US(19–27). Um aspecto fundamental para o uso desses métodos é a segmentação, que é uma técnica de processamento de imagens que visa a separar a lesão sob análise do restante da imagem(28).
A segmentação de uma região de interesse, em aplicações médicas, é de extrema dificuldade devido às restrições impostas pelo processo de aquisição da imagem, à doença e às variações biológicas(29). Particularmente em imagens por US, a segmentação é dificultada por sua natureza textural. Esta característica resulta de fatores como o processamento do sinal para a formação da imagem, a interação entre a onda ultrassônica e cada tipo de tecido biológico, o
speckle (granulação) e artefatos(30).
Com a lesão segmentada é possível determinar parâmetros que auxiliem na quantificação das características morfométricas das lesões de mama, tais como contorno e textura, sendo estes parâmetros avaliados quanto à sua capacidade de distinguir tumores benignos e malignos. Neste ponto, cabe ressaltar que o estudo de técnicas de segmentação, do cálculo de parâmetros, bem como a determinação daqueles que melhor distinguem entre tumores malignos e benignos, são etapas complexas e ainda objeto de investigação(19,20).
O objetivo deste trabalho é avaliar o desempenho de parâmetros morfométricos, calculados a partir do contorno de lesões de mama em US, na quantificação de suas características morfológicas e na distinção das categorias 2, 3, 4 e 5 do sistema de classificação ecográfica BI-RADS.
MATERIAIS E MÉTODOS
Banco de imagens
A casuística deste trabalho é composta por 40 lesões de 40 pacientes diferentes, com idade média de 50,7 anos, variando entre 16 e 88 anos, submetidas à cirurgia por indicação do seu médico assistente. O estudo prévio com US mamária, com registro ortogonal da imagem, foi realizado com o equipamento Logic 5 (GE Medical Systems; Wisconsin, EUA) com sonda linear e frequência de 12 MHz. O tamanho das lesões variou entre 6,0 e 27,0 mm.
O estudo e classificação das lesões foram realizados por um observador com 15 anos de experiência em radiologia mamária, com base no sistema de classificação ecográfica BI-RADS(31). O observador comparou a imagem com o laudo histopatológico e classificou a lesão na categoria do sistema BI-RADS mais apropriada para cada caso. Este procedimento foi adotado para minimizar variabilidades na classificação, pois esta servirá de referência para avaliação dos parâmetros morfométricos. Cabe ressaltar que, apesar do conhecimento prévio do laudo histopatológico, a imagem foi mandatória na definição da classificação BI-RADS.
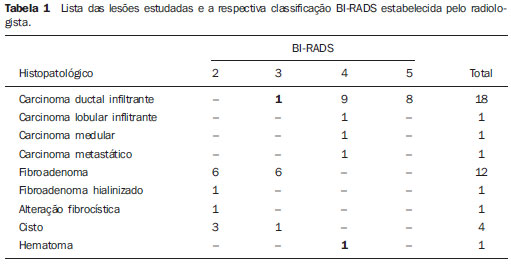
Para garantir o anonimato dos pacientes, suas identificações foram retiradas das imagens antes da análise, sendo cada uma delas identificada por um número. O laudo do exame histopatológico (peça cirúrgica) das 40 lesões foi utilizado como padrãoouro e indicou os seguintes achados malignos: 18 carcinomas ductais inflitrantes, 1 carcinoma lobular infiltrante, 1 carcinoma medular e 1 carcinoma oriundo de metástase; e os seguintes achados benignos: 12 fibroadenomas, 1 fibroadenoma hialinizado, 1 alteração fibrocística, 4 cistos e 1 hematoma.
Parâmetros morfométricos
As imagens de US foram segmentadas para a determinação do contorno das lesões, sendo os métodos de segmentação e detecção de contorno, aqui utilizados, baseados na transformada
watershed e na derivada média radial, respectivamente(20). Exemplos de contornos de uma lesão maligna e outra benigna, determinados pelo método de segmentação e detecção utilizado, são mostrados nas Figuras 2A e 2B.
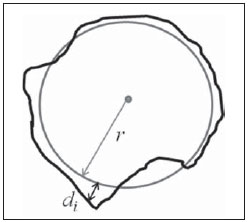
Figura 1. Exemplo de uma região circular hipotética de raio
r (círculo cinza), que possui a mesma área da lesão (contorno preto). A distância radial entre um ponto círculo médio e um pixel do contorno do tumor que está fora do círculo médio é representada por
di. O parâmetro
RA é dado pelo valor médio das distâncias
di.

Figura 2. Exemplo de formato de lesão (área cinza mais central) regular (A) e irregular (B). O polígono convexo é o contorno mais externo (em branco) que circunda o perímetro da lesão segmentada. Observar que há uma diferença maior entre o perímetro do polígono e a lesão irregular.
A partir do contorno das lesões segmentadas foram calculados cinco parâmetros morfométricos, a saber:
razão de área, circularidade, razão entre largura e profundidade, razão de superposição e valor residual normalizado, definidos a seguir.
A
razão de área (
RA) representa a distância média entre um contorno circular médio e os pixels do contorno do tumor que estão fora do contorno circular (Figura 1). Logo, o valor de
RA aumenta proporcionalmente ao número de pixels fora da região circular; espera-se que lesões espiculadas e lobuladas tendam a produzir maiores valores de
RA do que lesões com contorno regular(19).
A
circularidade (
C) é definida como a razão entre o quadrado do perímetro e a área da lesão segmentada. Normalmente usado para refletir a complexidade de contornos,
C atinge seu valor mínimo para contornos circulares, tendendo a crescer para lesões de formas complexas(28).
A razão entre
largura e profundidade (
depth-to-width ratio – DWR) é um parâmetro específico à análise de lesões de mama em imagens por US. Lesões benignas tendem a ser mais largas do que profundas, em relação à pele, produzindo valores de
DWR menores, o que contrasta com as lesões malignas, que tendem a ser mais profundas(19).
Os parâmetros
razão de superposição (
RS) e
valor residual normalizado (normalized residual value – nrv) são definidos a partir de uma técnica conhecida como polígono convexo, que é definido como o polígono no qual se circunscreve a lesão, onde nenhum dos seus ângulos internos é maior que 180°. Como exemplificado na Figura 2, quanto mais irregular for o contorno, maior a diferença entre este e o seu polígono convexo. Com base nesta característica, o parâmetro
RS é definido como a razão entre a área da lesão segmentada e seu respectivo polígono convexo. Assim, quando os contornos forem idênticos, as áreas também o serão e, portanto,
RS = 1. Quando os contornos forem diferentes, a área do polígono convexo será sempre maior, fazendo
RS < 1(19).
Observando a Figura 2, nota-se que existe uma área residual entre os contornos da lesão e do seu respectivo polígono convexo, e esta área residual tende a ser maior quanto mais irregular for o contorno da lesão. Assim,
nrv é definido como a razão entre a área residual e o perímetro do polígono convexo(19).
Análise discriminante linear
Os parâmetros morfométricos calculados foram submetidos a um método estatístico conhecido como análise discriminante linear (ADL), para distinguir as lesões de mama quanto à sua classificação BI-RADS e quanto ao seu diagnóstico histológico: maligna ou benigna.
De um modo simples, a ADL é usada para classificação e redução de dimensionalidade de dados e baseia-se na maximização da relação de discrepância entre classes e dentro de cada classe, garantindo a separação máxima dos dados(32).
Em razão do número limitado de casos, optou-se por analisar o desempenho dos parâmetros frente à classificação BI-RADS, juntando as lesões classificadas como “BIRADS 2 e 3” e como “BI-RADS 4 e 5”, formando-se dois grupos. Ainda devido ao número limitado de casos, utilizou-se o procedimento
leave-one-case out(33), para dar validade estatística à análise. O desempenho combinado dos parâmetros não foi estudado. A hipótese de não haver diferença estatística entre os grupos “BI-RADS 2 e 3” e “BI-RADS 4 e 5” foi avaliada com um teste-
t (α = 1%) entre os valores médios dos parâmetros para cada grupo.
O resultado da aplicação da ADL aos parâmetros pode ser modelado como uma variável aleatória bi-normal, cujas funções de densidade de probabilidade (PDF) para as duas hipóteses do teste apresentam uma distribuição normal(18). Estas distribuições podem estar superpostas, implicando um compromisso entre os resultados falso-positivos e falso-negativos, sendo que uma mudança no limiar de decisão altera os valores de sensibilidade e especificidade do teste(18). A curva ROC (
receiver operating characteristic) é uma ferramenta que relaciona a sensibilidade (
S) e a especificidade (
E) para cada valor do possível limiar de decisão. A área sob a curva ROC (
Az), medida usualmente empregada, varia de 0,5 (comportamento completamente aleatório) a 1,0 (discriminação perfeita). Com esta definição, quanto mais a curva se aproxima do canto superior esquerdo do gráfico (maior
S e menor 1 –
E), melhor o desempenho do teste diagnóstico(34).
Neste trabalho, o desempenho dos parâmetros em distinguir lesões entre malignas ou benignas foi avaliado utilizando-se a área
Az sob a curva ROC, assim como os valores de acurácia, sensibilidade e especificidade, referentes ao ponto de operação escolhido sobre a curva. Cabe ressaltar que a ADL, bem como o cálculo dos parâmetros, foi implementada num programa desenvolvido em linguagem Matlab (Mathworks; Natick, EUA).
RESULTADOS
A classificação BI-RADS das lesões é apresentada na Tabela 1. Nota-se que um carcinoma ductal inflitrante (Figura 3A) foi classificado como BI-RADS 3, e o hematoma (Figura 3B) foi classificado como BIRADS 4 (negritos na Tabela 1).
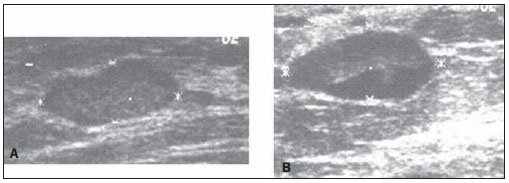
Figura 3. Ultrassonografias do carcinoma ductal inflitrante classificado como BI-RADS 3 (A) e do hematoma classificado como BI-RADS 4 (B).
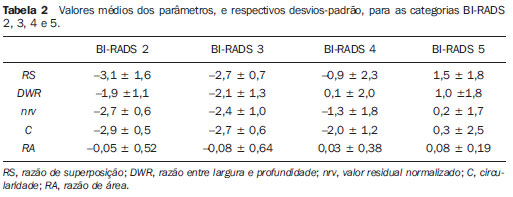
Na Tabela 2 são apresentados os valores médios dos parâmetros calculados, e respectivos desvios-padrão, para cada uma das categorias BI-RADS estudadas. Avaliando- se o desempenho dos parâmetros em distinguir entre as categorias BI-RADS consecutivas, o que apresentou melhor desempenho foi a
RS, sendo capaz de diferenciar estatisticamente entre as categorias BIRADS 3 e BI-RADS 4 (α = 5%;
p = 0,015) e entre as categorias BI-RADS 4 e BI-RADS 5 (α = 5%;
p = 0,014). Além de
RS, o parâmetro
DWR mostrou-se capaz de diferenciar estatisticamente entre as categorias BIRADS 3 e BI-RADS 4 (α = 1%;
p = 0,006), enquanto o parâmetro
C diferenciou estatisticamente entre as categorias BI-RADS 4 e BI-RADS 5 (α = 5%;
p = 0,011).
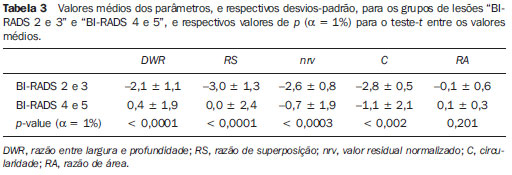
Os valores médios dos parâmetros morfométricos, e respectivos desvios-padrão, para os grupos de lesões “BI-RADS 2 e 3” e “BI-RADS 4 e 5” são apresentados na Tabela 3. Analisando os valores de
p (α = 1%) para o teste-
t, entre as médias dos parâmetros morfométricos para os grupos “BI-RADS 2 e 3” e “BI-RADS 4 e 5”, notase que apenas o parâmetro
RA não foi capaz de diferenciar os dois grupos, enquanto
RS foi o parâmetro que apresentou a maior diferença entre as médias dos dois grupos estudados.
As PDF dos grupos “BI-RADS 2 e 3” e “BI-RADS 4 e 5” para o parâmetro
RS, bem como os valores de
RS para cada lesão estudada, são apresentados na Figura 4. Analisando a distribuição dos valores para os diferentes grupos, observa-se que as lesões classificadas como BI-RADS 2 (–3,1 ± 1,6; asteriscos na Figura 4) estão bem concentradas, indicando uma baixa dispersão dos resultados. Todavia, o valor de
RS para o fibroadenoma hialinizado está próximo de 1,5 (círculo maior na Figura 4), aumentando o desvio-padrão do grupo BI-RADS 2. As lesões que fazem parte do grupo BI-RADS 3 (–2,7 ± 0,7, círculos menores na Figura 4) concentram-se sutilmente à direita das classificadas como BI-RADS 2, todavia, um pouco mais espalhadas. As lesões classificadas como BI-RADS 4 (–0,9 ± 2,3; losangos na Figura 4) estão mais espalhadas, com três carcinomas (imagens de ultrassom na Figura 5), sendo um medular, claramente ocupando a região do grupo “BI-RADS 2 e 3” (elipse na Figura 4). Por fim, as lesões classificadas como BI-RADS 5 (1,5 ± 1,8; quadrados na Figura 4), apesar de possuírem o valor médio de
RS maior que as BI RADS 4, se superpõem a estas, devido ao espalhamento dos dois grupos.
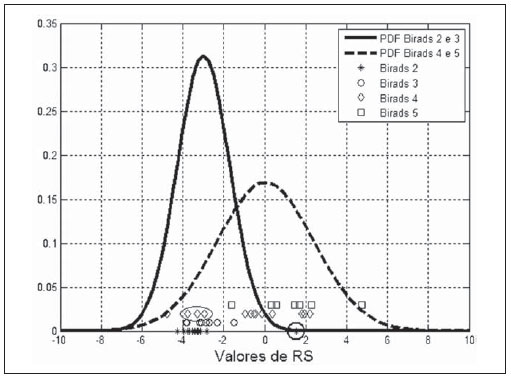
Figura 4. Densidade de probabilidade dos grupos “BI-RADS 2 e 3” e “BI-RADS 4 e 5” para o parâmetro
RS, bem como os valores de
RS para cada lesão estudada.
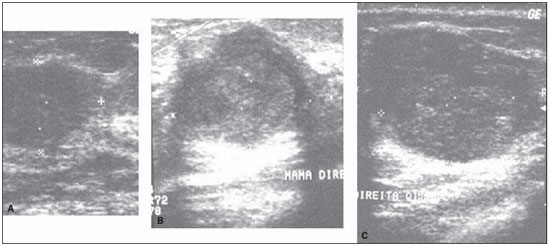
Figura 5. Ultrassonografias dos dois carcinomas ductais infiltrantes (A,B) e do carcinoma medular (C) classificados como benignos por
RS. Estas mesmas lesões foram corretamente classificadas por
RA e
DWR.
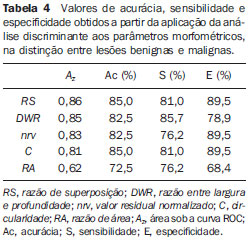
O resultado da aplicação da análise discriminante aos parâmetros na distinção entre lesões benignas e malignas é apresentado na Tabela 4. Entre os parâmetros morfométricos estudados, aquele que apresentou melhor desempenho (
Az = 0,86) foi a
RS. Com base em
RS, quatro carcinomas foram classificados como lesões benignas (
S = 81,0%), enquanto dois fibroadenomas foram classificados como lesões malignas (
E = 89,5%). Cabe ressaltar que um dos quatro carcinomas classificados erroneamente por
RS é o carcinoma ductal infiltrante classificado como BI-RADS 3 (Figura 3A; negrito na Tabela 1). Os outros três carcinomas classificados como benignos por
RS são apresentados na Figura 5. As PDF das lesões benignas e malignas para
RS, bem como seus valores para cada lesão estudada, são mostrados na Figura 6.
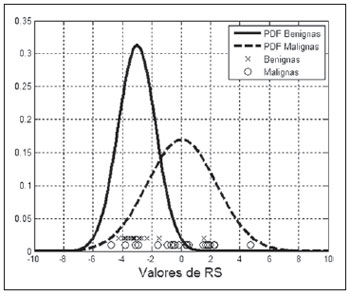
Figura 6. Densidade de probabilidade das lesões benignas e malignas para o parâmetro
RS, bem como os valores de
RS para cada lesão estudada.
A
DWR apresentou o segundo melhor desempenho (
Az = 0,85), com três carcinomas (imagens de ultrassom nas Figuras 3A, 7A e 7B) classificados como lesões benignas (
S = 85,7%), e três fibroadenomas (dois exemplos na Figura 7C e 7D) e um cisto classificados como lesões malignas (
E = 78,9%).
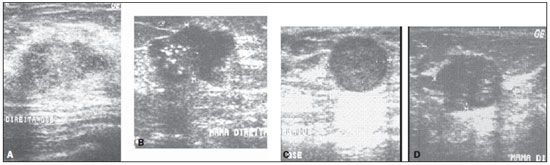
Figura 7. Ultrassonografias dos dois carcinomas ductais infiltrantes (A,B) classificados como benignos por
DWR. Estas mesmas lesões foram corretamente classificadas por
RS. Ultrassonografias de dois dos fibroadenomas (C,D) classificados como malignos por
DWR. Estas mesmas lesões foram corretamente classificadas por
RS.
O parâmetro
C, apesar de apresentar um valor de
Az (0,81) inferior ao de
RS, forneceu valores de acurácia, sensibilidade e especificidades idênticos aos do desempenho do melhor parâmetro. Na Figura 8, que contém as curvas
ROC dos parâmetros com valores de
Az maiores que 0,80, observa-se que, apesar de
C ter menor área, apresenta um ponto de operação coincidente com a curva de
RS (seta na Figura 8).
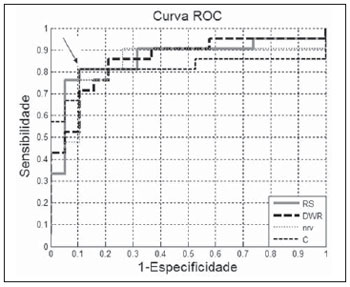
Figura 8. Curvas
ROC dos parâmetros com valores de
Az maiores que 0,80. A seta indica o ponto de operação coincidente entre as curvas
ROC de
RS e
C.
O menor valor de especificidade (76,2%) foi fornecido pelos parâmetros
nrv e
RA, que classificaram cinco carcinomas como lesões benignas. Todavia,
nrv apresentou um valor de especificidade (89,5%) superior ao obtido por
RA (68,4%), uma vez que apenas dois fibroadenomas foram classificados como lesões malignas por
nrv, contra cinco fibroadenomas e um cisto classificados equivocadamente por
RA.
Por fim, o pior desempenho foi apresentado pela
RA, com valores de acurácia (72,5%), sensibilidade (76,2%) e especificidade (68,4%) inferiores a 80%.
DISCUSSÃO
A US tem-se estabelecido como importante coadjuvante da mamografia no diagnóstico do câncer de mama, e o léxico BIRADS para US tem auxiliado nesta consolidação(3–5). O principal objetivo de seu uso é a padronização dos laudos ultrassonográficos, o que tende a facilitar o acompanhamento do achado ultrassonográfico, pela comparação entre laudos subsequentes. Todavia, apesar da padronização permitida pelo BI-RADS, o exame ultrassonográfico, assim como a elaboração do laudo, ainda é uma tarefa operador-dependente. Além disso, a literatura tem apontado que, usando do léxico BI-RADS para US, níveis de concordância de moderado a substancial foram encontrados em estudos inter e intraobservador( 11,12,14–17).
Neste trabalho, cinco parâmetros morfométricos foram calculados e seus desempenhos foram avaliados, em distinguir lesões de mama em ultrassonografias classificadas como BI-RADS 2, 3, 4 e 5, com base no resultado dos seus respectivos laudos histopatológicos. Dentre os cinco parâmetros estudados, quatro foram capazes de diferenciar estatisticamente os grupos “BIRADS 2 e 3” e “BI-RADS 4 e 5”, sendo a única exceção o parâmetro
RA. Dentre estes, o parâmetro
RS foi o que apresentou maior diferença entre seus valores médios para os dois grupos.
Segundo a literatura, pode haver variações significativas interobservador na classificação entre as categorias BI-RADS 3 ou BI-RADS 4(17). A demasiada classificação de lesões BI-RADS 3 na categoria BIRADS 4 tenderia a reduzir a especificidade das biópsias e aumentar o número de procedimentos invasivos desnecessários. Por outro lado, excessivas classificações BIRADS 4 na categoria BI-RADS 3 tenderiam a retardar o diagnóstico de um certo número de lesões malignas.
No presente estudo, as categorias BIRADS 3 e 4 foram diferenciadas pelos parâmetros
RS e
DWR, sugerindo que estes parâmetros podem auxiliar na distinção entre estes dois tipos de classificação BIRADS.
RS e
DWR foram ainda os parâmetros morfométricos que apresentaram melhor desempenho na diferenciação entre lesões malignas e benignas (Tabela 4).
Dos quatro carcinomas classificados como lesões benignas por
RS, um possui características que o assemelham a um fibroadenoma (Figura 3A), sendo também classificado como BI-RADS 3. Os outros três carcinomas têm como características ecográficas a ecotextura heterogênea e o contorno lobulado (Figura 5). Este achado indica que
RS não se apresenta como o melhor parâmetro para quantificar irregularidades e lobulações no contorno da lesão. Apesar do desempenho inferior (Tabela 4), o parâmetro
RA foi capaz de quantificar estas características, classificando corretamente estas lesões.
O parâmetro
DWR apresentou o segundo melhor desempenho em termos de
Az, identificando corretamente três dos quatro carcinomas erroneamente classificados como benignos pelo parâmetro
RS (Figura 5), bem como as duas lesões benignas (um fibroadenoma e o fibroadenoma hialinizado) classificadas como malignas pelo parâmetro
RS.
Por outro lado, outras três lesões malignas (carcinomas) foram classificadas equivocadamente como benignas pelo parâmetro
DWR, sendo uma delas a mesma lesão que foi classificada como BI-RADS 3 pelo radiologista e como benigna por
RS (Figura 3A). As outras duas lesões malignas possuem características ecográficas que as classificam como BI-RADS 4 e 5, porém, por apresentarem orientação horizontal,
DWR as classificou como benignas (Figura 7). Cabe ressaltar que estas mesmas duas lesões foram corretamente classificadas por
RS. As quatro lesões benignas classificadas como malignas por
DWR possuem critérios ecográficos de lesões benignas. Todavia, a análise quantitativa do parâmetro
DWR indica uma discreta verticalização das lesões, conforme exemplificado nas Figuras 7C e 7D. Contudo, de maneira complementar, o parâmetro
RS foi capaz de classificar corretamente essas quatro lesões.
O parâmetro
C, apesar de apresentar um valor de
Az menor, teve desempenho idêntico ao de
RS em termos de acurácia, sensibilidade e especificidade. Além disso,
C foi o único parâmetro que classificou, como maligno, o carcinoma classificado como BI-RADS 3 (Figura 3A). Cabe ressaltar que a literatura aponta
C como um parâmetro importante na diferenciação entre lesões malignas ou benignas(19,35).
Por fim, o hematoma, classificado como BI-RADS 4, foi corretamente classificado como benigno por todos os parâmetros estudados.
A análise do desempenho dos parâmetros
RS e
DWR sugere que a combinação de diferentes parâmetros pode acrescentar informações relevantes à quantificação das características morfométricas das lesões e melhorar o desempenho obtido com os parâmetros, individualmente. Além disso, corrobora os resultados apresentados por outros trabalhos, que apontam que a irregularidade do contorno, bem como a relação entre a largura e a profundidade, são características importantes na diferenciação entre lesões malignas e benignas em imagens por US(22,23,27) e podem ser quantificadas por parâmetros morfométricos.
CONCLUSÃO
Dentre os parâmetros morfométricos estudados, a
RS foi capaz de diferenciar estatisticamente entre as categorias BIRADS 3 e 4 e entre as categorias BI-RADS 4 e 5, sugerindo que a avaliação de parâmetros morfométricos, calculados a partir do contorno de lesões de mama em US, pode auxiliar na distinção das categorias do sistema BI-RADS. Além disso,
RS foi o parâmetro morfométrico que apresentou melhor desempenho na diferenciação entre lesões malignas e benignas. Estes resultados apontam o potencial da análise morfométrica em auxiliar na distinção entre pacientes que deveriam ser submetidas a procedimentos invasivos daquelas que, de forma segura, poderiam manter controle por métodos de imagem, reduzindo gastos financeiros e emocionais em casos específicos.
Cabe ressaltar que a casuística ainda é limitada e pretende-se realizar um estudo mais amplo. Como proposta futura, sugerem- se uma análise combinada destes parâmetros com outros, como a textura, e um número maior de imagens para uma adequada avaliação da correlação entre os parâmetros quantitativos extraídos de imagens ultrassonográficas de lesões mamárias e suas respectivas categorias BI-RADS.
REFERÊNCIAS
1. Rodrigues MCS, Calas MJG, Nadruz E. Mamografia: exame único, tecnologias diversas. Femina. 2008;36:373–7.
2. Humphrey LL, Helfand M, Chan BK, et al. Breast cancer screening: a summary of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med. 2002;137(5 part 1):347–60.
3. Calas MJG, Koch HA, Dutra MVP. Uma proposta de classificação ecográfica mamária. RBGO. 2005;27:515–23.
4. Calas MJG, Koch HA, Dutra MVP. Ultra-sonografia mamária: avaliação dos critérios ecográficos na diferenciação das lesões mamárias. Radiol Bras. 2007;40:1–7.
5. Paulinelli RR, Calas MJG, Freitas Junior R. BIRADS e ultra-sonografia mamária – uma análise crítica. Femina. 2007;35:565–72.
6. Arger PH, Sehgal CM, Conant EF, et al. Interreader variability and predictive value of US descriptions of solid breast masses: pilot study. Acad Radiol. 2001;8:335–42.
7. Baker JA, Kornguth PJ, Soo MS, et al. Sonography of solid breast lesions: observer variability of lesion description and assessment. AJR Am J Roentgenol. 1999;172:1621–5.
8. Stavros AT, Thickman D, Rapp CL, et al. Solid breast nodules: use of sonography to distinguish between benign and malignant lesions. Radiology. 1995;196:123–34.
9. Paulinelli RR, Freitas-Júnior R, Moreira MAR, et al. Risk of malignancy in solid breast nodules according to their sonographic features. J Ultrasound Med. 2005;24:635–41.
10. Berg WA, Blume JD, Cormack JB, et al. Operator dependence of physician-performed wholebreast US: lesion detection and characterization. Radiology. 2006;241:355–65.
11. Costantini M, Belli P, Ierardi C, et al. Solid breast mass characterisation: use of the sonographic BIRADS classification. Radiol Med. 2007;112:877–94.
12. Del Frate C, Bestagno A, Cerniato R, et al. Sonographic criteria for differentiation of benign and malignant solid breast lesions: size is of value. Radiol Med. 2006;111:783–96.
13. Hong AS, Rosen EL, Soo MS, et al. BI-RADS for sonography: positive and negative predictive values of sonographic features. AJR Am J Roentgenol. 2005;184:1260–5.
14. Calas MJG, Almeida RMVR, Gutfilen B. et al. Intraobserver interpretation of breast ultrasonography following the BI-RADS classification. Eur J Radiol. 2010;74:525–8.
15. Lazarus E, Mainiero MB, Schepps B, et al. BIRADS lexicon for US and mammography: interobserver variability and positive predictive value. Radiology. 2006;239:385–91.
16. Lee HJ, Kim EK, Kim MJ, et al. Observer variability of Breast Imaging Reporting and Data System (BI-RADS) for breast ultrasound. Eur J Radiol. 2008;65:293–8.
17. Levy L, Suissa M, Chiche JF, et al. BIRADS ultrasonography. Eur J Radiol. 2007;61:202–11.
18. Azevedo-Marques PM. Diagnóstico auxiliado por computador na radiologia. Radiol Bras. 2001;34:285–93.
19. Alvarenga AV, Infantosi AFC, Pereira WCA, et al. Assessing the performance of morphological parameters in distinguishing breast tumors on ultrasound images. Med Eng Phys. 2010;32:49–56.
20. Gómez W, Leija L, Alvarenga AV, et al. Computerized lesion segmentation of breast ultrasound based on marker-controlled watershed transformation. Med Phys. 2010;37:82–95.
21. Chen CM, Chou YH, Han KC, et al. Breast lesions on sonograms: computer-aided diagnosis with nearly setting-independent features and artificial neural networks. Radiology. 2003;226:504–14.
22. Drukker K, Giger ML, Horsch K, et al. Computerized lesion detection on breast ultrasound. Med Phys. 2002;29:1438–46.
23. Horsch K, Giger ML, Venta LA, et al. Computerized diagnosis of breast lesions on ultrasound. Med Phys. 2002;29:157–64.
24. Huang YL, Chen DR. Watershed segmentation for breast tumor in 2-D sonography. Ultrasound Med Biol. 2004;30:625–32.
25. Huber S, Danes J, Zuna I, et al. Relevance of sonographic B-mode criteria and computer-aided ultrasonic tissue characterization in differential/ diagnosis of solid breast masses. Ultrasound Med Biol. 2000;26:1243–52.
26. Karssemeijer N, Otten JD, Verbeek AL, et al. Computer-aided detection versus independent double reading of masses on mammograms. Radiology. 2003;227:192–200.
27. Lefebvre F, Meunier M, Thibault F, et al. Computerized ultrasound B-scan characterization of breast nodules. Ultrasound Med Biol. 2000;26: 1421–8.
28. Castleman KR. Digital image processing. Englewood Cliffs, NJ: Prentice-Hall; 1996.
29. Olabarriaga SD, Smeulders AWM. Interaction in the segmentation of medical images: a survey. Med Image Anal. 2001;5:127–42.
30. Szabo TL. Diagnostic ultrasound imaging: inside out. Amsterdam: Elsevier; 2004.
31. American College of Radiology. BI-RADS: Ultrasound. In: Breast Imaging Reporting and Data System. BI-RADS Atlas. 4th ed. Reston, VA: American College of Radiology; 2003.
32. Johnson RA, Wichern DW. Applied multivariate statistical analysis. 4th ed. Upper Saddle River, NJ: Prentice-Hall; 1998.
33. Bishop CM. Neural networks for pattern recognition. Oxford: Clarendon Press; 1995.
34. Metz CE. ROC methodology in radiologic imaging. Invest Radiol. 1986;21:720–33.
35. Chou YH, Tiu CM, Hung GS, et al. Stepwise logistic regression analysis of tumor contour features for breast ultrasound diagnosis. Ultrasound Med Biol. 2001;27:1493–8.
1. Mestre, Doutoranda do Departamento de Radiologia da Faculdade de Medicina da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil.
2. Pesquisador-Tecnologista do Laboratório de Ultrassom (Labus), Divisão de Metrologia Acústica e Vibrações (Diavi), Diretoria de Metrologia Científica e Industrial (Dimci), Instituto Nacional de Metrologia, Qualidade e Tecnologia (Inmetro), Rio de Janeiro, RJ, Brasil.
3. Doutora, Professora Associada do Departamento de Radiologia, Coordenadora do Programa de Pós-Graduação em Medicina (Radiologia) da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil.
4. Doutor, Professor Associado do Programa de Engenharia Biomédica da COPPE/UFRJ – Instituto Alberto Luiz Coimbra de Pós-Graduação e Pesquisa de Engenharia, Programa de Engenharia Biomédica, Rio de Janeiro, RJ, Brasil.
Endereço para correspondência:
Dr. André Victor Alvarenga / Dra. Maria Julia Calas
Programa de Engenharia Biomédica - Centro de Tecnologia
Bloco H, Sala 327, Cidade Universitária, Ilha do Fundão. Caixa Postal: 68510
Rio de Janeiro, RJ, Brasil, 21945-970
E-mail: avalvarenga@inmetro.gov.br / mjgcalas@terra.com.br
Recebido para publicação em 29/6/2011.
Aceito, após revisão, em 25/8/2011.
Suporte financeiro: Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes) e Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Trabalho realizado na COPPE/UFRJ – Instituto Alberto Luiz Coimbra de Pós-Graduação e Pesquisa de Engenharia, Programa de Engenharia Biomédica, Rio de Janeiro, RJ, Brasil.
 Vol. 44 nº 5 - Set. / Out. of 2011
Vol. 44 nº 5 - Set. / Out. of 2011