INTRODUÇÃO
A histiocitose de células de Langerhans (HCL), previamente conhecida como histiocitose X, é uma doença rara, de causa desconhecida, apesar de diversas evidências sugerirem origem imunológica(1).
A doença se caracteriza pela infiltração de células de Langerhans em diversos órgãos, embora o simples achado destas células não seja patognomônico da doença. A célula de Langerhans tem função imune acessória e suas características mais peculiares são os grânulos citoplasmáticos de Birbeck, vistos à microscopia eletrônica, e a glicoproteína CD1a, que é um marcador de superfície identificado por estudos de imuno-histoquímica(2,3).
A doença pode se apresentar nas formas sistêmica (ou multifocal), mais frequente em crianças, ou localizada (unifocal), comum em adultos. O comprometimento pulmonar da HCL ocorre mais frequentemente em adultos jovens, com pequeno predomínio em homens, sendo a grande maioria dos pacientes fumante. Lesões extrapulmonares, principalmente lesões ósseas líticas, podem ser observadas em associação às alterações pulmonares(4,5).
Patologicamente, a HCL pulmonar se caracteriza pela presença de lesões granulomatosas destrutivas contendo células de Langerhans, que apresentam aspecto nodular e se localizam preferencialmente junto aos bronquíolos terminais. Cistos surgem com a evolução da doença, mas o mecanismo exato da formação dessas lesões permanece indeterminado(6,7).
Nódulos e, principalmente, cistos são as manifestações radiológicas mais expressivas da HCL pulmonar. O estudo inicial dessas lesões é feito por radiografia simples de tórax, que, em grande número de casos, permite uma avaliação satisfatória. A falta de especificidade do método, no entanto, limita sua aplicação no diagnóstico desta doença(8).
As alterações observadas na tomografia computadorizada de alta resolução (TCAR) refletem as mudanças morfológicas induzidas pelas doenças com fidedignidade maior que a radiologia convencional, sendo, por isso, o método mais efetivo para identificar e caracterizar as modificações do interstício pulmonar(9).
O diagnóstico definitivo de HCL tem sido feito por meio de biópsia pulmonar a céu aberto, na maioria dos casos(10). Contudo, a TCAR pode ser capaz, em muitos casos, de determinar o diagnóstico de HCL pulmonar(11). A definição de padrões tomográficos característicos da doença é de grande impacto clínico, por permitir a realização do diagnóstico por imagem, tornando dispensável a biópsia pulmonar a céu aberto, que é um procedimento invasivo e de alto custo.
MATERIAIS E MÉTODOS
No presente estudo foram analisadas, retrospectivamente, as TCARs de oito pacientes com diagnóstico de HCL pulmonar.
Sete pacientes foram acompanhados no ambulatório de Pneumopatias Intersticiais Difusas do Serviço de Pneumologia do Hospital Universitário Pedro Ernesto da Universidade do Estado do Rio de Janeiro, e um paciente foi acompanhado no Serviço de Pneumologia do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro.
A idade dos pacientes, na época do diagnóstico da doença, variou entre 18 e 61 anos (média de 35,4 anos e mediana de 39,5 anos). As idades extremas (18 e 61 anos) foram de pacientes do sexo feminino. Dos oito pacientes estudados, quatro (50%) eram do sexo masculino e quatro (50%), do sexo feminino.
Sete (87,5%) dos oito pacientes relataram história de fumo. Dois destes sete pacientes eram ex-tabagistas. História de tabagismo importante foi mencionada por uma paciente. Esta paciente apresentou elevados níveis de CD1a no lavado broncoalveolar.
Quatro dos pacientes (50%) tinham lesões ósseas associadas às alterações pulmonares. Um desses pacientes apresentou, além de lesão óssea, lesões cutâneas ulceradas. As lesões ósseas se localizaram na ulna, na mandíbula, no crânio e na coluna dorsal.
Tosse e dispneia foram os sintomas de apresentação da doença dos oito pacientes. Três pacientes qualificaram a tosse como seca e um, como mucoide. Nos outros quatro casos não havia referência à expectoração. A terceira manifestação clínica mais frequente foi pneumotórax, que foi observado em 37,5% dos pacientes.
Informações a respeito da evolução da doença estavam disponíveis em sete dos oito prontuários estudados. A doença estabilizou, clinicamente, em quatro pacientes e em três casos houve progressão, com piora dos sintomas respiratórios e do quadro radiológico.
O diagnóstico foi feito por biópsia pulmonar a céu aberto em três pacientes, biópsia transbrônquica em um e estudo de imuno-histoquímica (elevação de CD1a) em dois. Em dois pacientes o diagnóstico foi baseado nos quadros clínico e tomográfico típicos, associados a lesões ósseas características. Identificação e dados clínicos dos pacientes foram obtidos a partir de revisão dos prontuários médicos.
Para a avaliação das radiografias de tórax foram analisadas a presença de nódulos, cistos, infiltração reticular, alterações enfisematosas e alterações do volume pulmonar, a distribuição das lesões pelo parênquima pulmonar e a simetria na distribuição.
Para o estudo das TCARs, as lesões foram definidas segundo o Glossário de Termos para TC dos Pulmões(12):
Nódulos
Foram considerados nódulos as “opacidades arredondadas, ao menos parcialmente bem delimitadas, com no máximo 3 cm no maior diâmetro”(4).
Para a avaliação do tamanho dos nódulos foi empregado o método modificado de Lacronique et al.(13). As lesões nodulares foram caracterizadas, de acordo com o tamanho, em nódulos de até 5 mm, nódulos entre 5-10 mm, e macronódulos maiores que 10 mm.
Foram considerados nódulos escavados os nódulos com escavação central, em que o componente sólido predominava sobre o cístico(14).
Cistos
Foram considerados cistos os “espaços parenquimatosos arredondados, com parede bem definida, habitualmente contendo ar, quando no pulmão, mas sem enfisema pulmonar associado”(12).
Os cistos foram classificados, segundo o tamanho, em pequenos (< 10 mm), médios (10-20 mm) e grandes (> 20 mm). As paredes foram referidas como finas, quando menores que 1 mm, e espessas, quando maiores que 1 mm. As lesões císticas foram diferenciadas, quanto à sua forma, em arredondadas, lobuladas, confluentes e com septos.
Distribuição das lesões
As lesões foram classificadas, quanto à sua distribuição no parênquima pulmonar, de acordo com o seu predomínio, nos terços superior, médio, inferior e na região extremo inferior. Terço superior foi considerado do ápice ao arco aórtico; terço médio, do arco aórtico à veia pulmonar inferior; terço inferior, da veia pulmonar inferior às cúpulas diafragmáticas; e região extremo inferior, os recessos costofrênicos.
Foi avaliado se as lesões apresentavam predomínio nas porções central ou periférica dos pulmões e se havia ou não simetria na distribuição das lesões entre os dois campos pulmonares.
Alterações associadas
Foi analisada a presença de alterações associadas aos nódulos e cistos, como opacidades lineares, infiltrado em vidro fosco, espessamento dos septos interlobulares, derrame pleural, distorção do parênquima pulmonar, pneumotórax e alterações enfisematosas.
RESULTADOS
Foram avaliadas, retrospectivamente, as TCARs de oito pacientes adultos com diagnóstico de HCL pulmonar.
Achados radiológicos
Radiografia de tórax
Radiografias de tórax de seis pacientes estavam disponíveis para avaliação. Uma das seis radiografias foi considerada normal. No entanto, a TCAR desta paciente mostrou raros cistos de paredes finas. Em três casos cistos puderam ser identificados na radiografia e a TCAR destes três pacientes mostrou cistos de paredes espessas. Nos demais (dois casos) em que a radiografia não identificou as lesões císticas, a TCAR mostrou somente cistos de paredes finas. Infiltrado reticular foi observado em quatro casos e reticulonodular, em um.
Pequenos nódulos foram bem individualizados nas radiografias de tórax de apenas dois pacientes, embora a TCAR de cinco pacientes tenha demonstrado lesões nodulares. Em um caso em que os nódulos foram identificados na radiografia, a TCAR evidenciou lesões maiores que 5 mm. Das cinco radiografias que mostraram alterações, três tiveram boa correlação com a TCAR quanto à distribuição das lesões.
Tomografia computadorizada de alta resolução
Na avaliação das TCARs observamos nódulos em seis (75%) dos oito casos. Em quatro casos a quantidade de lesões nodulares foi pequena e em dois, moderada. Os nódulos apresentaram distribuição predominantemente periférica nos seis pacientes (Figura 1). Em um caso os nódulos estavam randomicamente distribuídos pelo parênquima pulmonar.
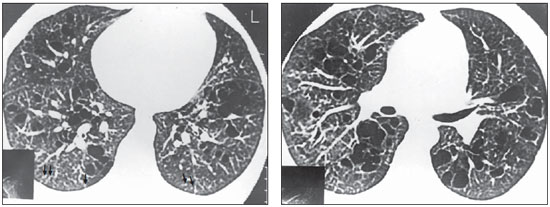
Figura 1. TCAR. Pequenos nódulos, menores que 5 mm, distribuídos na periferia dos pulmões, notadamente nas porções posteriores (setas), e cistos de paredes finas, alguns deles confluentes, com septos no seu interior, predominando nas zonas centrais do parênquima pulmonar (caso 4).
Os seis pacientes apresentaram nódulos menores que 5 mm de diâmetro, mas em um caso observamos também nódulos entre 5 e 10 mm, associados aos nódulos menores. Nenhum paciente apresentou nódulos maiores que 10 mm. Raros nódulos escavados foram identificados no caso 1 (Figura 2). O típico nódulo estrelado foi observado em apenas um paciente (Figura 2). Em todos os casos as lesões nodulares foram encontradas associadas a cistos.
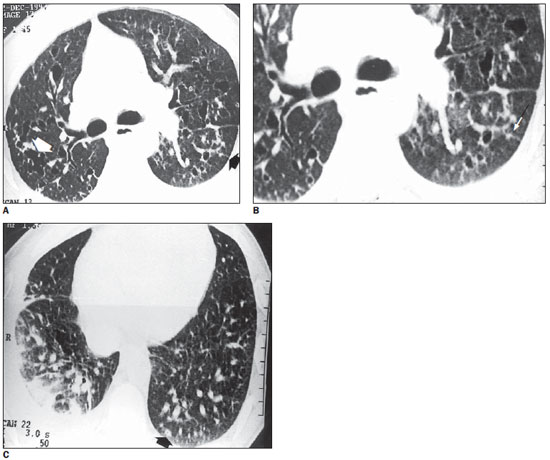
Figura 2. TCAR. Em A, múltiplos cistos de paredes finas, sendo alguns confluentes, determinando formas bizarras (seta branca), associados a nódulos de contornos irregulares, à esquerda (seta preta). Em B, ampliação de A com maior detalhe do nódulo de aspecto estrelado. Em C, raros cistos e nódulos nos lobos inferiores. Notar nódulo com pequena escavação central na topografia do segmento basal posterior esquerdo (seta). Derrame pleural à esquerda. Vasos de calibre aumentado (caso 1).
Todos os pacientes apresentaram, na TCAR, cistos pequenos (< 10 mm) em quantidades variáveis (Figuras 1, 2, 3, 4 e 5). Cistos com diâmetro entre 10 e 20 mm foram identificados em seis pacientes (75%), sendo em três casos em quantidade pequena, em dois casos em quantidade moderada e em um caso em grande quantidade. Em três pacientes (37,5%) notamos poucos cistos maiores que 20 mm. Em 75% dos casos observamos cistos de diversos tamanhos no mesmo paciente (Figura 1).
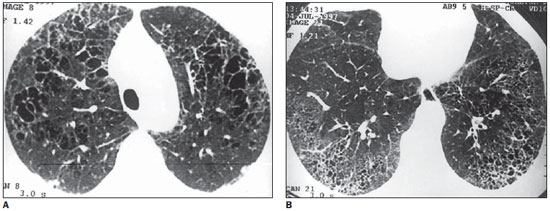
Figura 3. TCAR. Em A, cistos de paredes finas, de tamanhos variados, arredondados, com septos finos ou confluentes. Na periferia observam-se nódulos e espessamento de septos interlobulares (anterior, à direita). Em B, pequenos cistos de tamanhos semelhantes e distribuição periférica, sugerindo faveolamento, envolvendo as porções posteriores dos lobos inferiores. Notar nódulo na periferia, à direita (caso 5).
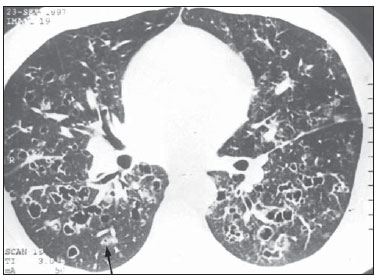
Figura 4. TCAR. Cistos arredondados, lobulados, confluentes e bizarros, com paredes de espessuras variáveis. Às vezes, torna-se difícil diferenciar pequenos cistos de paredes espessas de nódulos escavados (seta) (caso 1).
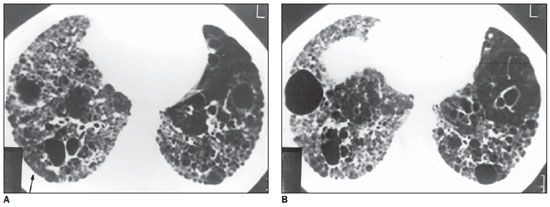
Figura 5. TCAR. Cistos de diâmetros variados, alguns de paredes espessas. Observam-se também brônquios dilatados, de paredes espessas, e áreas de distorção arquitetural. Notar em A, na periferia do segmento basal posterior direito, pequenos nódulos (seta). Em B, observam-se nódulo isolado anterior à esquerda e comprometimento dos recessos costofrênicos (caso 3).
Cistos de paredes finas (< 1 mm) foram observados em todas as TCARs. Em quatro casos, no entanto, notamos, associada aos cistos de paredes finas, pequena quantidade de cistos de paredes espessas, com mais de 1 mm (Figura 4).
Cistos arredondados foram encontrados em todos os pacientes. Em 62,5% dos casos observamos formas diferentes de cistos no mesmo paciente. As associações de cistos arredondados e confluentes (50%) e arredondados e lobulados (50%) foram as mais frequentes. A associação de cistos arredondados, confluentes e com septos finos no interior, foi encontrada em 37,5% (Figura 3). Cistos de aspectos bizarros foram notados em dois pacientes, sendo aparentemente secundários à confluência de vários cistos (Figura 2).
A combinação de cistos de diversos tamanhos e formas com lesões nodulares menores que 5 mm foi o achado mais frequente no nosso estudo, tendo sido observada em seis (75%) dos oito pacientes (Figuras 1, 2, 3 e 4).
Outras alterações em associação aos cistos e nódulos foram observadas na TCAR de seis pacientes. As mais frequentes foram espessamento dos septos interlobulares, opacidades lineares, infiltrado em vidro fosco, distorção do parênquima pulmonar e reação pleural, ocorrendo cada uma em três pacientes (Figura 5).
Dois pacientes com doença avançada apresentaram faveolamento e bronquiectasias. Pequenas lesões císticas periféricas, sugerindo faveolamento, também foram observadas em um caso (Figura 3).
Derrame pleural foi demonstrado pela TCAR somente no caso 1 e pneumotórax apenas no caso 8, embora ambos os achados tenham sido diagnosticados clinicamente e por radiografia simples em maior número de casos. Alterações enfisematosas e linfonodomegalias pouco habituais foram observadas em dois pacientes.
Em dois pacientes o parênquima pulmonar adjacente às lesões encontrava-se preservado. Em um destes casos, somente cistos de paredes finas foram observados, sendo o aspecto tomográfico indistinguível de linfangioliomiomatose pulmonar (Figura 6).
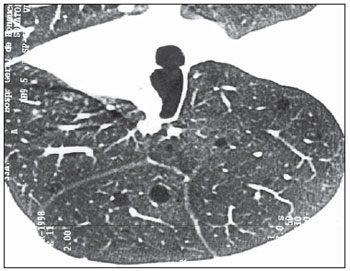
Figura 6. TCAR. Raros cistos de paredes finas esparsos pelos pulmões, com parênquima pulmonar entre as lesões preservado. Não há evidências de nódulos (caso 6).
Nos oito casos estudados, as lesões acometeram os terços superior e médio dos pulmões. Em sete pacientes (87,5%) as lesões envolveram também o terço inferior, porém, em seis (75%) pacientes, as lesões predominaram nos dois terços superiores. Na TCAR de um paciente as lesões apresentaram distribuição homogênea nos terços superior, médio e inferior. Em dois (25%) pacientes observamos comprometimento das porções mais inferiores dos pulmões, incluindo os recessos costofrênicos (Figura 5).
Distribuição homogênea das lesões nas porções centrais e periféricas dos pulmões foi observada em cinco (62,5%) dos oito pacientes estudados. No restante dos casos (37,5%), as lesões predominaram nas porções centrais do parênquima pulmonar (Figura 7). Observamos que nas porções centrais as lesões císticas foram mais frequentes, com os nódulos predominando na periferia.
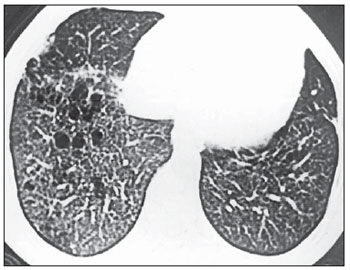
Figura 7. TCAR. Cistos confluentes predominando nas zonas centrais do pulmão e pequenos nódulos na periferia. Notar assimetria entre os pulmões, com predomínio das lesões à direita (caso 2).
As lesões acometeram simetricamente os campos pleuropulmonares em sete (87,5%) dos oito pacientes. Somente um dos casos apresentou assimetria na distribuição das lesões (Figura 7).
DISCUSSÃO
Observamos, durante nosso estudo, dois grandes obstáculos. O primeiro está relacionado à pequena incidência de HCL e o pouco frequente acometimento pulmonar desta doença. O reduzido número de casos permite somente estudos limitados a pequenos grupos e impossibilita estudos prospectivos.
A segunda dificuldade está relacionada à comprovação do diagnóstico de HCL pulmonar. O diagnóstico definitivo da doença é feito a partir de biópsia pulmonar a céu aberto(10). Estudos de imuno-histoquímica no lavado broncoalveolar (LBA), notadamente a presença de elevados níveis de CD1a, são altamente sugestivos, mas necessitam da associação de outros dados clínicos e radiológicos para o diagnóstico(15-17). A associação de história clínica e aspectos radiológicos característicos tem sido aceita por pneumologistas como diagnóstico, sendo utilizada para os pacientes que recusam a realização da biópsia pulmonar e nos quais o LBA não mostrou alterações significativas. Assim, em muitos pacientes o diagnóstico é de suposição, dificultando a utilização destes casos para estudo científico.
No nosso grupo, quatro (50%) dos oito pacientes estudados eram do sexo masculino e quatro (50%) eram do sexo feminino. A HCL pulmonar foi considerada, historicamente, uma doença típica de homens. No entanto, Colby e Lombard(6), em 1983, reviram 13 publicações que consideravam a distribuição por sexo e encontraram predomínio masculino em 10 estudos, predomínio feminino em 2 e casuísticas iguais em 1, com um total de 320 pacientes, sendo 185 homens (57,8%) e 135 mulheres (42,2%). Apesar de ter sido caracterizada uma maior frequência em homens, a tendência atual da literatura é não considerar a HCL pulmonar uma doença do sexo masculino. Assim, apesar da pequena amostra, nossos dados corroboram os encontrados em outros estudos(18.19).
A idade dos pacientes na época do diagnóstico da doença variou entre 18 e 61 anos, com média de 35,4 anos, sendo estes dados semelhantes aos habitualmente encontrados na literatura(6).
Acometimento extrapulmonar foi observado em quatro dos nossos pacientes (50%), sendo três com lesões ósseas e um com lesões ósseas e cutâneas associadas. O envolvimento de outros órgãos, além do pulmão, foi maior que o relatado na literatura. Colby(4) descreve que menos de 15% dos pacientes adultos com HCL pulmonar terão lesões extrapulmonares ou doença disseminada. O fato, possivelmente, é consequente à dificuldade de diagnosticar doenças intersticiais do parênquima pulmonar. Neste contexto, a presença de doença extrapulmonar, principalmente o achado de lesões ósseas, certamente facilita o diagnóstico de HCL. Somente no nosso grupo, dois pacientes foram diagnosticados pela associação de alterações pulmonares a lesões ósseas.
Informações relacionadas à evolução da doença foram obtidas de sete pacientes. Observamos estabilização do quadro clínico em 57% desses pacientes, e progressão, com piora dos sintomas respiratórios, em 43%. Estes dados contrastam com os encontrados em diversos estudos, que relatam uma evolução mais favorável para a forma pulmonar da HCL(20). No estudo de Friedman et al.(19), em que se obteve informações referentes à evolução da doença de 60 pacientes, 16 (26,7%) eram assintomáticos e assim permaneceram, 39 (65%) apresentaram estabilização ou remissão dos sintomas, e somente 5 (8,3%) tiveram progressão da doença.
Tivemos acesso a radiografias de tórax de seis pacientes, e as alterações encontradas com maior frequência foram reticulação, observada em quatro dos seis casos (66,7%), e cistos, em três dos seis casos (50%). A TCAR foi capaz de demonstrar, em três casos, que a reticulação observada na radiografia simples correspondia, em parte, a cistos de paredes finas. Os cistos bem definidos nas radiografias correspondiam a cistos de paredes espessas na tomografia. As radiografias, ao contrário da TCAR, não foram capazes de demonstrar características da forma dos cistos, que são de grande valor no diagnóstico de HCL pulmonar por meio de imagem.
Não observamos boa correlação das alterações observadas nas radiografias de tórax com as encontradas na TCAR. Em somente dois de seis casos (33,3%) a associação de nódulos e cistos, as mais características alterações da HCL pulmonar, pôde ser observada na radiografia simples. Grenier et al.(11) relataram achados semelhantes em seu estudo de 17 casos de HCL pulmonar, com diagnóstico de alta probabilidade da doença podendo ser feito em 40% das radiografias de tórax.
Na avaliação das TCARs, observamos nódulos em seis (75%) dos oito pacientes estudados, sendo esta frequência semelhante à encontrada na literatura(21). No entanto, a presença e a quantidade de nódulos variaram com a fase de evolução da doença. Em um dos casos em que nódulos não foram observados, o paciente apresentava doença em fase avançada e as principais alterações tomográficas eram de pulmão em estádio final. Os típicos nódulos estrelados são observados com maior frequência nas fases mais precoces da doença, e no nosso grupo de estudo foram incomumente observados (12,5%).
O achado mais frequente na TCAR de pacientes com HCL pulmonar foram cistos, que puderam ser observados em todos os pacientes. Quanto ao tamanho dos cistos, houve predomínio dos pequenos (< 10 mm), presentes em 100% das tomografias. Em 75% dos casos notamos cistos com diâmetro entre 10 e 20 mm e em 37,5% foram identificadas lesões maiores que 20 mm. Em 75% dos casos observamos cistos de diversos tamanhos no mesmo paciente. Estes dados estão de acordo com os habitualmente relatados(14).
Cistos de paredes espessas foram observados em 50% dos nossos casos. Apesar de cistos de paredes espessas terem sido observados somente em pequena quantidade em cada caso, a frequência de sua ocorrência foi maior que a relatada na literatura. Bonelli et al.(22) não encontraram cistos de paredes espessas nos dez casos por eles estudados. Destacamos, no entanto, que mesmo na TCAR pode ser difícil caracterizar lesões císticas, e a diferenciação de nódulos escavados e brônquios ectasiados com pequenos cistos de paredes espessas pode, por vezes, não ser óbvia.
A forma mais frequente dos cistos foi a arredondada, que foi encontrada em todos os pacientes. Em 62,5% dos casos observamos cistos com as formas lobulada, confluente ou com septos, muitos destes determinando formas bizarras. Estes aspectos atípicos de lesões císticas são muito particulares da doença(23).
A associação de cistos de diversos tamanhos e formas com lesões nodulares menores que 5 mm foi observada em 75% dos pacientes do nosso estudo. Esta associação é altamente sugestiva de HCL pulmonar(11).
Embora nódulos tenham sido observados em seis (75%) casos, notamos importante predomínio de lesões císticas em todos os pacientes. Em dois casos (25%) não observamos nódulos, entretanto, em um desses casos, os aspectos tomográficos eram incomuns para HCL, sendo evidenciados apenas pequenos cistos arredondados, de paredes finas, sem qualquer alteração do parênquima pulmonar adjacente, e no outro a doença estava em fase tardia da evolução, quando a presença de nódulos não é habitual.
As TCARs de seis pacientes evidenciaram outras alterações em associação aos cistos e nódulos. As mais frequentes foram espessamento dos septos interlobulares, opacidades lineares, infiltrado em vidro fosco, distorção do parênquima pulmonar e reação pleural, ocorrendo cada uma em três pacientes. Reação pleural não é um achado frequente nas tomografias dos pacientes com HCL pulmonar e, à microscopia, pode ser a expressão de pleurite eosinofílica reacional(4). Um dos nossos pacientes referiu história de derrame pleural. Nos outros dois casos não encontramos relato de doença da pleura. No entanto, no nosso meio, o achado de reação pleural deve ser considerado com cuidado, por causa da elevada prevalência desta alteração como consequência de doença tuberculosa. Em dois pacientes observamos, na TCAR, faveolamento, sendo que nos dois casos a doença apresentava-se em estádio avançado da evolução.
O acometimento dos recessos costofrênicos na HCL pulmonar não é habitual. Bonelli et al.(22) encontraram lesões nesta topografia em um (10%) de dez casos estudados. Diversos estudos destacam esta característica como sendo um dado importante no diagnóstico diferencial da HCL com outras doenças intersticiais(23,24). No nosso estudo encontramos uma porcentagem maior de envolvimento dos recessos costofrênicos (25%) do que a descrita na literatura. No entanto, devemos ressaltar que no caso 5 as lesões características de HCL pulmonar foram observadas somente nos dois terços superiores dos pulmões, sendo as alterações dos lobos inferiores semelhantes às encontradas na fibrose pulmonar, com as lesões (faveolamento) localizando-se nas porções periféricas dos pulmões, notadamente nos segmentos posteriores.
As lesões apresentaram distribuição homogênea pelas zonas centrais e periféricas do parênquima pulmonar em cinco (62,5%) dos oito casos. Nos casos restantes (37,5%), observamos predomínio das lesões nas zonas centrais do pulmão. No entanto, este achado não é o habitualmente relatado. Moore et al.(21) não observaram diferenças na distribuição horizontal das lesões, e Brauner et al.(14) e Lieberman et al.(24) descreveram predomínio na periferia.
Em um paciente foi possível correlacionar os aspectos da TCAR com as alterações histopatológicas. Diversas fases da evolução da doença puderam ser observadas. Alterações precoces como áreas de infiltrado celular, caracterizadas principalmente pela presença de linfócitos e células de Langerhans, foram identificadas em múltiplos locais.
À medida que a doença evolui, o infiltrado se organiza em granuloma, com localização tipicamente peribronquiolar. A extensão do infiltrado para os septos alveolares determina aspecto irregular do granuloma, que se manifesta na tomografia como nódulo estrelado.
Destruição do parênquima pulmonar com formação de cistos ocorre com a progressão da doença. A caracterização de cistos é difícil à microscopia, pois estes tendem a colapsar com o corte do material biopsiado. No entanto, áreas do parênquima pulmonar em destruição são comumente identificadas.
Nosso estudo confirma que a TCAR é o melhor método de imagem para avaliação das alterações observadas na forma pulmonar da HCL, por permitir melhor visualização e caracterização das lesões císticas e nodulares. A associação destas lesões não é comumente observada em outras doenças pulmonares e sua presença sugere fortemente o diagnóstico de HCL pulmonar.
REFERÊNCIAS
1. Osband ME. Histiocytosis X. Langerhans’ cell histiocytosis. Hematol Oncol Clin North Am. 1987;1:737-51.
2. Komp DM. Langerhans cell (eosinophilic) granulomatosis. In: Cecil RL, Plum F, Bennett JC, editors. Cecil textbook of medicine. 20th ed. Philadelphia, PA: Saunders; 1996. p. 955-6.
3. Reynolds HY. Langerhans cell granulomatosis. In: Fauci AS, Braunwald E, Isselbacher KJ, et al., editors. Harrison’s principles of internal medicine. 14th ed. New York, NY: McGraw-Hill; 1998. p. 1465.
4. Colby TV. Pulmonary histiocytosis X. In: Hasleton PS, editor. Spencer’s pathology of the lung. 5th ed. New York, NY: McGraw-Hill; 1996. p. 767-801.
5. Valeyre D, Soler P, Hance A. Langerhans’ cell granulomatosis. In: Bone RC, Dantzker DR, George RB, et al., editors. Pulmonary and critical care medicine on CD-ROM. St. Louis, MO: Mosby-Year Book; 1996.
6. Colby TV, Lombard C. Histiocytosis X in the lung. Hum Pathol. 1983;14:847-56.
7. Soler P, Kambouchner M, Valeyre D, et al. Pulmonary Langerhans’ cell granulomatosis (histiocytosis X). Annu Rev Med. 1992;43:105-15.
8. Naidich DP. High resolution computed tomography of cystic lung disease. Semin Roentgenol. 1991;26:151-74.
9. Nakata H, Kimoto T, Nakayama T, et al. Diffuse peripheral lung disease: evaluation by high-resolution computed tomography. Radiology. 1985;157:181-5.
10. Smith CM. Eosinophilic granuloma. In: Bone RC, Dantzker DR, George RB, et al., editors. Pulmonary and critical care medicine on CD-ROM. St. Louis, MO: Mosby-Year Book; 1996.
11. Grenier P, Valeyre D, Cluzel P, et al. Chronic diffuse interstitial lung disease: diagnostic value of chest radiography and high-resolution CT. Radiology. 1991;179:123-32.
12. Austin JHM, Müller NL, Friedman PJ, et al. Glossary of terms for CT of the lungs: recommendations of the Nomenclature Committee of the Fleischner Society. Radiology. 1996;200:327-31.
13. Lacronique J, Roth C, Battesti J-P, et al. Chest radiological features of pulmonary histiocytosis X: a report based on 50 adult cases. Thorax. 1982;37:104-9.
14. Brauner MW, Grenier P, Mouelhi MM, et al. Pulmonary histiocytosis X: evaluation with high-resolution CT. Radiology. 1989;172:255-8.
15. Arico M, Egeler RM. Clinical aspects of Langerhans cell histiocytosis. Hematol Oncol Clin North Am. 1998;12:247-58.
16. Brauner MW, Grenier P, Tijani K, et al. Pulmonary Langerhans cell histiocytosis: evolution of lesions on CT scans. Radiology. 1997;204:497-502.
17. Refabert L, Rambaud C, Mamou-Mani T, et al. Cd1a-positive cells in bronchoalveolar lavage samples from children with Langerhans cell histiocytosis. J Pediatr. 1996;129:913-5.
18. Weber WN, Margolin FR, Nielsen SL. Pulmonary histiocytosis X. A review of 18 patients with reports of 6 cases. Am J Roentgenol Radium Ther Nucl Med. 1969;107:280-9.
19. Friedman PJ, Liebow AA, Sokoloff J. Eosinophilic granuloma of the lung. Clinical aspects of primary pulmonary histiocytosis in the adult. Medicine (Baltimore). 1981;60:385-96.
20. Malpas JS. Langerhans cell histiocytosis in adults. Hematol Oncol Clin North Am. 1998;12:259-68.
21. Moore AD, Godwin JD, Müller NL, et al. Pulmonary histiocytosis X: comparison of radiographic and CT findings. Radiology. 1989;172:249-54.
22. Bonelli FS, Hartman TE, Swensen SJ, et al. Accuracy of high-resolution CT in diagnosing lung diseases. AJR Am J Roentgenol. 1998;170:1507-12.
23. Webb WR, Müller NL, Naidich DP. High-resolution CT of the lung. 2nd ed. Philadelphia: Lippincott-Raven; 1996.
24. Lieberman PH, Jones CR, Steinman RM, et al. Langerhans cell (eosinophilic) granulomatosis. A clinicopathologic study encompassing 50 years. Am J Surg Pathol. 1996;20:519-52.
1. Médica do Serviço de Radiologia do Hospital Universitário Clementino Fraga Filho (HUCFF) da Universidade Federal do Rio de Janeiro (UFRJ) e do Instituto D’Or para Pesquisa e Educação, Rio de Janeiro, RJ, Brasil.
2. Professor Assistente de Pneumologia da Universidade do Estado do Rio de Janeiro (UERJ), Rio de Janeiro, RJ, Brasil.
3. Professor Assistente de Radiologia da Universidade do Estado do Rio de Janeiro (UERJ), Médico do Serviço de Radiologia do Hospital Universitário Clementino Fraga Filho (HUCFF) da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil.
Endereço para correspondência:
Dra. Rosana Souza Rodrigues
Rua Diniz Cordeiro, 30, Botafogo
Rio de Janeiro, RJ, Brasil, 22281-100
E-mail: rosana.souzarodrigues@gmail.com
Recebido para publicação em 30/3/2011.
Aceito, após revisão, em 25/5/2011.
Trabalho realizado no Serviço de Radiologia do Hospital Universitário Clementino Fraga Filho (HUCFF) da Universidade Federal do Rio de Janeiro (UFRJ) e no Serviço de Pneumologia do Hospital Universitário Pedro Ernesto (HUPE) da Universidade do Estado do Rio de Janeiro (UERJ), Rio de Janeiro, RJ, Brasil.
 Vol. 44 nº 4 - Jul. / Ago. of 2011
Vol. 44 nº 4 - Jul. / Ago. of 2011






