Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 44 nº 2 - Mar. / Abr. of 2011
Vol. 44 nº 2 - Mar. / Abr. of 2011
|
ENSAIO ICONOGRÁFICO
|
|
|
|
|
Autho(rs): Filipe Ramos Barra1; Fabrício Guimarães Gonçalves2; Valter de Lima Matos3; Cássio Lemos Jovem1; José Luis Furtado de Mendonça4; Lázaro Luís Faria do Amaral5; Raquel delCarpio-O’Donovan6 |
|
|
Descritores: Sinais radiológicos; Neurorradiologia; Tomografia computadorizada; Imagem por ressonância magnética. |
|
|
Resumo: Sinal da “pegada do salto alto” (“high heel foot print sign”) na base do crânio
O sinal da “pegada do salto alto” (Figura 1) auxilia no entendimento da intrincada anatomia da base do crânio e compreende dois importantes forames da base do crânio. A parte anterior da “pegada do salto alto” representa o forame oval (FO), e a posterior, o “salto” propriamente dito, o forame espinhoso (FE). O nervo mandibular, terceira divisão do nervo trigêmeo, é o principal componente do FO(1). O gânglio ótico, a artéria meníngea acessória, o nervo petroso acessório e veias emissárias também são ali encontradas. No interior do FE encontra-se a artéria meníngea média(2), cuja ausência está relacionada à persistência da artéria estapedial(3). 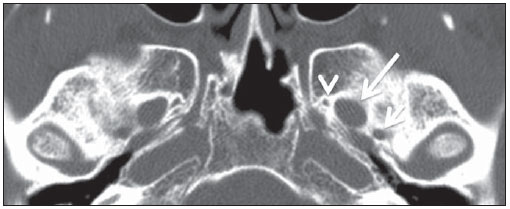 Figura 1. Imagem de TC no plano axial demonstrando o aspecto normal da base do crânio. O sinal da “pegada do salto alto” está em evidência. A seta pequena indica o forame espinhoso, e a seta grande, o forame oval. Anteriormente à “pegada do salto alto” localiza-se o forame de Vesalius (forame venoso) (cabeça de seta). Sinal do limão na espinha bífida O sinal do limão (Figura 2) é um achado útil na detecção de espinha bífida e está comumente associado a hidrocefalia e malformação de Arnold-Chiari II(4). O sinal do limão pode estar presente em até 98% dos casos de espinha bífida(5). O sinal do limão não é exclusivo da espinha bífida, sendo visto em encefaloceles, displasia tanatofórica, higroma cístico, malformação de Dandy-Walker, hérnia diafragmática, agenesia do corpo caloso, hidronefrose e em casos de varizes da veia umbilical. Nos primeiros seis meses de gestação o sinal do limão refere-se à alteração na configuração do osso frontal fetal, que perde sua convexidade, tornando-se côncavo ou retificado à ultrassonografia(4). O sinal é explicado pela perda da convexidade do osso frontal devido a uma diminuição da pressão intraespinhal e consequente redução da pressão intracraniana(6). 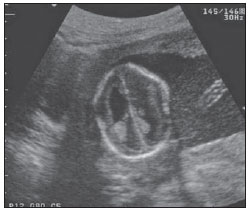 Figura 2. Imagem de ultrassonografia no plano axial de um feto de 18 semanas com espinha bífida ao nível dos plexos coroides evidenciando o sinal do limão, secundário a alterações na configuração do osso frontal. Sinal da banana na malformação de Arnold-Chiari II O sinal da banana (Figura 3) é encontrado em defeitos do tubo neural, principalmente na malformação de Arnold-Chiari II. Nestes casos, a fossa posterior é pequena, a cisterna magna perde a sua configuração normal, existe herniação do tronco cerebral e tonsilas cerebelares pelo forame magno, e o cerebelo passa a circundar o tronco cerebral assumindo uma configuração curva em formato de banana(7,8). A sensibilidade e especificidade deste sinal variam de acordo com o risco familiar prévio, com a população estudada e com as habilidades do operador, chegando ser positivo em até 69% dos casos de Chiari II(5). 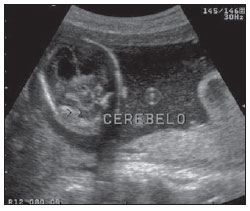 Figura 3. Imagem por ultrassonografia gestacional no 2º trimestre, ao nível da fossa posterior. Nota-se que o cerebelo tem aspecto anormal, circundando o tronco cerebral, configurando o sinal da banana. Sinal do dente molar na síndrome de Joubert O sinal do dente molar (Figura 4) é representado pela alteração do mesencéfalo visto em cortes axiais de tomografia computadorizada (TC) e ressonância magnética (RM). Este sinal é visto principalmente em casos de síndrome de Joubert. Nestes casos, não ocorre decussação dos pedúnculos cerebelares superiores, e estes se espessam e assumem orientação mais horizontal e perpendicular ao tronco cerebral(9). A síndrome de Joubert é uma doença autossômica recessiva caracterizada por movimentos oculares anormais, nistagmo, dificuldade de acompanhar objetos com o olhar, episódios de taquipneia, apneia e atraso no desenvolvimento motor(10). 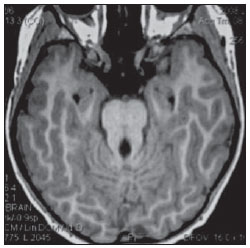 Figura 4. Imagem ponderada em T1 no plano axial na altura dos pedúnculos cerebelares superiores em um paciente com síndrome de Joubert demonstrando o sinal do dente molar. Cauda dural no meningioma A cauda dural é uma porção espessada da dura-máter adjacente a uma lesão, que realça assemelhando-se a uma cauda (Figura 5). O sinal, que já foi descrito como altamente específico para meningiomas, pode também estar presente em outros tumores, tanto extra quanto intra-axiais. Pode corresponder a alterações vasculares isoladas, invasão tumoral, crescimento tumoral adjacente e não contíguo e micronódulos tumorais. É pouco específico para meningiomas, mas possui boa sensibilidade, variando entre 50% e 80%(11,12). 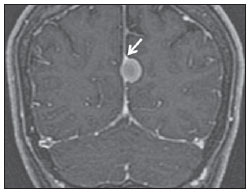 Figura 5. Imagem SPGR ponderada em T1 no plano coronal após uso de contraste em uma paciente de 40 anos. O sinal da cauda dural (seta) é evidenciado, associado a um pequeno meningioma parassagital parietal à esquerda. “Sal e pimenta” no paraganglioma O aspecto de “sal e pimenta” (Figura 6) é um sinal de alta sensibilidade e especificidade para os paragangliomas da cabeça e pescoço. O “sal” nas imagens ponderadas em T2 pode ser explicado pela matriz tumoral, que se mostra hiperintensa devido a hemorragia e fluxo lento intratumorais, e e nas imagens ponderadas em T1 pós-contraste, pelo ávido realce. A “pimenta” é explicada tanto em T2 como em T1 devido aos flow-voids dos pequenos vasos no interior dessas massas(13). 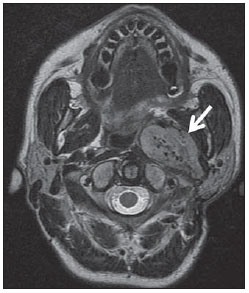 Figura 6. Imagem ponderada em T2 no plano axial de um paciente de 48 anos, ao nível da orofaringe. Observa-se um grande paraganglioma no espaço carotídeo à esquerda (seta) mostrando o aspecto típico de “sal e pimenta”. Cérebro em panqueca (“pancake sign”) na holoprosencefalia alobar Cérebro em panqueca (Figura 7) representa o aspecto do parênquima cerebral presente na holoprosencefalia alobar(14). Holoprosencefalia é uma malformação decorrente de um defeito na clivagem do prosencéfalo. As holoprosencefalias dividem- se basicamente em três grandes grupos: lobar, semilobar e alobar. Na forma alobar, a mais grave, encontra-se uma cavidade ventricular única, fusão dos lobos frontais, disgenesia do corpo caloso, alterações do terceiro ventrículo, bulbo e tratos olfatórios, ausência da fissura interhemisférica, além de fusão dos tálamos e gânglios da base(15,16). 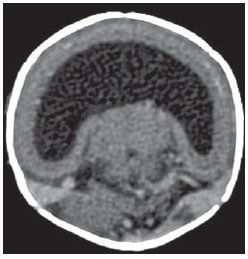 Figura 7. Imagem de TC em recém-nascido com achados típicos de holoprosencefalia alobar. Notase cavidade ventricular única, ausência do corpo caloso, do terceiro ventrículo, da fissura inter-hemisférica e tentório, além de fusão dos tálamos e gânglios da base. O cérebro em panqueca referese à extrema anomalia de clivagem do prosencéfalo, com fusão dos lobos frontais anteriormente a um cisto dorsal, outra anormalidade típica. Sinal do pão da Páscoa na esclerose de múltiplos sistemas do tipo C O sinal do pão da Páscoa (ou da cruz) (Figura 8) pode ser observado na atrofia de múltiplos sistemas do tipo C. O sinal é caracterizado por hipersinal cruciforme em T2 na ponte em razão da perda seletiva de neurônios das fibras transversas pontocerebelares, com preservação do tegmento pontino e das fibras dos tratos corticoespinhais. A atrofia de múltiplos sistemas é uma desordem neurodegenerativa que acomete em graus variados os gânglios da base e o complexo olivopontocerebelar(17,18). 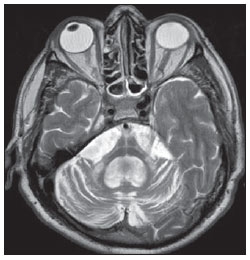 Figura 8. Imagem no plano axial ponderada em T2 ao nível dos pedúnculos cerebelares médios em uma paciente de 59 anos com atrofia de múltiplos sistemas tipo C. O sinal do pão da Páscoa (ou da cruz) é caracterizado por hipersinal cruciforme na ponte. Figura em oito na lissencefalia As lissencefalias são um grupo de desordens causadas por um distúrbio de migração neuronal entre a 8a e 14a semanas de gestação que cursam com pobreza generalizada de giros e sulcos. Elas podem ser completas (tipo I – agiria) ou incompletas (tipo II – agiria-paquigiria). Na lissencefalia tipo I as fissuras sylvianas são rasas e verticalizadas, com o cérebro tendo uma configuração semelhante à figura do oito, devido a um estreitamento na sua porção média pelas fissuras de Sylvius, associado a colpocefalia, giros planos, córtex espessado e má-definição córtico-subcortical, e está associada à síndrome de Miller-Dieker (Figura 9). Na lissencefalia tipo II o córtex é espessado, com uma aparência de polimicrogiria, paquigiria, hipoplasia do tronco e cerebelo e hidrocefalia, e está relacionada à síndrome de Walker-Warburg(19,20). 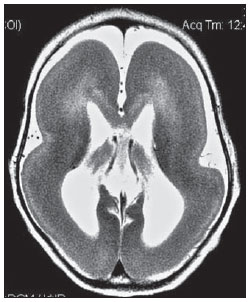 Figura 9. Imagem ponderada em T2 no plano axial em um paciente recém-nascido com lissencefalia demonstrando o aspecto típico da figura do oito. Este aspecto é caracterizado pela pobreza generalizada de giros e sulcos, estreitamento da fissuras sylvianas, associado a colpocefalia, giros planos, córtex espessado e má-definição córtico-subcortical. Sinal da face do panda gigante na doença de Wilson O sinal da face do panda gigante (Figura 10) pode estar presente na doença de Wilson. Esta doença é uma degeneração hepatocelular, causada por uma desordem genética associada a anormalidades no transporte de cobre e consequente acúmulo deste em vários órgãos, principalmente fígado e encéfalo. O sinal à RM caracteriza- se pela hiperintensidade em T2 no tegmento pontino, hipointensidade da substância cinzenta periaquedutal e preservação parcial do sinal nos núcleos rubros, na porção lateral da pars reticulata da substância negra e do colículo superior(21). 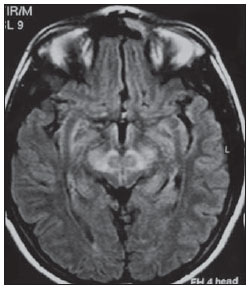 Figura 10. Imagem FLAIR no plano axial em uma paciente com doença de Wilson. O sinal da face do panda gigante é caracterizado pelo alto sinal em T2 no tegmento pontino, hipossinal da substância cinzenta periaquedutal e sinal preservado nos núcleos rubros, na porção lateral da pars reticulata da substância negra e do colículo superior. Sinal do copo de martini na persistência hiperplásica do vítreo primário Na persistência hiperplásica do vítreo primário (Figura 11) há remanescentes embrionários congênitos de vasos hialinos. O vítreo primário é suprido pela circulação hialoide embrionária que regride ao nascimento. Na forma posterior, a mais comum, um tecido conectivo fibromuscular localiza- se no vítreo adjacente e aderido à lente e conectando-se lateralmente a um processo ciliar anormalmente alongado. À RM notase uma massa retrolental de partes moles e vascular, associada a uma imagem linear de baixo sinal central que corresponde à vasculatura hialoide residual que liga o cristalino à cabeça do nervo óptico, lembrando a imagem de um copo de martini. Associadamente, o vítreo pode apresentar alto sinal devido a hemorragia, além da presença de um globo ocular pequeno(22). 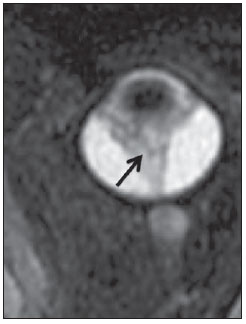 Figura 11. Imagem ponderada em T2 com saturação de gordura no plano axial da órbita direita de um paciente de 11 meses com leucocoria. Observa- se massa triangular retrolental de partes moles (seta), associada a um componente linear de baixo sinal central que corresponde à vasculatura hialoide residual que liga a lente à cabeça do nervo óptico. Tal achado é descrito como sinal do copo de martini e é encontrado na persistência hiperplásica do vítreo primário. Sinal do trilho de trem no meningioma da bainha do nervo óptico Os meningiomas da bainha do nervo óptico correspondem a aproximadamente um terço dos tumores primários do complexo nervo óptico-bainha e são mais comuns em mulheres entre a terceira e quinta décadas de vida. O sinal do trilho de trem (Figura 12) é melhor visualizado nas imagens axiais de TC ou RM pós-contraste e corresponde a uma faixa central não captante de contraste (nervo óptico) delimitada pela captação da bainha do nervo óptico de cada lado acometida pelo meningioma. O sinal do trilho de trem é extremamente útil na diferenciação entre meningioma da bainha do nervo óptico e glioma do nervo óptico. O nervo óptico poderá estar espessado e infiltrado pelo glioma, mas sua bainha geralmente não demonstra captação pelo meio de contraste. O sinal do trilho do trem, apesar de característico, não é específico do meningioma da bainha do nervo óptico e pode ocorrer no pseudotumor orbitário, na neurite perióptica, na sarcoidose, na leucemia e no linfoma(23,24). 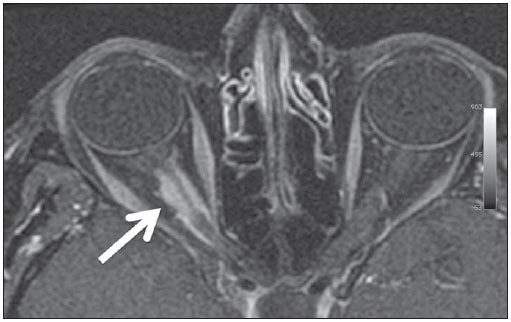 Figura 12. Imagem ponderada em T1 com saturação de gordura no plano axial pós-contraste de uma paciente do sexo feminino de 53 anos com perda progressiva da acuidade visual do olho direito. Observa- se o nervo óptico envolvido e comprimido por uma massa circunferencial captante de contraste circundando a bainha do nervo óptico (seta). “Boxcar ventricle” – ventrículos laterais em forma de vagão na doença de Huntington O sinal do ventrículo em vagão (Figura 13) representa o aspecto proeminente dos ventrículos laterais no plano coronal na doença de Huntington, secundário a atrofia dos núcleos da base, principalmente dos núcleos caudados(25). A doença de Huntington é uma alteração neurodegenerativa autossômica dominante que acomete principalmente adultos jovens. A doença de Huntington envolve a coordenação motora e alterações cognitivas e de comportamento. O achado de dilatação ventricular, assim como de atrofia dos gânglios da base, é muito sensível, mas pouco específica(26,27). 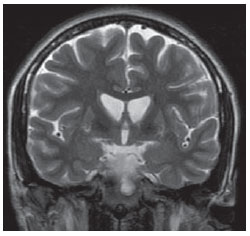 Figura 13. Imagem no plano coronal ponderada em T2 em um paciente de 50 anos com déficit cognitivo, movimentos involuntários dos dedos das mãos e descoordenação motora. Observa-se atrofia bilateral dos núcleos caudados e dilatação compensatória dos ventrículos laterais, achado conhecido como sinal do ventrículo em vagão (boxcar ventricle), encontrado na doença de Huntington. Sinal da órbita vazia na neurofibromatose tipo I A neurofibromatose tipo I é uma doença autossômica dominante com apresentação variável, e um terço dos pacientes tem alterações no encéfalo e na coluna. Entre as alterações possíveis destacam-se as manchas café-com-leite, os nódulos de Lisch, os neurofibromas, os fibromas plexiformes e os gliomas do nervo óptico. O sinal da órbita vazia (Figura 14) representa a aparência da órbita nos exames radiográficos e tomográficos do crânio, por causa da ausência da linha inominada decorrente da displasia da asa maior do esfenoide, com encurtamento da parede lateral da órbita e aplainamento do ângulo orbitário(28). 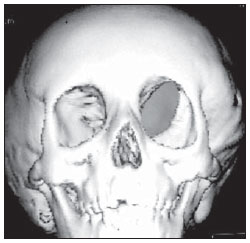 Figura 14. Sinal da órbita vazia à esquerda em um paciente de 22 anos com neurofibromatose do tipo I. Cortesia do Dr. Prasad Hanagandi, Montreal, Canadá. Sinal do golpe de sabre no escleroderma localizado Escleroderma localizado é caracterizado por lesões escleróticas da pele e tecidos subcutâneos e difere da esclerose sistêmica pela ausência de envolvimento sistêmico significativo; em geral, possui um prognóstico melhor(29). O escleroderma localizado invariavelmente afeta a cabeça, cuja manifestação inclui uma lesão linear, geralmente frontoparietal (escleroderma em coup de sabre) (Figura 15), hemiatrofia facial progressiva ou síndrome de Parry- Romberg, na qual a atrofia se estende além da pele e tecido celular subcutâneo, envolvendo músculo e ossos. Os achados de RM são anormais em 90% dos casos e incluem hiperintensidades em imagem ponderada em T2 no corpo caloso, subcorticais, na substância cinzenta profunda e tronco cerebral, na maioria das vezes ipsilaterais. Atrofia focal, achado dermatológico principal, também pode ser encontrada no parênquima cerebral(30). 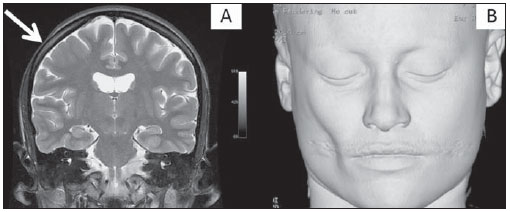 Figura 15. A: Imagem no plano coronal ponderada em T2 de uma paciente portadora de escleroderma evidenciando o sinal do golpe de sabre (seta), que consiste de uma lesão cutânea linear, usualmente frontoparietal. B: Em outra paciente, outra manifestação encontrada no escleroderma é a hemiatrofia facial progressiva ou síndrome de Parry-Romberg, na qual a atrofia se estende além da pele e tecido celular subcutâneo, envolvendo músculo e ossos. CONCLUSÃO Na prática radiológica nos deparamos com alguns sinais que nos remetem a analogias com alimentos, animais, figuras mitológicas, objetos, dentre outros. Independentemente das suas especificidades, sinais podem ser úteis na formulação de uma lista de diagnósticos diferenciais mais relevantes e contribuir no estreitamento entre esses diagnósticos. REFERÊNCIAS 1. Kamel HA, Toland J. Trigeminal nerve anatomy: illustrated using examples of abnormalities. AJR Am J Roentgenol. 2001;176:247–51. 2. Krayenbühl N, Isolan GR, Al-Mefty O. The foramen spinosum: a landmark in middle fossa surgery. Neurosurg Rev. 2008;31:397–401. 3. Silbergleit R, Quint DJ, Mehta BA, et al. The persistent stapedial artery. AJNR Am J Neuroradiol. 2000;21:572–7. 4. Thomas M. The lemon sign. Radiology. 2003; 228:206–7. 5. Van den Hof MC, Nicolaides KH, Campbell J, et al. Evaluation of the lemon and banana signs in one hundred thirty fetuses with open spina bifida. Am J Obstet Gynecol. 1990;162:322–7. 6. Aubry MC, Aubry JP, Dommergues M. Sonographic prenatal diagnosis of central nervous system abnormalities. Childs Nerv Syst. 2003;19: 391–402. 7. Benacerraf BR, Stryker J, Frigoletto FD Jr. Abnormal US appearance of the cerebellum (banana sign): indirect sign of spina bifida. Radiology. 1989;171:151–3. 8. Roche CJ, O’Keeffe DP, Lee WK, et al. Selections from the buffet of food signs in radiology. Radiographics. 2002;22:1369–84. 9. McGraw P. The molar tooth sign. Radiology. 2003;229:671–2. 10. van Beek EJ, Majoie CB. Case 25: Joubert syndrome. Radiology. 2000;216:379–82. 11. Wallace EW. The dural tail sign. Radiology. 2004;233:56–7. 12. Rokni-Yazdi H, Azmoudeh Ardalan F, Asadzandi Z, et al. Pathologic significance of the “dural tail sign”. Eur J Radiol. 2009;70:10–6. 13. Neves F, Huwart L, Jourdan G, et al. Head and neck paragangliomas: value of contrast-enhanced 3D MR angiography. AJNR Am J Neuroradiol. 2008;29:883–9. 14. Dubourg C, Bendavid C, Pasquier L, et al. Holoprosencephaly. Orphanet J Rare Dis. 2007;2:8. 15. Poe LB, Coleman LL, Mahmud F. Congenital central nervous system anomalies. Radiographics. 1989;9:801–26. 16. Thakur S, Singh R, Pradhan M, et al. Spectrum of holoprosencephaly. Indian J Pediatr. 2004;71: 593–7. 17. Shrivastava A. The hot cross bun sign. Radiology. 2007;245:606–7. 18. Schrag A, Kingsley D, Phatouros C, et al. Clinical usefulness of magnetic resonance imaging in multiple system atrophy. J Neurol Neurosurg Psychiatry. 1998;65:65–71. 19. Shinagare AB, Patil NK. Imaging of congenital malformations of brain: a pictorial essay. The Internet Journal of Radiology. 2008;9(1). 20. Ghai S, Fong KW, Toi A, et al. Prenatal US and MR imaging findings of lissencephaly: review of fetal cerebral sulcal development. Radiographics. 2006;26:389–405. 21. Kuruvilla A, Joseph S. ‘Face of the giant panda’ sign in Wilson’s disease: revisited. Neurol India. 2000;48:395–6. 22. Lameen H, Andronikou S, Ackermann C, et al. Persistent hyperplastic primary vitreous versus retinal detachment. SA Journal of Radiology. 2006;10:24–5. 23. Johns TT, Citrin CM, Black J, et al. CT evaluation of perineural orbital lesions: evaluation of the “tram-track” sign. AJNR Am J Neuroradiol. 1984;5:587–90. 24. Kanamalla US. The optic nerve tram-track sign. Radiology. 2003;227:718–9. 25. Mascalchi M, Lolli F, Della Nave R, et al. Huntington disease: volumetric, diffusion-weighted, and magnetization transfer MR imaging of brain. Radiology. 2004;232:867–73. 26. Mühlau M, Wohlschläger AM, Gaser C, et al. Voxel-based morphometry in individual patients: a pilot study in early Huntington disease. AJNR Am J Neuroradiol. 2009;30:539–43. 27. Postert T, Lack B, Kuhn W, et al. Basal ganglia alterations and brain atrophy in Huntington’s disease depicted by transcranial real time sonography. J Neurol Neurosurg Psychiatry. 1999;67: 457–62. 28. George RA, Godara SC, Som PP. Cranio-orbitaltemporal neurofibromatosis: a case report and review of literature. Indian J Radiol Imaging. 2004;14:317–9. 29. Appenzeller S, Montenegro MA, Dertkigil SS, et al. Neuroimaging findings in scleroderma en coup de sabre. Neurology. 2004;62:1585–9. 30. Kister I, Inglese M, Laxer RM, et al. Neurologic manifestations of localized scleroderma: a case report and literature review. Neurology. 2008;71: 1538–45. 1. Médicos Residentes em Radiologia e Diagnóstico por Imagem do Hospital Universitário de Brasília, Brasília, DF, Brasil. 2. Membro Titular do Colégio Brasileiro de Radiologia e Diagnóstico por Imagem (CBR), Fellow em Neurorradiologia do Montreal General Hospital, McGill University Health Centre (MUHC), Montreal, Quebec, Canadá. 3. Médico Neurorradiologista do Hospital Universitário de Brasília e do Hospital Santa Luzia, Brasília, DF, Brasil. 4. Médico Neurorradiologista do Hospital de Base do Distrito Federal, Brasília, DF, Brasil. 5. Médico Neurorradiologista, Chefe do Departamento de Neurorradiologia da Medimagem – Hospital da Beneficência Portuguesa de São Paulo e do Hospital Santa Catarina, São Paulo, SP, Brasil. 6. Médica Neurorradiologista, Professora de Radiologia, Diretora do Neuroradiology Fellowship Program, McGill University Health Centre (MUHC), Montreal, Quebec, Canadá. Endereço para correspondência: Dr. Fabrício Guimarães Gonçalves Department of Diagnostic Radiology, Montreal General Hospital 1650 Cedar Avenue Montreal, Quebec, Canada H3G 1A4 E-mail: goncalves.neuroradio@gmail.com Recebido para publicação em 17/4/2010. Aceito, após revisão, em 14/10/2010. Trabalho realizado no Montreal General Hospital, McGill University Health Centre (MUHC), Montreal, Quebec, Canadá. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554