INTRODUÇÃO
O lúpus eritematoso sistêmico (LES) é uma doença inflamatória multissistêmica crônica de causa desconhecida que pode afetar pele, rins, pulmões, sistema nervoso e, principalmente, articulações, sendo de interesse de todas as subespecialidades radiológicas. As alterações musculoesqueléticas no LES são frequentes(1), podendo estar relacionadas à atividade da doença ou muitas vezes ao tratamento instituído. Desde 1982, o Colégio Americano de Reumatologia considera artrite como um dos 11 critérios de classificação da doença(2). O grau de envolvimento pode variar desde uma artralgia transitória a formas severas de artropatia deformante, estimando-se que pelo menos 90% dos pacientes apresentarão algumas destas manifestações no curso da doença(3). Apesar dessa alta prevalência, esse tema tem recebido pouca atenção e suas formas radiológicas de apresentação, assim como muitas das complicações iatrogênicas ou não relacionadas à doença, são pouco reconhecidas no meio radiológico.
ARTRALGIA, ARTRITE E ARTROPATIA DEFORMANTE
Artralgia e artrite são as manifestações articulares mais comuns, esta última classicamente descrita como não erosiva, migratória e reversível, comprometendo principalmente punhos, joelhos, ombros e mãos (sobretudo interfalângicas proximais) em cerca de 80% dos pacientes lúpicos(4). Uma característica intrínseca da artropatia do LES é a possibilidade de ocorrência de deformidades associadas, presentes em cerca de 5% dos pacientes(5), que não tem ainda mecanismos etiopatogênicos muito bem conhecidos, mas que se acredita estar relacionada a algum tipo de frouxidão capsuloligamentar e tendínea intrínseca nesses pacientes(6). Bywaters tentou definir esta forma de artropatia deformante no LES, baseando-se principalmente no desvio, reversível ou não, do eixo dos metacarpais e no chamado índice de Jaccoud(7) (Tabela 1). Posteriormente, foram propostas três formas diferentes de artropatia deformante nesta doença: artropatia de Jaccoud (AJ),
rhupus hand e artropatia deformante discreta(8) (Figura 1).
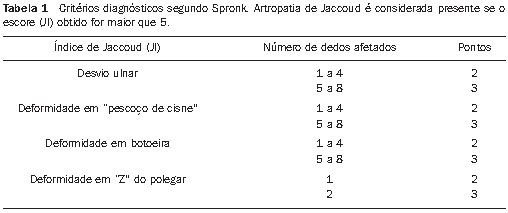
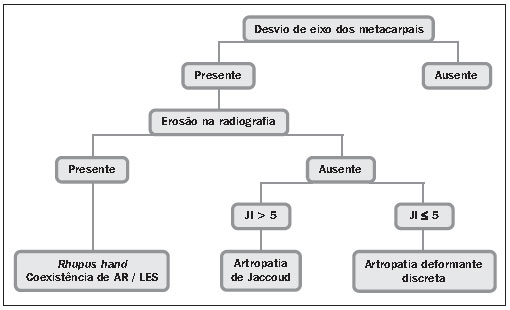
Figura 1. Algoritmo com as formas de classificação do comprometimento articular no LES.
inicialmente descrita em pacientes com febre reumática por Sigismond Jaccoud, em 1869(9), esta complicação tem sido relatada em outras doenças, tanto reumatológicas (esclerodermia, vasculites, síndrome de Sjögren, artrite psoriática e, principalmente, LES) quanto não reumatológicas (HIV, doença inflamatória intestinal, sarcoidose, neoplasias e outras)(10–14). Esta forma de artrite deformante lembra, inicialmente, aquelas observadas na artrite reumatoide (AR), mas classicamente é “reversível”(15,16). é caracterizada por desvio ulnar dos metacarpais, subluxações de metacarpofalângicas e deformidades em “pescoço de cisne” e em botoeira, além de deformidade em “Z” do polegar (Figura 2). Apesar de descrita principalmente nas mãos, pode envolver qualquer outra articulação, como joelhos(17), ombros(18) e pés(19), com presença de hálux valgo, dedos em martelo e subluxação de metatarsofalângicas. São poucas as informações histológicas sobre a AJ, mas se caracterizam pela presença de sinovite, com infiltrado inflamatório, fibrose pericapsular e alterações microvasculares, mas sem o
pannus clássico da AR(20,21).
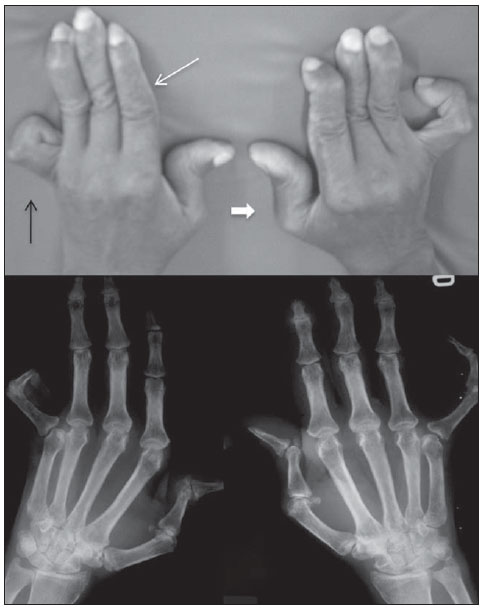
Figura 2. Artropatia de Jaccoud nas mãos. Paciente com 55 anos, diagnóstico de LES há 17 anos. Fotografia e radiografia simples mostrando desvio ulnar dos metacarpais, deformidade em “pescoço de cisne” (seta branca fina), botoeira (seta preta) e “Z” do polegar (seta branca cheia).
Além disso, este tipo de comprometimento articular no LES afeta a qualidade de vida desses pacientes, ressaltando-se ainda que não existem achados laboratoriais definidos que possam diferenciar pacientes lúpicos com e sem AJ(22).
Achados de imagem – A radiografia das mãos demonstra as clássicas deformidades vistas na AR, mas sem as erosões ósseas. Curiosamente, uma alteração radiológica descrita classicamente na literatura seria uma erosão focal na face radial da cabeça dos metacarpais ou metatarsais (erosão em gancho), determinada pelo desvio ulnar persistente e provavelmente representando uma adaptação local ao estresse anômalo gerado por este desvio ósseo(23). Porém, tal achado é visto muito raramente na prática mdica.
A ressonância magnética (RM) permite mostrar com mais precisão o comprometimento sinovial e tendíneo próprio desta condição. Apesar de normalmente haver espessamento sinovial e realce pós-contraste, não se caracteriza aquele exuberante
pannus da AR, sendo, em geral, um comprometimento mais discreto, mesmo nas formas mais deformantes de doença. Em 2003, Ostendorf et al. demonstraram, por meio de RM, a presença de tenossinovite edematosa e sinovite nas mãos da maioria dos seus 14 pacientes lúpicos, três deles definidos como AJ(24). Em outro recente estudo realizado no nosso serviço(25), 20 pacientes com critérios para AJ de mãos foram avaliados com RM e demonstrou-se a presença de tenossinovite de flexores em mais de 90% dos casos, bem como algum grau de erosão subarticular em cerca de 50% dos pacientes. Isto demonstra que a ausência de erosão pode não ser um achado patognomônico da AJ, como se pensava do ponto de vista radiológico, sendo que os novos métodos de imagem, não só na avaliação das mãos, como das outras articulações, podem fornecer informações importantes sobre este padrão de acometimento (Figura 3).
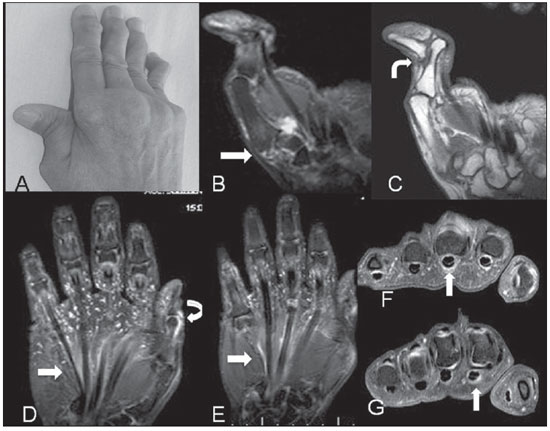
Figura 3. A–C: Paciente do sexo feminino, 60 anos, diagnóstico de LES há 24 anos. Fotografia e imagens coronais ponderadas em T2 com supressão de gordura e T1 demonstrando o aspecto da deformidade em “Z” do polegar, com subluxação e derrame na interlinha trapézio-base do primeiro metacarpal (seta reta), além de luxação completa da interfalângica distal (seta curva). D–G: Outra paciente do sexo feminino, com diagnóstico de LES há 13 anos. Imagens demonstrando sinais de tenossinovite (setas retas) em RM ponderada em T2 com supressão de gordura no plano coronal (D) e T1 pós-contraste coronal (E) e axial (F,G). Há também sinovite na interfalângica do polegar (seta curva).
A ultrassonografia é um bom método no acompanhamento e reconhecimento de sinovite, tenossinovite e erosão, porém tem sido subutilizada e pouco reconhecida no nosso meio na avaliação de doenças reumatológicas em geral.
Rhupus hand e artropatia deformante discreta
Apesar de usualmente não erosiva, há pacientes que desenvolvem uma forma erosiva de doença semelhante à AR. O termo
rhupus passou a ser empregado para descrever essa condição, pois tais pacientes geralmente preenchem critérios de classificação de LES e AR simultaneamente(26). Assim, até que ponto representa um subgrupo da artropatia lúpica ou uma associação das duas doenças é motivo de muita discussão. A possibilidade de superposição das duas doenças tem sido estimada em 1%(27). Do ponto de vista de imagem, apresenta-se com as deformidades típicas da AR com o comprometimento erosivo, geralmente já identificado nas radiografias simples, semelhante aos achados da AR.
A artropatia deformante discreta seria uma forma de acometimento deformante, contudo, mais branda, sem erosão e sem preencher os critérios para AJ. Predominam desvio ulnar e a deformidade em “pescoço de cisne”, sem deformidade ao nível do polegar e nos pés. Tal subgrupo não tem sido uniformemente reconhecido por todos os autores.
INFECÇÃO
Comprometimento infeccioso durante o curso da doença envolve principalmente o trato urinário e o respiratório, tendo prevalência acima de 50% e sendo uma das principais causas de morte e admissões hospitalares nesses pacientes(28). Do ponto de vista musculoesquelético, predominam a artrite séptica e a osteomielite, apesar de não serem muito comuns. O envolvimento articular pode ser isolado ou comprometer múltiplas articulações, sendo causado principalmente por bactérias gram-negativas, em particular espécies de
Salmonella e
Staphylococcus aureus, e é geralmente de origem hematogênica(29). Em relação à osteomielite, sua patogênese neste contexto também é multifatorial, estando relacionada à virulência do organismo infectante, doença subjacente, estado imune do paciente, bem como com o tipo e a localização do osso acometido, sendo o
S. aureus o principal agente nestes casos(30). Assim, a distribuição dos agentes infecciosos lembra o que ocorre na anemia falciforme(31).
Em razão do uso crônico de corticoide nesses pacientes, os sinais e sintomas de infecção são comumente mascarados e o processo segue geralmente um curso crônico e indolente. A falta de resposta clínica ao uso de corticoide ou outras drogas imunossupressoras diante de artrite monoarticular persistente deve levantar a suspeita de processo infeccioso subjacente. A depender da fase de doença, os diversos métodos de imagem podem reconhecer essas complicações e o radiologista tem papel importante no alerta desses quadros (Figura 4).
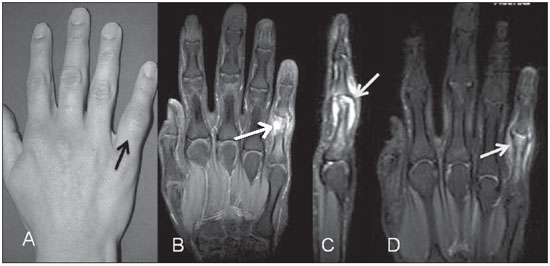
Figura 4. Artrite séptica da interfalângica proximal do quinto dedo. Paciente lúpica com dor e aumento de volume local (A). RM no plano coronal e sagital T2 com supressão de gordura (B,C) demonstrando edema medular nas bordas ósseas (seta em B) e distensão por líquido da cápsula articular da interfalângica proximal do quinto dedo (seta em C). Na imagem sagital fica mais bem caracterizada, também, a erosão da falange proximal correspondente. RM no plano coronal T1 pós-contraste (D) demonstrando o realce envolvendo osso, sinóvia e partes moles dessa área (seta).
Rotura tendínea espontânea é uma situação clínica rara. No início do sculo passado, McMaster demonstrou que uma rotura artificial em torno de 75% da espessura tendínea seria improvável de determinar uma rotura de toda sua espessura na ausência de um processo patológico de base(32). Doenças do colágeno e uso de corticoide, associados ou não, seriam as condições necessárias. Na AR, por exemplo, esta complicação é conhecida e relacionada sobretudo à alteração mecânica local, em decorrência das erosões ósseas que determinam laceração tendínea secundária.
Nos pacientes lúpicos sua etiologia não é muito conhecida e estaria relacionada a trauma local, processo inflamatório crônico de base e uso de corticoide(33), não havendo dados na literatura que definam a real incidência desta alteração. Ao contrário da AR, em que as roturas tendíneas são quase sempre nas mãos, no LES elas são mais comuns nos membros inferiores, comprometendo o quadríceps e, principalmente, patelar e tendão do calcâneo, traduzindo, também, um componente mecânico associado. O uso de corticoide é fator predisponente conhecido e presente em quase todos os relatos na literatura. Sua ação está relacionada a um efeito antimitótico e inibição dos fibroblastos, com estímulo de colagenase e consequente desorganização estrutural das fibras(34).
Evidências recentes mostram que este tipo de complicação no LES pode estar relacionado a um predomínio do processo inflamatório primário nas bainhas tendíneas, causando enfraquecimento tendíneo local e posterior rotura(25). Uma revisão sistemática recente desenvolvida no nosso serviço revelou que a AJ está presente em pelo menos 35% dos casos de rotura tendínea espontânea no LES(35).
OSTEONECROSE
Osteonecrose é causa de morbidade e disfunção em pacientes lúpicos e sua ocorrência varia segundo diversos autores, com prevalência de 2% a 30%(36). Acomete geralmente múltiplos sítios, sendo mais comum na cabeça femoral, que está envolvida em mais de 70% dos casos e sempre deve ser avaliada quando outras áreas de infarto ou necrose são identificadas(37). No contexto da doença, sua etiologia é multifatorial e permanece controversa em muitos casos, havendo vários potenciais fatores de risco, como presença de fenômeno de Raynaud, vasculite, hiperlipidemia e provavelmente a presença de anticorpos antifosfolípides(38). Porém, o uso de corticoide em altas doses (mais que 20 mg/dia) é sem dúvida o principal determinante(39). A osteonecrose nos pacientes lúpicos provoca dor antes da destruição articular, ao contrário da AR, que ocorre sincronicamente com a destruição articular pela doença inflamatória sinovial, comprometendo tanto a cabeça femoral como a margem acetabular.
A radiografia simples, geralmente, mostra-se é normal nas fases iniciais, e a presença de esclerose subcondral já infere um dano articular irreversível. A RM é o método de escolha no diagnóstico precoce, permitindo que intervenções terapêuticas possam ser empreendidas(40), visando prevenir o colapso articular e a doença degenerativa secundária, que é a complicação mais comum (Figura 5). A tomografia computadorizada e a cintilografia são menos acuradas e não identificam as lesões na fase inicial da doença.
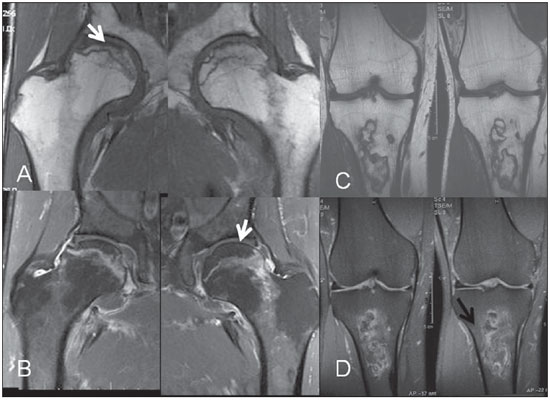
Figura 5. Necrose avascular aguda em paciente lúpico oculta radiograficamente. RM dos quadris direito e esquerdo no plano coronal T1 (A) e T1 pós-contraste com supressão de gordura (B) demonstrando a área necrótica de contornos serpiginosos (setas) na região subcondral da cabeça femoral, sem evidente colapso da superfície articular. A bilateralidade do achado é típica do uso associado de corticoide. Imagens de RM do joelho direito de outro paciente lúpico sob corticoterapia nas ponderações T1 (C) e T2 com supressão de gordura (D) mostrando área de infarto medular com sinal da “dupla linha” traduzindo a interface osso isquêmico/zona reparativa na região metaepifisária proximal da tíbia (seta em D).
Em 5% a 10% dos pacientes lúpicos também manifesta-se um quadro de miopatia inflamatória, porém achados laboratoriais da doença muscular podem estar presentes em até 50% dos casos(41). O padrão de miosite inflamatória relacionada ao LES é similar à miosite idiopática, muitas vezes tão severa quanto a forma primária, é trazendo dificuldade para se definir como miosite do LES ou superposição de LES com miosite clássica(42).
Mais comum ainda no LES seria uma miopatia associada ao uso de drogas. Além do corticoide, que é a medicação classicamente associada a miopatia não inflamatória, alguns casos raros de miopatia secundária ao uso de cloroquina têm sido descritos(43). O diagnóstico geralmente é clínico e laboratorial, raramente necessitando a confirmação por biópsia muscular.
Assim como nas formas clássicas de miosite, a RM é o método de imagem de eleição, apesar de pouco específico. Auxilia no diagnóstico diferencial, acompanhamento de resposta terapêutica e ajuda a definir o local da biópsia. A alteração típica observada na RM é de aumento de sinal em T2 e STIR, por aumento intracelular de líquido ou infiltrado inflamatório, associado ao aumento de volume muscular(44). Em 2000, um estudo brasileiro com 13 pacientes lúpicos avaliados por RM demonstrou principalmente predomínio de atrofia muscular(45).
Assim como nas outras doenças do colágeno, calcificações de partes moles também são identificadas no LES, porém são pouco frequentes(46,47). Fatores precipitantes como nefrite, uso de alfacarcidol e mesmo diurticos têm sido recentemente vinculados a esta condição(48).
O estudo radiológico mostra muito bem estas calcificações e a RM, na dúvida diagnóstica, pode identificar, além das calcificações, eventual comprometimento inflamatório associado de partes moles.
FRATURA DE INSUFICIÊNCIA
Muitos fatores estão envolvidos na gênese da osteoporose no LES, tais como insuficiência renal, amenorreia, menopausa precoce, citocinas inflamatórias crônicas e, principalmente, uso crônico de corticoide(49). Em particular no LES, o uso crônico de corticoide é determinante no desenvolvimento das fraturas de insuficiência de coluna e outros sítios (sobretudo dos membros inferiores), com prevalência de fratura vertebral osteoporótica superior a 20% em estudo recente(50). Este achado demonstra que é necessária atenção especial na avaliação por imagem destes pacientes, sobretudo radiológica, que é sempre a mais utilizada no nosso meio, valorizando-se o aspecto de osteopenia e da morfologia dos corpos vertebrais. A RM é o método de escolha nas fases iniciais, quando a radiografia convencional ainda não é diagnóstica. Identificam-se os aspectos clássicos de edema ósseo medular nas sequências com supressão de gordura, com áreas lineares de baixo sinal no seu interior (Figura 6). O estudo cintilográfico é também sensível a estas fraturas, porém, nem sempre muito específico.
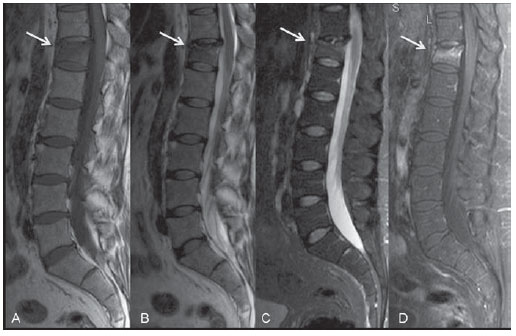
Figura 6. Fratura de insuficiência aguda de corpo vertebral. Paciente lúpica, 47 anos, em uso de corticoide. RM no plano sagital T1 (A) e FSE T2 (B) demonstram colapso parcial do platô superior de T12 (setas). O edema existente fica mais bem caracterizado na sequência STIR (C), associado a processo inflamatório reacional local com impregnação pós-contraste em T1 (D).
O envolvimento musculoesquelético na doença lúpica é frequente e pode ser um indicador precoce de atividade de doença. O grau de envolvimento pode variar desde discreta artralgia até acentuadas formas de artropatia deformante, além de roturas tendíneas e outras formas de comprometimento, como miopatia, osteonecrose, fraturas de insuficiência e infecção, estas últimas muito frequentemente associadas ao tratamento instituído.
De particular importância no envolvimento musculoesquelético do LES é o quadro de artrite com deformidades (AJ), que embora classicamente “reversíveis”, podem trazer grande confusão com o quadro clínico da AR. Nesse ponto, o radiologista assume grande importância ao chamar a atenção do clínico para essa possibilidade diante de um quadro radiológico articular (radiografia simples) com grandes deformidades e subluxações, e virtualémente ausência de erosões.
Outra grande contribuição da avaliação radiológica do sistema musculoesquelético no paciente com LES foi obtida com a utilização mais frequente da RM para identificar precocemente o desenvolvimento de necrose avascular secundária ao uso prolongado de corticoide e, assim, permitir que medidas possam ser tomadas objetivando evitar o colapso ósseo.
Outro método de imagem que tem ganhado grande espaço no acompanhamento de pacientes reumatológicos, particularmente na AR, é o estudo ultrassonográfico de alta definição das articulações. A experiência desse método em LES é extremamente limitada. Um estudo que está em andamento no nosso Serviço visa avaliar a importância da ultrassonografia nos pacientes com AJ, além de determinar a distribuição e intensidade das alterações quando comparadas aos pacientes lúpicos com artrite, porém sem AJ.
Assim, com o maior conhecimento das alterações radiológicas presentes nos pacientes com LES, o radiologista passa a ter um papel diferenciado no seguimento desses pacientes, como já o faz em outras condições reumatológicas como a AR.
REFERÊNCIAS
1. Lebowitz R, Schumacher HR Jr. Articular manifestations of systemic lupus erythematosus. Ann Intern Med. 1971;74:911–21.
2. Tan EM, Cohen AS, Fries JF, et al. The 1982 revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum. 1982;25:1271–7.
3. Dubois EL, Tuffanelli DL. Clinical manifestations of systemic lupus erythematosus. JAMA. 1964;190:104–11.
4. Reilly PA, Evison G, McHugh NJ, et al. Arthropathy of hands and feet in systemic lupus erythematosus. J Rheumatol. 1990;17:777–84.
5. Aptekar RG, Lawless OJ, Decker JL. Deforming non-erosive arthritis of the hand in systemic lupus erythematosus. Clin Orthop Relat Res. 1974;(100):120–4.
6. Sierra-Jimenez G, Sanchez-Ortiz A, Aceves-Avila FJ, et al. Tendinous and ligamentous derangements in systemic lupus erythematosus. J Rheumatol. 2008;35:2187–91.
7. Bywaters EGL. Jaccoud’s syndrome: a sequel to the joint involvement of systemic lupus erythematosus. Clin Rheum Dis. 1975;1:125–48.
8. van Vugt RM, Derksen RH, Kater L, et al. Deforming arthropathy or lupus and rhupus hands in systemic lupus erythematosus. Ann Rheum Dis. 1998;57:540–4.
9. Manthorpe R. The man behind the syndrome. Sigismond Jaccoud. With his 23d lecture he became part of medical history. Lakartidningen. 1992;89:1585–6.
10. Amano H, Furuhata N, Tamura N, et al. Hypocomplementemic urticarial vasculitis with Jaccoud’s arthropathy and valvular heart disease: case report and review of the literature. Lupus. 2008;17:837–41.
11. Ballard M, Meyer O, Adle-Biassette H, et al. Jaccoud’s arthropathy with vasculitis and primary Sjögren’s syndrome. A new entity. Clin Exp Rheumatol. 2006;24(2 Suppl 41):S102–3.
12. Ben Miled-M’Rad K, M’Rad S, Kchir M, et al. Caroli’s disease and Jaccoud’s arthropathy. Ann Gastroenterol Hepatol (Paris). 1993;29:107–9.
13. Bradley JD, Pinals RS. Jaccoud’s arthropathy in scleroderma. Clin Exp Rheumatol. 1984;2:337–40.
14. Conrozier T, Balblanc JC, Chapard R, et al. Jaccoud’s arthritis and angioimmunoblastic lymphadenopathy. Rev Rhum Mal Osteoartic. 1990;57:423–5.
15. Santiago MB, Galvão V. Jaccoud arthropathy in systemic lupus erythematosus: analysis of clinical characteristics and review of the literature. Medicine (Baltimore). 2008;87:37–44.
16. Caznoch CJ, Esmanhotto L, Silva MB, et al. Padrão de comprometimento articular em pacientes com lúpus eritematoso sistêmico e sua associação com presença de fator reumatóide e hiperelasticidade. Rev Bras Reumatol. 2006;46:261–5.
17. De la Sota M, Maldonado Cocco JA. Jaccoud’s arthropathy in knees in systemic lupus erythematosus. Clin Rheumatol. 1989;8:416–7.
18. Siam AR, Hammoudeh M. Jaccoud’s arthropathy of the shoulders in systemic lupus erythematosus. J Rheumatol. 1992;19:980–1.
19. Morley KD, Leung A, Rynes RI. Lupus foot. Br Med J (Clin Res Ed). 1982;284:557–8.
20. Spronk PE, ter Borg EJ, Kallenberg CG. Patients with systemic lupus erythematosus and Jaccoud’s arthropathy: a clinical subset with an increased C reactive protein response? Ann Rheum Dis. 1992;51:358–61.
21. Paredes JG, Lazaro MA, Citera G, et al. Jaccoud’s arthropathy of the hands in overlap syndrome. Clin Rheumatol. 1997;16:65–9.
22. Galvão V, Atta AM, Sousa Atta ML, et al. Profile of autoantibodies in Jaccoud’s arthropathy. Joint Bone Spine. 2009;76:356–60.
23. Pastershank SP, Resnick D. “Hook” erosions in Jaccoud’s arthropathy. J Can Assoc Radiol. 1980;31:174–5.
24. Ostendorf B, Scherer A, Specker C, et al. Jaccoud’s arthropathy in systemic lupus erythematosus: differentiation of deforming and erosive patterns by magnetic resonance imaging. Arthritis Rheum. 2003;48:157–65.
25. Ribeiro DS, Galvão V, Fernandes JL, et al. Magnetic resonance imaging of Jaccoud’s arthropathy in systemic lupus erythematosus. Joint Bone Spine. 2010;77:241–5.
26. Fernández A, Quintana G, Rondón F, et al. Lupus arthropathy: a case series of patients with rhupus. Clin Rheumatol. 2006;25:164–7.
27. Mawson AR. Are rheumatoid arthritis and systemic lupus erythematosus inversely related diseases? Med Hypotheses. 1985;18:377–86.
28. Petri M. Infection in systemic lupus erythematosus. Rheum Dis Clin North Am. 1998;24:423–56.
29. Chen JY, Luo SF, Wu YJ, et al. Salmonella septic arthritis in systemic lupus erythematosus and other systemic diseases. Clin Rheumatol. 1998;17:282–7.
30. Cuchacovich R, Gedalia A. Pathophysiology and clinical spectrum of infections in systemic lupus erythematosus. Rheum Dis Clin North Am. 2009;35:75–93.
31. Epss CH, Bryant DD, Coles MJ, et al. Osteomyelitis in patients who have sickle-cell disease. Diagnosis and management. J Bone Joint Surg Am. 1991;73:1281–94.
32. McMaster PE. Tendon and muscle rupture. Clinical and experimental studies on the causes and location of subcutaneous ruptures. J Bone Joint Surg. 1933;15:705–22.
33. Kissel CG, Sundareson AS, Unroe BJ. Spontaneous Achilles tendon rupture in a patient with systemic lupus erythematosus. J Foot Surg. 1991;30:390–7.
34. Houck JC, Patel YM. Proposed mode of action of corticosteroids on the connective tissue. Nature. 1965;206:158–60.
35. Alves EM, Macieira JC, Borba E, et al. Spontaneous tendon rupture in systemic lupus erythematosus: association with Jaccoud’s arthropathy. Lupus. 2010;19:247–54.
36. Mont MA, Glueck CJ, Pacheco IH, et al. Risk factors for osteonecrosis in systemic lupus erythematosus. J Rheumatol. 1997;24:654–62.
37. Cozen L, Wallace DJ. Avascular necrosis in systemic lupus erythematosus: clinical associations and a 47-year perspective. Am J Orthop (Belle Mead NJ). 1998;27:352–4.
38. Campos LM, Kiss MH, D’Amico EA, et al. Antiphospholipid antibodies and antiphospholipid syndrome in 57 children and adolescents with systemic lupus erythematosus. Lupus. 2003;12:820–6.
39. Zizic TM, Marcoux C, Hungerford DS, et al. Corticosteroid therapy associated with ischemic necrosis of bone in systemic lupus erythematosus. Am J Med. 1985;79:596–604.
40. Alves EM, Angrisani AT, Santiago MB. The use of extracorporeal shock waves in the treatment of osteonecrosis of the femoral head: a systematic review. Clin Rheumatol. 2009;28:1247–51.
41. Isenberg D. Myositis in other connective tissue disorders. Clin Rheum Dis. 1984;10:151–74.
42. Garton MJ, Isenberg DA. Clinical features of lupus myositis versus idiopathic myositis: a review of 30 cases. Br J Rheumatol. 1997;36:1067–74.
43. Richter JG, Becker A, Ostendorf B, et al. Differential diagnosis of high serum creatine kinase levels in systemic lupus erythematosus. Rheumatol Int. 2003;23:319–23.
44. Adams EM, Chow CK, PremkumarA, et al. The idiopathic inflammatory myopathies: spectrum of MR imaging findings. Radiographics. 1995;15:563–74.
45. Hilário MO, Yamashita H, Lutti D, et al. Juvenile idiopathic inflammatory myopathies: the value of magnetic resonance imaging in the detection of muscle involvement. Sao Paulo Med J. 2000;118:35–40.
46. Souza RAS, Rangel LV, Souza HFS, et al. Lúpus eritematoso cutâneo e calcinose universalis. Rev Bras Reumatol. 2000;40:18–20.
47. Souza HFS, Souza RAS, Rangel LV, et al. Calcificação intracerebral em lúpus eritematoso sistêmico. Rev Bras Reumatol. 2001;41:123–6.
48. Okada J, Nomura M, Shirataka M, et al. Prevalence of soft tissue calcifications in patients with SLE and effects of alfacarcidol. Lupus. 1999;8:456–61.
49. Panopalis P, Yazdany J. Bone health in systemic lupus erythematosus. Curr Rheumatol Rep. 2009;11:177–84.
50. Bultink IE, Lems WF, Kostense PJ, et al. Prevalence of and risk factors for low bone mineral density and vertebral fractures in patients with systemic lupus erythematosus. Arthritis Rheum. 2005;52:2044–50.
1. Especialista em Diagnóstico por Imagem, Médico Radiologista da Clínica Image Memorial e do Hospital Santa Izabel, Pós-graduando (Doutorado) da Escola Bahiana de Medicina e Saúde Pública, Salvador, BA, Brasil.
2. Professor de Radiologia da Faculdade de Medicina da Bahia/UFBA, Diretor Médico da Clínica Image Memorial, Salvador, BA, Brasil.
3. Especialista em Diagnóstico por Imagem, Diretor Médico da Clínica Image Memorial, Salvador, BA, Brasil.
4. Mestre, Fisioterapeuta, Professora da Universidade Católica do Salvador, Salvador, BA, Brasil.
5. Doutor, Professor Adjunto da Escola Bahiana de Medicina e Saúde Pública, Coordenador do Serviço de Reumatologia do Hospital Santa Izabel, Salvador, BA, Brasil.
Endereço para correspondência:
Dr. Daniel Sá Ribeiro
Rua Pacífico Pereira, 590/101, Garcia
Salvador, BA, Brasil, 40100-170
E-mail: danielribeiro.sa@gmail.com
Recebido para publicação em 18/4/2010.
Aceito, após revisão, em 13/9/2010.
 Vol. 44 nº 1 - Jan. / Fev. of 2011
Vol. 44 nº 1 - Jan. / Fev. of 2011






