Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 43 nº 6 - Nov. / Dez. of 2010
Vol. 43 nº 6 - Nov. / Dez. of 2010
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Andre Dietz Furtado1; Marcus Vinicius Rocha Pinto2; Cláudio de Carvalho Rangel3; Luiz Celso Hygino da Cruz Jr4; José Maria A. Lopes5; Manoel de Carvalho5; Jofre Antônio Oliveira Cabral5; Romeu Côrtes Domingues6; Emerson Leandro Gasparetto7 |
|
|
Descritores: Prematuros; Cérebro; Imagem por ressonância magnética; Imagem; Hipóxia. |
|
|
Resumo: INTRODUÇÃO
Ao longo das últimas décadas, avanços significativos têm sido observados nos cuidados perinatais e neonatais, o que tem melhorado dramaticamente as taxas de sobrevida de recém-nascidos que apresentam peso extremamente baixo ao nascer. Entretanto, observa-se preocupação cada vez maior com os desafios em relação ao desenvolvimento neurológico enfrentados após o nascimento pelos neonatos sobreviventes(1). O cérebro em desenvolvimento é extremamente vulnerável a lesões resultantes de grande variedade de fatores isquêmicos, inflamatórios, infecciosos e neurotóxicos(2). Recém-nascidos prematuros extremos apresentam risco maior de hemorragia cerebral, lesões da substância branca e desenvolvimento cerebral insuficiente(3). Os danos ao sistema nervoso central (SNC) aumentam a probabilidade de deficiências neurológicas e de desenvolvimento nesse grupo de pacientes(4). A técnica convencional de neuroimagem é geralmente empregada para se avaliar a presença e a extensão de danos cerebrais, assim como para prever resultados em termos de desenvolvimento neurológico. As duas principais modalidades de neuroimagem utilizadas na avaliação do cérebro em recém-nascidos prematuros são a ultrassonografia (US) e a ressonância magnética (RM) de crânio(5–8). A US craniana é confiável na avaliação de lesões hemorrágicas, hidrocefalia e alterações císticas(5,6). Tal técnica, entretanto, é normalmente realizada através da fontanela anterior, o que resulta em pequeno campo de visão. Ademais, a US craniana não apresenta precisão suficiente para se avaliar lesões difusas ou discretas, particularmente aquelas localizadas na substância branca(5–8). A RM do cérebro é mais sensível e específica que a US craniana para se detectar hemorragias, isquemia e lesões da substância branca(5,6,9–11). Ela também proporciona melhor caracterização das anomalias cerebrais mais comuns em neonatos prematuros(5,6,12). O objetivo do presente estudo foi avaliar a confiabilidade da análise visual qualitativa de anomalias cerebrais, por meio da RM de cérebro em uma coorte de 45 recém-nascidos prematuros extremos. MATERIAIS E MÉTODOS População de pacientes O Comitê de Ética em Pesquisa do Hospital aprovou o estudo, e um termo de consentimento livre e esclarecido para a realização dos estudos de RM sob sedação em idade equivalente a termo foi obtido de todos os pais. Uma coorte de 45 neonatos consecutivos com idade gestacional de 30 semanas ou menos (mediana de 27 semanas, variando entre 25 e 30 semanas) foi incluída neste estudo prospectivo. A idade gestacional foi calculada com base na data da última menstruação e confirmada por meio de dados de exames ultrassonográficos anteriores. Em média, os pacientes apresentaram peso ao nascer correspondente a 890 g (variando entre 385 g e 1.225 g). Pacientes em estado critico não foram incluídos no estudo, pelo menos até que o neonatologista encarregado desses pacientes confirmasse que eles poderiam ser submetidos à RM, sem nenhum risco, no centro de imagens associado ao hospital. Protocolo de imagem Todos os pacientes realizaram RM em equipamento de 1.5 T (Magnetom Avanto – Siemens Medical Systems; Erlangen, Alemanha) utilizando bobina de cabeça. As seguintes sequências foram obtidas: imagens sagitais 3D gradiente-eco ponderadas em T1 (tempo de repetição (TR)/tempo de eco (TE) = 1770/3,9 ms, field of view (FOV) = 190 Χ 190 mm, matriz = 256 Χ 256, espessura de corte = 0,7 mm), imagens axiais fast spin-echo (FSE) ponderadas em T2 (TR/TE = 5610/159 ms, FOV = 180 Χ 180 mm, matriz = 256 Χ 256, espessura de corte = 4 mm), e axiais, gradiente eco ponderadas em T2 (TR/TE = 786/35 ms, FOV = 180 Χ 180 mm, matriz = 256 Χ 256, espessura de corte = 4 mm, ângulo de inclinação = 30°). Análise das imagens Todos os exames de RM foram analisados de forma independente por dois neurorradiologistas (com cinco e seis anos de experiência) cegos aos dados clínicos. Em casos de discordância, um terceiro neurorradiologista analisava as imagens e as decisões finais eram definidas por consenso. Os seguintes achados de RM foram avaliados: 1) presença de hipersinal difuso e excessivo (diffuse and excessive high signal intensity – DEHSI), definida como áreas de alta intensidade de sinal dentro da substância branca periventricular e/ou subcortical em imagens FSE ponderadas em T2 (intensidade de sinal similar ao fluido cérebro-espinhal(7); 2) ventrículos laterais dilatados (diâmetro transversal >10 mm), medidos ao nível dos átrios(13–15), presença de hemorragia intracraniana definida como áreas anormais com características de sinal compatíveis com produtos de sangue, classificadas de acordo com sua localização em 3) hemorragia intraparenquimatosa (HIP), 4) hemorragia intraventricular (HIV) e 5) hemorragia da matriz germinativa (HMG); 6) áreas de sinal anormal nos gânglios basais e córtex; 7) áreas de aspecto cístico; 8) deformidades ventriculares; 9) aumento dos espaços subaracnóides que revestem as convexidades corticais (> 3 mm); 10) alargamento de fissura inter-hemisféricas (> 3 mm); 11) focos de leucoencefalomalácia precoce; 12) e anomalia de giros(7). Análise estatística A concordância interobservadores na análise das imagens de RM foi avaliada por meio do cálculo do índice kappa (κ), com os seguintes níveis de concordância: 0,00, pouca; 0,00 a 0,20, leve; 0,21 to 0,40, razoável; 0,41 a 0,60, moderada; 0,61 a 0,80, substancial; e 0,81 a 1,00, quase perfeita(16). O valor de p menor que 0,05 foi considerado estatisticamente significante. RESULTADOS Prevalência de anormalidades à RM cerebral em neonatos prematuros extremos Dos 45 casos estudados, apenas quatro (8,9%) apresentaram imagens normais à RM (Tabela 1). Os outros 41 (91,1%) apresentaram anormalidades à RM. Os achados mais frequentes foram: presença de hipersinal difuso e excessivo (DEHSI) na substância branca (75,6%) (Figura 1), dilatação dos ventrículos laterais (42,2%) (Figura 2), HMG (31,1%) (Figura 3), HIV (28,9%) (Figura 4), deformidades ventriculares (24,4%) (Figura 5), e aumento dos espaços subaracnóides (22,2%). 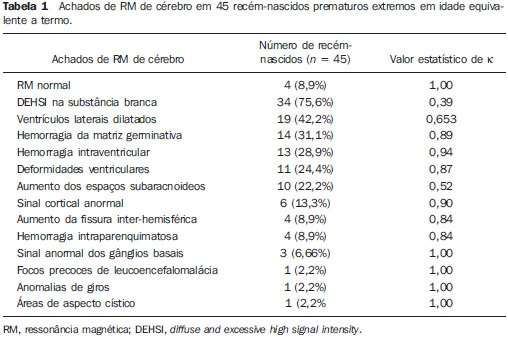 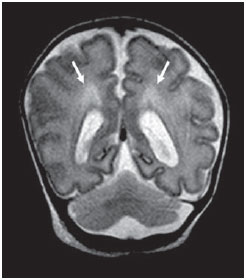 Figura 1. Imagem coronal ponderada em T2 (5610/159) demonstra alta intensidade de sinal difusa e excessiva, observada como alta intensidade de sinal anormal dentro da substância branca periventricular. 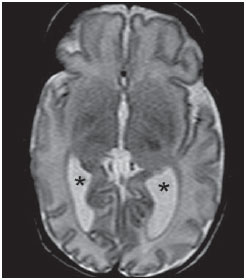 Figura 2. Imagem axial ponderada em T2 (5610/159) demonstra dilatação de ventrículos laterais medida ao nível dos átrios ventriculares (> 10 mm) (asteriscos). 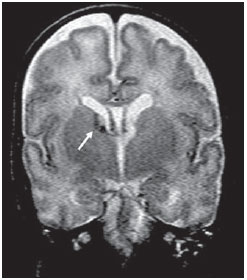 Figura 3. Imagem coronal ponderada em T2 (5610/159) demonstra hemorragia da matriz germinativa observada como material com baixa intensidade de sinal na zona subependimária (seta). 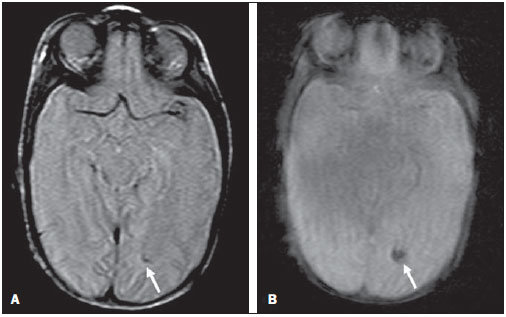 Figura 4. Imagens axial ponderada em T2 (A) (5610/159) e axial gradiente-eco (B) (1770/3.9; ângulo de inclinação = 30°) demonstram uma camada de material com baixa intensidade de sinal no corno occipital do ventrículo lateral esquerdo (setas). Observar o marcante efeito marcante de suscetibilidade dos produtos de sangue na imagem gradiente-eco. 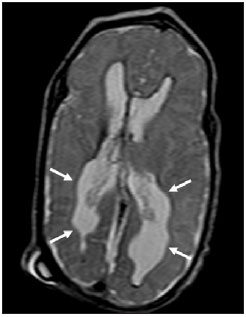 Figura 5. Imagem axial ponderada em T2 (5610/159) demonstra deformidades ventriculares evidenciadas como paredes ventriculares irregulares (setas). Confiabilidade da análise visual qualitativa das imagens de RM de cérebro convencional Todos os valores de κ obtidos na análise da variabilidade interobservadores foram estatisticamente significantes. A concordância interobservadores foi alta (κ > 0,60) para a maioria do achados anormais à RM (Tabela 1). O valor de κ foi moderado para aumento dos espaços subaracnóides que revestem as convexidades corticais (κ = 0,52) e foi apenas razoável para DEHSI na substância branca (κ = 0,39). DISCUSSÃO Recém-nascidos prematuros extremos apresentam alto risco de resultados adversos em termos de desenvolvimento neurológico(17–19). Estudos anteriores avaliaram as principais anomalias cerebrais observadas em pacientes submetidos à RM em idade equivalente a termo(6,7,12,20–23). A prevalência de anomalias cerebrais à RM foi alta em nossa coorte de pacientes. Apenas quatro (8,9%) pacientes tiveram RM de cérebro normais. As anomalias mais comuns foram DEHSI na substância branca (75,6%), dilatação ventricular (42,2%), e lesões hemorrágicas (HMG: 31,1% e HIV: 28,9%). Essa alta prevalência de anormalidades cerebrais observada neste estudo com 45 neonatos prematuros extremos é similar àquela observada em estudos anteriores(7,22). A US craniana é menos sensível para demonstrar a maioria dessas anormalidades da substância branca. Ademais, a relevância do achado de ecogenicidade da substância branca à US é controversa(1,5–9,20,21). Inder et al.(21) compararam séries de US craniana e RM de cérebro a termo em uma coorte de 96 recém-nascidos prematuros extremos. Esses autores enfatizaram as significativas limitações da US para detecção de lesões não císticas da substância branca. Além disso, a US craniana não demonstrou lesões discretas na substância branca entre o nascimento e o termo em um grupo de 32 neonatos prematuros, quando comparada à RM de cérebro(5). Concluindo, a US parece apresentar menor sensibilidade e especificidade para a avaliação de anomalias da substância branca em neonatos prematuros extremos, quando comparada à RM, e não se correlaciona com os resultados clínicos(5,21). A RM de cérebro é, portanto, considerada como a principal modalidade de imagem para prever resultados de desenvolvimento neurológico em neonatos prematuros extremos. Sugeriu-se que a gravidade das anormalidades observadas à RM convencional está diretamente relacionada a resultados adversos de desenvolvimento neurológico a longo prazo(20). Em nosso estudo, avaliamos a confiabilidade da análise visual subjetiva de imagens de RM convencional de cérebro adquiridas em idade equivalente a termo, em 45 neonatos prematuros extremos. A concordância interobservadores foi alta (κ > 0,60) para a maioria dos achados de RM, exceto para DEHSI na substância branca. No nosso estudo, observamos valor de κ relativamente baixo para DEHSI na substância branca (κ = 0,39). Ainda que estudos anteriores tenham definido as características de sinal de DEHSI na substância branca, elas são bastante dependentes da experiência do radiologista(1,7,22,23). Um profundo conhecimento dos padrões de normalidade da mielinização é essencial quando se considera a possibilidade de hipersinal difuso e excessivo na substância branca. Além disso, em alguns casos, lesões do SNC eram muitos graves e ocorreram precocemente no desenvolvimento fetal, tornando a avaliação dos padrões de normalidade da mielinização ainda mais difícil. Esse achado de concordância interobservadores relativamente baixa para DEHSI na substância branca, em nosso estudo, pode ter implicações clínicas importantes, pois o achado de anomalias da substância branca foi relatado como a principal anomalia à RM de cérebro relacionada ao prognóstico de curto e longo prazos em neonatos prematuros extremos; e as decisões clínicas e terapêuticas são frequentemente baseadas na presença ou ausência de anomalias da substância branca(5,20). Reconhecemos algumas limitações do nosso estudo. Pacientes em condições críticas não foram considerados para o estudo para se evitar que corressem riscos adicionais. A aquisição de imagens de RM foi feita em idade equivalente a termo, mas não ao nascer, de forma semelhante a outros estudos(6,7,12,20–23). Finalmente, como objetivo do nosso estudo era avaliar a confiabilidade de anomalias cerebrais observadas à RM, não correlacionamos os achados de RM com os resultados de longo prazo, o que já foi estudado(20). Concluindo, a RM convencional é geralmente empregada para se avaliar anomalias cerebrais em neonatos prematuros extremos. Os achados mais comuns de RM de cérebro em idade equivalente a termo em neonatos prematuros extremos foram DEHSI na substância branca, dilatação ventricular, HMG e HIV, que têm sido associados a resultados adversos em termos de desenvolvimento neurológico. Segundo o presente estudo, a RM convencional parece ser um método confiável para se avaliar as anormalidades cerebrais mais comuns em recém-nascidos prematuros extremos; entretanto, parece que a presença de hipersinal difuso e excessivo na substância branca é um achado menos confiável. REFERÊNCIAS 1. Inder TE, Wells SJ, Mogridge NB, et al. Defining the nature of the cerebral abnormalities in the premature infant: a qualitative magnetic resonance imaging study. J Pediatr. 2003;143:171–9. 2. Kuban KC, Leviton A. Cerebral palsy. N Engl J Med. 1994;330:188–95. 3. Vohr BR, Allen M. Extreme prematurity – the continuing dilemma. N Engl J Med. 2005;352:71–2. 4. Wood NS, Marlow N, Costeloe K, et al. Neurologic and developmental disability after extremely preterm birth. EPICure Study Group. N Engl J Med. 2000;343:378–84. 5. Maalouf EF, Duggan PJ, Counsell SJ, et al. Comparison of findings on cranial ultrasound and magnetic resonance imaging in preterm infants. Pediatrics. 2001;107:719–27. 6. Inder TE, Warfield SK, Wang H, et al. Abnormal cerebral structure is present at term in premature infants. Pediatrics. 2005;115:286–94. 7. Maalouf EF, Duggan PJ, Rutherford MA, et al. Magnetic resonance imaging of the brain in a cohort of extremely preterm infants. J Pediatr. 1999;135:351–7. 8. Hope PL, Gould SJ, Howard S, et al. Precision of ultrasound diagnosis of pathologically verified lesions in the brains of very preterm infants. Dev Med Child Neurol. 1988;30:457–71. 9. Blankenberg FG, Norbash AM, Lane B, et al. Neonatal intracranial ischemia and hemorrhage: diagnosis with US, CT, and MR imaging. Radiology. 1996;199:253–9. 10. Blankenberg FG, Loh NN, Bracci P, et al. Sonography, CT, and MR imaging: a prospective comparison of neonates with suspected intracranial ischemia and hemorrhage. AJNR Am J Neuroradiol. 2000;21:213–8. 11. Barkovich AJ, Westmark K, Partridge C, et al. Perinatal asphyxia: MR findings in the first 10 days. AJNR Am J Neuroradiol. 1995;16:427–38. 12. Battin MR, Maalouf EF, Counsell SJ, et al. Magnetic resonance imaging of the brain in very preterm infants: visualization of the germinal matrix, early myelination, and cortical folding. Pediatrics. 1998;101:957–62. 13. Farrell TA, Hertzberg BS, Kliewer MA, et al. Fetal lateral ventricles: reassessment of normal values for atrial diameter at US. Radiology. 1994;193:409–11. 14. McArdle CB, Richardson CJ, Nicholas DA, et al. Developmental features of the neonatal brain: MR imaging. Part I. Gray-white matter differentiation and myelination. Radiology. 1987;162(1 Pt 1):223–9. 15. McArdle CB, Richardson CJ, Nicholas DA, et al. Developmental features of the neonatal brain: MR imaging. Part II. Ventricular size and extracerebral space. Radiology. 1987;162(1 Pt 1):230–4. 16. Landis JR, Koch GG. The measurement of observer agreement for categorical data. Biometrics. 1977;33:159–74. 17. Saigal S, Feeny D, Rosenbaum P, et al. Self-perceived health status and health-related quality of life of extremely low-birth-weight infants at adolescence. JAMA. 1996;276:453–9. 18. Hack M, Flannery DJ, Schluchter M, et al. Outcomes in young adulthood for very-low-birth-weight infants. N Engl J Med. 2002;346:149–57. 19. Marlow N, Wolke D, Bracewell MA, et al. Neurologic and developmental disability at six years of age after extremely preterm birth. N Engl J Med. 2005;352:9–19. 20. Woodward LJ, Anderson PJ, Austin NC, et al. Neonatal MRI to predict neurodevelopmental outcomes in preterm infants. N Engl J Med. 2006;355:685–94. 21. Inder TE, Anderson NJ, Spencer C, et al. White matter injury in the premature infant: a comparison between serial cranial sonographic and MR findings at term. AJNR Am J Neuroradiol. 2003;24:805–9. 22. Arthur R. Magnetic resonance imaging in preterm infants. Pediatr Radiol. 2006;36:593–607. 23. Valkama AM, Pääkkö EL, Vainionpää LK, et al. Magnetic resonance imaging at term and neuromotor outcome in preterm infants. Acta Paediatr. 2000;89:348–55. 1. Pós-graduando em Neurorradiologia no Children’s Hospital of Pittsburgh, Pittsburgh, PA, EUA. 2. Acadêmico de Medicina da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil. 3. Radiologista da CDPI – Clínica de Diagnóstico Por Imagem e Clínica Multi-Imagem, Rio de Janeiro, RJ, Brasil. 4. Radiologista da CDPI – Clínica de Diagnóstico Por Imagem e Clínica Multi-Imagem, Pós-graduando (Doutorado) da Universidade Federal do Rio de Janeiro, (UFRJ), Rio de Janeiro, RJ, Brasil. 5. Neonatologistas da Clínica Perinatal Laranjeiras, Rio de Janeiro, RJ, Brasil. 6. Radiologista e Diretor Médico da CDPI – Clínica de Diagnóstico Por Imagem e Clínica Multi-Imagem, Rio de Janeiro, RJ, Brasil. 7. Radiologista da CDPI – Clínica de Diagnóstico Por Imagem e Clínica Multi-Imagem, Professor Associado do Departamento de Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil. Endereço para correspondência: Dr. Emerson L. Gasparetto Avenida das Américas, 4666, sala 325, Barra da Tijuca Rio de Janeiro, RJ, 22640-102, Brasil E mail: egasparetto@gmail.com Recebido para publicação em 26 de agosto de 2010. Aceito, após revisão, em 21 de outubro de 2010. * Estudo realizado na CDPI – Clínica de Diagnóstico Por Imagem, Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554