Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 43 nº 6 - Nov. / Dez. of 2010
Vol. 43 nº 6 - Nov. / Dez. of 2010
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Letícia Yurie Kimura1; Gustavo Spadaccia dos Santos Fernandes1; Karina Tavares de Melo Nobrega1; Luiz Augusto Gadia Gabure1; César Augusto Mastrofrancisco Cattani2; José Pedro da Silva3; Beatriz Helena Sanches Furlanetto4 |
|
|
Descritores: Drenagem anômala; Veias pulmonares; Anomalias congênitas; Tomografia computadorizada multidetectores. |
|
|
Resumo: INTRODUÇÃO
A drenagem venosa pulmonar anômala (DVPA) é um raro defeito cardíaco de etiologia desconhecida que ocorre quando há uma falha na formação das veias pulmonares, ocorrendo em menos de 1% dos defeitos cardíacos congênitos. É definida como drenagem de uma ou mais veias pulmonares fora do átrio esquerdo, com retorno venoso direta ou indiretamente para o átrio direito(1–4). A DVPA pode ser classificada em total, quando todas as quatro veias pulmonares drenam fora do átrio esquerdo, ou parcial, quando uma a três veias pulmonares drenam em uma veia sistêmica ou no átrio direito. A conexão anômala de parte ou de todas as veias pulmonares no circuito venoso sistêmico tem sido conhecida na forma parcial desde 1739 e na forma total desde 1798. Estas variações na conexão venosa pulmonar são incomuns, ocorrendo em 0,4% dos espécimes de autópsia(5). A DVPA total é uma condição rara na população geral, mas é frequentemente encontrada em hospitais especializados em cardiopatias congênitas(4–7). Há quatro tipos anatômicos desta condição, segundo a classificação de Darling, Rothney e Craig: – Supracardíaco: via uma veia vertical, geralmente drenando na veia inominada esquerda. É o tipo mais frequente, somando 40% a 50% dos casos. – Cardíaco: diretamente no átrio direito ou no seio coronário (20%). – Infracardíaco: via uma veia vertical para a veia porta ou para a veia cava inferior (10% a 20%). – Misto: uma combinação de dois ou mais dos tipos citados anteriormente (em torno de 10%). Todos os tipos de drenagens venosas pulmonares anômalas totais apresentam defeito do septo atrial associado, pois sua ausência é incompatível com a vida(4,6,7). Até pouco tempo atrás, o diagnóstico de DVPA era obtido por ecocardiograma e angiografia convencional. As principais desvantagens do ecocardiograma são ser operador-dependente, depender da janela acústica do paciente e a dificuldade de avaliar as estruturas extracardíacas, sobretudo a drenagem das veias pulmonares no átrio esquerdo, por sua posição posterior, muitas vezes deixando dúvidas sobre a real comunicação das veias pulmonares ao átrio esquerdo. A principal desvantagem da angiografia convencional é ser um método invasivo com maiores riscos de complicações. O objetivo deste estudo é demonstrar que a angiotomografia computadorizada com múltiplos detectores (ACMD) é um método efetivo e não invasivo para o diagnóstico de DVPA. MATERIAIS E MÉTODOS Realizou-se estudo retrospectivo das ACMDs cardíacas realizadas em nosso serviço, em aparelhos de 16 fileiras de detectores (Aquilion – Toshiba Medical Systems; Tóquio, Japão) e 64 fileiras de detectores (Light Speed VCT – GE Healthcare; Milwaukee, WI, EUA), no período de julho de 2003 a novembro de 2007, montando-se um banco de dados. A partir deste banco de dados das ACMDs cardíacas, foram separadas as que foram destinadas para avaliação de cardiopatias congênitas das que tiveram por objetivo analisar as artérias coronárias. Foram realizadas 2.905 ACMDs cardíacas neste período. Destas, 393 foram destinadas para avaliar cardiopatias congênitas e as 2.512 restantes, destinadas para analisar as artérias coronárias, conforme solicitação médica. Praticamente, todos os exames para avaliação de cardiopatias congênitas foram realizados sob procedimento anestésico, exceto os que o paciente colaborava com a apneia. Para os exames com anestesia, obedeceu-se jejum de 6 a 8 horas, de acordo com o tipo de alimentação, somente leite materno ou outro tipo de dieta, respectivamente. Para os que não necessitaram de anestesia, solicitou-se jejum de 4 horas. Todos os exames foram sincronizados ao eletrocardiograma do paciente de forma retrospectiva e foram realizadas duas aquisições, uma fase arterial e uma fase venosa, com injeção de 2 ml/kg de contraste iodado (Optiray 320 – Mallinckrodt; St. Louis, MO, EUA) seguida de 2 ml/kg de soro fisiológico a 0,9%, ambos em bolus. Não foi necessário utilizar beta-bloqueador nos casos com suspeita de cardiopatia congênita. Nas crianças com menos de 10 kg, puncionava-se um acesso venoso periférico utilizando-se jelco 24 ou 22 e injetava-se manualmente, ou seja, através de seringa de 10 ml, todo o volume de contraste seguido do volume de soro e iniciava-se a aquisição da primeira fase quando já tivesse injetado metade do volume de contraste, seguida da segunda fase, sem tempo de espera, sempre com apneia realizada pelo anestesista. Nos pacientes com mais de 10 kg, utilizou-se bomba injetora com injeção periférica a 2 ml/s em jelco 22, iniciando-se a primeira varredura quando já tivesse injetado metade do volume do contraste, também em apneia. Já nos pacientes adultos, que colaboravam com a apneia inspiratória, utilizou-se bomba injetora com injeção a 4 ml/s num total de 1,2 ml/kg de volume de contraste em acesso venoso periférico puncionado com jelco 20 ou 18, seguida da injeção de 40 ml de soro fisiológico na mesma velocidade de injeção, monitorando a chegada do contraste no átrio esquerdo, quando se iniciavam as duas varreduras com intervalo de respiração de 6 segundos entre elas. Assim, avaliaram-se todos os laudos de ACMDs de cardiopatias congênitas, contabilizando-se todos os casos de DVPA. Os relatórios foram confeccionados por profissionais com quatro, dois e um anos de experiência em ACMD cardíaca, e todos os diagnósticos foram confirmados cirurgicamente e acompanhados clinicamente, observando-se a sobrevida dos pacientes. RESULTADOS De todas as ACMDs cardíacas para análise de cardiopatias congênitas (393), encontraram-se 21 casos de DVPA, sendo 7 (33,3%) do tipo total e 14 (66,7%) do tipo parcial. Não foram encontrados casos de DVPA nos exames cardíacos para avaliação das artérias coronárias. Quinze pacientes eram do sexo masculino (71%) e os seis pacientes restantes eram do sexo feminino (29%). A idade dos pacientes variou de 7 dias a 35 anos, com uma média de 3,3 anos (desvio-padrão de 8,9 meses), sendo que a DVPA foi encontrada somente em dois pacientes adultos (24 e 35 anos). Das DVPAs totais, três foram do tipo supracardíaco, três do tipo infracardíaco e uma do tipo cardíaco, todas mostradas na Tabela 1, junto com as DVPAs parciais. 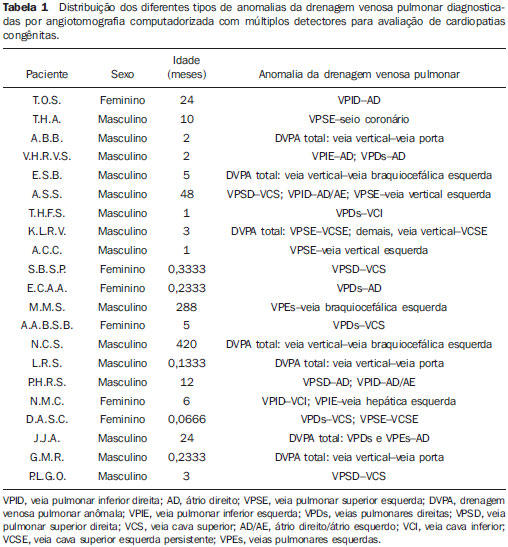 As DVPAs totais do tipo supracardíaco foram representadas por dois casos em que quatro veias pulmonares drenavam em uma veia vertical, a qual drenava na veia braquiocefálica esquerda, e outro caso em que a veia pulmonar superior esquerda drenava diretamente na veia cava superior esquerda persistente e as demais veias pulmonares drenando em uma veia vertical, a qual também drenava para a veia cava superior esquerda persistente. As DVPAs totais do tipo infracardíaco foram encontradas em pacientes em que as quatro veias pulmonares drenavam para uma veia vertical que drenava na veia porta. A DVPA total do tipo cardíaco foi caracterizada pelas quatro veias pulmonares drenando diretamente no átrio direito. Das DVPAs parciais, sete envolviam somente o lado direito (50%), três envolviam somente o lado esquerdo (21,4%) e quatro apresentavam anomalia de ambos os lados (28,6%). As DVPAs parciais apresentaram uma grande variedade do tipo de drenagem e estão sumarizadas na Tabela 1. Foram observados nove óbitos (42,8%), sendo que oito ocorreram nos primeiros seis meses de vida (88,9%) e somente um ocorreu em um paciente com dois anos. Dos pacientes que evoluíram a óbito, três apresentavam DVPA total (33,3%) e o restante apresentava DVPA parcial. Os principais tipos de DVPA encontrados no nosso serviço estão exemplificados nas Figuras 1 a 5. 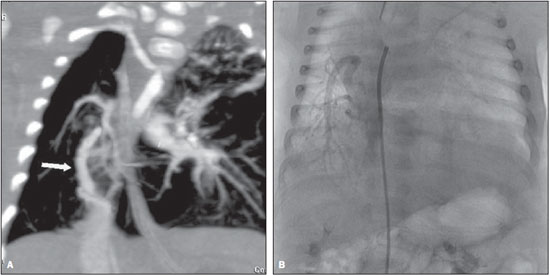 Figura 1. Reconstrução multiplanar da ACMD (A) de um paciente com um mês de vida demonstrando a drenagem venosa pulmonar anômala do tipo parcial, em que as veias pulmonares direitas drenam na veia cava inferior, formando o aspecto da espada turca (cimitarra), confirmada pela angiografia convencional (B). 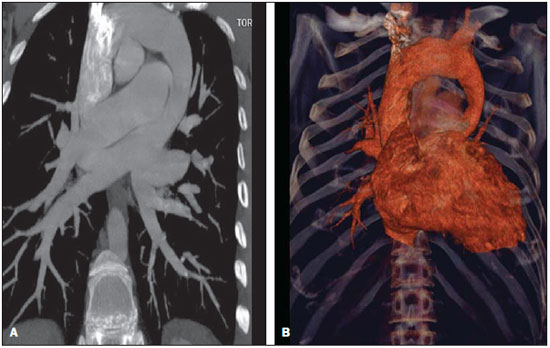 Figura 2. Reconstruções multiplanar (A) e tridimensional (B) da ACMD de um paciente de 35 anos que realizou o exame por suspeita de tumor mediastinal demonstrando anomalia da conexão venosa pulmonar total, representada por todas as quatro veias drenando na veia vertical, a qual drena na veia braquiocefálica esquerda, dirigindose para a veia cava superior. 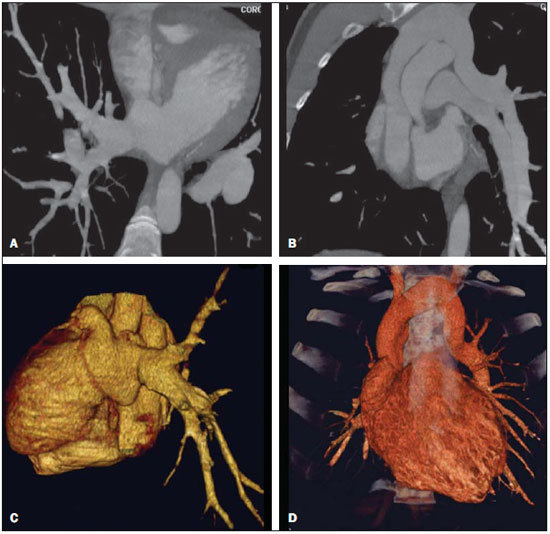 Figura 3. Reformatações multiplanares (A,B) e tridimensionais (C,D) da ACMD de um paciente de 24 anos com anomalia parcial da drenagem venosa pulmonar, em que as veias pulmonares direitas drenam habitualmente no átrio esquerdo e as veias pulmonares esquerdas drenam na veia vertical que se dirige para a veia braquiocefálica esquerda. 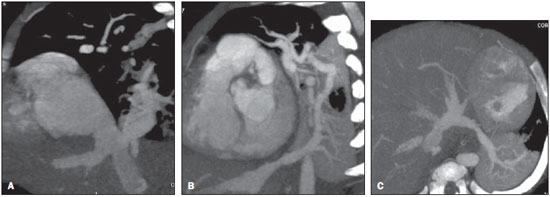 Figura 4. Reconstruções multiplanares da ACMD de uma paciente de 6 meses de idade com drenagem venosa pulmonar anômala do tipo parcial, notando-se que a veia pulmonar inferior direita drena na veia cava inferior (A) e a veia pulmonar inferior esquerda drena na veia hepática esquerda (B,C). 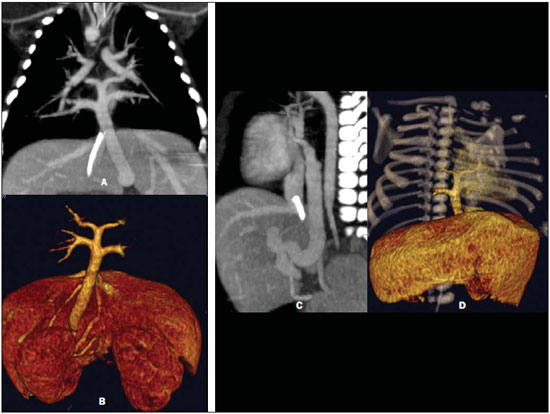 Figura 5. Reformatações multiplanares (A,C) e tridimensionais (B,D) da ACMD de um paciente com sete dias de vida demonstrando drenagem venosa pulmonar anômala total, onde todas as veias pulmonares drenam em uma veia vertical, a qual drena na veia porta. DISCUSSÃO Apesar de ser uma anomalia cardíaca congênita rara, com prevalência menor que 1% na literatura, em nosso estudo sua prevalência foi de 5,34%, provavelmente por ser um centro de referência em cardiopatias congênitas, e conforme demonstrado em outros estudos, sua prevalência é maior em hospitais especializados(1–6). A grande maioria dos pacientes com DVPA parcial é assintomática, sendo que o diagnóstico geralmente é feito pela radiografia ou pela tomografia de tórax por outro motivo(5,7–10). O diagnóstico tem sido realizado principalmente por ecocardiograma transtorácico ou pela angiografia convencional, a qual é considerada método de escolha, porém com algumas desvantagens: o primeiro por ser operador dependente, ser prejudicado pela janela acústica do paciente e pela dificuldade de avaliar as estruturas extracardíacas, principalmente a drenagem das veias pulmonares, devido à sua posição posterior; e o segundo, principalmente por tratar-se de um método invasivo, com risco de morte, principalmente nos pacientes com DVPA obstrutiva(10–12). A ressonância magnética também tem sido aplicada para este diagnóstico(10,13–15), porém este método não vem sido utilizado em nosso serviço pela dificuldade de monitoração dentro da sala de exame e pela sua menor resolução espacial nos pacientes com menos de 10 kg. A ACMD tem demonstrado o seu valor na avaliação de várias alterações vasculares em adultos, particularmente em afecções aórticas, como aneurismas e dissecções(16–18). Suas principais desvantagens são a necessidade de apneia, ou seja, anestesia geral nos pacientes pediátricos, o uso de meio de contraste iodado e da radiação ionizante, também necessários na angiografia convencional. Em 2000, Kim et al. estudaram a aplicação da angiotomografia helicoidal em neonatos e crianças com DVPA total, antes não estudada por este método, porém sem o uso de apneia(12). Não encontramos nenhum estudo que utilizou a ACMD no diagnóstico de DVPA, somente um estudo em que se utilizou a ressonância, e outros nos quais se utilizou a ressonância para avaliar anomalias congênitas em geral(10,13–15). A maioria dos casos observados em nosso estudo foi do tipo parcial, o mesmo encontrado na literatura, já que a maioria dos pacientes com DVPA total falece nos primeiros anos de vida. Os nossos pacientes não eram assintomáticos, e o exame de ACMD foi solicitada com indicação precisa para avaliação pré-operatória, pois a maioria apresentava cardiopatia congênita grave associada(5,7–9,10). Raramente os pacientes portadores de DVPA total sobrevivem até a vida adulta, pois quase sempre essa anomalia requer tratamento cirúrgico no período neonatal, tão logo se estabeleça o diagnóstico, muitas vezes, em caráter de urgência, evitando alterações patológicas irreversíveis no leito vascular pulmonar. Na vida adulta, os pacientes podem apresentar fadiga ou dispneia aos esforços devido à sobrecarga de volume sanguíneo produzida pelo shunt esquerda-direita(5,7–10,19–23). Os dois pacientes adultos encontrados em nosso trabalho eram assintomáticos, sendo um com DVPA total e outro com DVPA parcial, sendo que este último realizou a tomografia por suspeita de tumor mediastinal devido a um alargamento do mediastino observado na radiografia de tórax. Na DVPA parcial o lado direito é muito mais envolvido que o esquerdo, numa razão de 2:1 a 10:1. Quando esta se faz do lado esquerdo, geralmente as veias pulmonares demonstram um retorno para uma veia vertical, a qual drena na veia braquiocefálica esquerda, dando um aspecto típico à radiografia e/ou tomografia, chamado de “boneco de neve”(8–10). Estes achados corroboram os encontrados em nosso estudo, sendo que sete (50%) dos pacientes com DVPA parcial envolviam somente o lado direito e quatro pacientes demonstravam DVPA parcial em ambos os lados (28,6%). Somente três (21,4%) pacientes apresentavam DVPA parcial envolvendo o lado esquerdo isoladamente. Esta anomalia pode levar a algumas alterações hemodinâmicas, como sobrecarga de volume no ventrículo direito e na circulação pulmonar, resultando em insuficiência cardíaca congestiva. Há também mistura de sangue venoso sistêmico e pulmonar no átrio direito, levando à dessaturação arterial(5,7,8,19–23). A DVPA total é incompatível com a vida se não houver coexistência com comunicação interatrial que permita a passagem de sangue oxigenado para as câmaras cardíacas esquerdas. Mais de 75% das crianças com DVPA total morrem no primeiro ano de vida, em geral subitamente, sendo que a maioria falece nos primeiros seis meses de vida(7,8,19–23). Em nosso estudo, foram observados nove óbitos, sendo oito nos primeiros seis meses de vida (88,89%), confirmando os achados da literatura. Destes óbitos, três apresentavam DVPA total (33,33%). A primeira cirurgia de correção de DVPA total realizada com êxito foi em 1951. Desde então, a mortalidade cirúrgica destes pacientes vem diminuindo, permanecendo alta principalmente em pacientes menores de três anos com hipertensão pulmonar severa ou obstrução venosa pulmonar, que determinam instabilidade hemodinâmica no pré-operatório(5,7). Em nosso estudo não foram analisadas as complicações pós-cirúrgicas, nem as causas de óbito dos pacientes, sendo importante analisá-las em trabalhos futuros. O diagnóstico precoce da DVPA e seu reparo imediato são de fundamental importância para o prognóstico destas crianças, por causa da possibilidade de deterioração clínica e hemodinâmica, o que piora os resultados cirúrgicos destes pacientes(5). Das DVPAs totais encontradas em nossa estatística, quatro foram diagnosticadas em pacientes com menos de 5 meses de idade, uma com 24 meses e outra com 35 anos de idade, este sendo caso raro na literatura. O tratamento cirúrgico consiste na reinserção das quatro veias pulmonares no átrio esquerdo, sendo indicado tão logo se faça o diagnóstico, impedindo alterações hemodinâmicas e lesões no leito vascular pulmonar, que ocorre geralmente nos primeiros anos de vida(1–7,9,11,12,19–23). A oclusão de uma veia cateterizada ou de uma veia central é uma complicação frequente, ocorrendo em aproximadamente 23% dos pacientes submetidos a procedimentos de acesso venoso central. A oclusão sintomática ocorre em 1% a 4% dos casos, apresentando-se com sudorese, dor e síndrome da veia cava superior, que pode ser tratada com uma combinação de trombólise, angioplastia e implante de stents(8–10). Apesar da necessidade de anestesia, do uso de contraste iodado e da radiação ionizante, a ACMD tem mostrado sua aplicabilidade no diagnóstico de DVPA, por ser um exame não invasivo, por analisar estruturas intra e extracardíacas e por permitir um estudo completo da anatomia torácica, contribuindo sobremaneira na conduta cirúrgica e, consequentemente, no prognóstico destes pacientes, especialmente por diagnosticar malformações não suspeitadas clinicamente. As principais limitações do presente estudo foram não existir comparação com outros métodos diagnósticos, como o ecocardiograma e a angiografia convencional, não observar as complicações pós-cirúrgicas e as causas dos óbitos dos pacientes com DVPA, nem ter um seguimento dos pacientes, servindo de investigações futuras. CONCLUSÃO A ACMD é um método diagnóstico de alta acurácia e não invasivo na DVPA, que apesar de rara, pode ser letal se não diagnosticada precocemente, sendo uma alternativa aos outros exames mais invasivos, reduzindo os custos e a morbimortalidade destes pacientes. Agradecimento A Valdomiro Ferreira França, pelo auxílio na edição e no acabamento das imagens deste artigo. REFERÊNCIAS 1. Geva T, Van Praagh S. Anomalies of the pulmonary veins. In: Allen H, Gutgesell Clark E, Driscoll D, editors. Moss and Adams’ heart disease in infants, children, and adolescent. Philadelphia, PA: Lippincott Williams & Wilkins; 2001. p. 736–72. 2. Lupinetti FM, Kulik TJ, Beekman RH 3rd, et al. Correction of total anomalous pulmonary venous connection in infancy. J Thorac Cardiovasc Surg. 1993;106:880–5. 3. Reitz BA, Yuh DD. Cyanotic defects. In: Reitz BA, Yuh DD, editors. Congenital cardiac surgery. New York, NY: McGraw-Hill; 2002. p. 148–52. 4. Miller SW. Congenital heart disease. In: Miller SW, editor. Cardiac imaging: the requisites. Philadelphia, PA: Elsevier Mosby; 2005. p. 316–23. 5. Albert D, Girona J, Bonjoch C, et al. Retorno venoso pulmonar total anómalo en pediatría: importancia del diagnóstico ecocardiográfico y de la cirugía precoz. Rev Esp Cardiol. 2000;53:810–4. 6. Raisher BD, Grant JW, Martin TC, et al. Complete repair of total anomalous pulmonary venous connection in infancy. J Thorac Cardiovasc Surg. 1992;104:443–8. 7. Behrendt DM, Aberdeen E, Waterson DJ, et al. Total anomalous pulmonary venous drainage in infants. I. Clinical and hemodynamic findings, methods, and results of operation in 37 cases. Circulation. 1972;46:347–56. 8. Levy JM, Smyth SH. Partial anomalous pulmonary venous return: iatrogenic occlusion of the innominate vein producing right-to-left shunt. J Vasc Interv Radiol. 2002;13:423–5. 9. Cooley DA, Collins HA. Anomalous drainage of entire pulmonary venous system into left innominate vein: clinical and surgical considerations. Circulation. 1959;19:486–95. 10. Masui T, Seelos KC, Kersting-Sommerhoff BA, et al. Abnormalities of the pulmonary veins: evaluation with MR imaging and comparison with cardiac angiography and echocardiography. Radiology. 1991;181:645–9. 11. Vicente WVA, Dias-da-Silva PS, Vicente LM, et al. Correção cirúrgica de drenagem venosa pulmonar anômala total em adulto. Arq Bras Cardiol. 2006;87:e172–5. 12. Kim TH, Kim YM, Suh CH, et al. Helical CT angiography and three-dimensional reconstruction of total anomalous pulmonary venous connections in neonates and infants. AJR Am J Roentgenol. 2000;175:1381–6. 13. Didier D, Higgins CB, Fisher MR, et al. Congenital heart disease: gated MR imaging in 72 patients. Radiology. 1986;158:227–35. 14. Choe YH, Lee HJ, Kim HS, et al. MRI of total anomalous pulmonary venous connections. J Comput Assist Tomogr. 1994;18:243–9. 15. White CS, Baffa JM, Haney PJ, et al. MR imaging of congenital anomalies of the thoracic veins. Radiographics. 1997;17:595–608. 16. Chung JW, Park JH, Im JG, et al. Spiral CT angiography of the thoracic aorta. Radiographics. 1996;16:811–24. 17. Murayama S, Hashiguchi N, Murakami J, et al. Helical CT imaging of bronchial arteries with curved reformation technique in comparison with selective bronchial arteriography: preliminary report. J Comput Assist Tomogr. 1996;20:749–55. 18. Kopecky KK, Gokhale HS, Hawes DR. Spiral CT angiography of the aorta. Semin Ultrasound CT MR. 1996;17:304–15. 19. Atik FA, Irun PE, Barbero-Marcial M, et al. [Total anomalous drainage of the pulmonary veins – surgical therapy for the infradiaphragmatic and mixed anatomical types]. Arq Bras Cardiol. 2004; 82:259–63. 20. Serraf A, Belli E, Roux D, et al. Modified superior approach for repair of supracardiac and mixed total anomalous pulmonary venous drainage. Ann Thorac Surg. 1998;65:1391–3. 21. Cope JT, Banks D, McDaniel NL, et al. Is vertical vein ligation necessary in repair of total anomalous pulmonary venous connection? Ann Thorac Surg. 1997;64:23–9. 22. Shah MJ, Shah S, Shankargowda S, et al. L–R shunt: a serious consequence of TAPVC repair without ligation of vertical vein. Ann Thorac Surg. 2000;70:971–3. 23. Girard C, Neidecker J, Laroux MC, et al. Inhaled nitric oxide in pulmonary hypertension after total repair of total anomalous pulmonary venous return. J Thorac Cardiovasc Surg. 1993;106:369. 1. Médicos do Setor de Cardio-Radiologia da Med Imagem da Real e Benemérita Associação Portuguesa de Beneficência de São Paulo, São Paulo, SP, Brasil. 2. Doutor, Médico do Setor de Cardio-Radiologia da Med Imagem da Real e Benemérita Associação Portuguesa de Beneficência de São Paulo, São Paulo, SP, Brasil. 3. Chefe de Equipe do Setor de Cirurgia Cardiovascular da Real e Benemérita Associação Portuguesa de Beneficência de São Paulo, São Paulo, SP, Brasil. 4. Médica Assistente do Setor de Cirurgia Cardiovascular da Real e Benemérita Associação Portuguesa de Beneficência de São Paulo, São Paulo, SP, Brasil. Endereço para correspondência: Dra. Letícia Yurie Kimura Rua Maestro Cardim, 476, ap. 83, Bela Vista São Paulo, SP, Brasil, 01323-000 E-mail: lyk78@terra.com.br Recebido para publicação em 10/2/2010. Aceito, após revisão, em 12/5/2010. * Trabalho realizado no Setor de Cardio-Radiologia da Med Imagem da Real e Benemérita Associação Portuguesa de Beneficência de São Paulo, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554