Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 43 nº 4 - Jul. / Ago. of 2010
Vol. 43 nº 4 - Jul. / Ago. of 2010
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Adelmo José Giordani1; Rodrigo Souza Dias2; Helena Regina Comodo Segreto3; Roberto Araujo Segreto4 |
|
|
Descritores: Reprodutibilidade de posicionamento; Câncer de próstata; Radioterapia conformada. |
|
|
Resumo: INTRODUÇÃO
Um dos maiores desafios da radioterapia é liberar o mais homogeneamente possível a dose de radiação prescrita em um volume alvo e minimizar a dose de radiação nos tecidos normais adjacentes(1-3). Para isto, técnicas de planejamento em três dimensões (3D) com radioterapia conformada com ou sem modulação da intensidade do feixe de radiação (IMRT) têm sido utilizadas(4). A radioterapia conformada pode ser considerada tratamento padrão para os tumores de próstata localizados, permite entrega de dose de radiação maior que a convencional e possibilita redução de 40% a 50% do volume de tecido normal irradiado(5). Porém, é necessária exatidão do posicionamento dos pacientes e sua reprodutibilidade é imprescindível, pois qualquer alteração geométrica poderá comprometer a eficácia do tratamento e aumentar a incidência de efeitos indesejáveis(6,7). Em relação à radioterapia para câncer de próstata, a definição do volume alvo é fundamental para o planejamento e execução do tratamento. Geralmente, uma margem é adicionada ao volume do tumor (gross tumour volume - GTV), para inclusão da doença subclínica no campo de radiação, o que constitui o clinical target volume (CTV). Além disso, uma margem das incertezas geométricas, incluindo erros de setup e movimentação de órgãos, é adicionada, criando-se o volume de tratamento (planning target volume - PTV)(8). O tamanho das margens depende da magnitude das incertezas, e no caso específico do tratamento de próstata, margens de 10 mm do CTV para o PTV são consideradas padrão. Pode haver redução para 6 a 8 mm na margem posterior em direção ao reto(8). Estes valores, no entanto, constituem apenas uma orientação, cabendo a cada instituição decidir pela margem mais adequada(9). É importante ressaltar que a radioterapia com intensidade modulada permite obtenção de curvas de isodose mais restritas ao PTV, o que gera preocupação ainda maior com o posicionamento dos pacientes(4). A capacidade de redução das margens do CTV para o PTV está relacionada à diminuição dos erros de setup, o que é feito pela correção do posicionamento baseando-se em referências ósseas das imagens radiológicas obtidas no decorrer do tratamento(10). Devido à importância de se reproduzir no acelerador linear o que foi executado na simulação e à necessidade de concentrar a dose em um volume alvo restrito, desenvolveram-se técnicas para a verificação do posicionamento do campo a ser tratado, antes e no decorrer do tratamento(11-13). Para verificação das incertezas geométricas são realizadas radiografias durante o tratamento, que são comparadas com as radiografias digitalmente reconstruídas (digitally reconstructed radiography - DRR) obtidas a partir da tomografia de planejamento. O portal de imagens eletrônicas (electronic portal images - EPI) também pode ser empregado com a mesma finalidade, além de permitir correções no momento do tratamento e reduzir os erros de 5 mm para 3 mm(8). Estudos sugerem a realização de uma a três tomografias computadorizadas (TC) durante o tratamento, para a identificação da movimentação de órgãos. A ressonância magnética (RM) também tem sido utilizada nos planos de tratamento através dos sistemas de planejamento computadorizados que efetuam a fusão de imagens, conseguindo-se assim melhor delimitação do volume alvo. A RM oferece maiores vantagens quando comparada à TC, pois possibilita melhor visualização da próstata, vesículas seminais, reto e músculos(14). O uso de marcador fiducial também tem sido cada vez mais indicado, especialmente para a radioterapia guiada por imagem (image guided radiation therapy - IGRT). Assim, na rotina, consegue-se reduzir as margens do PTV e, consequentemente, minimizar doses no reto e bexiga, e ainda, corrigir o posicionamento do paciente no momento do tratamento(15). Com o avanço da tecnologia e a utilização de técnicas cada vez mais complexas, uma maior precisão na determinação e obtenção do PTV é desejável. Movimento do paciente, erros de posicionamento, movimentação de órgãos, todos contribuem para as incertezas no tratamento(9). A literatura mostra que quando são usados protocolos para posicionamento dos pacientes e padronização do processo de verificação do mesmo, erros de 2 a 4 mm são observados em cerca de 80% dos portais(16). Em relação aos erros, os mais significativos são os sistemáticos, pois levam à entrega de doses inadequadas no volume alvo e nos órgãos normais. Os erros aleatórios ou randômicos apresentam menor impacto das doses nas estruturas mencionadas(4). Para a redução de tais erros, vários trabalhos têm sugerido a verificação diária da reprodutibilidade dos campos(2,6,11,12,17). Este processo combina duas etapas: a identificação do desvio de posicionamento e a decisão de intervenção caso esta seja significativa(2,12). A imobilização do paciente, associada a marcas na pele e ao alinhamento com o laser da sala, reduz em muito as incertezas de tratamento(6). Mesmo com todos os recursos e métodos descritos, ainda é extremamente difícil eliminar todas as incertezas, e para reduzi-las de modo significante são criados protocolos para a verificação de erros de posicionamento e correção dos mesmos. Desta forma, o presente trabalho tem por objetivo avaliar a reprodutibilidade do posicionamento de pacientes portadores de tumores de próstata submetidos a radioterapia conformada, utilizando-se o planejamento digital, a DRR e o filme radiológico, nos campos de localização ântero-posterior e látero-lateral. MATERIAIS E MÉTODOS Casuística Foram incluídos 120 pacientes portadores de tumor de próstata encaminhados para realização rotineira de radioterapia. Para o planejamento da próstata, os pacientes foram submetidos inicialmente a uma simulação em aparelho Acuity (Varian Medical Systems; Palo Alto, CA, EUA). Permaneceram em decúbito dorsal, com os tornozelos fixados e as mãos sobre o peito. Foi localizado o isocentro, definido por meio de radiografia anterior com campo 10 × 10 cm com centro na linha média do paciente e limite inferior na borda inferior do púbis, e radiografia lateral com limite anterior do campo de 1 a 1,5 cm posterior à borda do púbis. Tais pontos foram marcados externamente na pele dos pacientes. Estas mesmas condições de posicionamento foram aplicadas na tomografia e no acelerador linear 6 MV (Varian Medical Systems; Palo Alto, CA, EUA). As imagens da tomografia foram processadas no sistema de planejamento computadorizado Eclipse (Varian Medical Systems; Palo Alto, CA, EUA). Posteriormente, foram definidos o CTV e o PTV, que consistiu no CTV com adição de margem de 10 mm, exceto na porção posterior, que foi de 8 mm. Em relação ao tratamento, todos os pacientes receberam dose > 72 Gy em uma ou duas fases, dependendo do estádio. Em todos os pacientes foram utilizadas seis portas de entrada. Após definição do PTV, foi delimitado um novo isocentro e um plano de localização com campos de 10 × 10 cm a 0º, 90º e 270º foi construído (Figura 1). A seguir, foram obtidas as DRRs dos referidos campos. Estas imagens foram transferidas para o simulador e serviram como referência para a definição do novo isocentro no paciente e verificação deste durante o tratamento. 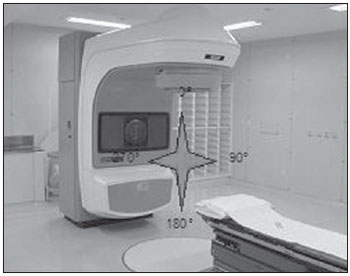 Figura 1. Definição dos ângulos. Realizaram-se, no primeiro dia de tratamento e após, semanalmente, radiografias anterior e lateral no campo 10 × 10 cm. Estas foram comparadas com as DRRs do sistema de planejamento computadorizado. Foram obtidos os valores dos deslocamentos nos sentidos látero-lateral, crânio-caudal e ântero-posterior. Foram avaliados, aleatoriamente, 480 pares de filmes (anterior e lateral, num total de 960 filmes). Para a avaliação dos filmes realizados nas posições anterior e lateral foram usadas referências ósseas. Na radiografia anterior foi medida a distância do isocentro à pequena pelve no sentido crânio-caudal e à linha pectínea no sentido látero-lateral (Figuras 2A e 2B). Para a incidência lateral foram usadas duas medidas: a distância do isocentro à sínfise púbica e ao sacro (Figuras 2C e 2D). 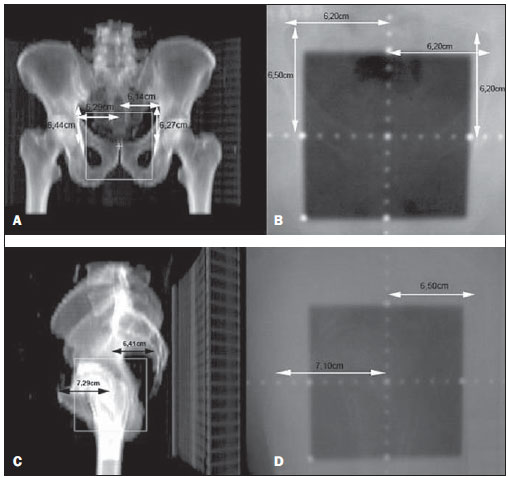 Figura 2. Observam-se, em A e B, imagens anteriores da DRR e da radiografia, e em C e D, as imagens laterais, respectivamente. O limite de aceite para o deslocamento do posicionamento foi de 2,5 mm, estabelecido como erro padrão (EP = 2,5 mm). Para variações entre 2,5 mm e 5 mm, estabeleceu-se a correção no acelerador linear e, acima de 5 mm, retorno do paciente ao simulador para correção. Análise estatística Foi realizada análise descritiva com cálculo das médias e desvios-padrão das variações dos erros de posicionamento utilizando-se o programa Excel for Windows, versão 2009. RESULTADOS Os resultados obtidos demonstram que, nas radiografias anteriores, 115 pacientes (95,8%) estavam dentro do erro padrão (2,5 mm) no sentido crânio-caudal e apenas 5 pacientes (4,2%) precisaram de correção. Quanto ao sentido látero-lateral, 98 pacientes (81,67%) estavam dentro do limite de aceitação, 21 (17,5%) necessitaram de correção, e apenas 1 (0,83%) retornou ao simulador para replanejamento. Em relação à incidência lateral, no sentido ântero-posterior, 102 pacientes (85,0%) apresentavam variação de posicionamento menor do que 2,5 mm, 17 (14,17%) realizaram correções, e apenas 1 (0,83%) retornou ao simulador para replanejamento (Figura 3). 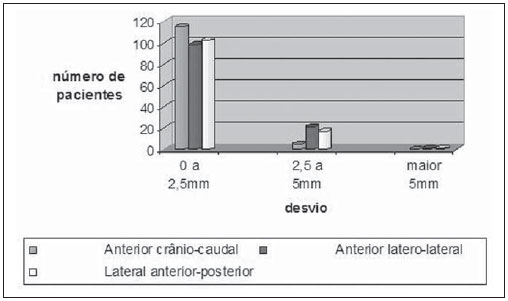 Figura 3. Relação desvio de posicionamento versus número de pacientes. Quando analisadas as incidências anterior e lateral de todos os pacientes, 87,5% encontravam-se dentro do erro padrão, 11,95% entre 2,5 e 5 mm e 0,55%, maior do que 5 mm. Quando analisadas as médias e desvios-padrão das variações de posicionamento, observaram-se, nos sentidos crânio-caudal, látero-lateral e ântero-posterior, os valores de 1,99 ± 1,25 mm, 1,37 ± 0,84 mm e 1,94 ± 1,10 mm, respectivamente. Aplicando o mesmo sistema de avaliação das distâncias utilizando referências ósseas, a Figura 4 mostra radiografias anteriores e laterais com erros de localização. 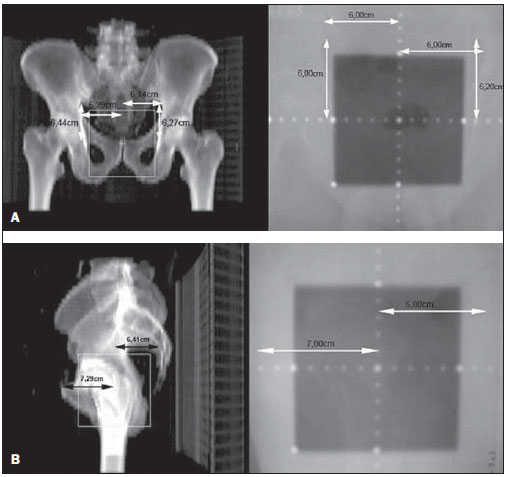 Figura 4. Observa-se radiografia considerada não adequada quanto ao setup (A) na radiografia anterior e (B) na radiografia lateral, quando comparadas às DRRs obtidas no sistema de planejamento. DISCUSSÃO No presente trabalho foram seguidos protocolos baseados na literatura e adequados às necessidades e condições do Setor de Radioterapia da Universidade Federal de São Paulo. A principal finalidade foi estabelecer disciplina e rotina de controle de qualidade do planejamento e do tratamento de pacientes portadores de câncer de próstata num hospital público. Foram realizadas verificações sucessivas da reprodutibilidade do posicionamento dos pacientes, utilizando planejamento digital, DRR e filme radiológico. Para o tratamento do câncer de próstata com feixe externo de radiação existem controvérsias quanto à necessidade de localização diária, ou periódica do alvo. O alinhamento diário por meio de imagem guiada (IGRT) é considerado padrão ouro, porém os custos e o tempo de sala são maiores quando comparadas a radioterapia conformada e a IMRT(18). Os deslocamentos do posicionamento observados foram de 1,99 ± 1,25 mm e 1,37 ± 0,84 mm nos sentidos crânio-caudal e látero-lateral, e 1,94 ± 1,10 mm no sentido ântero-posterior. No caso da próstata, variações de posicionamento de 1,0 a 3,8 mm no campo ântero-posterior e 1,2 a 3,5 mm no campo lateral são relatadas quando a imobilização para pernas é utilizada(19). Variações no posicionamento observadas com o uso de marcadores implantados diretamente na próstata possibilitam avaliação real do volume de tratamento, além da adequação do posicionamento(20). Redução no erro de posicionamento de 3,2 mm para 1,4 mm, com uma média de 2,2 mm, é obtida orientando-se os pacientes para manter a bexiga cheia no momento do tratamento, além do uso de marcadores retal e fiduciais na próstata padronizados para todos os pacientes(21). Considerando os valores encontrados no presente trabalho em relação aos erros de posicionamento e adicionando a movimentação interna da próstata, que, segundo a literatura, apresenta variações de 1,8 a 5,8 mm no sentido ântero-posterior e de 1,4 a 3,3 mm no sentido súpero-inferior, acreditamos que uma margem de 10 mm seria suficiente para conter o erro de posicionamento e movimentação interna(22). Conforme mostra a literatura, com a utilização de fixador do corpo e delimitação real do volume de tratamento podem ocorrer erros de posicionamento de 7,3 mm no campo ântero-posterior e de 3 mm no lateral(23). Em outro estudo foram observadas variações de posicionamento de 7 a 10 mm no campo ântero-posterior e de 4 a 6 mm lateralmente(24). Quando a dosimetria in vivo é realizada, variações de dose de 2,5% a 10% são observadas(25). A implementação de técnicas de planejamento, de simulação e de tratamento auxilia na verificação do deslocamento do posicionamento do paciente e estabelece um limite de erro de 3 mm. Tal limite deve ser usado para assegurar a dose adequada no volume alvo durante a radioterapia conformada(24,26,27). Grandes deslocamentos nos volumes irradiados da pelve devem ser corrigidos, a fim de se obter distribuição de dose adequada no volume alvo e, ao mesmo tempo, respeitar a tolerância do tecido normal adjacente(28). Diversos autores têm observado, no tratamento pélvico, erros de até 10 mm, e recomendam nova verificação do posicionamento no simulador, com base nos portal films(29,30). A eficácia do tratamento depende da minimização dos erros de posicionamento e da movimentação de órgãos. Erros de posicionamento de até 2 mm não promovem alteração significante na distribuição de dose no CTV e na parede retal(31). Recentemente, estudos em que a verificação frequente do posicionamento é realizada, com observação cuidadosa das margens do volume alvo, mostram melhor distribuição de dose neste volume, proporcionando melhor controle da doença e menor incidência de efeitos adversos(21,32). Os resultados satisfatórios obtidos com a radioterapia conformada para diversos sítios anatômicos têm aumentado o interesse nessa técnica e estimulado o desenvolvimento de protocolos para posicionamento e suas verificações. Os dados obtidos pela comparação dos filmes radiológicos com as imagens digitalmente reconstruídas evidenciam adequada reprodutibilidade de posicionamento dos pacientes portadores de câncer de próstata submetidos a radioterapia conformada e possibilitam estabelecer controle interno de qualidade do tratamento. REFERÊNCIAS 1. Stryker JA, Shafer J, Beatty RE. Assessment of accuracy of daily set-ups in prostate radiotherapy using electronic imaging. Br J Radiol. 1999;72: 579-83. 2. Gilhuijs KG, Herk M. Automatic on-line inspection of patient setup in radiation therapy using digital portal images. Med Phys. 1993;20:667-77. 3. Kijewski P. Three-dimensional treatment planning. In: Mauch PM, Loeffler JS, editors. Radiation oncology: biology and technology. Philadelphia, PA: WB Saunders; 1994. p. 10-33. 4. Zhu SY, Mizowaki T, Norihisa Y, et al. Comparisons of the impact of systematic uncertainties in patient setup an prostate motion on doses to the target among different plans for definitive external-beam radiotherapy for prostate cancer. Int J Clin Oncol. 2008;13:54-61. 5. Stanley S, Griffiths S, Sydes MR, et al. Accuracy and reproducibility of conformal radiotherapy using data from a randomised controlled trial of conformal radiotherapy in prostate cancer (MRC RT01, ISRCTN47772397). Clin Oncol (R Coll Radiol). 2008;20:582-90. 6. Alasti H, Petric MP, Catton CN, et al. Portal imaging for evaluation of daily on-line setup errors and off-line organ motion during conformal irradiation of carcinoma of the prostate. Int J Oncol Biol Phys. 2001;49:869-84. 7. Langmack KA. Portal imaging. Br J Radiol. 2001;74:789-804. 8. McGarry CK, Cosgrove VP, Fleming VAL, et al. An analysis of geometric uncertainty calculations for prostate radiotherapy in clinical practice. Br J Radiol. 2009;82:140-7. 9. Alonso-Arrizabalaga S, Brualla González L, Roselló Ferrando JV, et al. Prostate planning treatment volume margin calculation based on the ExacTrac X-Ray 6D image-guided system: margins for various clinical implementations. Int J Radiat Oncol Biol Phys. 2007;69:936-43. 10. Middleton M, See A, Rolfo A, et al. Intraprostatic fiducials for image guidance: workflow implications in a single linac department. Radiography. 2008;14:312-7. 11. Greer PB, Jose CC, Matthews JHL. Set-up variation of patients treated with radiotherapy to the prostate measured with an electronic portal imaging device. Australas Radiol. 1998;42:207-12. 12. Bollet MA, McNair HA, Hansen VN, et al. Can digitally reconstructed radiographs (DRRs) replace simulation films in prostate cancer conformal radiotherapy? Int J Radiat Oncol Biol Phys. 2003;57:1122-30. 13. Washington CM, Leaver TD, Myles J, et al. Simulator design and operation. In: Washington CM, Leaver DT, editors. Principles and practice of radiation therapy: practical applications. St. Louis, MO: Mosby; 1996. p. 81-105. 14. Nakamura K, Shioyama Y, Tokumaru S, et al. Variation of clinical target volume definition among Japanese radiation oncologists in external beam radiotherapy for prostate cancer. Jpn J Clin Oncol. 2008;38:275-80. 15. Lock M, Catton C. High-precision radiotherapy: where are we going and how do we get there? Can J Urol. 2006;13 Suppl 2:34-6. 16. de Boer HCJ, Heijmen BJM. A protocol for the reduction of systematic patient setup errors with minimal portal imaging workload. Int J Radiat Oncol Biol Phys. 2001;50:1350-65. 17. Varian Medical System. Varian Portal Vision Match Guide, Therapists manual 2000. [cited 2009 Jun 10]. Available from: www.varian.com 18. Kupelian PA, Lee C, Langen KM, et al. Evaluation of image-guidance strategies in the treatment of localized prostate cancer. Int J Radiat Oncol Biol Phys. 2008;70:1151-7. 19. Hurkmans CW, Remeijer P, Lebesque JV, et al. Set-up verification using portal imaging: review of current clinical practice. Radiother Oncol. 2001;58:105-20. 20. Halperin R, Roa W, Field M, et al. Setup reproducibility in radiation therapy for lung cancer: a comparison between T-bar and expanded foam immobilization devices. Int J Radiat Oncol Biol Phys. 1999;43:211-6. 21. Lattanzi J, McNeely S, Hanlon A, et al. Daily CT localization for correcting portal errors in the treatment of prostate cancer. Int J Radiat Oncol Biol Phys. 1998;41:1079-86. 22. Rabinowitz I, Broomberg J, Goitein M, et al. Accuracy of radiation field alignment in clinical practice. Int J Radiat Oncol Biol Phys. 1985;11: 1857-67. 23. Wu J, Haycocks T, Alasti H, et al. Positioning errors and prostate motion during conformal prostate radiotherapy using on-line isocentre set-up verification and implanted prostate markers. Radiother Oncol. 2001;61:127-33. 24. McGary JE, Grant W 3rd. A clinical evaluation of setup errors for a prostate immobilization system. J Appl Clin Med Phys. 2000;1:138-47. 25. Lanson JH, Essers M, Meijer GJ, et al. In vivo dosimetry during conformal radiotherapy requirements for and findings of a routine procedure. Radiother Oncol. 1999;52:51-9. 26. Mubata CD, Bidmead AM, Ellingham LM, et al. Portal imaging protocol for radical dose-escalated radiotherapy treatment of prostate cancer. Int J Radiat Oncol Biol Phys. 1998;40:221-31. 27. Wratten CR, Denham JW, Kron T, et al. 'When measurements mean action' decision models for portal image review to eliminate systematic setup errors. Australas Radiol. 2004;48:272-9. 28. Wyman DR, Ostapiak OZ, Gamble LM. Analysis of mechanical sources of patient alignment errors in radiation therapy. Med Phys. 2002;29: 2698-704. 29. Morgan TL, Banks DA, Kagan AR. Radiation therapy port films: a quality assurance study. Int J Radiat Oncol Biol Phys. 1998;42:223-7. 30. Creutzberg CL, Althof VGM, de Hoog M, et al. A quality control study of the accuracy of patient positioning in irradiation of pelvic fields. Int J Radiat Oncol Biol Phys. 1996;34:697-708. 31. Noel C, Parikh PJ, Roy M, et al. Prediction of intrafraction prostate motion: accuracy of pre- and post-treatment imaging and intermittent imaging. Int J Radiat Oncol Biol Phys. 2009;73:692-8. 32. Verhey LJ, Goitein M, McNulty P, et al. Precise positioning of patients for radiation therapy. Int J Radiat Oncol Biol Phys. 1982;8:289-94. 1. Professor Doutor, Físico Responsável pelo Setor de Radioterapia da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil 2. Mestre, Médico Assistente do Setor de Radioterapia da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil 3. Pós-Doutorado, Professora Associada do Departamento de Oncologia Clínica e Experimental da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil 4. Livre-Docente, Professor Associado e Chefe do Setor de Radioterapia da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil Trabalho realizado no Setor de Radioterapia da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil Endereço para correspondência: Dr. Adelmo José Giordani Rua do Estilo Barroco, 708, ap. 91, Alto da Boa Vista 04709-011. São Paulo, SP, Brasil E-mail: adelmogiordani@ig.com.br Recebido para publicação em 14/11/2009 Aceito, após revisão, em 7/5/2010 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554