Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 34 nº 1 - Jan. / Fev. of 2001
Vol. 34 nº 1 - Jan. / Fev. of 2001
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Alair Augusto S.M.D. dos Santos, Denise Madeira Moreira, Pedro Ângelo Andreiuolo, Cristina Asvolinsque P. Fontes, Fernando Barros de Oliveira, Lucia Furtado Stella, Ricardo Tostes D. Teixeira, Bruno Beber Machado |
|
|
Descritores: Microadenomas hipofisários. Tumores selares. Ressonância magnética. |
|
|
Resumo: INTRODUÇÃO Os tumores hipofisários são a principal causa de alterações clínico-laboratoriais que afetam o eixo hipotálamo-hipofisário. São classificados pelo tamanho: aqueles menores de 10 mm são microadenomas, e os maiores, macroadenomas. Sua apresentação clínica depende não só do tamanho da lesão, como da presença ou ausência de atividade hormonal, tipo de hormônio produzido e grau de extensão extra-selar, sendo raros nas crianças e em pacientes adultos com menos de 20 anos de idade(1-14). Os objetivos deste trabalho foram verificar o tipo principal de microadenomas, correlacionando com dados clínico-laboratoriais, rever a relação do microadenoma com as estruturas vizinhas, notadamente com a haste hipofisária, e comentar sobre a técnica do exame de ressonância magnética (RM) para este tipo de alteração hipofisária.
MATERIAL E MÉTODOS Fizemos uma revisão de 95 casos de pacientes que se submeteram a exame de RM com diagnóstico confirmado de microadenoma hipofisário, em clínicas privadas nas cidades de Niterói e do Rio de Janeiro, RJ. Procuramos definir o tipo de microadenoma, de acordo com a atividade hormonal detectada laboratorialmente, correlacionando com os dados clínicos. Verificamos, ainda, a topografia do nódulo e sua relação com a haste hipofisária. Os exames de RM foram realizados em equipamentos modelos Gyroscan T5 III da Philips e Vectra da GE, ambos de 0,5 Tesla, e em dois equipamentos de 1,0 Tesla, modelo Signa da GE. Foram realizadas seqüências rápidas ponderadas em T1 nos planos coronal e sagital, antes e após administração venosa de meio de contraste paramagnético (gadolínio), na dose de 0,01 ml/kg de peso. Todas as seqüências obtidas tiveram duração máxima de três minutos e campos de exame (FOV) variando de 170 a 190 mm. Foram classificados como microadenomas os nódulos hipofisários com menos de 10 mm de diâmetro, hipointensos nas seqüências ponderadas em T1 e que não se impregnaram após a administração de meio de contraste paramagnético.
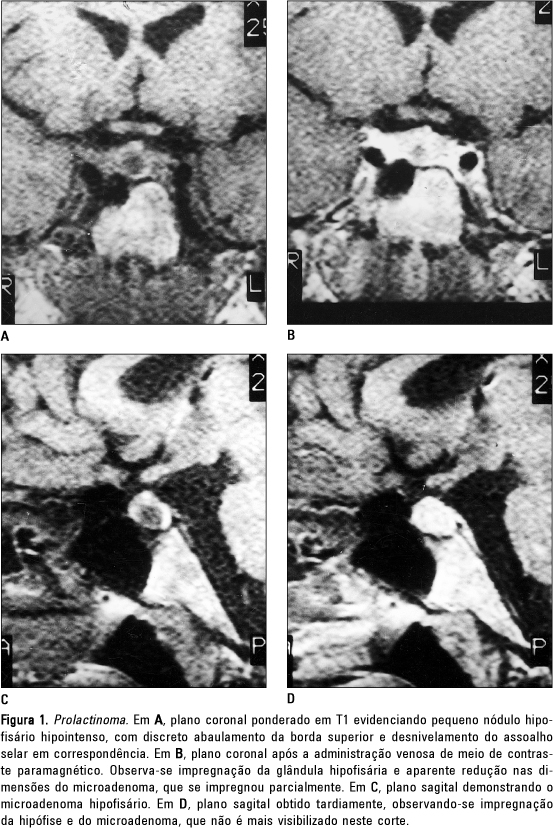
RESULTADOS Nos 95 pacientes estudados, houve nítido predomínio do sexo feminino, com 87 casos, e apenas oito pacientes do sexo masculino. Em relação ao quadro clínico, a principal indicação para RM foi a hiperprolactinemia, manifestada como galactorréia, amenorréia ou outras alterações menstruais no sexo feminino, e nos pacientes masculinos, como perda da libido, impotência sexual e galactorréia. Tivemos 90 pacientes com prolactinomas, três pacientes com doença de Cushing, e dois pacientes com microadenomas produtores de hormônio do crescimento (GH), apresentando clínica de acromegalia. Todos os oito pacientes do sexo masculino eram portadores de prolactinomas. Tivemos um caso em que constatamos dois microadenomas no mesmo paciente, o qual tinha clínica de prolactinoma. Para a correta interpretação do exame, é de fundamental importância a aquisição das imagens precocemente após a administração do meio de contraste paramagnético, pois seqüências mais demoradas ou tardias podem acarretar impregnação do microadenoma (Figura 1).
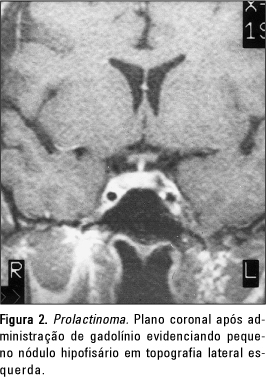
Verificamos que a maioria dos microadenomas estava em topografia lateral, à direita ou à esquerda, onde estão localizados preferencialmente os lactótrofos (Figura 2). Este é também o local preferencial dos microadenomas produtores de GH, enquanto os microadenomas medianos, em geral pequenos (2 a 3 mm), tendem a ser produtores de ACTH.
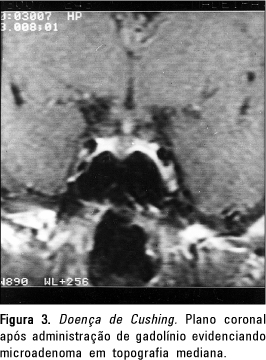
Em dois pacientes com doença de Cushing constatamos pequeno nódulo hipofisário em topografia mediana (Figura 3), e no terceiro o microadenoma estava localizado no lobo anterior da hipófise à direita, junto à porção cavernosa da artéria carótida.
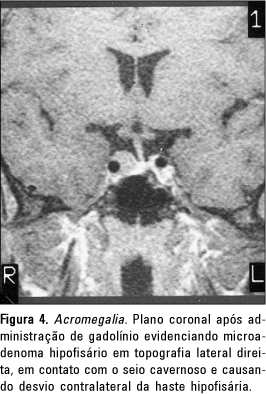
Avaliamos, ainda, a posição da haste hipofisária, que estava desviada em apenas 21 casos (Figura 4).
Conseguimos fazer o controle evolutivo de apenas dez desses casos, dos quais sete permaneceram inalterados, apesar do tratamento clínico instituído; em dois casos o exame de controle foi normal e em um caso houve acentuada redução das dimensões do microadenoma. Nenhum dos casos foi submetido a procedimento cirúrgico.
DISCUSSÃO O microadenoma manifesta-se na RM como hipointensidade focal, arredondada, podendo ter localização lateral ou mediana, em geral não se impregnando após a administração de gadolínio. Os critérios diagnósticos secundários são inconstantes e tendem a refletir um potencial efeito de massa do microadenoma. Esses critérios seriam: desvio da haste hipofisária em oposição à lesão; assimetria ou desvio do leito capilar, que seria detectado em tempo muito precoce; convexidade focal lateralizada ou assimetria da borda superior da hipófise; assimetria do assoalho selar, tipo desnivelamento(2,5,7,9,11,15-17). Em geral, considera-se o deslocamento lateral da haste hipofisária como um indicativo da presença de microadenoma fora da linha média da glândula. Ahmadi et al.(18), revendo 50 pacientes pela RM, encontraram 46% com desvio mais ou menos pronunciado da haste, sem estar relacionado com evidências clínicas ou radiológicas de doença hipofisária. Consideraram o posicionamento excêntrico da haste como uma variação anatômica, não sendo parâmetro fidedigno para inferir sobre a presença de microadenomas. Em nossa casuística, encontramos nítido predomínio de microadenomas em topografia lateral na glândula, porém um número pequeno de desvios da haste hipofisária em correspondência. Os microadenomas secretores de ACTH, além de muito pequenos, o que dificulta sua detecção, necessitam de documentação acurada da sua presença e posição, pois isto é essencial para facilitar a remoção cirúrgica, que constitui a única e efetiva modalidade terapêutica nesses casos(2,11,19,20). No que se refere à técnica do exame, os microadenomas são melhor visibilizados nas fases precoces da impregnação do gadolínio, quando apresentam intensidade de sinal menor do que a glândula normal. Isto ocorre porque há uma quebra da barreira hematoencefálica. Entretanto, estudos com emprego de altas doses de meio de contraste paramagnético ou seqüências tardias podem diminuir a eficácia da detecção dessas lesões. Assim sendo, foi proposta a utilização de metade da dose do gadolínio na detecção de microadenomas, o que é suficiente para o diagnóstico(5,21-23). Verificamos que, quando utilizamos a dose plena (0,2 ml/kg de peso), podemos impregnar completamente a hipófise e o microadenoma. Outro dado importante é que devemos considerar o tempo rápido de impregnação da hipófise, sendo fundamental utilizarmos seqüências com no máximo três minutos de duração. Técnicas dinâmicas têm particular valor em casos em que há suspeita de microadenomas secretores de corticotropina, permitindo ainda o estudo da microcirculação hipofisária(11,24-27). Kucharczyk et al., estudando 80 pacientes com evidência clínica e laboratorial de microadenomas hipofisários com técnica convencional sem e com utilização de meio de contraste paramagnético e técnica dinâmica (em "fast" spin-eco), concluíram que esta última é uma seqüência útil nesses pacientes, podendo demonstrar lesões que escaparam à detecção prévia.
CONCLUSÕES Após confronto entre os nossos achados e os dados da literatura consultada, concluímos que: 1. Entre os microadenomas hipofisários, o tipo mais freqüente é o prolactinoma, que acomete preferencialmente pacientes do sexo feminino com queixas de galactorréia, hiperprolactinemia e amenorréia. 2. Outros tipos de microadenomas são os produtores de GH, acarretando aparecimento de acromegalia em adultos, e os produtores de ACTH, que desenvolvem, nos pacientes, quadro clínico de doença de Cushing. 3. Os microadenomas produtores de prolactina e GH tendem a ter localização lateral na hipófise, e os produtores de ACTH, a ocupar posição mediana. Isto é explicado pela topografia das células produtoras destes hormônios. 4. Encontramos nítido predomínio de hastes centradas, o que contraria um conceito de que o microadenoma deve provocar desvios das hastes hipofisárias. 5. Na detecção dos microadenomas é fundamental a injeção venosa do meio de contraste paramagnético o mais próximo possível à aquisição das imagens, sendo recomendável a utilização de seqüências rápidas e metade da dose do gadolínio.
REFERÊNCIAS 1. Aron DC, Tyrrell JB, Wilson CB. Pituitary tumors. Current concepts in diagnosis and management. West J Med 1995;162:340-52. [ ] 2. Dupas B, Delacroix MG, Buthiau D, Charbonnel B, Derome PJ, Grob R. Pathologie sellaire et parasellaire. In: TDM et IRM cliniques. Paris: Frison-Roche, 1992:311-38. [ ] 3. Elster AD. Imaging of the sella: anatomy and pathology. Semin Ultrasound CT MR 1993;14: 182-94. [ ] 4. Hirsch WLJ, Roppolo HMN, Hayman LA, Hinck VC. Sellar and parasellar regions: normal anatomy and pathology. In: Latchaw RE, ed. MR and CT imaging of the head, neck and spine. 2nd ed. St. Louis: Mosby-Year Book, 1991:667-747. [ ] 5. Kucharczyk W, Montanera WJ, Becker LE. The sella turcica and parasellar region. In: Atlas SW, ed. Magnetic resonance imaging of the brain and spine. 2nd ed. Philadelphia: Lippincott-Raven, 1996:871-901. [ ] 6. Magalhães ACA. Estudo por RM das lesões tumorais e pseudotumorais da hipófise. Jornal da Imagem 1995;197, 198, 2o caderno. [ ] 7. Osborn AG. Diagnostic neuroradiology. 1st ed. St. Louis: Mosby, 1994:461-83, 649-57. [ ] 8. Rossitch E Jr, Carrazana EJ, Black PM. Isolated oculomotor nerve palsy following apoplexy of a pituitary adenoma. J Neurosurg Sci 1992;36: 103-5. [ ] 9. Taveras JM. Neuroradiology. 3rd ed. Baltimore: Williams & Wilkins, 1996:627-39. [ ] 10. Wynne AG, Scheithauer BW, Young WF Jr, Kovacs K, Ebersold MJ, Horvath E. Coexisting corticotroph and lactotroph adenomas: case report with reference to the relationship of corticotropin and prolactin excess. Neurosurgery 1992;30:919-23. [ ] 11. Elster AD. Modern imaging of the pituitary. Radiology 1993;187:1-14. [ ] 12. Felsberg GJ, Tien RD. Sellar and parasellar lesions involving the skull base. Neuroimaging Clin N Am 1994;4:543-60. [ ] 13. Fisher BJ, Gaspar LE, Stitt LW, Noone BE. Pituitary adenoma in adolescents: a biologically more aggressive disease? Radiology 1994;192:869-72. [ ] 14. Oliveira MC, Abech DD, Coutinho LMB, Ferreira NP. Macroprolactinoma aos seis anos de idade: dificuldades diagnósticas. Arq Neuropsiquiatr 1992;50:397-401. [ ] 15. Chong BW, Newton TH. Hypothalamic and pituitary pathology. Radiol Clin North Am 1993;31: 1147-83. [ ] 16. Simmons GE, Suchnicki JE, Rak KM, Damiano TR. MR imaging of the pituitary stalk: size, shape, and enhancement pattern. AJR 1992;159: 375-7. [ ] 17. Stadnik T, Stevenaert A, Beckers A, Luypaert R, Buisseret T, Osteaux M. Pituitary microadenomas: diagnosis with two- and three-dimensional MR imaging at 1.5 T before and after injection of gadolinium. Radiology 1990;176:419-28. [ ] 18. Ahmadi H, Larsson EM, Jinkins JR. Normal pituitary gland: coronal MR imaging of infundibular tilt. Radiology 1990;177:389-92. [ ] 19. Dwyer AJ, Frank JA, Doppman JL, et al. Pituitary adenomas in patients with Cushing disease: initial experience with Gd-DTPA-enhanced MR imaging. Radiology 1987;163:421-6. [ ] 20. Escourolle H, Abecassis JP, Bertagna X, et al. Comparison of computed tomography and magnetic resonance imaging for the examination of the pituitary gland in patients with Cushing's disease. Clin Endocrinol (Oxf) 1993;39:307-13. [ ] 21. Miki Y, Matsuo M, Nishizawa S, et al. Pituitary adenomas and normal pituitary tissue: enhancement patterns on gadopentetate-enhanced MR imaging. Radiology 1990;177:35-8. [ ] 22. Stadnik T, Spruyt D, van Binst A, Luypaert R, d'Haens J, Osteaux M. Pituitary microadenomas: diagnosis with dynamic serial CT, conventional CT and T1-weighted MR imaging before and after injection of gadolinium. Eur J Radiol 1994;18: 191-8. [ ] 23. Yuh WTC, Fisher DJ, Nguyen HD, et al. Sequential MR enhancement pattern in normal pituitary gland and in pituitary adenoma. AJNR 1994;15: 101-8. [ ] 24. Bishop J, Henkelman RM, Plewes DB. Dynamic spin-echo imaging: theoretical assessment and implementation. J Magn Reson Imaging 1994;4: 843-52. [ ] 25. Davis WL, Lee JN, King BD, Harnsberger HR. Dynamic contrast-enhanced MR imaging of the pituitary gland with fast spin-echo technique. J Magn Reson Imaging 1994;4:509-11. [ ] 26. Finelli DA, Kaufman B. Varied microcirculation of pituitary adenomas at rapid, dynamic, contrast-enhanced MR imaging. Radiology 1993;189:205-10. [ ] 27. Korogi Y, Takahashi M, Hirai T, Okuda T, Sakamoto Y, Yoshizumi K. Rectangular field of view for dynamic MR imaging of sellar and parasellar regions. Radiat Med 1994;12:193-5. [ ]
* Trabalho realizado no Hospital Santa Cruz/Beneficência Portuguesa de Niterói (Scan Diagnósticos por Imagem), Niterói, RJ, Clínica X-Labs/RJ e Instituto de Pós-Graduação Médica Carlos Chagas (IPGMCC), Rio de Janeiro, RJ. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554