Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 34 nº 3 - Maio / Jun. of 2001
Vol. 34 nº 3 - Maio / Jun. of 2001
|
RELATOS DE CASOS
|
|
|
|
|
Autho(rs): Claudia da Costa Leite, Maria Teresa Carvalho de Lacerda, Maria Olívia Rodrigues da Costa, Edson Amaro Júnior, Alessandra Sato, Vanessa Quintas Passos, Maria Adelaide Albergaria Pereira, Luciani Renata Silveira de Carvalho |
|
|
Descritores: Ressonância magnética. Hipófise. Duplicação. Malformação congênita. |
|
|
Resumo: INTRODUÇÃO A duplicação da hipófise é malformação bastante rara, descrita em 1880 por Ahlfeldt. A revisão da literatura evidenciou 18 publicações desta condição. Nos 19 casos anteriormente descritos havia duas pequenas adeno-hipófises e duas neuro-hipófises separadas entre si, apresentando, cada uma, a sua haste hipofisária em 18 casos(1-12), sendo descrita haste única em "Y" em um único relato(1). Essa alteração da hipófise pode estar associada a outras malformações faciais, encefálicas e espinhais. O objetivo deste trabalho é descrever um caso de duplicação da hipófise associada a fenda palatina e hamartoma hipotalâmico, cuja manifestação endocrinológica foi de puberdade precoce dependente de gonadotrofinas.
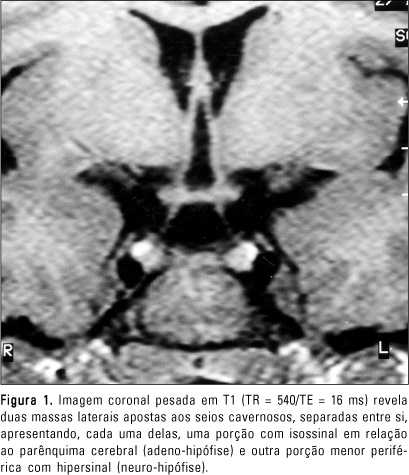
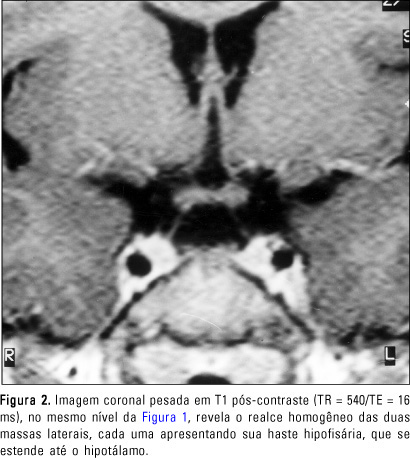
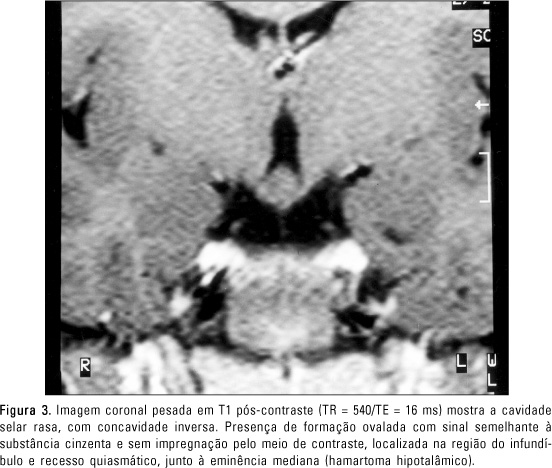
RELATO DO CASO Paciente do sexo feminino, de sete anos de idade, encaminhada ao setor de Endocrinologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo para investigação do quadro de aparecimento de mamas, bilateralmente. A história pregressa evidenciava ser primeira filha de uma prole de dois filhos de pais consanguíneos. Nascida a termo, de parto normal, sem intercorrências pré, peri e pós-natais. Desenvolvimento neuropsicomotor normal. Ao exame físico, apresentava: altura = 124,5 cm, desvio padrão = ± 1,52; mamas Tanner III, bilateralmente; pêlos pubianos Tanner II; palato ogival; fenda palatina corrigida; epicanto interno e externo; ptose palpebral à direita; pescoço curto (alado); hipertelorismo; cúbito valgo discreto; discreta dificuldade ao articular palavras. A investigação laboratorial evidenciou: E2 = 42,6 pg/ml (normal até 24 pg/ml na fase pré-púbere); 17-hidroxi-progesterona de 0,5 ng/ml (normal de 0,1 a 1,5 ng/ml) e testosterona < 14 ng/dl (pré-púbere < 14 ng/dl); GH = 2,3 ng/ml; IGF1 = 1.060 ng/ml; IGFBP3 = 5,7 mg/l; T4 livre = 0,9 ng/dl; TSH = 1,51 mU/ml. O teste de estímulo de GnRH demonstrou LH basal = 4,5 UI/l, com pico = 18 UI/l, FSH basal = 10 UI/l, e pico = 14 UI/l, compatível com padrão puberal. Foram realizadas dosagens basais de gonadotrofinas (LH/FSH), estradiol (E2) e 17-hidroxi-progesterona pelo método imunofluorométrico (AutoDelfia - Wallac, Turku, Finland) e no teste de estímulo após a administração de GnRH (Relisorm®), 100 mg endovenosos, com coletas de LH e FSH nos tempos -15, 0, 15, 30, 45, 60, 90 minutos. Foram considerados valores pré-púberes os basais de LH < 0,6 UI/l e pico de LH após estímulo com GnRH < 6,9 UI/l em meninas(13). A dosagem do sulfato de de-hidroepiandrosterona (DHEAS) foi feita pelo método de radioimunoensaio. As dosagens de T3, T4 total, T4 livre, TSH e testosterona foram feitas por ensaios fluorométricos com "kits" AutoDelfia. As dosagens de IGF-I (após extração com etanol) e IGFBP-3 foram realizadas pelo método de radioimunoensaio (DSL - Webster, TX, USA). Os valores de IGF-I e IGFBP-3 foram expressos em escores de desvio padrão para uma população normal de mesmo sexo e idade (gráfico produzido pelo DSL a partir de valores normais). A idade óssea da paciente era de 11 anos, avaliada por radiografia de mão e punho, de acordo com os critérios de Greulich-Pyle, com a idade cronológica de sete anos. Foi realizado ultra-som pélvico, que revelou útero de dimensões aumentadas para a idade, com 9 cc, ovário direito de 0,8 cc e ovário esquerdo de 0,7 cc, com morfologia compatível com fase pós-puberal e relação corpo/colo maior que 1. O bandeamento cromossômico revelou cariótipo 46,XX. A ressonância magnética foi realizada em aparelho de 0,5 Tesla (T5-Philips) na região da hipófise. Foram feitos cortes coronais em seqüências pesadas em T1 e T2, e cortes sagitais pesados em T1. As seqüências pesadas em T1 foram realizadas com TR = 436-540 ms, TE = 16 ms, campo de visão de 18 cm, espessura de 3 mm, interespaço de 0,3 mm, número de excitações de 4 e matriz de 154 × 256, antes e após a administração de gadolínio, na dosagem habitual de 0,1 mmol/kg. A seqüência pesada em T2 foi realizada com TR = 2.618 ms, TE = 120 ms, campo de visão de 18 cm, espessura de 3 mm, interespaço de 0,3 mm, número de excitações de 6 e matriz de 168 × 256. A ressonância magnética evidenciou o parênquima hipofisário dividido em duas massas laterais apostas aos seios cavernosos, havendo entre as massas hipofisárias uma área onde a cavidade selar apresentava concavidade voltada para cima. Cada massa de tecido hipofisário continha, anteriormente, o parênquima da adeno-hipófise, com sinal semelhante ao do parênquima cerebral, e, posteriormente, identificava-se o parênquima da neuro-hipófise, que apresentava hipersinal nas seqüências pesadas em T1 (Figura 1). Em relação a cada uma das massas hipofisárias, foi observada uma haste hipofisária íntegra que se estendia do parênquima até o hipotálamo (Figura 2). O realce das massas e hastes hipofisárias foi homogêneo após a administração de gadolínio. Na região supra-selar, junto à eminência mediana, observou-se formação ovalada com sinal semelhante ao do parênquima cerebral, tanto nas seqüências pesadas em T1 como em T2, sem impregnação anômala pelo meio de contraste paramagnético, com aspecto sugestivo de hamartoma hipotalâmico (Figura 3).
O estudo das colunas cervical, torácica e lombar não evidenciou nenhuma anormalidade. Foi iniciado tratamento com acetato de leuprolida (agonista do GnRH), cuja ação é promover inibição dos receptores de GnRH, reduzindo a resposta da hipófise ao GnRH, causando diminuição na secreção de gonadotrofinas e hormônios esteróides sexuais, impedindo a progressão dos caracteres sexuais. Os níveis, após o início do acetato de leuprolida, foram de LH < 0,6 UI/l, FSH < 1,0 UI/l e E2 < 13 pg/ml, compatíveis com níveis pré-puberais, sendo notada a regressão das mamas, concomitantemente.
DISCUSSÃO Malformações do eixo hipotálamo-hipofisário são raras, incluindo ausência de hipófise em alguns casos de cíclopes, ausência de neuro-hipófise em anencefalia, hipoplasia da hipófise, ectopia da hipófise intra-esfenoidal, persistência do canal craniofaríngeo, cistos hipofisários congênitos e teratomas da região selar(1). A duplicação da hipófise é malformação rara, descrita em 1880 por Ahlfeldt(2). Embriologicamente, a hipófise é derivada de dois primórdios ectodérmicos que se unem para constituí-la. Por volta da quarta semana de gestação, observa-se uma evaginação posterior da orofaringe, chamada de bolsa de Rathke, que se dirige superiormente em direção ao encéfalo, unindo-se, na quinta semana, a um divertículo que se estende inferiormente a partir do tubo neural. A bolsa de Rathke dará origem à adeno-hipófise, enquanto o divertículo com origem no tubo neural dará origem à neuro-hipófise e à haste hipofisária. Por volta do segundo mês de gestação, a comunicação entre a bolsa de Rathke e a orofaringe oblitera-se(3). Morton et al. hipotetizaram que a duplicação da hipófise poderia ser resultado da duplicação da placa protocordal e da porção anterior rostral da notocorda, causando duplicação da região do estomódio, incluindo a hipófise(4). A massa hipotalâmica, comumente descrita nestes casos, está provavelmente relacionada à duplicação da porção final da notocorda(5). Nos 19 casos descritos anteriormente, na literatura, havia duas pequenas adeno-hipófises e duas neuro-hipófises separadas entre si, apresentando, cada uma, a sua haste hipofisária em 18 casos(1-12). Somente em um caso há descrição de haste única em "Y" para as duas hipófises(1). O achado mais comum associado à duplicação da hipófise foi o de massa hipotalâmica, que nos casos de autópsia revelou presença de neurônios com fibras nervosas mielinizadas ou não, porém sem identificação de formação definitiva de núcleos hipotalâmicos(4,6,8). Outros achados associados com a duplicação da hipófise incluem: malformações faciais (fenda palatina, hipertelorismo, micrognatia, malformações de língua e de mandíbula, massas nas cavidades nasal, bucal ou na faringe - incluindo teratomas -, implantação do cabelo em "V" e implantação baixa das orelhas) e alterações intracranianas e espinhais (lipoma inter-hemisférico, agenesia do corpo caloso, anomalias de migração, ausência dos bulbos olfatórios, ausência do septo pelúcido, hipoplasia do vermis ou de todo o cerebelo, hidrocefalia, tálamos fundidos, anomalias do polígono de Willis, espinhas bífidas, diplomielia, mielomeningocele e tumores congênitos, como lipomas, teratomas)(1-12). O espectro clínico desta malformação estende-se desde puberdade precoce a in- divíduos assintomáticos, sendo a duplicação da hipófise um achado de autópsia(1,2,4,8,13). Outras malformações associadas podem ocorrer, como cardíacas, ósseas, dos tratos gastrointestinal e genitourinário(7). Este é o primeiro relato da literatura em que se vêem as associações: duplicação da haste, adeno e neuro-hipófise, presença de hamartoma e puberdade dependente de gonadotrofinas.
REFERÊNCIAS 1. Bainborough AR. Double hypophysis. Can Med Assoc J 1958;79:912-3. [ ] 2. Bale PM, Reye RDK. Epignathus, double pituitary, and agenesis of the corpus callosum. J Pathol 1976;120:161-4. [ ] 3. Jinkins JR. Embryology. In: Jinkins JR, ed. Atlas of neuroradiologic embryology, anatomy and variants. Philadelphia: Lippincott Williams & Wilkins, 2000:39. [ ] 4. Morton WRM. Duplication of the pituitary and stomadaeal structures in a 38-week male infant. Arch Dis Child 1957;32:135-41. [ ] 5. Hamon-Kérautret M, Ares GS, Demondion X, Rouland V, Francke JP, Pruvo JP. Duplication of the pituitary gland in a newborn with median cleft face syndrome and nasal teratoma. Pediatr Radiol 1998;28:290-2. [ ] 6. Hori A. A brain with two hypophyses in median cleft face syndrome. Acta Neuropathol (Berl) 1983; 59:150-4. [ ] 7. Kollias SS, Ball WS, Prenger EC. Review of the embryologic development of the pituitary gland and report of a case of hypophyseal duplication detected by MRI. Neuroradiology 1995;37:3-12. [ ] 8. Roessmann U. Duplication of the pituitary gland and spinal cord. Arch Pathol Lab Med 1985;109: 518-20. [ ] 9. Ryals BD, Brown DC, Levin SW. Duplication of the pituitary gland as shown by MR. AJNR 1993; 14:137-9. [ ] 10. Shah S, Pereira JK, Becker CJ, Roubal SE. Duplication of pituitary gland. J Comput Assist Tomogr 1997;21:459-61. [ ] 11. Tagliavini F, Pilleri G. Mammillo-hypophyseal duplication (diplo-mammillo-hypophysis). Acta Neuropathol (Berl) 1986;69:38-44. [ ] 12. Vandenhaute B, Leteurtre E, Lecomte-Houcke M, et al. Epignathus teratoma: report of three cases with a review of the literature. Cleft Palate Craniofac J 2000;37:83-91. [ ] 13. Brito VN, Batista MC, Borges MF, et al. Diagnostic value of fluorometric assays in the evaluation of precocious puberty. J Clin Endocrinol Me tab 1999;84:3539-44. [ ]
* Trabalho realizado no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP), São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554