Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 34 nº 4 - Jul. / Ago. of 2001
Vol. 34 nº 4 - Jul. / Ago. of 2001
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Fabio Luiz Navarro Marques, Miriam Roseli Yoshie Okamoto, Carlos Alberto Buchpiguel |
|
|
Descritores: Radiofármacos. Geradores. Tecnécio-99m. Controles de qualidade. |
|
|
Resumo: INTRODUÇÃO Os radiofármacos de tecnécio-99m (99mTc) tornaram-se, nos últimos 30 anos, importantes ferramentas para o diagnóstico de várias doenças ou disfunções de órgãos e sistemas que compõem o corpo humano. Atualmente, existem aproximadamente 30 desses compostos sendo utilizados em medicina nuclear(1,2), gerando um volume de exames correspondente a 80% da rotina clínica de um serviço de medicina nuclear. O elevado índice de utilização desses compostos é resultado das propriedades físicas e químicas ideais do radioisótopo, tais como: meia-vida física de 6,01 horas; decaimento por emissão de radiação gama pura, com fótons de 140 keV; a praticidade da obtenção do radioisótopo a partir de um sistema gerador de molibdênio-99/tecnécio-99m (99Mo/99mTc); a possibilidade do metal atingir vários estados de oxidação e de coordenação, dando origem a diferentes radiofármacos, a partir da simples reconstituição de conjuntos de reativos liofilizados ("kits"), conforme apresentado na Figura 1. Também, o baixo índice de reações adversas desses agentes(3), quando comparado a outros agentes de contraste, favorecem sua ampla utilização.
No entanto, as reações de complexação do radioisótopo pelo fármaco podem não ser tão eficientes, em conseqüência da qualidade do eluato, dos componentes dos "kits" ou dos procedimentos utilizados para as marcações. Nesses casos, a ineficiência nos processos pode dar origem a impurezas radioquímicas, como o próprio pertecnetato (99mTcO-4), decorrente da sua não-redução; o óxido de tecnécio (TcO2), também denominado de tecnécio hidrolisado e reduzido (TcHR), decorrente da redução e não-complexação do metal; e outras espécies reduzidas e complexadas com arranjos diferentes do desejado. Devido aos possíveis problemas que podem ocorrer durante a preparação dos radiofármacos marcados com 99mTc, é importante que o próprio usuário seja capaz de certificar a qualidade do eluato do gerador e do produto marcado, ainda que caiba à indústria produtora a garantia da qualidade dos geradores de 99Mo/99mTc e dos "kits" para marcação.
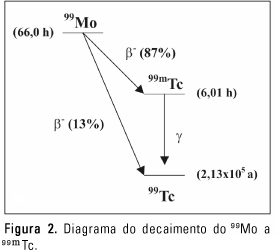
FATORES QUE AFETAM A MARCAÇÃO E A BIODISTRIBUIÇÃO DOS RADIOFÁRMACOS O gerador e o eluato de 99mTcO-4 O gerador 99Mo/99mTc é um sistema composto por uma coluna cromatográfica empacotada com óxido de alumínio (Al2O3), onde é depositado o molibdato (99MoO2-4 ), o qual decai a 99mTcO-4, conforme se vê na Figura 2.
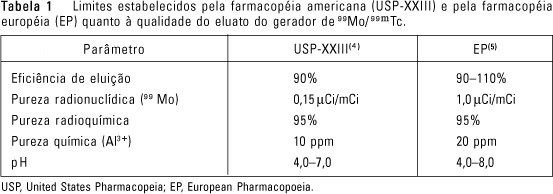
Estas duas espécies apresentam diferentes afinidades pelo Al2O3, possibilitando que o 99mTcO-4, juntamente com seu isômero "não-radioativo" ou carreador (99TcO-4), sejam extraídos do gerador. No entanto, algumas vezes também são extraídos excessos de íons Al3+, 99MoO2-4 e compostos de tecnécio com outros estados de oxidação, que são considerados impurezas presentes no eluato e devem ser quantificados antes da utilização, para que sejam respeitados os limites descritos nas farmacopéias, conforme apresentado na Tabela 1.
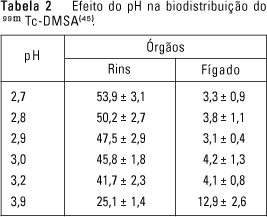
Embora a determinação da eficiência de eluição, ou seja, a razão entre a atividade eluída e a atividade teórica esperada para um determinado horário não caracterize nenhuma das impurezas citadas anteriormente, rendimentos inferiores a 90% para geradores de leito seco podem indicar problemas no empacotamento da coluna, com conseqüente aumento nos índices de contaminação. Também, a determinação deste parâmetro pode ser utilizada para indicar o regime de eluição a ser seguido, pois a máxima atividade no eluato é alcançada em diferentes tempos, em função do 99mTcO-4 remanescente na coluna(6,7). A determinação do 99Mo, considerado uma impureza radionuclídica, é importante para prevenir a exposição desnecessária do paciente à radiação beta, proveniente do seu decaimento, podendo também prejudicar a qualidade das imagens em função da emissão de radiação gama, com energia de aproximadamente 740 keV. Nos casos de contaminação com índices acima do permitido, existe a possibilidade, pouco usual, de regenerar o eluato passando-o pela coluna de um gerador recém-eluído e que tenha apresentado resultado negativo para 99Mo(8). Do mesmo modo, a determinação de formas de 99mTc com outros estados de oxidação(9), considerados impurezas radioquímicas, é importante, porque durante o processo de marcação dos radiofármacos podem dar origem a compostos com características biológicas diferentes daquelas desejadas. A determinação da concentração de íons Al3+, ou pureza química, serve para prevenir o grande número de problemas com a qualidade dos radiofármacos associados à presença deste íon. As principais alterações são: floculação do 99mTc-enxofre coloidal, levando à retenção do produto nos capilares pulmonares; aglutinação dos 99mTc-eritrócitos(10) ; formação de radiocolóide pela interação do íon Al3+ com os 99mTc-difosfonatos, permitindo a visibilização da atividade hepática e esplênica; aumento no tamanho das partículas do 99mTc-microagregado de albumina, com conseqüente aumento da concentração do produto nos pulmões(11); dissociação do complexo 99mTc-DTPA, aumentando a concentração de tecnécio livre e, portanto, subestimando a taxa da filtração glomerular; e, ainda, a alteração da captação do 99mTcO-4 pela tireóide em concentrações de Al3+ superiores a 4 mg/ml. Nesses casos, constatada a alta concentração do íon no eluato, o gerador deve ser eluído seguidamente até a obtenção de solução dentro dos limites aceitáveis(10). Também, a presença de altas concentrações do íon Al3+ no organismo, decorrentes de administrações de medicamentos, pode levar à mudança no comportamento dos radiofármacos, como já observado para o DTPA(12). Para o pH, embora as farmacopéias aceitem uma considerável faixa de valores, variando de 4,0 a 7,0, o que se observa, em geradores de diferentes procedências, é um valor médio de pH de 5,5. É provável que eluatos com valor de pH diferente deste possam alterar o pH de marcação dos "kits" e, por conseguinte, prejudicar a eficiência de marcação e a biodistribuição. Estudos rotineiros com geradores de diferentes procedências(13-17) têm demonstrado aumento na qualidade dos produtos, com aprovação de todas as unidades avaliadas recentemente. Contudo, o número de amostras é insignificante perto da demanda mundial de geradores, e os resultados não devem ser utilizados como parâmetro para a não-realização dos controles de qualidade. Além dos aspectos mencionados anteriormente, existe uma característica no eluato de 99mTcO-4 que não faz parte dos controles de qualidade, mas interfere na qualidade dos radiofármacos. Esta característica é a atividade específica, a qual é definida como a relação entre a atividade da espécie radioativa (99mTcO-4) e a massa total da espécie (99mTcO-4 + 99TcO-4). Para melhor entender a importância desta característica, deve-se pensar a atividade e a massa como número de átomos. Nessa circunstância, para geradores não eluídos há 24, 48 e 72 horas, a concentração total da espécie radioativa é de 28%, 14% e 7%, respectivamente. Assim, no uso de eluatos de geradores não eluídos há 72 horas existe grande possibilidade de ocorrerem marcações com baixa pureza radioquímica, por causa das reações concorrentes de oxi-redução e complexação com o isômero não-radioativo (99TcO-4), em detrimento da espécie radioativa (99mTcO-4), já que ambos possuem as mesmas propriedades químicas e este último está em uma concentração muito menor. A importância da atividade específica na qualidade dos radiofármacos foi enfatizada em estudo realizado na Universidade de Iowa(18), entre 1983 e 1985, onde foram realizados controles de qualidade em 3.775 marcações, das quais 20 (0,5%) foram rejeitadas, sendo que 18 referiam-se a agregados de albumina, os quais possuem baixa concentração de estanho e foram marcados com primeiro eluato dos geradores não eluídos a mais de 24 horas, ou então com eluatos que tinham decaído por mais de 12 horas. Em estudos recentes(19,20) utilizando muitos dos novos radiofármacos disponíveis, como o HMPAO, o MAG3®, anticorpos monoclonais, etc., todos com baixa concentração de estanho, a taxa de rejeição no controle de qualidade subiu para aproximadamente 7% das marcações. Assim, é recomendável a eluição rotineira de todos os geradores, mesmo que seus eluatos não sejam utilizados. Esta eluição pode se dar em períodos de 24 horas ou em intervalos inferiores a este, em função das necessidades da rotina de trabalho nas clínicas(21). Os componentes dos "kits" Com relação aos componentes dos "kits", a qualidade dos radiofármacos de 99mTc está intimamente relacionada ao agente redutor, em especial o íon estanoso (Sn2+), que tem a função de gerar os estados de oxidação reduzidos do 99mTc, com os quais vão ocorrer as ligações com os fármacos. Como a falta ou insuficiência do Sn2+ leva à obtenção de radiofármacos com baixa pureza radioquímica, durante a produção do "kit" é adicionado um excesso do íon, para compensar uma possível deterioração deste nesta etapa, ou durante o armazenamento dos "kits"(22,23), como observado nos "kits" de difosfonatos(24,25), DTPA(26) e ECD(27), e também para inibir a decomposição do produto marcado induzida pela radiação(28). Contudo, este excesso deve ser cuidadosamente adicionado, para permitir que a reação ocorra a bom termo, uma vez que um grande excesso pode levar à formação do TcHR(29) ou de compostos com estrutura química diferente da desejada, como observado nas marcações do DMSA(30), ou, ainda, acelerar a decomposição do complexo, como ocorre com o 99mTc-HMPAO(31). Para assegurar a integridade da marcação, algumas vezes são utilizados agentes estabilizantes, mais especificamente o ácido ascórbico ou o ácido gentísico, que funcionam como seqüestradores de ânions ou radicais livres, espécies que atuam na decomposição do agente redutor(32). Entretanto, sua utilização também pode alterar a biodistribuição do radiofármaco, conforme foi verificado quando da utilização de ácido ascórbico para estabilizar "kits" de pirofostafo e gluconato(33). Em outro estudo, comparando o uso de ácido ascórbico e ácido gentísico em "kit" de MDP(34), foi demonstrado que o ácido gentísico promove a formação de uma espécie com melhor relação tecido ósseo/partes moles, quando comparado ao uso do ácido ascórbico. Outros agentes estabilizantes além do ácido gentísico(35), tais como o etanol(36), o cloreto de cobalto(37) e o azul de metileno(38), têm sido utilizados para a estabilização do HMPAO por período de seis horas, sem alterar sua biodistribuição. Outro fator importante no processo de marcação é o pH. Funcionando como um "guia" ou uma "chave" para as reações, o pH interfere significativamente na eficiência de marcação(39-43), além de poder ocasionar a formação de complexo com estrutura química e comportamento biológico diferentes daqueles esperados, como o observado para o HMPAO(44) e para o "kit" de 99mTc-DMSA(45), conforme apresentado na Tabela 2.
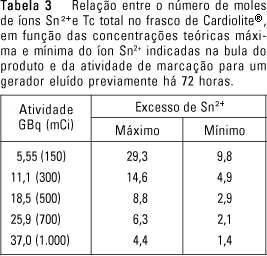
Outros fatores que podem alterar a qualidade dos radiofármacos são a pureza dos reagentes utilizados(46), a temperatura de armazenamento(47) e a qualidade do material de envase(48), como os tampões e frascos. Os procedimentos de marcação A terceira fonte de problemas na qualidade dos radiofármacos está relacionada aos procedimentos utilizados para o processo de sua marcação. Uma prática que ocorre com freqüência em vários serviços de medicina nuclear do Brasil e de outros países(49,50) é o fracionamento de "kits" liofilizados, ou seja, reconstituí-los em solução fisiológica sem a adição do radioisótopo, fracioná-los e guardá-los em "freezer" até o momento do uso. Esta é uma prática não recomendada, uma vez que altera as formulações originais dos "kits" e, após o fracionamento, dependendo das condições de estocagem, pode haver a degradação do agente redutor, diminuindo a eficiência de marcação(51-57). Contudo, existem algumas alternativas que podem ser aplicadas para minimizar os efeitos adversos. Para o fracionamento do Ceretec® em até cinco doses, por exemplo, é recomendado o uso de solução fisiológica purgada com nitrogênio e, antes da marcação, a adição extra de Sn2+ utilizando solução de um "kit" de pirofosfato reconstituído sem a adição do radioisótopo(58). Outra alternativa para este radiofármaco fracionado é a adição extra de Sn2+, mais uma mistura de ácido gentísico e etanol, o que permite utilizar o produto por até sete horas após a marcação(59). Para o "kit" de Neurolite®, cujo frasco contendo o produto liofilizado é reconstituído utilizando-se 3 ml de solução fisiológica, dos quais é utilizado apenas 1 ml para o processo de marcação, os 2 ml restantes podem ser fracionados em volumes de 0,5 ml e congelados por até quatro semanas(60). Novamente, embora esta seja uma prática não recomendada, as exigências para a sua realização são: que o procedimento seja executado por pessoal qualificado, em área com condições de manter a esterilidade do produto e, após cada preparação, sejam realizados os controles de qualidade dos produtos. Outra prática comum nas clínicas de medicina nuclear é a utilização de atividades superiores àquelas especificadas pelo fabricante. Isto também é um risco ao processo de marcação, uma vez que, aumentando a atividade, aumenta-se também a quantidade do carreador (99Tc) que irá participar no processo de quelação. Um caso bastante comum é a marcação do Cardiolite®, para o qual o fabricante recomenda a utilização de atividade máxima de 5,55 GBq (150 mCi), mas tem-se conhecimento do uso de atividades de até 16,65 GBq (450 mCi), a partir da qual começa a ocorrer diminuição na eficiência de marcação do produto(61). Isto é facilmente explicado considerando-se a estequiometria da reação de oxi-redução, que é de três íons de Sn2+ para cada íon de Tc7+. Nos casos de máxima e de mínima concentrações de íons Sn2+ especificadas pelo fabricante, e considerando a quantidade total de tecnécio em função da atividade, temos as relações que estão apresentadas na Tabela 3. Observe-se que para a marcação com 18,50 GBq (500 mCi), o excesso de íons Sn2+ na situação concentração máxima é menor que o seu excesso quando da concentração mínima para marcações a 5,55 GBq (150 mCi), ou seja, pode ocorrer a falta de íons Sn2+ para a redução.
Deve-se também ter cuidado na limpeza das rolhas dos frascos dos radiofármacos, não utilizando álcool iodado, já que o iodo pode ser introduzido no frasco e, por ser um agente oxidante, pode reagir com os íons Sn2+, diminuindo a eficiência de marcação do radiofármaco(62). Outros fatores Uma série de outros fatores, como efeitos de diluição(63), temperatura(43,64,65), origem da solução fisiológica(66), falha no processo de marcação devido a erro humano(67), interações com outros medicamentos(68), efeito de equipamentos na estabilidade da marcação(69), podem levar a marcações inadequadas ou alteração na biodistribuição do produto.
OS CONTROLES DE QUALIDADE Para garantir a qualidade do eluato de 99mTcO-4, dos radiofármacos e, por conseguinte, dos exames de medicina nuclear, deve-se elaborar um programa de controle rotineiro das espécies envolvidas(70,71). Para isso, existem vários procedimentos descritos em literaturas, como as farmacopéias(4,5), as bulas dos medicamentos, ou os livros e revistas especializadas, os quais apresentam técnicas alternativas às duas primeiras fontes, com maior possibilidade de serem utilizadas nas clínicas de medicina nuclear(72). O controle de qualidade do gerador de tecnécio Para garantir a adequada realização do controle de qualidade do eluato do gerador, deve-se ter certeza que o calibrador de dose utilizado na determinação da eficiência de eluição e da pureza radionuclídica (99Mo) esteja respondendo adequadamente à quantificação dos radioisótopos(73), uma vez que esta quantificação deve ser absoluta e não relativa, como ocorre na determinação da pureza radioquímica que é feita por medidas comparativas. A utilização de recursos da informática para processamento e registro dos dados dos controles realizados pode facilitar o trabalho diário(74). Com o calibrador ajustado, a eficiência da eluição pode ser facilmente determinada, bastando corrigir adequadamente a atividade esperada, em função da atividade do 99Mo, dos decaimentos do par 99Mo/99mTc e do intervalo entre as eluições(6). Esse valor é importante para permitir calcular o regime de eluição e a quantidade de carreador (99Tc) presente no eluato(75-77). Do mesmo modo, a pureza radionuclídica pode ser facilmente determinada, bastando inserir o frasco contendo o eluato em uma blindagem de chumbo de 6 mm(78) e determinar a atividade de 99Mo existente, lembrando que o valor obtido na leitura representa a metade do valor total. Para avaliar a pureza química existem vários métodos para a determinação quantitativa ou semiquantitativa do teor do íon Al3+, sendo que a maioria faz uso da reação de complexação do íon por agentes quelantes específicos, os quais, no final, levam à formação de um composto colorido. Os agentes complexantes mais utilizados são a Eriocromocianina, para a determinação espectrofotométrica(79), a Alizarina-S(78), para a determinação por análise de gota em placa, e o Aluminon(74), para a determinação por análise de gota em papel. A reação com o Aluminon é bastante simples, bastando aplicar uma gota do eluato no papel impregnado com o reativo; a reação com a Alizarina-S requer a adição de uma série de reagentes para que se observe a reação; e para a utilização da Eriocromocianina é necessário o uso de um espectrofotômetro, que é um aparelho caro e pouco comum nas clínicas de medicina nuclear, mas que fornece resultados mais precisos que os outros dois métodos. Os controles de qualidade dos radiofármacos Simultaneamente ao controle de qualidade dos geradores, deve-se garantir a qualidade final dos radiofármacos. A principal técnica utilizada para esse fim é a cromatografia ascendente, em que uma amostra do produto é aplicada sobre um suporte (fase estacionária) e arrastada por um solvente (fase móvel). Além dos sistemas apresentados nas farmacopéias e bulas dos produtos, vários estudos têm procurado apresentar alternativas quanto aos tipos de fases estacionária e móvel, de modo a permitir a realização dos testes de forma mais rápida, precisa e barata, como já publicado para os radiofármacos de primeira geração, dentre eles o 99mTc-MDP, o 99mTc-DTPA, o 99mTc-DMSA, etc.(80-84), assim como para vários derivados de 99mTc-IDA(85), para compostos baseados em fosfato(86) e para a determinação de colóide em radiofármacos que formam agregados, a exemplo do 99mTc-enxofre coloidal e dos 99mTc-agregados de albumina(87,88). Sistemas alternativos aos oficiais também foram apresentados para os novos radiofármacos, como o uso da ITLC-SG(89), papel Whatman 3MM(90) e Whatman 1MM(91) para o 99mTc-MIBI; ITLC-SG para o 99mTc-MAG3(92) ; papel Whatman 3MM para o 99mTc-ECD(93); ITLC-SG para o 99mTc-tetrofosmin(94). Contudo, alguns cuidados devem ser tomados, de modo a se evitar ocorrências de artefatos no desenvolvimento da cromatografia, como os observados quando amostras foram aplicadas nas fases estacionárias, deixadas secar e depois desenvolvidas com a fase móvel(95,96). Uma outra técnica que tem sido bastante utilizada é a extração por meio de solvente, em que os radiofármacos lipofílicos como o ECD(97), o HMPAO(98) e o MIBI(89) são extraídos da fase aquosa por solventes lipofílicos, como o acetato de etila ou o clorofórmio. Esta técnica, além da praticidade e rapidez, permite que a determinação da atividade nas fases líquidas seja realizada em um calibrador de dose. Outras técnicas de controle de qualidade utilizadas com menor freqüência são a cromatografia de permeação em gel e a eletroforese em papel(99). No caso da cromatografia de permeação em gel, a técnica é aplicada no controle de radiofármacos como os derivados de 99mTc-IDA, 99mTc-DTPA, 99mTc-MDP, entre outros, com a vantagem de a determinação da atividade na coluna poder ser realizada utilizando-se uma gama-câmara(100). Contudo, o tipo de solvente e os fatores de diluição exercem papel fundamental na apresentação dos resultados, podendo não permitir a separação(101) do 99mTcO-4, ou, ainda, aumentando a concentração da espécie TcHR(102). O uso da eletroforese é um recurso interessante, principalmente para separar diferentes tipos de complexos de um mesmo produto, como no caso do 99mTc-DMSA, em que foram determinados dois compostos, um neutro e outro aniônico(103), ou para o HMPAO, no qual, em função do pH, podem ser formados diferentes compostos(44).
CONCLUSÃO Apesar da aparente simplicidade com que os radiofármacos de tecnécio são obtidos, ou seja, mediante simples adição de solução de 99mTcO-4 ao "kit" liofilizado, reações químicas bastante complexas ocorrem entre as espécies reativas, existindo inúmeros fatores que podem interferir no desenvolvimento adequado dessas reações. Cabe aos profissionais envolvidos com a medicina nuclear conhecer os aspectos relacionados com a preparação e manipulação dos radiofármacos e implantar um programa de controle de qualidade, utilizando as várias técnicas apresentadas na literatura, para identificar e corrigir eventuais problemas, ou mesmo evitá-los. Também, esses profissionais devem ter em mente que o custo operacional da remarcação de um exame pode ser superior à realização de mais de uma centena de controles de qualidade(18).
REFERÊNCIAS 1. Dewanjee MK. The chemistry of 99mTc-labeled radiopharmaceuticals. Semin Nucl Med 1990;20: 5-27. [ ] 2. Jurrisson S, Berning D, Jia W, Ma D. Coordination compounds in nuclear medicine. Chem Rev 1993;93:1137-56. [ ] 3. Hesslewood SR, Keeling DH. Frequency of adverse reactions to radiopharmaceuticals in Europe. Eur J Nucl Med 1997;24:1179-82. [ ] 4. United States Pharmacopeia. The United States Pharmacopeia, 23rd rev., and The National Formulary, 18th ed. Rockville: The United States Pharmacopeial Convention, 1994. [ ] 5. European Pharmacopoeia. 3rd ed. Strasbourg: Council of Europe, 1997. (European Treaty Series n. 50). [ ] 6. Husák V, Vlcek J. Some remarks on 99Mo-99mTc generator kinetics. Eur J Nucl Med 1982;7:331-2. [ ] 7. Moore PW. Technetium-99 in generator systems. J Nucl Med 1984;25:499-502. [ ] 8. Lo HH, Berke RA, Potsaid MS. A simple method of correcting 99Mo breakthrough from a 99mTc-99Mo generator. Radiology 1969;93:1198-9. [ ] 9. Cífka J. Lower-oxidation-state 99mTc in the generator product - its determination and occurrence. Int J Appl Radiat Isot 1982;33:849-55. [ ] 10. Lin MS, MacGregor-Jr RD, Yano Y. Ionic aluminum (III) in generator eluate as an erythrocyte-agglutinating agent. J Nucl Med 1971;12:297-9. [ ] 11. Chia HL, De Schrijver M. Modified in vivo behaviour of 99mTc-labelled liver-spleen preparations due to 99Mo/99mTc-generator eluate impurities. Eur J Nucl Med 1983;8:450-3. [ ] 12. Specht HD, Belsey R, Hanada J. Aluminemic disturbance of technetium-99m DTPA renal function measurement. J Nucl Med 1987;28:383-6. [ ] 13. Webber MM, Cragin MD, Victery WK. Aluminum content in eluents from commercial technetium generators. J Nucl Med 1971;12:700. [ ] 14. Vinberg N, Kristensen K. Fission Mo-99/Tc-99m generators - a study of their performance and quality. Eur J Nucl Med 1980;5:435-8. [ ] 15. Holland ME, Deutsch E, Heineman WR. Studies on commercially available 99Mo/99mTc radionuclide generators-II. Operating characteristics and behavior of 99Mo/99mTc generators. Appl Radiat Isot 1986;37:173-80. [ ] 16. Hammermaier A, Reich E, Bögl W. Chemical, radiochemical, and radionuclide purity of eluates from different commercial fission 99Mo/99mTc generators. Eur J Nucl Med 1986;12:41-6. [ ] 17. Marengo M, Aprile C, Bagnara C, et al. Quality control of 99Mo/99Tcm generators: results of a survey of the Radiopharmacy Working Group of the Italian Association of Nuclear Medicine (AIMN). Nucl Med Commun 1999;20:1077-84. [ ] 18. Ponto JA, Ponto LL. Cost-effectiveness of routine radiochemical quality assurance testing of technetium Tc-99m radiopharmaceuticals. Am J Hosp Pharm 1986;43:1218-22. [ ] 19. Decristoforo C, Chen F, Riccabona G. [Quality control of radiopharmaceuticals from the clinical aspect - a necessity]? Nuklearmedizin 1993;32: 144-8. German. [ ] 20. Decristoforo C, Chen F, Stöger A, Riccabona G. Failure of labelling of anti-granulocyte antibody. Eur J Nucl Med 1993;20:565-6. [ ] 21. Murphy CA. Generator 99Mo- 99mTc. In: Murphy CA, ed. El tecnecio en la medicina nuclear. México: Sociedad Mexicana de Medicina Nuclear, 1989:277-90. [ ] 22. McBride MHD, Shaw SM, Kessler WV. Deterioration of stannous ion in radiopharmaceutical kits during storage. Am J Hosp Pharm 1979;36:1370-2. [ ] 23. Chervu LR, Vallabhajosyula B, Mani J, Chun SB, Blaufox MD. Stannous ion quantitation in 99mTc-radiopharmaceutical kits. Eur J Nucl Med 1982; 7:291-3. [ ] 24. Yano Y, McRae J, Van Dyke DC, Anger HO. Technetium-99m-labeled stannous ethane-1-hydroxy-1 1-diphosphonate: a new bone scanning agent. J Nucl Med 1973;14:73-8. [ ] 25. Kroesbergen J, Wortelboer MR, Rijnsent A, Gelsema WJ, de Ligny CL. 99mTc bone scanning agents-V. Influence of experimental conditions on the labeling efficiency and gel chromatography of 99mTc (Sn) HMDP. Int J Rad Appl Instrum B 1987;14:37-41. [ ] 26. Colombetti LG, Barnes WE. Effect of chemical and radiochemical impurities from eluants on 99mTc-labeling efficiency. Nuklearmedizin 1977; 16:271-4. [ ] 27. Afshan A, Jehangir M, Ashraf M, Waqar A, Chiotellis E. Formulation of a single-component kit for the preparation of technetium-99m labelled ethyl cysteinate dimer: biological and clinical evaluation. Eur J Nucl Med 1994;21:991-5. [ ] 28. Billinghurst MW, Rempel S, Westendorf BA. Radiation decomposition of technetium-99m radiopharmaceuticals. J Nucl Med 1979;20:138-43. [ ] 29. Zimmer AM, Pavel DG. Experimental investigations of the possible cause of liver appearance during bone scanning. Radiology 1978;126:813-6. [ ] 30. Ikeda I, Inoue O, Kurata K. Preparation of various Tc-99m dimercaptosuccinate complexes and their evaluation as radiotracers. J Nucl Med 1977;18: 1222-9. [ ] 31. Hung JC, Corlija M, Volkert WA, Holmes RA. Kinetic analysis of technetium-99m d,l-HM-PAO decomposition in aqueous media. J Nucl Med 1988;29:1568-76. [ ] 32. Berger R. Radical scavengers and the stability of 99mTc-radiopharmaceuticals. Int J Appl Radiat Isot 1982;33:1341-4. [ ] 33. Malja S. Characteristics and properties of some Albanian 99mTc-kits. J Radioanal Nucl Chem, Letters 1996;214:187-97. [ ] 34. Handeland A, Lindegaard MW, Heggli D-E. Biodistribution of anionic separated MDP complexes from different MDP preparations. Eur J Nucl Med 1989;15:609-11. [ ] 35. Hung JC, Volkert WA, Holmes RA. Stabilization of technetium-99m-D, L-hexamethylpropyleneamine oxime (99mTc-D, L-HMPAO) using gentisic acid. Nucl Med Biol 1989;16:675-80. [ ] 36. Billinghurst MW, Abrams DN, Lawson MS. Stabilization of [99mTc] HMPAO-1. Ethanolic preparation. Int J Rad Appl Instrum [A] 1991; 42:607-12. [ ] 37. Mang'era KO, Vanbilloen HP, Schiepers CW, Verbruggen AM. Stabilisation of high-activity 99mTc-d, l-HMPAO preparations with cobalt chloride and their biological behaviour. Eur J Nucl Med 1995;22:1163-72. [ ] 38. Barthel H, Kampfer I, Seese A, et al. Improvement of brain SPECT by stabilization of Tc-99m-HMPAO with methylene blue or cobalt chloride. Comparison with Tc-99m-ECD. Nuklearmedizin 1999;38:80-4. [ ] 39. Billinghurst MW, Abrams DN, Lawson MS. Chemical aspects of labeling sucralfate with 99mTcO4. J Nucl Med 1989;30:523-30. [ ] 40. Hirano T, Tomiyoshi K, Zhang YJ, Ishida T, Inoue T, Endo K. Preparation and clinical evaluation of technetium-99m dimercaptosuccinic acid for tumour scintigraphy. Eur J Nucl Med 1994;21: 82-5. [ ] 41. Bormans G, Cleynhens B, Adriaens P, Vanbilloen H, De Roo M, Verbruggen A. Investigation of the labelling characteristics of 99mTc-mercaptoacetyltriglycine. Nucl Med Biol 1995;22:339-49. [ ] 42. Reyes-Herrera L, Ferro-Flores G, Lezama-Carrasco J, Gonzales-Zavala MA, Ureña-Nuñez F, Avila-Ramirez E. An alkaline kit formulation to obtain [99mTc] MAG3 in high radiochemical yields. J Radioanal Nucl Chem, Letters 1995; 199:507-16. [ ] 43. Hnatowich DJ, Chang F, Lei K, Qu T, Rusckowski M. The influence of temperature and alkaline pH on the labeling of free and conjugated MAG3 with technetium-99m. Appl Radiat Isot 1997;48:587-94. [ ] 44. Lo J-M, Lin K-S. Chemical characteristics of 99mTc-labeled amine oximes. Appl Radiat Isot 1993;44:1139-46. [ ] 45. Jovanovic V. Standardization of quality control methods for 99mTc radiopharmaceuticals. J Radioanal Nucl Chem, Letters 1987;117:23-34. [ ] 46. Sharp PF, Smith FW, Gemmell HG, et al. Technetium-99m HM-PAO stereoisomers as potential agents for imaging regional cerebral blood flow: human volunteer studies. J Nucl Med 1986;27: 171-7. [ ] 47. Moretti JL, Rapin JR, Saccavini JC, Lageron A, Poncin ML, Bardy A. 2,3-Dimercaptosuccinic-acid chelates - 1. Structure and pharmacokinetic studies. Int J Nucl Med Biol 1984;11:270-4. [ ] 48. Petry NA, Shaw SM, Kessler WV, Born GS, Belcastro PF. Effect of rubber closures on the stability of stannous ion in reagent kits for radiopharmaceuticals. J Parenter Drug Assoc 1979;33:283-6. [ ] 49. Lazarus C, Palmer AM, Hesslewood SR. Radiopharmaceutical kit modification. Nucl Med Commun 1998;19:613-4. [ ] 50. Millar AM. Radiopharmaceutical kit modification. Nucl Med Commun 1999;20:105-6. [ ] 51. Piera C, Pavia A, Bassa P, Garcia J. Preparation of [99mTc]-HM-PAO. J Nucl Med 1990;31:127-8. [ ] 52. Ballinger J. Preparation of technetium-99m-HMPAO. J Nucl Med 1990;31:1892. [ ] 53. Lerthirunwong C, Cheng KT, Hladik-III WB. A study of the concept of non-radioactive unit-dosed reagent kits [cold unit doses (CUDs)] as an efficient and cost-saving method for 99mTc radiopharmaceutical preparation. Int J Rad Appl Instrum B 1992;19:727-35. [ ] 54. Fleming WK, Jay M, Ryo UY. Reconstitution and fractionation of radiopharmaceutical kits. J Nucl Med 1992;33:1915. [ ] 55. Cheng KT, Spicer KM, Deshpande RV. Preparation and storage of single-dose portions of exametazime: effects on radiochemical purity after labeling. Am J Hosp Pharm 1992;49:1950-4. [ ] 56. Decristoforo C, Riccabona G. Problems with fractionated cold kits. J Nucl Med 1996;37:1912-3. [ ] 57. Kumar V. Fractionated cold-kits: address the critical issues to obviate problems. J Nucl Med 1997; 38:1664. [ ] 58. Baker RJ. Preparation and properties of 99Tcm-exametazime using stannous ion augmentation of fractionated cold kits. Nucl Med Commun 1999; 20:287-93. [ ] 59. Solanki C, Wraight EP, Barber RW, Sampson CB. Seven-hour stabilization of 99Tcm-exametazime (HMPAO) for cerebral perfusion. Nucl Med Commun 1998;19:567-72. [ ] 60. Verbeke K, Boonen C, Verbruggen A. Usefulness of residual fractions of L,L-ethylcysteinate dimer (Neurolite®) for the preparation of 99Tcm-L,L-ethylcysteinate dimer. Nucl Med Commun 1997; 18:535-9. [ ] 61. Hung JC, Herold TJ, Gibbons RJ. Optimal conditions of 99mTc eluate for the radiolabeling of 99mTc-sestamibi. Nucl Med Biol 1996;23:599-603. [ ] 62. Hung JC, Ponto JA, Hammes RJ. Radiopharmaceutical-related pitfalls and artifacts. Semin Nucl Med 1996;26:208-55. [ ] 63. Hung JC. Comparison of technetium-99m MAG3 kit formulations in Europe and the USA. Eur J Nucl Med 1992;19:990-2. [ ] 64. Sachdev SS, Ramamoorthy N, Nayak UN, et al. Preparation and evaluation of 99mTc-t-butylisonitrile (99mTc-TBI) for myocardial imaging: a kit for hospital radiopharmacy. Int J Rad Appl Instrum B 1990;17:543-52. [ ] 65. Hung JC, Chowdhury S, Redfern MG, Mahoney DW. Rapid preparation method for technetium-99m bicisate. Eur J Nucl Med 1997;24:655-9. [ ] 66. Millar AM, O'Brien LM. Preparation of 99Tcm-MAG3: no confirmation that sodium chloride injections from plastic containers affect radiochemical purity. Nucl Med Commun 1998;19: 475-7. [ ] 67. Lecklitner ML, Benedetto AR, Straw JD. Failure of quality control to detect errors in the preparation of technetium-99m disofenin (DISIDA). Clin Nucl Med 1985;10:468-74. [ ] 68. Hesslewood S, Leung E. Drug interactions with radiopharmaceuticals. Eur J Nucl Med 1994;21: 348-56. [ ] 69. Waldman DL, Weber DA, Oberdorster G, et al. Chemical breakdown of technetium-99m DTPA during nebulization. J Nucl Med 1987;28:378-82. [ ] 70. Kawada TK, Tubis M, Ebenkamp T, Wolf W. Review of nuclear pharmacy practice in hospitals. Am J Hosp Pharm 1982;39:266-74. [ ] 71. Ramírez de Arellano I, Piera C, Pavia J, Setoain J. Experiences in setting up the first centralized radiopharmacy in Spain. Nucl Med Commun 1999;20:279-85. [ ] 72. Hung JC, Budde PA, Wilson ME. Testing the radiochemical purity of technetium Tc-99m-labeled radiopharmaceuticals. Am J Health Syst Pharm 1995;52:310-3. [ ] 73. Williams CC, Kereiakes JG, Grossman LW. The accuracy of 99Molybdenum assays in 99mTechnetium solutions. Radiology 1981;138:445-8. [ ] 74. Hoory S, Bandyopadhyay D, Vaugeois J-C, Levy LM. Impurities in generator eluates and radiopharmaceuticals: a computerized quality assurance approach. Health Phys 1986;50:843-8. [ ] 75. Bauer R, Pabst H-W. Tc-generators - yield of 99mTc and ratio to "inactive" 99Tc. Eur J Nucl Med 1982;7:35-6. [ ] 76. Bonnyman J. Effect of milking efficiency on 99Tc content of 99mTc derived from 99mTc generators. Int J Appl Radiat Isot 1983;34:901-6. [ ] 77. Moore PW. Technetium-99 in generator systems. J Nucl Med 1984;25:499-502. [ ] 78. Mitta AEA, Robles AM. Generador de 99Mo-99mTc. In: Mitta AEA, Robles AM, eds. Manual de control de calidad de radiofarmacos. Montevideo: ALASBIMN, 1986:17-30. [ ] 79. Van der Walt TN, Fourie PJ. Rapid and sensitive method for the determination of aluminium in 99Mo-99mTc generators eluates. Appl Radiat Isot 1987;38:74-6. [ ] 80. Zimmer AM, Pavel DG. Rapid miniaturized chromatographic quality-control procedures for Tc-99m radiopharmaceuticals. J Nucl Med 1977;18: 1230-3. [ ] 81. Van Gansbeke B, Jeghers O, Ermans AM. Comparative study of quality control procedures for 99mTc radiopharmaceuticals. J Radioanal Nucl Chem, Articles 1985;92:323-32. [ ] 82. Sanada S, Ando A, Ando I, Hiraki T, Hisada K. A single-strip mini-paper chromatographic method for rapid purity-control of 99mTc-labeled radiopharmaceuticals. Eur J Nucl Med 1986;12:390-3. [ ] 83. Zucchini GL, Marinelli M, Pozzato R, Garuti P. Comparison of different chromatographic quality-control procedures to determine the radiochemical purity of common 99mTc-diagnostic agents. Int J Rad Appl Instrum [A] 1987;38:283-8. [ ] 84. Mallol J, Bonino C. Comparison of radiochemical purity control methods for 99Tcm radiopharmaceuticals used in hospital radiopharmacies. Nucl Med Commun 1997;18:419-22. [ ] 85. Zimmer AM, Majewski W, Spies SM. Rapid miniaturized chromatography for Tc-99m IDA agents: comparison with gel chromatography. Eur J Nucl Med 1982;7:88-91. [ ] 86. Owunwanne A, Weber DA, O'Mara RE. Factors influencing paper chromatographic analysis of technetium-99m phosphorus compounds: concise communication. J Nucl Med 1978;19:534-7. [ ] 87. Belkas EP, Archimandritis S. Quality control of colloid and particulate 99mTc-labeled radiopharmaceuticals. Eur J Nucl Med 1979;4:375-7. [ ] 88. Ercan MT. Rapid determination of hydrolyzed-reduced technetium-99m in particulate radiopharmaceuticals. Appl Radiat Isot 1992;43:1175-7. [ ] 89. Proulx A, Ballinger JR, Gulenchyn KY. Routine determination of radiochemical purity of 99mTc-MIBI. Int J Rad Appl Instrum [A] 1989;40:95-7. [ ] 90. Patel M, Sadek S, Jahan S, Owunwanne A. A miniaturized rapid paper chromatographic procedure for quality control of technetium-99m sestamibi. Eur J Nucl Med 1995;22:1416-9. [ ] 91. Pandey PM, Sachdev SS, Ramamoorthy N, et al. Formulation and evaluation of a two-components lyophilized kit for Tc-sestamibi: transchelation preparation of Tc-99m-sestamibi. Nucl Med Biol 1997;24:697-700. [ ] 92. Chen F, Decristoforo C, Rohrbacher B, Riccabona G. A simple two-strip method to determine the radiochemical purity of technetium-99m mercaptoacetyltriglycine. Eur J Nucl Med 1993; 20:334-8. [ ] 93. Amin KC, Saha GB, Go RT. A rapid chromatographic method for quality control of technetium-99m-bicisate. J Nucl Med Technol 1997; 25:49-51. [ ] 94. Gomez JL, Vega F, Penafiel A, et al. Un método alternativo para determinar la pureza radioquímica de las preparaciones de 99mTc-tetrofosmina. Rev Esp Med Nucl 1999;18:94-8. [ ] 95. Mallot J. Analytical artifacts in quality control of 99mTc-radiopharmaceutical. Nucl Med Biol 1990;6:609-11. [ ] 96. Graham D, Millar AM. Artifacts in the thin-layer chromatographic analysis of 99Tcm-tetrofosmin injections. Nucl Med Commun 1999;20:439-44. [ ] 97. Mitta AEA, Suarez AHF, Troparevsky MLP. Tc-99m.L.L-ECD. In: Mitta AEA, Suarez AHF, Troparevsky MLP. Anexo del manual de control de calidad de radiofarmacos. Buenos Aires: ALASBIMN, 1992:4. [ ] 98. Ballinger JR, Reid RH, Gulenchyn KY. Radiochemical purity of [99mTc] HM-PAO. J Nucl Med 1988;29:572-3. [ ] 99. Pauwels EKJ, Feitsma RIJ. Radiochemical quality control of 99mTc-labeled radiopharmaceuticals. Some daily practice guidelines. Eur J Nucl Med 1977;2:97-103. [ ] 100. Darte L, Persson BRR. Quality control of 99mTc-radiopharmaceuticals. Evaluation of GCS minicolumns in routine clinical work with scintillation cameras. Eur J Nucl Med 1980;5:521-7. [ ] 101. Jovanovic V, Maksin T, Rastovac M, Bzenic J. Comparative quality control of 99mTc-pyrophosphate and 99mTc-diphosphonate radiopharmaceuticals. Eur J Nucl Med 1983;8:179-82. [ ] 102. Vucina JL. Comparative quality control of some bone-seeking 99mTc radiopharmaceuticals by gel chromatography. J Radioanal Nucl Chem, Letters 1995;200:291-8. [ ] 103. Jovanovic V, Maksin T, Konstantinovska D, Zmbova B, Cvoric J. Radiochemical quality control of 99mTc-labelled radiopharmaceuticals. J Radioanal Chem 1980;59:239-43. [ ]
* Trabalho realizado no Centro de Medicina Nuclear (LIM-44) do Departamento de Radiologia da Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554