Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 36 nº 3 - Maio / Jun. of 2003
Vol. 36 nº 3 - Maio / Jun. of 2003
|
ARTIGOS
|
|
|
|
|
Autho(rs): Nestor Hugo Kisilevzky, Maurício de Sena Martins |
|
|
Descritores: Miomas; Embolização uterina; Tumor ginecológico; Menorragia. |
|
|
Resumo:
INTRODUÇÃO Os miomas de útero, também denominados de leiomiomas ou fibromas, são os tumores ginecológicos mais comuns e incidem em até 30% das mulheres em idade reprodutiva(1). A miomatose acomete com maior freqüência mulheres da raça negra, nuligestas, obesas, aquelas com história familiar de miomatose e as portadoras de síndrome hiperestrogênica(2). Embora os miomas de útero sejam muito freqüentes, tem sido estimado que somente 20% a 50% das pacientes apresentam algum tipo de sintoma, como menorragia, dismenorréia, sensação de pressão pélvica, freqüência urinária alterada, dor,infertilidade ou aumento do volume abdominal e massa pélvica palpável(3). A forma de apresentação clínica é variável e depende, principalmente, do tamanho, da localização e do número de nódulos miomatosos. O sintoma mais comum é o sangramento uterino anormal (menorragia), que geralmente se apresenta como menstruação com duração e fluxo sanguíneo aumentados, que podem inclusive levar a anemia(4). Até recentemente, as únicas modalidades terapêuticas para a miomatose sintomática eram o tratamento cirúrgico ou o tratamento hormonal. A ablação endometrial, uma alternativa minimamente invasiva, também tem sido ponderada, porém, por apresentar recidiva elevada dos sintomas (24% após seis meses do procedimento) e estar associada freqüentemente com gravidez ectópica, formação de hematomas e dor pélvica cíclica, esta alternativa não tem ganho muita popularidade(5). Histerectomia ou miomectomia têm sido as opções cirúrgicas. A miomatose é responsável por um terço das histerectomias realizadas nos EUA(6).Embora tenha a vantagem de ser definitivamente curativa, a histerectomia é um procedimento cirúrgico formal, o que demanda alguns dias de hospitalização e um período de convalescença pós-operatória. Pode ainda estar associada a perda sanguínea considerável, lesão do ureter e outras complicações(7). A miomectomia, que foi desenvolvida para preservar a fertilidade feminina, é um procedimento cirúrgico mais refinado, que comumente está associado com aumento da perda sanguínea, tempo operatório, dor, morbidade pós-operatória e tempo de hospitalização, quando comparada com a histerectomia(8). Também está associada à formação de bridas, que podem levar a infertilidade (foi relatado índice de gravidez de somente 40% após miomectomia)(3). A abordagem farmacológica, seja com compostos progestacionais ou com agonistas gonadotróficos, tem mostrado ser uma opção efetiva para melhorar os sintomas e reduzir o tamanho uterino. Todavia, a interrupção da terapia provoca rapidamente a recorrência dos sintomas(9). Assim, devido às limitações que apresentam essas opções terapêuticas, a miomatose uterina continua a ser causa de menorragia e dor pélvica crônica em número significativo de mulheres. A partir de 1991, um grupo francês liderado por Ravina começou a utilizar clinicamente a embolização uterina como alternativa primária para tratamento dos miomas de útero. Os resultados iniciais dessa experiência foram publicados em 1995 e sugeriam que se tratava de um método altamente eficiente para o controle dos sintomas da miomatose uterina(10).A partir de então, numerosas experiências clínicas foram surgindo ao redor do mundo, determinando a validade e promissão desse procedimento percutâneo(11–18). Apresentamos, aqui, a nossa experiência clínica inicial com a técnica de embolização arterial uterina (EAU), mostrando tratar-se de um método seguro e eficaz para tratamento da miomatose sintomática.
CASUÍSTICA E MÉTODO No período compreendido entre outubro/1999 e abril/2002 realizamos EAU em 100 pacientes portadoras de miomatose sintomática (Tabela 1).
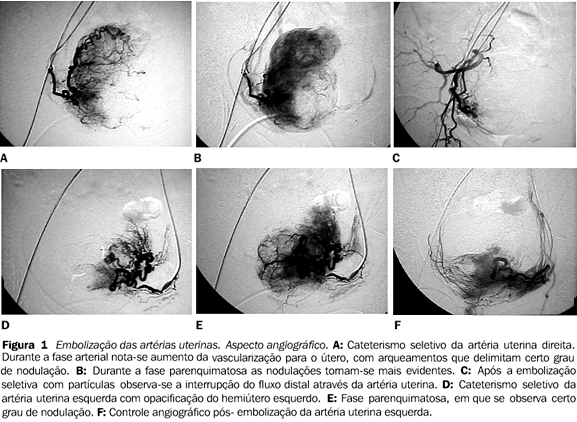
A idade das pacientes variou de 24 a 56 anos (média de 37 anos), sendo 55 da raça negra, 39 brancas e 6 orientais. Nos antecedentes obstétricos e ginecológicos verificou-se que 84 eram multíparas e 16 eram nuligestas, sendo que 5 haviam realizado laqueadura de trompas, 9 haviam realizado miomectomia cirúrgica e 14 tinham realizado tratamento hormonal previamente. Duas pacientes estavam em tratamento de reposição hormonal pós-menopausa. Os procedimentos foram realizados em duas instituições hospitalares: uma pública, onde foram atendidas 54 pacientes dependentes do Sistema Único da Saúde (SUS), e uma particular, onde foram atendidas 46 pacientes de forma particular ou através de planos de saúde. O principal sintoma que indicou a intervenção foi o aumento do fluxo menstrual em 79 pacientes e dor associada à miomatose em 21. O tempo transcorrido desde o aparecimento dos sintomas até a consulta médica variou de 3 a 20 meses (média de 8 meses). O diagnóstico de miomatose foi realizado por ultra-sonografia (US) em 75 pacientes ou associação da US com a ressonância magnética (RM) em 25. O volume uterino avaliado por estes métodos é considerado como a soma de miométrio normal e dos nódulos miomatosos e variou de 181 cm³ a 1.840 cm³ (média de 487 cm³). Foi realizada biópsia de endométrio previamente ao tratamento em 56 casos. Todas as pacientes foram hospitalizadas por ocasião do procedimento, sendo este sempre realizado em sala angiográfica equipada com aparelho por subtração digital (Figura 1).
Invariavelmente o procedimento foi realizado sob anestesia local e sedação consciente com um hipnótico (midazolan) e um analgésico (citrato de fentanila). Sondagem vesical, protetor da mucosa gástrica (ranitidina), antibiótico profilático (cefalotina) e antiinflamatório não-esteróide (cetoprofeno) foram utilizados como rotina durante o procedimento. O estudo angiográfico e a embolização uterina foram realizados por meio de punção e cateterismo da artéria femoral. Em 94 oportunidades utilizou-se um cateter angiográfico de calibre 5F (tipo Dav, Cobra ou Berenstein) para realizar a embolização, e em 6 casos houve necessidade de se utilizar um microcateter de calibre 2,8 F (Tracker 18 – Target) para embolizar uma ou ambas as artérias uterinas. Foram empregados como agente embólico: partículas de álcool polivinílico (PVA) de 350–500 m em 42 casos, em quantidade média de 310 mg por paciente (variação de 100 a 600 mg); PVA de 500–700 m em 54 casos, em quantidade média de 340 mg (variação de 100 a 800 mg); e microesferas calibradas de 700–900 m em quatro casos, em quantidade média de 250 mg por paciente (variação de 200 a 300 mg). Depois de finalizado o procedimento, o cateter angiográfico foi retirado, realizando-se compressão manual do sítio da punção da artéria femoral até obter-se a parada do sangramento. Após a alta hospitalar, todas as pacientes foram orientadas para comparecerem a uma consulta de acompanhamento pós-operatório uma semana após a embolização. Foram também orientadas para realizar estudo de imagem (US ou RM) e retornar à consulta para avaliação clínica após 12 semanas. Setenta e seis pacientes foram acompanhadas por um período de 12 semanas após a embolização e constituem a população para a análise dos resultados clínicos do tratamento.
RESULTADOS Os resultados são apresentados sob dois aspectos: técnico e clínico. No aspecto técnico foram considerados: acesso vascular, possibilidade de cateterismo seletivo das artérias uterinas, anatomia vascular, melhores incidências radiológicas, possibilidade de completar a embolização, duração do procedimento e intercorrências técnicas. No aspecto clínico foram considerados: tempo de internação, síndrome pós-embolização, alteração dos sintomas, redução do tamanho uterino, complicações clínicas pós-operatórias e a necessidade de intervenções complementares. Resultados técnicos Acesso vascular – Em 97 casos o procedimento foi realizado por meio de punção e cateterismo da artéria femoral direita. Em três pacientes houve necessidade de se realizar a punção bilateral (ambas as artérias femorais). Cateterismo seletivo – Em 97 pacientes ambas as artérias uterinas foram cateterizadas seletivamente para se realizar a embolização. Em três pacientes somente foi possível o cateterismo seletivo de uma artéria uterina (duas à direita e uma à esquerda). Anatomia vascular – Em todas as pacientes foi observada a presença de duas únicas artérias uterinas (direita e esquerda) originando-se a partir de ramificações das artérias hipogástricas. Na observação das 200 artérias uterinas notou-se que a variação anatômica mais freqüente foi a origem da artéria uterina como sendo o primeiro ramo da divisão anterior (visceral) da artéria hipogástrica (68%). Observou-se também a artéria uterina originando-se na divisão da artéria hipogástrica (trifurcação) em 9%, na artéria hipogástrica (acima da divisão) em 4% e ainda originando-se num tronco comum com a artéria vesical em 3%. No restante dos casos foi variável ou não se conseguiu definir com precisão o local exato de origem. Em 80% dos casos a anatomia vascular foi diferente comparando ambos os lados (direito e esquerdo). Verificou-se a presença de uma artéria uterina hipoplásica de forma unilateral em quatro oportunidades (três à esquerda e uma à direita). Observou-se, ainda, presença de uma artéria ovariana vicariante em seis oportunidades e de ambas as artérias ovarianas vicariantes em dois casos. Incidências radiológicas – A origem da artéria uterina esquerda foi mais bem visualizada na incidência radiológica oblíqua anterior direita (OAD) em 52% dos casos, na ântero-posterior (AP) em 33% e na oblíqua anterior esquerda (OAE) em 15%. Já a origem da artéria uterina direita foi mais bem visualizada na incidência OAE em 41% dos casos, na AP em 35% e na OAD em 24% dos casos. Possibilidade de embolização – Em 97 pacientes realizou-se embolização uterina bilateral e somente em três casos foi feita embolização unilateral. Duração do procedimento – O tempo total necessário para completar o procedimento, contabilizando o momento da punção femoral até a retirada do cateter, variou de 14 a 162 minutos, com média de 38 minutos. Já o tempo de exposição fluoroscópica, incluindo a fluoroscopia e a documentação angiográfica, variou de 7 a 47 minutos, com média de 18 minutos. Intercorrências técnicas – O cateterismo seletivo da artéria uterina provocou espasmo vascular em sete oportunidades. Em todas conseguiu-se realizar a embolização seletiva. Verificou-se uma dissecção do ramo anterior da artéria hipogástrica, que inviabilizou, deste lado, o cateterismo seletivo da artéria uterina. Resultados clínicos Tempo de internação após a embolização – Todas as pacientes pernoitaram pelo menos uma vez no hospital. O tempo de hospitalização após a embolização variou de 16 a 98 horas (média de 34 horas). O tempo de hospitalização das 46 pacientes internadas na instituição particular variou de 16 a 28 horas (média de 22 horas). Para as 54 pacientes hospitalizadas na instituição pública o tempo de hospitalização variou de 30 a 96 horas (média de 50 horas). Síndrome pós-embolização – Todas as pacientes desta casuística manifestaram algum tipo de sintoma após a EAU. Dor do tipo cólica foi o sintoma mais freqüente e esteve presente em 95 pacientes. Náusea e/ou vômitos foram referidos por 42 pacientes, e indisposição geral, por 34. A intensidade da dor foi considerada leve, moderada ou grave, dependendo do tipo de medicação necessária para controlá-la. Assim, a dor foi considerada leve quando controlada com analgésicos comuns do tipo dipirona ou tramadol, associados a antiinflamatório não-esteróide (cetoprofeno); moderada quando controlada com opiáceos (meperidina, morfina) prescritos de forma horária; e grave quando controlada com opiáceos administrados por bomba de infusão contínua. Assim, das 95 pacientes que tiveram dor pós-EAU, 52 (54,7%) manifestaram dor leve, 35 (36,8%) apresentaram dor moderada e 8 (8,5%) manifestaram dor grave. Na comparação entre as pacientes particulares e do SUS, notamos que, das 44 pacientes particulares, 6 (13,6%) manifestaram dor leve, 30 (68,2%) tiveram dor moderada e 8 (18,2%) apresentaram dor grave, enquanto no grupo de 56 pacientes do SUS, 5 (8,9%) não manifestaram qualquer tipo de dor, 46 (82,2%) manifestaram dor leve e 5 (8,9%) apresentaram dor moderada. Em nenhum caso deste grupo foi observada dor de intensidade grave que requeresse infusão contínua de opiáceo. Alteração dos sintomas – Todas as pacientes foram citadas para consulta de avaliação clínica 12 semanas após a EAU. Das 76 pacientes que compareceram à consulta, 62 (81,5%) haviam tido queixa de alteração do fluxo menstrual e 14 (18,5%) haviam tido queixa de dor relacionada à miomatose como sintoma principal. Todas as pacientes responderam a um questionário em que se perguntava sobre a alteração da regularidade, volume e duração da menstruação. Também foi perguntado sobre a alteração na sensação da dor (Tabela 2).
Das 62 pacientes com queixa de alteração menstrual, obtiveram-se as seguintes respostas: a) com relação à regularidade menstrual, 54 (87,1%) responderam que a menstruação se tornou mais regular, 6 (9,7%) responderam que permaneceu inalterada e 2 (3,2%) responderam que se tornou mais irregular; b) com relação à alteração no volume menstrual, 57 (91,9%) responderam que o volume reduziu, 5 (8,1%) responderam que permaneceu inalterado e nenhuma respondeu que aumentou; c) com relação à duração da menstruação (em dias), 58 (93,5%) responderam que a duração reduziu, 4 (7,5%) responderam que permaneceu inalterada e nenhuma respondeu que aumentou. Entre as 14 pacientes cuja queixa principal foi dor relacionada à miomatose, 9 (64,2%) referiram que a dor desapareceu, 5 (35,8%) relataram que a dor melhorou mas não desapareceu, e nenhuma paciente manifestou que a dor permaneceu ou aumentou após a EAU. Redução do tamanho uterino – Na observação e comparação dos estudos de imagem (US ou RM) realizados 12 semanas após a EAU, verificou-se que, das 76 pacientes consultadas, 71 apresentaram redução de volume maior que 10% e 5 apresentaram aumento de volume menor que 10%. A média de volume uterino foi de 199 cm³ (variação de 122 cm³ a 650 cm³), o que, quando comparado com a média do volume apresentado pelas mesmas pacientes previamente à EAU (412 cm³, com variação de 187 cm³ a 1.840 cm³), evidenciou uma redução volumétrica média de 52%. Complicações clínicas – Dezessete pacientes apresentaram febre na primeira semana pós-EAU, que cessou com medicação convencional (dipirona). Verificaram-se dois hematomas inguinais, que evoluíram com resolução espontânea. A queixa mais freqüente após a EAU foi corrimento vaginal, relatado por 47 pacientes. Este corrimento foi referido como sendo similar a uma menstruação incipiente, com duração variável entre 5 e 22 dias. Doze pacientes referiram eliminação de fragmentos de mioma por via vaginal, sendo que seis apresentaram dor em cólica associada, o que motivou a prescrição de analgésicos e antibióticos. Em duas oportunidades foi necessária a reinternação das pacientes para realizar curetagem. Duas outras pacientes foram internadas para tratamento farmacológico da dor. Duas pacientes apresentaram dor abdominal pós-EAU com sinais de peritonismo. Nestas pacientes foi realizada laparotomia exploradora com 25 e 45 dias pós-EAU, respectivamente, tendo sido encontrado mioma subseroso pediculado isquêmico em processo de degeneração, que motivou uma miomectomia. Três pacientes apresentaram amenorréia após a EAU, sendo que em duas destas foi transitória, já que voltaram a menstruar dois e três meses, respectivamente, após a EAU. O único caso de amenorréia permanente ocorreu numa paciente de 52 anos de idade.
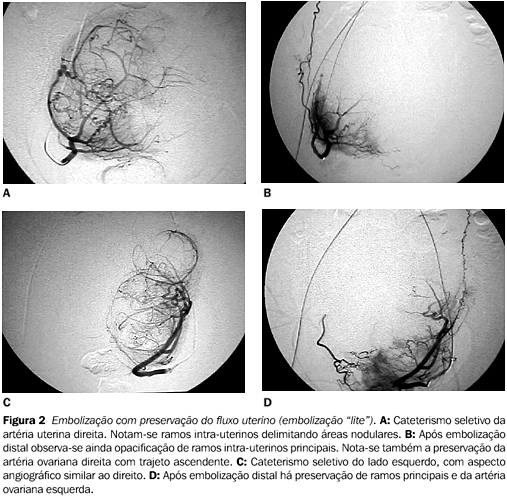
DISCUSSÃO A emboloterapia, ou simplesmente embolização, é uma técnica de radiologia intervencionista que se aplica clinicamente desde a década de 60. Basicamente, consiste na obliteração intencional de um vaso em uma determinada região anatômica. Para isto, um cateter é introduzido dentro do sistema vascular e, por meio de orientação fluoroscópica, é conduzido até o local onde se deseja ocluir o fluxo vascular, fazendo-se então a injeção de diferentes tipos de material apropriado, como partículas, fluidos, substâncias adesivas, balões, espirais metálicas, etc.(19). Dessa forma, a técnica de embolização tem sido empregada ao longo dos anos para corrigir numerosas situações clínicas como sangramentos, aneurismas, malformações vasculares, tumores, etc.(20). Na área ginecológica, a técnica de embolização tem sido largamente empregada como tratamento principal em vários tipos de situações hemorrágicas como as observadas em pós-parto, alterações placentárias, malformações vasculares da pelve, pós-operatório de intervenções ginecológicas, tumores malignos, etc.(20–24). A idéia de utilizar a técnica de embolização para tratamento da miomatose sintomática surgiu de duas hipóteses: 1) se a embolização pode tratar um sangramento pós-operatório, poderia prevenir também um sangramento intra-operatório?; 2) se os sintomas decorrentes da miomatose melhoram após degeneração e involução espontânea dos miomas, melhorariam também após se provocar intencionalmente a isquemia dos miomas? Essas duas hipóteses foram respondidas por um ginecologista francês, o Dr. Jacques Ravina, que preocupado com o sangramento intra-operatório que acontecia nas suas pacientes durante as miomectomias, encaminhou um grupo delas para fazer embolização uterina pré-operatória(11). A surpresa foi geral quando essas pacientes prescindiram da cirurgia previamente agendada em virtude de significativa melhora clínica que experimentaram apenas com a embolização. Assim, a revelação de Ravina foi que se pode embolizar ambas as artérias uterinas sem causar dano aparente anatômico ou funcional ao parênquima uterino(10). Desde então, a embolização vem sendo aplicada clinicamente em numerosas instituições ao redor do mundo, como uma alternativa para o tratamento da miomatose sintomática. Os resultados iniciais já publicados na literatura médica têm sido muito positivos e geraram considerável interesse pela EAU como alternativa ao tratamento cirúrgico. Desde 1998, pelo menos dez series com mais de 50 casos mostraram que a EAU é muito eficiente para melhorar os sintomas na grande maioria das pacientes(12,14,16,18, 25–30). Em 81% a 94% das pacientes houve melhora da menorragia, e entre 64% e 96% das pacientes comprovou-se melhora dos sintomas compressivos como dor, sensação de peso, ou freqüência urinária. Nossos resultados iniciais, apresentados neste trabalho, estão de acordo com a experiência internacional. Todavia, para facilitar a análise e compreensão deste procedimento inovador, é importante analisar alguns aspectos específicos relacionados com o procedimento. Deve-se compreender, inicialmente, que um programa de embolização uterina sustenta-se em três pilares: seleção de pacientes, técnica de embolização em si e manejo e acompanhamento pós-operatório. Seleção de pacientes Resulta importante lembrar que provavelmente menos de 50% das mulheres portadoras de mioma uterino apresentam sintomas e requerem formalmente de tratamento. O aumento do fluxo menstrual tem sido referido como o sintoma mais comum na maioria das casuísticas e também na nossa experiência. Devemos salientar, todavia, a importância do componente subjetivo relacionado aos sintomas. Temos observado que algumas pacientes que relatam o uso de fraldas durante a menstruação e que seguramente sangram mais que 100 ml a cada ciclo consideram a sua menstruação absolutamente normal, e outras que utilizam apenas um único absorvente ao dia manifestam-se angustiadas por acharem suas menstruações exageradas. Por isso, temos enfocado com maior atenção alguns indicadores clínicos, como a presença de anemia, o aumento no consumo de absorventes a cada menstruação, a troca de absorvente a cada duas horas, o aumento progressivo na duração da menstruação ou o encurtamento do ciclo, os sangramentos intercurso e principalmente o relato de situações sociais embaraçosas ou constrangedoras. Um dado interessante é o tempo transcorrido entre o início dos sintomas e a procura por tratamento, que em nosso estudo resultou numa média de oito meses. Isto se correlaciona com o tamanho do útero avaliado pelos estudos de imagem; enquanto nas casuísticas norte-americanas(16) os úteros miomatosos medem quase que invariavelmente mais de 600 cm³, a nossa média tem sido ao redor de 400 cm³, o que pode significar que a mulher brasileira procura pelo tratamento de forma mais precoce. Nas pacientes hipermenorréicas e principalmente naquelas que apresentam sangramentos intercurso torna-se necessário diferenciar a miomatose de outras afecções hemorrágicas orgânicas (principalmente endometriais), disfuncionais, provocadas intencionalmente ou sistêmicas. A US e a RM têm sido os estudos de imagem suficientes para caracterizar a miomatose e descartar doenças similares ou associadas(31,32). A US transvaginal ou transabdominal é um método simples, econômico, amplamente distribuído e muito eficiente para caracterizar o aspecto e tamanho uterinos, a quantidade, tamanho e localização dos nódulos, assim como a espessura endometrial. Permite ainda avaliar o fluxo das artérias uterinas e realizar cálculos hemodinâmicos com o recurso do Doppler. Tem como desvantagens o fato de ser um método muito dependente do operador e fornecer pouco detalhe anatômico. Já a RM tem a vantagem de fornecer imagens mais anatômicas e facilitar o cálculo das dimensões, bem como a localização dos miomas e as suas características. A RM é muito precisa para detectar miomas pediculados e também é um método mais eficaz para descartar outras afecções como a adenomiose. Entretanto, a RM não permite avaliar o fluxo, além de encarecer a propedêutica da miomatose pelo seu alto custo, quando comparada com a US. Todas as pacientes da nossa casuística foram avaliadas com US e somente em alguns casos duvidosos ou naquelas cujo seguro de saúde dava cobertura foi solicitada a RM. Embora tenhamos realizado biópsia endometrial em mais da metade das nossas pacientes, este continua a ser um ponto controvertido. Inicialmente o fazíamos de forma protocolar, mas, mais recentemente, temos indicado biópsia endometrial somente naqueles casos suspeitos devidos a crescimento nodular muito rápido, espessamento endometrial ou sangramentos intermenstruais. Essas pacientes devem fazer biópsia endometrial para demonstrar ausência de hiperplasia endometrial ou neoplasia durante os 12 meses prévios à embolização. É importante mencionar que o câncer de endométrio é raro na mulher jovem, somente sangra durante o período menstrual e, portanto, a biópsia de rotina pode ser de valor questionável(33). Embora, de forma geral, a indicação de embolização independa do tamanho, número e localização de nódulos miomatosos, há situações especiais que merecem ser comentadas. Os miomas pediculados, subserosos ou submucosos, constituem um risco para a embolização, pela possibilidade de infarto e desprendimento do parênquima uterino. Com isto podem ocorrer complicações infecciosas intra-abdominais ou intra-uterinas. As duas únicas complicações, em nossa experiência, que requereram procedimento cirúrgico maior (laparotomia) deveram-se justamente à isquemia de miomas subserosos pediculados. Por isso, recomenda-se que miomas pediculados sejam retirados por laparoscopia ou histeroscopia, que podem ser realizadas antes ou depois da embolização se esta for ainda necessária para abordar outros miomas uterinos(34). Dependendo das suas características, as pacientes com indicação para EAU podem ser agrupadas em quatro categorias: 1) pacientes pré-menopáusicas; 2) pacientes com recidiva dos sintomas pós-miomectomia; 3) pacientes com desejo de manter a fertilidade; 4) pacientes pós-menopáusicas em tratamento de reposição hormonal. As pacientes com miomatose sintomática no período pré-climatério são as que se apresentam com maior freqüência e constituem a população em que habitualmente se indica histerectomia, similarmente ao que acontece com as pacientes que sangram após a menopausa por causa da reposição hormonal. Já as pacientes que desejam manter a fertilidade, sejam elas previamente miomectomizadas ou não, têm representado grande desafio terapêutico na tentativa de oferecer um tratamento eficaz para controlar os sintomas decorrentes dos miomas, sem, entretanto, comprometer a sua fertilidade. É muito importante diferenciar a paciente cuja queixa primordial é a infertilidade, daquela que se queixa de sintomas hemorrágicos ou compressivos e que manifesta não desejar ser submetida a tratamento que elimine suas possibilidades futuras de engravidar, no caso, a uma histerectomia. Embora existam relatos de casos esporádicos de gravidez e paridade após a embolização uterina, deve-se considerar que a maioria das embolizações foi realizada em pacientes no período da pré-menopausa, sem desejo e/ou sem condições de engravidar. Num estudo europeu recentemente apresentado, verificou-se que, de um grupo de pacientes submetidas a EAU que desejavam engravidar, 38% o conseguiram, mas somente 25% o levaram a termo(35). Num outro estudo norte-americano verificou-se que a chance de gravidez após a embolização uterina é similar à observada após a miomectomia cirúrgica(36). Todavia, os trabalhos enfocando este assunto são poucos e os números são pequenos para determinar o verdadeiro impacto que a embolização provoca na fertilidade. Assim, parece ser de bom senso não indicar este método para tratamento de infertilidade; ao mesmo tempo, a EAU pode representar uma alternativa muito válida para as pacientes que desejam preservar as suas possibilidades futuras de engravidar, principalmente quando a única alternativa terapêutica para os seus sintomas passa a ser uma histerectomia. Outro desafio terapêutico está representado pelas pacientes pós-menopáusicas. A antiga regra de que a menopausa "cura" os miomas não é mais verdadeira desde que muitas pacientes (se não a maioria) fazem uso da terapia de reposição hormonal (TRH). Nesta situação é freqüente o aparecimento de sangramento vaginal e até mesmo sintomas compressivos em decorrência do aumento do tamanho do útero. Alguns autores, inclusive nós, têm indicado a EAU nesta situação(37,38). Deve-se salientar, no entanto, que mulheres pós-menopáusicas com sangramento vaginal têm risco maior de carcinoma de endométrio que mulheres pré-menopáusicas. Por isso, uma correta propedêutica deve ser realizada nessas pacientes. Adicionalmente, uma alternativa pode ser a suspensão da TRH por um período de três a seis meses. Se o sangramento continuar, então o diagnóstico presuntivo deverá ser câncer de endométrio e a embolização estará contra-indicada; porém, se o sangramento cessar, seguramente recomeçará com a reintrodução da TRH. Neste caso, a EAU deve ser considerada. Nos dois casos de embolização em pacientes pós-menopáusicas da nossa casuística obtivemos controle integral dos sintomas. O mesmo foi observado num estudo apresentado recentemente(38). Seguramente, esta será uma indicação a ser explorada num futuro próximo. A EAU deve ser contra-indicada na paciente grávida, na infecção pélvica aguda, na vasculite ativa, na paciente com antecedente de irradiação pélvica, na evidência de malignidade, nas pacientes com alergia grave ao contraste radiológico, nas coagulopatias incontroláveis, na insuficiência renal grave (pacientes em diálise) e ante a associação de miomatose e outras afecções ginecológicas(33). Aspectos técnicos relacionados à EAU A embolização uterina é geralmente um procedimento tecnicamente simples em mãos de um radiologista intervencionista experiente e pode ser realizada em mais de 95% dos casos(12,14,16,18,25–30). Em nossa experiência clínica inicial conseguimos realizar a embolização bilateral em 97% dos casos. Somente em três oportunidades não foi possível cateterizar seletivamente uma das artérias uterinas, e por este motivo a embolização foi feita de forma incompleta. Isto se deveu ao achado de artérias hipoplásicas em duas oportunidades e a uma dissecção acidental num outro caso. Muito mais importante foi o fato de se verificar que o procedimento pôde ser feito igualmente na instituição privada quanto na pública, comumente carente de recursos. Isto é um indicador da simplicidade técnica do método ou, ao menos, de que uma infra-estrutura complexa para realizá-lo é prescindível quando o operador é um especialista em técnicas angiográficas. Na maioria das vezes foi necessário um simples cateter angiográfico, e somente em alguns poucos casos, com variantes anatômicas, tortuosidade vascular acentuada, com artéria hipoplásica ou quando comprovamos espasmo vascular, foi necessário utilizar microcateteres e técnica mais refinada. Atenção adicional deve ser requerida para evitar os espasmos da artéria uterina provocados pelo cateterismo, já que, mesmo com a utilização de vasodilatadores, como a papaverina ou a nitroglicerina, na maioria das vezes resulta difícil revertê-los(18). Por isso, a utilização de guias hidrofílicos e cateteres com curvatura adequada são uma boa medida para evitar essa complicação técnica e comprometer o procedimento. Um aspecto importante que deve ser sempre considerado é o tempo necessário para completar o procedimento, principalmente no que se refere ao tempo de irradiação fluoroscópica. Com o propósito de evitar a irradiação desnecessária, principalmente para os ovários, a Sociedade Americana de Radiologia Intervencionista estabeleceu que o tempo ideal de fluoroscopia para completar uma EAU deve ser menor que 25 minutos(39). A irradiação provocada durante uma EAU foi calculada como sendo similar à provocada na realização de quatro TC da pelve ou até de dois estudos de enema baritado, o que não condiciona um risco maior de nascimentos com defeitos congênitos ou maior incidência de lesões cancerígenas na pelve(40). Esta preocupação nos levou a modificar a concepção técnica do procedimento. Inicialmente realizávamos um estudo detalhado da anatomia vascular da pelve, o que evidentemente prolongava o tempo de procedimento e de exposição radiológica. Após os primeiros 30 casos, começamos a prescindir das angiografias iniciais, e como preferimos na atualidade, após o acesso vascular procuramos atingir imediatamente a artéria uterina, primeiro de um lado (geralmente o contralateral) e, posteriormente, do outro lado. Com isto, reduzimos consideravelmente o tempo de procedimento, mantendo-o dentro dos limites da segurança, sem causar prejuízo no resultado técnico final. A vantagem de se obter estudos anatômicos mais detalhados reside na possibilidade de identificação de circulação aberrante para o útero. A vantagem mais importante é quando se observa uma ou duas artérias ovarianas irrigando parte do útero(41). Como esta é uma situação que pode ser causa de recidiva dos sintomas após a EAU, alguns autores têm sugerido embolizar também as artérias ovarianas com diferentes manobras(42,43). Embora tivéssemos a oportunidade de identificar as artérias ovarianas vicariantes em alguns casos, preferimos evitar a manipulação antecipada deste vaso e eventualmente aguardar o resultado clínico, para reintervir se houvesse recidiva dos sintomas nestes casos. Este é outro motivo pelo qual preferimos fazer um procedimento rápido, já que, mesmo quando identificamos irrigação aberrante, não a embolizamos. Os dois assuntos mais importantes do ponto de vista técnico são a escolha do material embolizante e o ponto final da embolização. Existem, atualmente, três tipos de agentes embolizantes que têm sido usados para a EAU: as partículas de PVA, a esponja hemostática do tipo Gelfoam e as microesferas calibradas (não disponíveis comercialmente no mercado brasileiro)(44–48). As partículas de PVA são bastante familiares para os radiologistas intervencionistas e, na atualidade, existe uma maior documentação da sua utilização para embolização uterina(12,14,16,18,25–30). O PVA é um agente seguro e eficiente e tem sido utilizado em tamanhos variáveis de 355 m a 700 m, porém, devido à irregularidade na sua forma, apresenta tendência a formar grumos e provocar obstrução mais proximal ao desejado(44). O Gelfoam (esponja hemostática) é também muito familiar e acessível para os radiologistas intervencionistas. Tem a vantagem adicional de ser um material bem mais econômico que as partículas de PVA. Alguns trabalhos recentes mostraram que a EAU com Gelfoam produz resultados comparáveis aos observados com PVA, abrindo-se assim uma possibilidade para diminuir ainda mais o custo do procedimento(46,47). A principal crítica para este material é a maior reação inflamatória que provoca, o que condicionaria uma oclusão vascular maior, com tendência a infecção, e talvez a sua menor durabilidade(44). Já as microesferas calibradas (embosferas) são um produto da nova tecnologia para embolização e correspondem a partículas esféricas e regulares de gelatina(48). Tecnicamente, as microesferas calibradas resultam muito atrativas, já que o seu manuseio e injeção é muito fácil devido à sua regularidade. Teoricamente, com este material seria possível usar menor quantidade de partículas para atingir os vasos desejados e com isto diminuir a extensão da isquemia uterina. Entretanto, a experiência clínica inicial não mostrou ainda vantagens clínicas da sua utilização e, portanto, não dispomos, no momento, de uma justificativa sólida para gastos maiores(48,49). Na nossa experiência trabalhamos com partículas de PVA, inicialmente com tamanho de 355 m a 500 m e posteriormente de 500 m a 700 m, tendo realizado, ainda, uma experiência incipiente com as microesferas. Nossa percepção é que as partículas com tamanho de 500 m a 700 m provocam menos dor no período pós-operatório, sem, entretanto, alterar os resultados clínicos, e por isso as preferimos na atualidade. O ponto final da embolização é talvez a chave técnica para o sucesso. Interpreta-se que uma subembolização pode não estar acompanhada de resultado clínico satisfatório e uma superembolização pode provocar isquemia intensa e aumentar o risco de complicações. É importante compreender o que se pretende obter com a embolização. Deve haver uma explicação anatomopatológica e isto ainda não foi bem esclarecido. Estudos de peças obtidas após histerectomia mencionam que os vasos do plexo vascular perimiomatoso, que seriam o alvo da embolização, têm calibre de 500 m(50). Entretanto, ficou demonstrado que a embolização completa de ambas as artérias uterinas produz resultados satisfatórios e é segura, embora seja provavelmente mais do que necessário e provoque um pico maior na curva de dor pós-embolização devido a isquemia universal do útero(14–16). Na atualidade temos tentado realizar a embolização do plexo vascular perimiomatoso e preservando o tronco arterial principal (EAU "lite") (Figura 2). Isto adquire fundamental importância nas pacientes que desejam manter-se férteis, já que pressupomos que para suportar uma gravidez as artérias uterinas devem estar pérvias.
Também é importante salientar que quanto menor a quantidade de partículas utilizadas, menor será a chance de acontecer sua migração acidental provocando embolização fora do alvo, principalmente no ovário. Já para fins práticos temos definido alguns sinais angiográficos indicadores do final da embolização, entre os quais destacamos: a ausência de fluxo nos ramos secundários das artérias uterinas, com a observação angiográfica de imagem de "árvore podada", o acúmulo de contraste no útero, o refluxo ao redor do cateter e o aparecimento de drenagem venosa precoce. Por fim, deve-se mencionar a importância de uma boa compressão manual após a retirada do cateter. Atente-se que muitas dessas pacientes são obesas e/ou têm tendência à mobilização dos membros no pós-operatório imediato, por causa da invariável síndrome pós-embolização. Com o intuito de evitar complicações no local da punção arterial, em alguns casos pode ser útil o uso de dispositivos de fechamento vascular em vez da compressão manual(51). Manejo e acompanhamento pós-EAU O acompanhamento pós-operatório é talvez o aspecto mais desafiador de um programa de embolização uterina. Até o momento, a EAU tem sido um procedimento seguro e com poucas complicações graves. Todavia, com o aumento da sua indicação, complicações têm sido descritas, sendo algumas destas bastante sérias. Na discussão do manejo pós-operatório devem ser considerados os cuidados de rotina e a identificação de complicações. Este assunto é crítico para o sucesso de qualquer programa de embolização uterina. Se este não for executado apropriadamente, as pacientes podem experimentar resultados negativos e ficar insatisfeitas com o método, mesmo que este tenha sido executado tecnicamente de forma correta. A grande maioria das pacientes submetidas a EAU experimenta o que se conhece como síndrome pós-embolização e que geralmente se apresenta com dor, febre e náuseas e/ou vômitos, que requerem cuidados específicos(14,15,52). Estes sintomas são atribuídos à liberação de produtos resultantes da degeneração miomatosa após a isquemia(53). A dor tipicamente começa após a embolização da segunda artéria uterina, geralmente na própria sala angiográfica, e se mantém de forma intensa por até seis horas após o procedimento(15,54). A dor é comumente descrita como sendo similar a uma cólica menstrual intensa e geralmente melhora rapidamente dentro das primeiras 24 horas após o procedimento. A gravidade da dor pós-embolização não depende do tamanho, número e/ou localização de miomas, e, portanto, não pode ser predita(54). Da mesma forma, a gravidade da dor não se correlaciona com a evolução clínica pós-operatória(54). Como comentado anteriormente, a escolha do tipo e do tamanho das partículas, bem como a definição do ponto final da embolização, podem sim ter relação direta com a dor no pós-operatório. Um dado curioso na nossa experiência foi a enorme diferença na intensidade da dor referida pelas pacientes, quando comparadas as particulares com as dependentes do SUS. Embora tenha sido empregada a mesma técnica e cuidados intra e pós-operatórios em ambos os grupos, resultou evidente que as pacientes de baixa renda apresentaram limiar para a dor muito mais alto, o que provavelmente não decorre de diferenciação patológica ou de variações da técnica empregada e sim de uma experiência de vida muito mais dura e traumática dessas pacientes. Mesmo nas pacientes particulares o manejo da dor não tem sido muito problemático. O procedimento foi realizado invariavelmente sob sedação consciente, diferentemente de outros serviços, que preferem o bloqueio raquidiano ou peridural de rotina. Após o procedimento, definimos três regimes analgésicos, dependendo da intensidade dos sintomas. A maioria das pacientes tem sido controlada com antiinflamatórios não-esteróides, analgésicos comuns e eventualmente opiáceos (meperidina) prescritos de forma horária. Com este esquema, a maioria das pacientes pode ser liberada na manhã seguinte à embolização, o que tem acontecido com as pacientes atendidas no hospital particular. A extensão do tempo de internação das pacientes internadas na instituição pública deveu-se principalmente a questões operacionais do hospital público e não à verdadeira necessidade clínica de permanecer hospitalizada. Em geral, o procedimento tem sido tão bem tolerado que alguns preconizam a sua aplicação em regime ambulatorial(26). Noventa por cento das pacientes voltam ao seu padrão de atividade normal após três a quatro dias, e o restante, ao longo das primeiras duas semanas pós-EAU(15). O acompanhamento ambulatorial após EAU respeita uma consulta durante a primeira semana e a cada três meses. Exames laboratoriais e de imagem são solicitados de rotina a cada três meses ou diante de qualquer intercorrência clínica e/ou suspeita de complicações. A identificação e manejo de complicações da EAU representam um importante aspecto do seguimento pós-operatório. Desde um ponto de vista didático, as complicações podem ser divididas naquelas decorrentes do método angiográfico ou nas decorrentes da embolização em si(14,55). Complicações decorrentes do método angiográfico podem ser consideradas as provocadas pelo cateterismo no local da punção, as reações ao meio de contraste e os problemas relacionados com a exposição à radiação. Dentre as complicações decorrentes da EAU devem ser consideradas a amenorréia e insuficiência ovariana, infecção, retenção de mioma submucoso, isquemia de mioma subseroso e problemas tromboembólicos. É importante salientar que a gravidade da uma complicação avalia-se pela necessidade de consultas adicionais, internações, procedimentos complementares, intervenções cirúrgicas, além da persistência ou aparecimento de sintomas indicadores de uma determinada condição clínica(56). As complicações angiográficas são em geral muito raras, principalmente nas pacientes submetidas a EAU que habitualmente são jovens e sem alterações vasculares. O mais comum é a observação de hematoma inguinal relacionado com a punção arterial. A incidência exata é desconhecida, já que na maioria das vezes não requer qualquer conduta e, portanto, não se menciona como uma complicação verdadeira. Teoricamente, é mais freqüente que o observado na população geral de pacientes submetidos a estudo angiográfico, já que as pacientes submetidas a EAU costumam mover mais os membros inferiores no período de repouso pós-operatório. Deve-se salientar que há, também, um número considerável de pacientes obesas submetidas a EAU, nas quais a punção arterial e a posterior compressão resultam geralmente mais difíceis, possibilitando o aparecimento de hematoma. Como comentado anteriormente, alguns autores sugerem o uso de sistemas de fechamento arterial, com o intuito de evitar os hematomas locais e permitir a deambulação precoce(51). As reações alérgicas e intolerâncias medicamentosas são difíceis de prever e de evitar. A utilização de meio de contraste radiológico, bem como de alguns medicamentos como analgésicos, antiinflamatórios e antibióticos durante o período imediatamente após o procedimento, pode desencadear este tipo de complicação. Geralmente são facilmente contornáveis com difenil-hidramina e excepcionalmente requerem terapia maior(57). Uma das complicações mais temidas da embolização uterina é a possibilidade de desencadear uma menopausa precoce por insuficiência ovariana. O aparecimento de amenorréia após a EAU tem sido relatado numa incidência que varia de 2% a 15% na população geral submetida ao procedimento(12–15,58–61). Todavia, foi verificado que esta incidência depende da idade da paciente, podendo ser observada em até 43% das pacientes acima dos 45 anos ou em nenhuma (0%) das pacientes abaixo dos 45 anos(59). Isto se correlaciona bem com estudos em que foi analisado o nível de hormônio folículo estimulante, verificando-se um significativo aumento nas pacientes acima dos 45 anos de idade(58,60). O mecanismo pelo qual surgem as mudanças ovarianas após a EAU não é totalmente conhecido. Três teorias foram sugeridas: 1) efeito da radiação diretamente sobre os ovários; 2) isquemia do ovário por passagem de partículas através das anastomoses arteriais tubo-ováricas; 3) interrupção dessas anastomoses, com eliminação do fluxo ovariano proveniente do útero(58). A dose de radiação para os ovários durante a EAU foi analisada, comprovando-se ser bem inferior àquela utilizada no tratamento radioterapêutico de algumas lesões pélvicas como o linfoma de Hodgkin(62,63). Com base nisto, parece ser pouco provável que a irradiação durante a EAU possa provocar uma disfunção ovariana na população geral, embora possa contribuir naquelas pacientes com limitada reserva funcional ovariana(58). Similarmente, a isquemia ovariana, seja por impacto direto seja por diminuição da vascularização, teria um efeito negativo somente nas pacientes com comprometimento natural dos ovários. Até elucidar o verdadeiro motivo que condiciona o aparecimento de amenorréia pós-EAU, alguns cuidados técnicos, principalmente no grupo de pacientes mais propensas, podem fazer diminuir a sua incidência. A utilização de partículas de tamanho maior e em menor quantidade, a definição consciente do ponto final da embolização, a utilização de técnica com exposição radiológica apropriada são alguns desses cuidados(44,48,62). Seguindo este princípio, observamos, na nossa casuística, somente três casos de amenorréia, sendo permanente numa única paciente de 52 anos de idade. A complicação mais freqüente que pode requerer uma intervenção ginecológica adicional é a eliminação de fragmentos ou de miomas inteiros por via vaginal, o que amiúde pode estar acompanhado de sangramento e/ou infecção(64,65). Geralmente o material é derivado de nódulos submucosos e é expelido sem intercorrências, porém quando retido na cavidade uterina pode dar origem a uma infecção. Por isso, a eliminação de um mioma por via vaginal pode ser considerada um efeito desejado da EAU, porém, na maioria das vezes, este evento requer maiores cuidados, o que o define como uma complicação. A incidência dessa situação é difícil de ser determinada com precisão, embora alguns trabalhos referem como sendo ao redor de 5%(30). As pacientes referem, freqüentemente, dor em cólica cíclica, similar à referida no trabalho de parto, previamente à passagem do material pela vagina. Por isto, esta situação tem sido denominada como o "parto do mioma". É importante mencionar que somente um terço das pacientes elimina o material sem assistência. Assim, um acompanhamento médico cuidadoso deve ser estabelecido quando se suspeita dessa situação. Um exame ginecológico, prescrição de antibióticos ou admissão hospitalar podem ser necessários, além de se realizar estudos laboratoriais e de imagem e, eventualmente, curetagem ou histeroscopia para ajudar na eliminação do material(57). Na nossa experiência, embora a eliminação de material tenha sido referida por 12 pacientes, somente em seis houve necessidade de algum tipo de acompanhamento ou procedimento médico, que representou a prescrição de antibióticos em todas as pacientes e curetagem somente em duas delas. Enquanto uma infecção endometrial menor pode ser facilmente controlada com antibioticoterapia oral ou endovenosa, se não se agir rápido e corretamente esta infecção pode progredir para piometria, ruptura uterina e sepse(66). A histerectomia poderá ser a inevitável conseqüência de uma infecção não controlada e por isso é importante agir precocemente. Walker et al. reportaram duas de 109 pacientes que requereram histerectomia por causa de infecção por Escherichia coli e desenvolvimento de abscessos tubo-ováricos(67). Numa revisão de quatro grandes casuísticas, com 751 casos, comprovou-se que somente 0,7% das pacientes requereram histerectomia para tratar infecção uterina aguda(68). Uma única morte decorrente de infecção uterina foi reportada na Inglaterra(66). Outras complicações clínicas, como trombose venosa profunda, embolia pulmonar e trombose arterial, têm sido relatadas. Um fator comum em pacientes que apresentam essas complicações é o sobrepeso e o uso de hormônios exógenos(57). Impacto da EAU no ambiente ginecológico A histerectomia é, seguramente, a cirurgia universalmente mais difundida e aplicada no ambiente ginecológico. Provoca alívio definitivo dos sintomas e é razoavelmente segura, em virtude da baixa incidência de morbimortalidade. Todavia, e como é obvio, provoca esterilidade irreversível, o que constitui um obstáculo para as pacientes que desejam manter a sua fertilidade. Apresenta, ainda, certos aspectos desconfortáveis relacionados com uma cirurgia formal, como o prolongamento da estadia hospitalar e da retomada das atividades normais. Alem disso, deve-se enfocar com seriedade a existência de traumas emocionais relacionados com a perda do útero, pela sua identidade de gênero, como preconizam os defensores dos direitos reprodutivos e da sexualidade e que merecem toda a atenção(69). Nos dias de hoje a histerectomia tem uma alternativa que se chama embolização; um procedimento relativamente simples e eficiente que, como demonstrado neste trabalho, pode ser realizado com uma estrutura convencional sem demandar grandes recursos hospitalares. Num recente estudo publicado no Journal of Vascular and Interventional Radiology(70), e num outro recentemente apresentado(71), comprova-se que a embolização é um procedimento mais barato quando comparado à histerectomia ou à miomectomia como forma de tratamento, evidenciando uma vantagem adicional. Por que então mutilar se pode-se preservar? Uma pergunta cuja resposta pode ultrapassar desafios éticos e profissionais e gerar um dilema corporativo. No ambiente ginecológico a embolização tem sido vista, em geral, com enormes ressalvas(72). Nota-se uma preocupação substancial sobre o papel desempenhado pelo ginecologista no procedimento técnico de embolização, que invariavelmente é realizado por um radiologista intervencionista. Um sentimento compreensível e até certo ponto similar àquele que alguns radiologistas sentem quando comentam as ultra-sonografias e mamografias realizadas por ginecologistas. Todavia, ignorar a existência deste método inovador, sonegar informação a pacientes que poderiam se beneficiar com ele ou criticá-lo sem fundamentação científica é menosprezar a capacidade das mulheres para se instruírem por si mesmas e, ao mesmo tempo, é atentar contra a própria idoneidade e desenvolvimento profissional, principalmente nos dias de hoje, quando a informação e a comunicação acontecem em tempo real. Revistas semanais, programas televisivos de grande audiência, internet, rádio e também o bate-papo no cabeleireiro são fontes permanentes de atualização da mulher adulta. No mundo de hoje, soluções radicais ou extremas encontram pouco espaço e receptividade. Cada vez mais o intercâmbio e a colaboração entre os diversos profissionais e entre as especialidades geram o melhor resultado na obtenção do bem estar físico e mental da mulher. Esta visão antroposófica do ser humano é cada vez mais difundida entre as especialidades médicas. Assim, a melhor estratégia para encarar o procedimento de embolização uterina passa seguramente por um trabalho conjunto e cooperativo entre ginecologistas e radiologistas intervencionistas, que compartilhando seus conhecimentos possam dedicar uma atenção mais abrangente à saúde da mulher portadora de mioma sintomático. Perspectivas futuras A embolização uterina para tratamento da miomatose sintomática é uma indicação nova para um procedimento antigo. Ao longo dos últimos anos tem sido comprovado que é uma opção terapêutica eficaz sob vários pontos de vista e isto tem estimulado um crescente interesse pelo método por parte de ginecologistas e radiologistas intervencionistas e, principalmente, por parte das pacientes. Todavia, é importante mencionar que ainda não existem as respostas para todas as perguntas, principalmente no que se refere à sua segurança, durabilidade, relação custo/benefício, impacto sobre a fertilidade e comparação com as outras terapias já estabelecidas para a miomatose, como são a miomectomia e a histerectomia. Abre-se assim um enorme campo para a investigação sobre este procedimento, bem como nas suas variáveis técnicas, o que poderá preencher muito do nosso tempo no futuro próximo.
CONCLUSÃO A embolização uterina representa uma indicação inovadora e um procedimento extremamente promissor para o tratamento da miomatose sintomática. Embora numerosas perguntas continuem sem resposta, há na literatura médica evidência científica suficiente para considerar que se trata de um procedimento razoavelmente seguro e satisfatoriamente eficaz. O desenvolvimento de um programa de embolização uterina sustenta-se na seleção de pacientes, na preparação técnica e nos cuidados pós-operatórios. A chave para o sucesso de programas como estes radica-se na formação de equipes multidisciplinares, em que ginecologistas e radiologistas intervencionistas possam desenvolver um trabalho conjunto e harmônico.
REFERÊNCIAS 1.Cramer SF, Patel A. The frequency of uterine leiomyomas. Am J Clin Pathol 1990;94:435–8. [ ] 2.Brosens IA, Lunenfeld B, Donnez J. Pathogenesis and medical management of uterine fibroids. London: Parthenon Publishing, 1999. [ ] 3.Buttram VC Jr, Reiter RC. Uterine leiomyomata: etiology, symptomatology, and management. Fertil Steril 1981;36:433–45. [ ] 4.American College of Obstetricians & Gynecologists. An educational aid to obstetrician-gynecologists. Uterine leiomyomata. ACOG Technical Bulletin 1994;192:863–70. [ ] 5.Crosignani PG, Vercellini P, Apolone G, De Giorgi O, Cortesi I, Meschia M. Endometrial resection versus vaginal hysterectomy for menorrhagia: long-term clinical and quality-of-life outcomes. Am J Obstet Gynecol 1997;177:95–101. [ ] 6.Lepine LA, Hillis SD, Marchbanks PA, et al. Hysterectomy surveillance – United States, 1980-1993. MMWR CDC Surveill Summ 1997;46:1–15. [ ] 7.Harris WJ. Complications of hysterectomy. Clin Obstet Gynecol 1997;40:928–38. [ ] 8.Nezhat FR, Roemisch M, Nezhat CH, Seidman DS, Nezhat CR. Recurrence rate after laparoscopic myomectomy. J Am Assoc Gynecol Laparosc 1998; 5:237–40. [ ] 9.Sutton CJG. Treatment of large uterine fibroids. Br J Obstet Gynaecol 1996;103:494–6. [ ] 10.Ravina JH, Herbreteau D, Ciraru-Vigneron N, et al. Arterial embolisation to treat uterine myomata. Lancet 1995;346:671–2. [ ] 11.Ravina JH, Merland JJ, Herbreteau D, Houdart E, Bouret JM, Madelenat P. Preoperative embolization of uterine fibroma. Preliminary results (10 cases). Presse Med 1994;23:1540. [ ] 12.Goodwin SC, McLucas B, Lee M, et al. Uterine artery embolization for the treatment of uterine leiomyomata midterm results. J Vasc Interv Radiol 1999;10:1159–65. [ ] 13.Spies JB, Scialli AR, Jha RC, et al. Initial results from uterine fibroid embolization for symptomatic leiomyomata. J Vasc Interv Radiol 1999;10:1149–57. [ ] 14.Walker W, Green A, Sutton C. Bilateral uterine artery embolisation for myomata: results, complications and failures. Min Invas Ther & Allied Technol 1999;8:449–54. [ ] 15.Worthington-Kirsch RL, Popky GL, Hutchins FL Jr. Uterine arterial embolization for the management of leiomyomas: quality-of-life assessment and clinical response. Radiology 1998;208:625–9. [ ] 16.Hutchins FL Jr, Worthington-Kirsch RL, Berkowitz RP. Selective uterine artery embolization as primary treatment for symptomatic leiomyomata uteri: a review of 305 consecutive cases. J Am Assoc Gynecol Laparosc 1999;6:279–84. [ ] 17.Spies JB, Ascher SA, Roth AR, Kim J, Levy EB, Gomez-Jorge J. Uterine artery embolization for leiomyomata. Obstet Gynecol 2001;98:29–34. [ ] 18.Pelage JP, Le Dref O, Soyer P, et al. Fibroid-related menorrhagia: treatment with superselective embolization of the uterine arteries and midterm follow-up. Radiology 2000;215:428–31. [ ] 19.Kadir S, Kaufman SL, Barth KH, White RI Jr. Embolotherapy: theory, materials technique. In: Kadir S, ed. Selected techniques in interventional radiology. London: WB Saunders, 1982:27–46. [ ] 20.Kadir S, Kaufman SL, Barth KH, White RI Jr. Embolotherapy: clinical applications of embolotherapy. In: Kadir S, ed. Selected techniques in interventional radiology. London: WB Saunders, 1982: 46–103. [ ] 21.Tadavarthy SM, Knight L, Ovitt TW, Snyder C, Amplatz K. Therapeutic transcatheter arterial embolization. Radiology 1974;112:13–6. [ ] 22.Smith DC, Wyatt JF. Embolization of the hypogastric arteries in the control of massive vaginal hemorrhage. Obstet Gynecol 1977;49:317–22. [ ] 23.Heaston DK, Mineau DE, Brown BJ, Miller FJ Jr. Transcatheter arterial embolization for control of persistent massive puerperal hemorrhage after bilateral surgical hypogastric artery ligation. AJR 1979;133:152–4. [ ] 24.Pais SO, Glickman M, Schwartz P, Pingoud E, Berkowitz R. Embolization of pelvic arteries for control of postpartum hemorrhage. Obstet Gynecol 1980;55:755–8. [ ] 25.Ravina J, Ciraru-Vigneron N, Aymard A, Ferrand J, Merland JJ. Uterine artery embolisation for fibroid disease: results of a 6 year study. Min Invas Ther & Allied Technol 1999;8:441–7. [ ] 26.Siskin GP, Stainken BF, Dowling K, Meo P, Ahn J, Dolen EG. Outpatient uterine artery embolization for symptomatic uterine fibroids: experience in 49 patients. J Vasc Interv Radiol 2000;11:305–11. [ ] 27.Brunereau L, Herbreteau D, Gallas S, et al. Uterine artery embolization in the primary treatment of uterine leiomyomas: technical features and prospective follow-up with clinical and sonographic examinations in 58 patients. AJR 2000;175:1267–72. [ ] 28.Walker WJ, Pelage JP. Uterine artery embolisation for symptomatic fibroids: clinical results in 400 women with imaging follow up. Br J Obstet Gynaecol 2002;109:1262–72. [ ] 29.Andersen PE, Lund N, Justesen P, Munk T, Elle B, Floridon C. Uterine artery embolization of symptomatic uterine fibroids. Initial success and short-term results. Acta Radiol 2001;42:234–8. [ ] 30.McLucas B, Adler L, Perrella R. Uterine fibroid embolization: nonsurgical treatment for symptomatic fibroids. J Am Coll Surg 2001;192:95–105. [ ] 31.Jha RC, Ascher SM. Ultrasound and magnetic resonance imaging findings with uterine artery embolization for symptomatic fibroids. J Women's Imaging 2000;2:125–31. [ ] 32.Jha RC, Ascher SM, Imaoka I, Spies JB. Symptomatic fibroleiomyomata: MR imaging of the uterus before and after uterine arterial embolization. Radiology 2000;217:228–35. [ ] 33.Goodwin SC, Wong GCH. Uterine artery embolization for uterine fibroids: a radiologist's perspective. Clin Obstet Gynecol 2001;44:412–24. [ ] 34.Pelage JP, Ferrand J, Wassef M, et al. Combined embolization and myomectomy for symptomatic fibroids. Cardiovasc Intervent Radiol 2001;24 Suppl 1:32. [ ] 35.Pelage JP, Walker WJ. Uterine artery embolization for symptomatic fibroids and pregnancy. J Vasc Interv Radiol 2002;13(2):s65. [ ] 36.McLucas B, Goodwin S, Adler L, Rappaport A, Reed R, Perrella R. Pregnancy following uterine fibroid embolization. Int J Gynaecol Obstet 2001; 74:1–7. [ ] 37.Hutchins FL Jr, Worthington-Kirsch RL. Embolotherapy for myoma-induced menorrhagia. Obstet Gynecol Clin North Am 2000;27:397–405. [ ] 38.Min RJ, Troiano R, Kandarpa K, et al. Uterine fibroid embolization in post-menopausal women. J Vasc Interv Radiol 2002;13(2):s64. [ ] 39.Goodwin SC, Landow WJ, Matalon TAS, Mauro MA, Pomerantz P, Worthington-Kirsch RL. Opportunity and responsibility: SCVIR's role with uterine artery embolization. J Vasc Interv Radiol 2000; 11:409–10. [ ] 40.Nikolic B, Spies JB, Lundsten MJ, Abbara S. Patient radiation dose associated with uterine artery embolization. Radiology 2000;214:121–5. [ ] 41.Matson M, Nicholson A, Belli AM. Anastomoses of the ovarian and uterine arteries: a potential pitfall and cause of failure of uterine embolization. Cardiovasc Intervent Radiol 2000;23:393–6. [ ] 42.Pelage JP, Le Dref O, Jacob D, Rymer R. Ovarian artery supply of uterine fibroid (letter). J Vasc Interv Radiol 2000;11:535. [ ] 43.Andrews RT, Bromley PJ, Pfister ME. Successful embolization of collaterals from the ovarian artery during uterine artery embolization for fibroids: a case report. J Vasc Interv Radiol 2000;11:607–10. [ ] 44.Siskin GP, Englander M, Stainken BF, Ahn J, Dowling K, Dolen EG. Embolic agents used for uterine fibroid embolization. AJR 2000;175:767–73. [ ] 45.Katsumori T, Nakajima K, Mihara T, Tokuhiro M. Uterine artery embolization using gelatin sponge particles alone for symptomatic uterine fibroids: midterm results. AJR 2002;178:135–9. [ ] 46.Stancato-Pasik A, Katz R, Mitty HA, et al. Uterine artery embolisation of myomas: preliminary results of gelatin sponge pledgets as the embolic agent. Min Invas Ther & Allied Technol 1999;8:393–6. [ ] 47.Katz RN, Mitty HA, Stancato-Pasik A, Cooper JM, Ahn J. Comparison of uterine artery embolization for fibroids using gelatin sponge-pledgets and polyvinyl alcohol (abstract). J Vasc Interv Radiol 1998; 9:184. [ ] 48.Spies JB, Benenati JF, Worthington-Kirsch RL, Pelage JP. Initial experience with use of tris-acryl gelatin microspheres for uterine artery embolization for leiomyomata. J Vasc Interv Radiol 2001;12:1059–63. [ ] 49.Ryu RK, Omary RA, Chrisman HB, et al. Tri-acryl gelatin microspheres versus polyvinyl alcohol particles for uterine artery embolization. J Vasc Interv Radiol 2002;13(2):s18. [ ] 50.Pelage JP, Laurent A, Wassef M, Bonneau M, Rymer R, Merland JJ. Uterine artery embolization: choise of an embolic particle. J Vasc Interv Radiol 2000; 11:189. [ ] 51.Meyerson SL, Feldman T, Desai TR, Leef J, Schwartz LB, McKinsey JF. Angiographic access site complications in the era of arterial closure devices. Vasc Endovascular Surg 2002;36:137–44. [ ] 52.Machan L, Goodwin S, Worthington-Kirsch R, Spies J. Fibroid embolization: periprocedural care. Semin Intervent Radiol 2000;17:247–54. [ ] 53.Goodwin SC, Vedantham S, McLucas B, Forno AE, Perrella R. Preliminary experience with uterine artery embolization for uterine fibroids. J Vasc Interv Radiol 1997;8:517–26. [ ] 54.Roth AR, Spies JB, Walsh SM, Wood BJ, Gomez-Jorge J, Levy EB. Pain after uterine artery embolization for leiomyomata: can its severity be predicted and does severity predict outcome? J Vasc Interv Radiol 2000;11:1047–52. [ ] 55.Nott V, Reidy JF, Forman RG, Braude P. Complications of fibroid embolisation. Min Invas Ther & Allied Technol 1999;8:421–4. [ ] 56.Goodwin SC, Bonilla SM, Sacks D, et al. Reporting standards for uterine artery embolization for the treatment of uterine leiomyomata. J Vasc Interv Radiol 2001;12:1011–20. [ ] 57.Spies JB. Management of adverse events following UFE. J Vasc Interv Radiol 2002;13:278–82. [ ] 58.Spies JB, Roth AR, Gonsalves SM, Murphy-Skrzyniarz KM. Ovarian function after uterine artery embolization for leiomyomata: assessment with use of serum follicle stimulanting hormone assay. J. Vasc Interv Radiol 2001;12:437–42. [ ] 59.Chrisman HB, Saker MB, Ryu RK, et al. The impact of uterine fibroid embolization on resumption of menses and ovarian function. J. Vasc Interv Radiol 2000;11:699–703. [ ] 60.Amato P, Roberts AC. Transiet ovarian failure: a complication of uterine artery embolization. Fertil Steril 2001;75:438–9. [ ] 61.Stringer NH, Grant T, Park J, Oldham L. Ovarian failure after uterine artery embolization for treatment of myomas. J Am Assoc Gynecol Laparosc 2000;7:395–400. [ ] 62.Nikolic B, Spies JB, Campbell L, Walsh SM, Abbara S, Lundsten MJ. Uterine artery embolization: reduced radiation with refined technique.J Vasc Interv Radiol 2001;12:39–44. [ ] 63.Nikolic B, Abbara S, Levy E, et al. Influence of radiographic technique and equipment on absorbed ovarian dose associated with uterine artery embolization.J Vasc Interv Radiol 2000;11:1173–8. [ ] 64.Abbara S, Spies JB, Scialli AR, Jha RC, Lage JM, Nikolic B. Transcervical expulsion of a fibroid as a result of uterine artery embolization for leiomyomata. J Vasc Interv Radiol 1999;10:409–11. [ ] 65.Berkowitz RP, Hutchins FL Jr, Worthington-Kirsch RL. Vaginal expulsion of submucosal fibroids after uterine artery embolization: a report of three cases. J Reprod Med 1999;44:373–6. [ ] 66.Vashisht A, Studd J, Carey A, Burn P. Fatal septicaemia after fibroid embolisation. Lancet 1999; 354:307–8. [ ] 67.Walker W, Dover R, Sutton C. Bilateral uterine artery embolisation for fibroids. SMIT, 1998 September 4, London, England. [ ] 68.SCVIR survey 1999. Preparatory brief for FDA obstetrics & gynecology devices panel. Fairfax, VA: SCVIR News Nov/Dec 1999;12(6). [ ] 69.Schofield MJ, Bennett A, Redman S, Walters WA, Sanson-Fisher RW. Self-reported long-term outcomes of hysterectomy. Br J Obstet Gynaecol 1991; 98:1129–36. [ ] 70.Subramanian S, Spies JB. Uterine artery embolization for leiomyomata: resource use and cost estimation. J Vasc Interv Radiol 2001;12:571–4. [ ] 71.Baker CM, Winkel CA, Subramanian S, Spies JB. A comparation of estimated costs for uterine artery embolization and abdominal myomectomy at a single institution. J Vasc Interv Radiol 2002;13(2): s19. [ ] 72.Lvoff NM, Omary RA, Ryu RK, et al. The role and effect of gynecologist in referring patients for uterine artery embolization. J Vasc Interv Radiol 2002; 13(2):s72. [ ]
Recebido para publicação em 12/9/2002
* Trabalho realizado nos Serviços de Radiologia Intervencionista do Hospital Santa Catarina e do Complexo Hospitalar Heliópolis, São Paulo, SP |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554