Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 34 nº 6 - Nov. / Dez. of 2001
Vol. 34 nº 6 - Nov. / Dez. of 2001
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Edson Marchiori, Cyntia Inez Guedes Soares Pereira, Luiza Beatriz Melo Moreira, Domenico Capone, Heleno Pinto de Moraes |
|
|
Descritores: Pneumocistose, Síndrome da imunodeficiência adquirida, Tomografia computadorizada de alta resolução, Anatomopatologia |
|
|
Resumo:
INTRODUÇÃO
Complicações pulmonares são causas comuns de morbidade e mortalidade em pacientes com a síndrome da imunodeficiência adquirida (SIDA), sendo mais freqüentes as de natureza infecciosa. A pneumonia por Pneumocystis carinii, ou pneumocistose, é a causa mais comum de doença pulmonar difusa aguda na SIDA. É também usualmente vista em outros pacientes imunocomprometidos, particularmente após transplante de medula óssea(1). Na última década, avanços no tratamento e na prevenção da pneumocistose alteraram a incidência relativa da doença, pois, com a quimioprofilaxia, o número de novos casos diminuiu bastante. Constataram-se também, secundárias a estes avanços, modificações na sua história natural e nas suas manifestações radiológicas(2). Em razão de o tratamento e a quimioprofilaxia terem tornado mais freqüentes as manifestações atípicas da doença, aumentou a importância de o radiologista reconhecer, também, os seus aspectos menos comuns(2,3). Estudos recentes têm mostrado a utilidade da tomografia computadorizada de alta resolução (TCAR) na avaliação de pacientes com SIDA e doença pulmonar(1,4,5). A tomografia pode demonstrar doença não diagnosticada nas radiografias convencionais, evidenciar achados característicos ou sugestivos de uma doença específica, sugerir a concomitância de doenças, e servir para selecionar sítios ou guiar biópsias(6).
CASUÍSTICA E MÉTODOS Foram analisadas as TCARs de 15 pacientes adultos que apresentavam SIDA e pneumocistose, estudados em Instituições do Rio de Janeiro, com diagnósticos confirmados histopatologicamente por lavado broncoalveolar ou por material de necropsia, e foi feita a correlação com material anatomopatológico obtido de necropsias de cinco pacientes. Onze pacientes eram do sexo masculino e quatro eram do sexo feminino, com idades variando entre 23 e 54 anos (média de 33,8 anos).
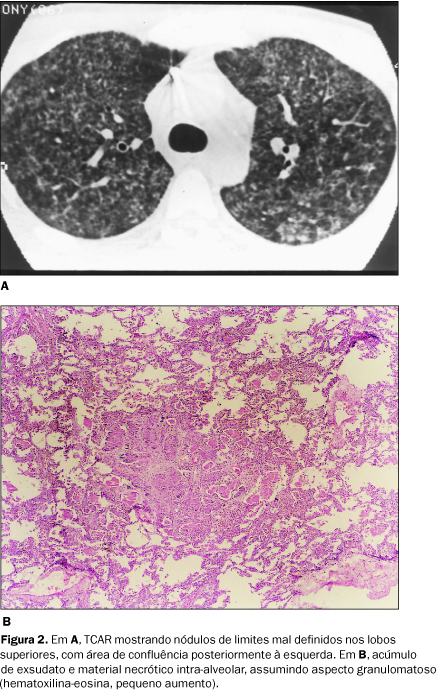
RESULTADOS Os achados mais observados foram, em ordem decrescente de freqüência, o padrão em vidro fosco, as consolidações alveolares, as alterações das vias aéreas (dilatações brônquicas e espessamento de paredes brônquicas), o espessamento de septos interlobulares, eventualmente formando o padrão de pavimentação em mosaico (Figura 1A), a reticulação intralobular, as lesões císticas e os nódulos. O padrão em vidro fosco e as consolidações alveolares se deveram à presença de ocupação alveolar por exsudato eosinofílico espumoso, constituído basicamente por surfactante, fibrina e restos celulares, com parasitos de permeio (Figuras 1C e 1D). O espessamento de septos interlobulares foi pouco expressivo, exceto em dois pacientes, que apresentavam septos espessados de permeio a áreas com atenuação em vidro fosco (padrão de pavimentação em mosaico). Os septos estavam espessados por edema e infiltração celular (Figura 1B). Os nódulos se deveram basicamente à formação de "granulomas" não-caseosos. Nestas áreas, os alvéolos apresentaram-se preenchidos por microorganismos, células inflamatórias e necrose, assumindo um padrão "granulomatoso" (Figura 2).
A reticulação intralobular correspondeu à presença de espessamento de septos alveolares, com pouco ou nenhum enchimento alveolar (Figura 3B). Evidências de fibrose em septos alveolares foram também observadas (Figura 3C). Em um dos pacientes conseguiu-se também identificar, anatomopatologicamente, a presença de cistos, que não tinham paredes próprias; as paredes eram constituídas pelo próprio parênquima pulmonar, colabado ao redor dos cistos (Figura 3D). Não se conseguiu obter, no material histopatológico analisado, elementos suficientes para a correlação das alterações nas vias aéreas.
DISCUSSÃO O achado mais característico na TCAR dos pacientes com pneumocistose é a presença de áreas com atenuação em vidro fosco, isto é, aumento homogêneo da atenuação sem obscurecer as imagens vasculares(4). Pode ser visto também um padrão geográfico, ou em mosaico, com lóbulos secundários normais adjacentes a outros doentes(2,7). O encontro deste padrão em um paciente toxêmico com SIDA é muito sugestivo de pneumocistose(1,4). A distribuição pode ser difusa ou predominar nos lobos superiores. Embora isto ocorra mais freqüentemente em pacientes sendo tratados com aerossol de pentamidina, este predomínio pode ocorrer também em pacientes que não estão recebendo quimioprofilaxia(1). O achado histopatológico mais proeminente é a presença de exsudato intra-alveolar espumoso(8). Trata-se de um líquido proteináceo que contém parasitos, fibrina e restos celulares(2,7). É este acúmulo de líquido que produz o padrão em vidro fosco na TCAR(7). Pode haver também espessamento de septos interlobulares dentro das áreas em vidro fosco, refletindo infiltração intersticial por edema e células mononucleares(7). A associação de padrão em vidro fosco com septos interlobulares espessados de permeio origina o padrão de pavimentação em mosaico(9). Com o progresso da doença, áreas de consolidação do espaço aéreo podem ser vistas(1). Um achado relativamente comum é a presença de espaços císticos(1,3,4). Os cistos podem ser basicamente divididos em dois tipos: os intraparenquimatosos, que são cavidades necróticas envolvidas por inflamação aguda, cujas paredes consistem de espaços alveolares cheios de exsudato eosinofílico e microorganismos(7), ou inflamação crônica, com fina camada de tecido fibroso(8,10). Geralmente estes cistos se situam no parênquima subpleural, embora alguns estejam associados com bronquíolos respiratórios(8). As paredes podem ser finas ou espessas, e o cisto pode ter formas regulares ou irregulares, estando ou não envolvido por consolidação parenquimatosa ou padrão em vidro fosco(7). O outro tipo são os cistos subpleurais, que não são envolvidos por parênquima alveolar e são revestidos por fina parede fibrosa(8,10), sem evidência de inflamação aguda ou de microorganismos(2). Ocasionalmente, os cistos intraparenquimatosos se comunicam com cavidades subpleurais(8). Postula-se também a possibilidade de haver evolução das lesões parenquimatosas para os cistos subpleurais(2). As lesões císticas têm predileção pelos lobos superiores e regiões subpleurais, podendo haver pneumotórax espontâneo(1,2). Na vigência de tratamento com aerossol de pentamidina, há um aumento da incidência de lesões nos lobos superiores, das formas císticas e de pneumotórax(10). Após o tratamento, os cistos podem persistir ou desaparecer(1). Deve ser ressaltado que, embora cavidades de paredes espessas possam ser vistas na pneumocistose, o seu encontro deve levar à suspeição de uma segunda doença associada(11). A patogênese da formação dos cistos pulmonares não é bem conhecida. Várias teorias têm sido propostas, como ação de enzimas proteolíticas, invasão vascular e tissular agressiva, com necrose isquêmica e cavitação, obstrução de pequenas vias aéreas, com mecanismo valvular, reação granulomatosa com cavitação, infecção pelo próprio vírus da SIDA, uso de drogas intravenosas, etc.(2,8,12). Esta multiplicidade de teorias demonstra que, na verdade, a gênese dos cistos não é conhecida. Estudos seqüenciais demonstram que, na fase aguda da pneumonia, a reticulação pode se tornar achado predominante(1), provavelmente refletindo linfáticos nos septos interlobulares "clareando" a alveolite, edema, ou acúmulo de células plasmáticas e macrófagos(2,7). Uma freqüente seqüela da infecção é a fibrose intersticial(7). Estas alterações podem se apresentar como áreas de cicatrização focal ou como fibrose pulmonar mais difusa(2). Um mecanismo comum de fibrose nesses pacientes é a reação celular à agressão da membrana alveolocapilar, com proliferação de pneumócitos tipo II, e mobilização de macrófagos e células plasmáticas dentro do interstício (dano alveolar difuso). Esta resposta resulta em pneumonite intersticial branda, com posterior fibrose intersticial quando o pulmão tenta a reparação(2). Encontro de calcificações intersticiais microscópicas também já foi relatado(8,10). Cerca de 5% a 10% dos pacientes apresentam manifestações atípicas da doença, que incluem doença lobar isolada, opacidades com nódulos focais parenquimatosos, nódulos ou massas escavados, padrão miliar, lesões endobrônquicas, derrame pleural e linfonodomegalias(1-3,7,10). Granulomas têm sido relatados em 4% das biópsias pulmonares(10). Exsudato eosinofílico e microorganismos são encontrados dentro da maioria dos granulomas que, por vezes, têm aspecto sarcóide e podem ser necróticos(10). Células gigantes isoladas são ocasionalmente vistas adjacentes ao exsudato alveolar(8). Os granulomas podem ser imaturos ou completamente organizados(10). As formações nodulares variam de poucos milímetros até lesões mais raras, sob forma de massas, podendo atingir alguns centímetros de diâmetro. Eventualmente, estas lesões podem cavitar(10). De qualquer forma, estas lesões nodulares são bastante raras(7) e o seu encontro deve levar à suspeita de uma segunda doença associada, antes de serem atribuídas à pneumocistose(3,11). Invasão vascular tem sido descrita e pode ser acompanhada de necrose local(10). A infiltração vascular pode estar associada focalmente à vasculite. O exsudato espumoso e os microorganismos podem ser encontrados infiltrando as paredes vasculares. Podem estar envolvidos artérias, veias ou capilares nos septos alveolares(8). Linfonodomegalias, tipicamente associadas com terapia profilática com aerossol de pentamidina, raramente são vistas fora desse contexto(7). Também derrames pleurais são raros, em geral em pacientes em uso de quimioprofilaxia(2,4).
REFERÊNCIAS 1.Primack SL, Müller NL. High-resolution computed tomography in acute diffuse lung disease in the immunocompromised patient. Radiol Clin North Am 1994;32:731¾44. [ ] 2.Kuhlman JE. Pneumocystic infections: the radiologist's perspective. Radiology 1996;198:623¾35. [ ] 3.Boiselle PM, Crans CA Jr, Kaplan MA. The changing face of Pneumocystis carinii pneumonia in AIDS patients. AJR 1999;172:1301¾9. [ ] 4.Pereira CIGS, Marchiori E, Souza Jr AS. Pneumocistose no paciente com síndrome da imunodeficiência adquirida: avaliação pela tomografia computadorizada de alta resolução do tórax. Rev Imagem 2001;23:91¾9. [ ] 5.Marchiori E, Valiante PM, Sales AR, Capone D, Moraes HP, Santos MLA. Sarcoma de Kaposi pulmonar: correlação da tomografia computadorizada de alta resolução com a anatomopatologia. Rev Imagem 2000;22:63¾7. [ ] 6.Brown MJ, Miller RR, Müller NL. Acute lung disease in the immunocompromised host: CT and pathologic examination findings. Radiology 1994;190:247¾54. [ ] 7.McGuinness G. Changing trends in the pulmonary manifestations of AIDS. Radiol Clin North Am 1997;35:1029¾82. [ ] 8.Travis WD, Pittaluga S, Lipschik GY, et al. Atypical pathologic manifestations of Pneumocystis carinii pneumonia in the acquired immune deficiency syndrome. Review of 23 lung biopsies from 76 patients with emphasis on cysts, vascular invasion, vasculitis, and granulomas. Am J Surg Pathol 1990;14:615¾25. [ ] 9.Marchiori E, Kavakama J, Capelozzi VL, Vabo KA, Damato SD. "Pavimentação em mosaico": correlação da tomografia computadorizada de alta resolução com a anatomopatologia. Radiol Bras 2000;33:169¾73. [ ] 10.Kennedy CA, Goetz MB. Atypical roentgenographic manifestations of Pneumocystis carinii pneumonia. Arch Intern Med 1992;152:1390¾8. [ ] 11.Kuhlman JE, Kavuru M, Fishman EK, Siegelman SS. Pneumocystis carinii pneumonia: spectrum of parenchymal CT findings. Radiology 1990;175:711¾4. [ ] 12.Panicek DM. Cystic pulmonary lesions in patients with AIDS. Radiology 1989;173:12¾4. [ ]
* Trabalho realizado nos Departamentos de Radiologia e de Patologia da Universidade Federal Fluminense (UFF), Niterói, RJ, e no Serviço de Radiologia do Hospital Universitário Clementino Fraga Filho (HUCFF) da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554